Интоксикация при раке ободочной кишки

Автор Александра Томберг | Врач международного отдела, основатель Clinics Direct | 9 декабря 2019 г.
Онкология кишечника входит в перечень наиболее часто диагностируемых злокачественных патологий с одинаковым уровнем распространённости по всему миру. Чаще всего данное заболевание поражает толстый кишечник, но и в зоне тонкого кишечника могут создаваться предпосылки для развития онкологического процесса.
Причины возникновения
К общим предрасполагающим факторам развития злокачественного процесса в области кишечника, относят:
- Наследственная предрасположенность к развитию онкологии кишечника.
- Семейный полипоз.
- Синдром Линча.
- Такие алиментарные факторы, как регулярное употребление алкоголя, злоупотребление жирной и жареной пищей.
- Ожирение.
- Введение малоподвижного образа жизни (гиподинамия).
- Хронические запоры.
- Табакокурение.
- Неспецифический язвенный колит.
- Болезнь Крона.
- Одиночные полипы в области толстого кишечника.
- Дивертикулярная болезнь толстого кишечника.
Кроме того, канцерогенное воздействие на кишечный эпителий оказывают метаболиты стероидных гормонов, производные тирозина и триптофана, амины и ароматические углеводороды.
Первые признаки рака кишечника
В зависимости от вовлечённости того или иного отдела кишечника в злокачественный процесс могут преобладать разные клинические симптомы. К общим клиническим симптомам онкологии кишечника, можно отнести:
- Отвращение к жареной и жирной пище.
- Снижение или полное отсутствие аппетита.
- Резкая потеря массы тела.
- Присутствие алой крови в кале.
- Постоянное ощущение тяжести в животе не связанное с перееданием.
- Чередование запоров и диареи.
- Снижение показателей гемоглобина в крови.
Признаки рака толстой кишки
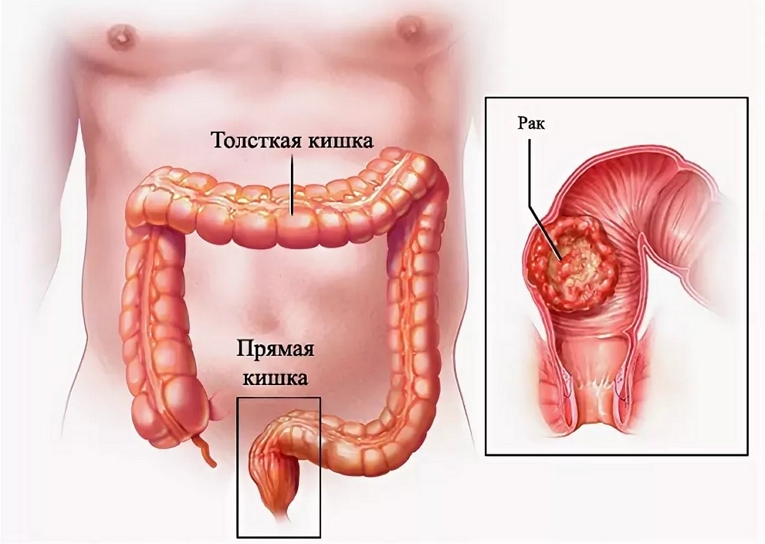
На развитие онкологии толстого кишечника указывает ряд таких клинических симптомов:
- Боль в правом подреберье или околопупочной области.
- Потеря аппетита.
- Тошнота и рвота.
- Повышенное газообразование в кишечнике.
- Хронические запоры, сменяющиеся диареей.
- Прогрессирующая анемия.
- Кишечная непроходимость.
- Появление в испражнениях примесей гноя, слизи или крови.
Признаки рака прямой кишки
На ранних стадиях данное заболевание протекает в бессимптомной форме. По мере прогрессирования онкологического процесса, клиническая картина патологии включает такие симптомы:
- Выделение алой крови из заднего прохода, примеси крови в кале.
- Стул имеет форму ленты или карандаша.
- Нарастающая анемия.
- Хронические запоры.
- Боль в области прямой кишки.
Признаки рака тонкой кишки
Онкология тонкой кишки сопровождается спастической болью в животе, возникающей с определенной периодичностью. Кроме того, на первый план выходят такие симптомы, как тошнота и рвота, метеоризм, неустойчивость стула, прогрессирующее снижение массы тела, интоксикация.
Стадии
В клинической практике выделяют такие стадии опухолевого процесса в области кишечника:
- 0 стадия. Возникают предраковые изменения.
- 1 стадия. Атипичные клетки начинают неконтролируемо делиться.
- 2 стадия. Наблюдается активный рост опухоли.
- 3 стадия. Опухоль выходит за пределы кишечника, наблюдаются признаки метастазирования.
- 4 стадия. Метастазы выявляются в других органах и лимфоузлах, развивается выраженная интоксикация организма.
Метастазы
Метастазирование при данном виде онкологии происходит в лимфатические узлы, легочную ткань, печень и кости таза.
Диагностика
План диагностики при подозрении на рак кишечника включает такие варианты осбледования:
Лечение
Радикальным методом лечения онкологии кишечника является оперативное вмешательство. Также, используются методики лучевого воздействия и химиотерапии.
Для лечения онкологии кишечника используются такие химиотерапевтические препараты, как Фторурацил, Луйковорин, Капецитабин, Иринотекан. С лечебной целью при онкологии кишечника используется дистанционный и контактный вид лучевого воздействия. Также, проводится предоперационное и послеоперационное облучение опухоли.
Прогноз для жизни
Прогноз относительно выживаемости и качества жизни при онкологии кишечника напрямую зависит от стадии, на которой был выявлен злокачественный процесс. Если лечение было проведено на 1 стадии онкологического процесса, то уровень пятилетней выживаемости составляет от 90 до 100%. Уровень пятилетней выживаемости на 2-3 стадии составляет не более 30%. На 4 стадии онкологического процесса, прогнозы менее благоприятные.
Профилактика
План профилактических мероприятий подразумевает регулярное диспансерное наблюдение пациентов из так называемой группы риска по возникновению рака кишечника. В группу риска попадают люди, имеющие так называемые предраковые заболевания. Также необходима коррекция образа жизни и рациона питания. Большое значение имеют скрининговые методы обследования (колоноскопия, анализ кала на скрытую кровь). Если у пациента ранее был диагностирован колоректальный рак, и было проведено оперативное вмешательство, то ему необходимо проходить комплексное обследование и получать консультацию врача онколога не реже 1 раза в 3 месяца. Регулярное обследование позволяет предупредить или своевременно выявить рецидив злокачественного процесса.
В зависимости от места локализации патологического очага, радикальное лечение рака кишечника предусматривает операцию с последующим наложением колостомы, реконструктивной операцией и закрытием кишечной стомы. Если злокачественный процесс локализуется в области восходящего отдела ободочной кишки или в области слепой кишки, то пациентам выполняется правосторонняя гемиколэктомия. Если новообразование располагается в восходящем отделе поперечно-ободочной кишки, то проводится ее резекция, а при раке нисходящего отдела — левосторонняя гемиколэктомия.
Остались вопросы? Вы можете позвонить нам или оставить заявку на нашей сайте и опытные врачи-координаторы ответят на все ваши вопросы по поводу лучших специалистов, клиник и цен на лечение!

Рак толстого кишечника в последние годы привлекает особое внимание ученых и клиницистов в связи с неуклонным ростом заболеваемости данной патологией, прежде всего в социально-экономических развитых странах. Каждый год на планете диагностируется более 800 тыс. вновь выявленных пациентов с колоректальным раком и 440 тыс. смертей от него, при этом общее количество больных составляет 3,5 млн человек [2, 3, 6]. Несмотря на внедрение новых медицинских технологий и значительные достижения в онкологии и хирургии, по-прежнему продолжается рост числа больных с осложненными формами колоректального рака. Так, в 2001 г. было зарегистрировано 24 849 вновь заболевших раком ободочной и 20 541 – раком прямой кишки. В 2003 году (10 лет назад) в России выявлено 50 689 новых случаев заболевания, на данный момент имеется тенденция роста данной нозологической единицы [1, 5].
В 2003 году в России от данной патологии умерло 36 036 человек [1, 5]. Прирост стандартизированных показателей смертности за последнее десятилетие наиболее выражен при раке ободочной кишки за счет осложнений в послеоперационном периоде – 13,3 % [5, 6]. Основной причиной летальности при данной патологии является отсутствие раннего выявления злокачественных заболеваний толстой кишки и развившихся осложнений [4, 7].
Цель исследования: анализ осложнений в периоперационном периоде хирургического лечения больных раком толстого кишечника.
Материал и методы исследования
С 2010 по 2012 годы в клинике кафедры госпитальной хирургии медицинского факультета им. Т.З. Биктимирова Ульяновского государственного университета г. Ульяновска пролечено 196 больных по поводу осложненных форм рака толстой кишки. Мужчин было 101 человек (51,5 %), женщин – 95 (48,5 %) в возрасте от 36 до 86 лет. Анализ возрастного состава больных показал, что 138 (70,4 %) пациентов были пожилого и старческого возраста, опухолевый процесс у которых был отягощен сопутствующими заболеваниями сердечно-сосудистой системы, органов дыхания и мочевыделительной системы, а также нарушениями обменных процессов. И 58 (29,6 %) пациентов были молодого и среднего возраста. Диагностика распространенности рака ободочной кишки, выявление осложнений опухолевого процесса, а также сопутствующих заболеваний основывались на комплексе клинико-инструментальных обследований, который включал лабораторные, рентгенологические, ультразвуковые, эндоскопические и морфологические методы диагностики.
В зависимости от осложнений злокачественных опухолей толстой кишки было выделено четыре группы пациентов, представленные в таблице, в клинической картине которых преобладали основные симптомы: первая группа – острая толстокишечная непроходимость – 98 (50,0 %), вторая группа – воспалительные параканкрозные осложенения с элементами абсцедирования – 45 (23,0 %), третья группа – перфорация опухоли с развитием перитонита различной распространенности – 28 (14,3 %), четвертая группа – профузное кишечное кровотечение – 25 (12,7 %).
Группы пациентов, распределённые по клиническим проявлениям
Симптомы рака толстого кишечника
Острая толстокишечная непроходимость
Воспалительные параканкрозные осложенения с элементами абсцедирования
Перфорация опухоли с развитием перитонита
Профузное кишечное кровотечение
Большая часть выявленных осложнений отмечена у пациентов с раком сигмовидной и слепой кишок – 78 %. Осложненные опухоли в 36 % случаев (n = 70) локализовались в правой половине ободочной кишки, в 59 % (n = 116) – в левой, в поперечной ободочной кишке у 5 % (n = 10) больных.
Наибольшее количество больных с вновь диагностированным колоректальным раком приходится на 3–4 стадию заболевания [1, 2]. По нашим данным, у большинства оперированных пациентов – 123 (62,7 %) – выявлена III стадия, у 54 (27,5 %) – IV стадия рака ободочной кишки и лишь у 19 (9,8 %) – II стадия.
При анализе данных обследования и клинической картины, изучении операционных находок и морфологического материала не было обнаружено зависимости распространения процесса от пола и возраста больных. Во всех группах больных по данным гистологического исследования основное место занимали аденокарциномы различной степени дифференциации – 80,8 %, гораздо реже встречались перстневидно-клеточные и недифференцированные формы рака (7,1 и 12,1 % соответственно).
В 45 % наблюдений во время оперативного вмешательства было обнаружено метастатическое поражение регионарных лимфатических узлов, отдаленные метастазы выявлены у 27 % обследованных с наиболее частой локализацией в печени (62 %), легких (12 %), канцероматоз брюшины выявлен в 18 % наблюдений.
Результаты исследования и их обсуждение
Острая обтурационная толстокишечная непроходимость (n = 98 (50 %)) являлась самой частой формой осложнений рака ободочной кишки. Причем в 75 % это были больные старше 60 лет. Преобладающее число пациентов с этим осложнением составили больные с опухолями сигмовидной (n = 54 (53,3 %)) и слепой (n = 29 (31 %)) кишок. В эту группу вошли больные с декомпенсированным нарушением проходимости ободочной кишки и при отсутствии эффекта от консервативных мероприятий, направленных на разрешение непроходимости кишечника. Клинически у всех были отмечены анемия, интоксикация, гипопротеинемия и нарушение водно-электролитного баланса. В 59 % наблюдений отмечены проявления токсико-анемичного синдрома преимущественно у пациентов с локализацией опухоли в правых отделах ободочной кишки. Неблагоприятным явился тот факт, что у 21 (22 %) больного обтурационная непроходимость сочеталась с опухолевым перифокальным воспалением, у 12 (11 %) – имела место перфорация опухоли в свободную брюшную полость с развитием разлитого перитонита, у 4 (4 %) – с пенетрацией опухоли в брыжейку тонкой кишки с развитием абсцесса. Предоперационная подготовка заключалась в проведении лечебных мероприятий, направленных на коррекцию водного и белково-электролитного баланса, кислотно-щелочного состояния, купирования интоксикации.
Объем операции при обтурационной непроходимости ободочной кишки зависел от локализации опухоли, степени непроходимости, состояния толстой кишки, характера метастазирования, тяжести общего состояния и наличия сопутствующих заболеваний. Из 70 оперированных пациентов с локализацией опухоли в правых отделах ободочной кишки в 21,2 % (n = 15) случаев выполнили правостороннюю гемиколэктомию с наложением илеотрансверзанастомоза и интраоперационную декомпрессию тонкой кишки. Восьми (11,4 %) пациентам с локализацией нерезектабельной опухоли в печеночном изгибе и восходящем отделе ободочной кишки были выполнены паллиативные симптоматические операции – наложение илеотрансверзанастомоза с обязательной зондовой назоинтестинальной декомпрессией, пятерым пациентам (7,1 %) этой группы при наличии тяжелой сопутствующей патологии наложена разгрузочная цекостома. При IV стадии онкологического процесса с наличием отдаленных метастазов, но при технически возможной резектабельности опухоли считали правомочным выполнение паллиативной санационной правосторонней гемиколэктомии с первичным наложением анастамоза.
При раке левой половины и поперечно-ободочной кишок, осложненных кишечной непроходимостью, у 71 (61,2 %) пациента выполнены резекции сегмента кишки со стенозирующей опухолью с последующим ушиванием дистального отрезка кишки и выведением проксимального конца в виде одноствольной колостомы на переднюю брюшную стенку по типу операции Гартмана. При неоперабильности опухоли 45 (38,7 %) пациентам были наложены разгрузочные трансверзо- и сигмостомы.
Умерли после операции 12 (12,2 %) пациентов от прогрессирующей раковой интоксикации и декомпенсации сопутствующей патологии.
Параканкрозные воспалительные процессы осложняют клиническое течение рака ободочной кишки. По нашим данным, воспалительные изменения в опухоли, выходящие за пределы кишечной стенки, составили 22,9 % (n = 45). У большинства пациентов (n = 38 (84 %)) опухоль с перифокальным воспалением локализовалась в правой половине ободочной кишки, что клинически проявлялось токсико-анемичным синдромом. И только у 7 (16 %) пациентов воспалительный процесс локализовался при опухолях селезеночного изгиба и сигмовидной кишки.
Клинические проявления в этой группе зависели от степени выраженности и характера воспалительной реакции тканей вокруг опухоли (стадии развития опухолевого процесса, локализации опухоли, реактивности организма больного). В 87 % случаев эти больные поступали по неотложным показаниям с симптоматикой острых хирургических заболеваний органов брюшной полости или забрюшинного пространства. Сложность дифференцировки перифокального воспаления, обусловленного опухолью или доброкачественной воспалительной инфильтрацией стенки ободочной кишки (при дивертикулите, болезни Крона, неспецифическом язвенном колите), позволяла разрешить эндоскопическое исследование. При ирригоскопии определялся суженный участок ободочной кишки, неровность рельефа слизистой, выход контрастного вещества за пределы кишечной стенки, что не позволяло отдифференцировать опухолевое поражение от доброкачественного воспалительного процесса. В сомнительных случаях при наличии положительных симптомов раздражения брюшины, а также в связи с дифференциальной диагностикой острой хирургической патологии органов брюшной полости у 8 (17,7 %) пациентов была выполнена диагностическая лапароскопия, которая позволила определить характер воспалительного процесса и его распространенность. У 22 больных (51,1 %) этой группы при отсутствии симптомов перитонита и прогрессирования воспалительного процесса предпринята выжидательная тактика, позволяющая выполнить операцию в плановом порядке после купирования воспалительного процесса путем проведения курса антибактериальной и детоксикационной терапии. Однако у 15 (33,3 %) из 45 больных с клиникой прогрессирования перитонита и кишечной непроходимости пришлось выполнить экстренные оперативные вмешательства.
При локализации опухоли в правых отделах, печеночном изгибе, правой трети поперечной ободочной кишки с распространением воспалительной инфильтрации на брыжейку у 25 (55,5 %) больных была выполнена расширенная правосторонняя гемиколэктомия с адекватным дренированием забрюшинной клетчатки и брюшной полости в зоне оперативного пособия. При левосторонней локализации (n = 8 (16 %)) выполняли операцию типа Гартмана, так как наличие даже умеренного перифокального воспаления тканей в зоне оперативного вмешательства не создают условия для безопасного наложения первичного толстокишечного анастомоза, тем более при наличии параканкрозных абсцессов.
Тяжелым осложнением при раке ободочной кишки является перфорация кишечной стенки. Перфорацию кишечной стенки в зоне опухоли и диастатическую перфорацию проксимальнее опухоли мы наблюдали у 28 (14,2 %) больных. Значительно чаще это осложнение развивалось при поражении левых отделов ободочной кишки (n = 26 (92,8 %)) с перфорацией опухоли вследствие ее распада. Перфорация вне зоны опухоли от пролежня каловым камнем или перерастяжения кишечной стенки при обтурационной непроходимости выявлена у 2 (7,2 %) больных. Обнаруженные осложнения позволяют предполагать, что ведущим этиологическим фактором при диастатической перфорации кишки являются сосудистые расстройства и дистрофические изменения стенки кишки, тогда как основной причиной перфорации самой опухоли явились нарушения кровоснабжения с последующей ишемией и некрозом. Во всех случаях перфорации обнаружены при III и IV стадии заболевания преимущественно у пациентов пожилого и старческого возраста.
Исходы лечения в этой группе пациентов характеризовались наибольшим количеством осложнений и летальных исходов (n = 12, что составило 42,8 %).
Кишечные кровотечения являются нередким осложнением рака ободочной кишки. Мы наблюдали 25 (12,7 %) больных с профузными (n = 7, то есть 28 %) и рецидивирующими (n = 18 соответственно 72 %) кровотечениями из опухолей толстой кишки. Локализация опухолей, явившихся источником профузного кровотечения, по нашим данным была преимущественно в левой половине ободочной кишки (92 %), тогда как для рецидивирующих кровотечений более характерна правосторонняя локализация опухоли (8 %). Как правило, возникновение обильных кровотечений связано с аррозией сосудов при распаде опухолевой ткани.
Клиническая картина кишечного кровотечения проявляется значительной слабостью пациентов, анемией и кровянистыми выделениями или кратковременными периодическими кровотечениями из прямой кишки. Длительность существования этих признаков у 20 пациентов (80 %) превышала несколько месяцев. Эти больные длительно лечились и обследовались по поводу анемии, которая в определенной степени была связана не только с кровотечением, но и с раковой интоксикацией. Половина пациентов этой группы (n = 13, что составило 52 %) поступила в стационар с анемией тяжелой степени и требовала заместительных гемотрансфузий.
В диагностический алгоритм этой группы пациентов нами включены эндоскопия и ультразвуковая диагностика, которые в 72 % случаев помогли поставить правильный диагноз. Проведение экстренной диагностической фиброколоноскопии у 5 (20 %) больных было затруднительным вследствие невозможности адекватной подготовки кишечника к исследованию из-за наличия сгустков крови и поступления её из проксимальных отделов кишки, затрудняющих визуализацию и идентификацию источника кровотечения.
В связи с отсутствием эффекта от гемостатической терапии и невозможностью выполнения эндоскопического гемостаза 2 пациента с профузным кишечным кровотечением опухолевого генеза были оперированы по жизненным показаниям в ургетном порядке, выполнена правосторонняя гемиколэктомия. Крайне тяжелое состояние двух пациентов старческого возраста с анемией тяжелой степени позволило выполнить только паллиативные резекции сигмовидной кишки с кровоточащей опухолью по типу операции Гартмана. Эта группа пациентов с геморрагическими осложнениями опухолей ободочной кишки характеризовалась наименьшим количеством послеоперационных осложнений и двумя летальными исходами.
У 166 (84,7 %) пациентов удалось выполнить радикальную операцию. Умерло 26 пациентов, следовательно, послеоперационная летальность составила 13,3 %. Наибольшее количество осложнений в послеоперационном периоде выявлено у больных с перфорацией опухоли и развитием перитонита.
Таким образом, непосредственные результаты хирургического лечения больных осложненным течением рака ободочной кишки находятся в прямой зависимости от своевременной диагностики основного заболевания и его осложнения, обоснованной хирургической тактики, выбора способа и техники выполнения оперативного вмешательства, а также от полноценной профилактики и терапии послеоперационных осложнений.
Несмотря на современный уровень организации и оснащенность медицинской помощи, ранняя диагностика рака толстого кишечника остается на низком уровне, и выявление данной патологии происходит на поздних стадиях, что способствует увеличению периоперационных осложнений.
Рецензенты:
Аннотация научной статьи по клинической медицине, автор научной работы — Свистунов Николай Николаевич, Осипов Владимир Александрович, Шульга А. Ф., Терских Н. В., Пирогов Артур Валентинович
Ретроспективному анализу подверглись данные от 168 больных с осложненным колоректальным раком , которые были оперированы в больнице Святого Великомученика Георгия (Санкт-Петербург) в период с 2001 по 2009 год. Больные были разделены на две группы: первая 91 (54%) больной с колоректальным раком, осложненным перфорацией опухоли; вторая 77 (46%) пациентов с колоректальным раком, осложненным острой обтурационной кишечной непроходимостью. Авторами оценена эффективность собственной прогностической шкалы в сравнении с SAPS II.
Похожие темы научных работ по клинической медицине , автор научной работы — Свистунов Николай Николаевич, Осипов Владимир Александрович, Шульга А. Ф., Терских Н. В., Пирогов Артур Валентинович
Value of prognosis for of the sick with the complicated colorectal cancer
Data about 168 patients with complicated колоректальным a cancer which have been operated in hospital Sacred Great martyr George (St.-Petersburg) during the period with 2001 for 2009 has undergone to the retrospective analysis. Patients have been divided on two groups: the fi rst 91 (54,2 %) the patient with колоректальным a cancer complicated by punching of a tumour; the second 77 (45,8 %) patients with a colorectal cancer complicated by sharp intestinal impassability. Authors estimate effi ciency own prognosis scales in comparison with SAPS II.
УДК 616 Вестник СПбГУ. Сер. 11. 2011. Вып. 1
Н. Н. Свистунов2, В. А. Осипов1,
А. Ф. Шульга2, Н. В. Терских2, А. В. Пирогов2
ПРОГНОСТИЧЕСКОЕ ЗНАЧЕНИЕ ОЦЕНКИ ТЯЖЕСТИ СОСТОЯНИЯ БОЛЬНЫХ ОСЛОЖНЕННЫМ КОЛОРЕКТАЛЬНЫМ РАКОМ
Колоректальный рак является распространенным заболеванием и во многих странах мира по темпам роста он переместился на второе-третье место среди всех злокачественных новообразований [1]. Непрерывный рост числа больных со злокачественными новообразованиями пищеварительного тракта и высокая частота развития осложнений при этих заболеваниях привлекают к себе самое пристальное внимание специалистов хирургического профиля [2]. Ежегодно в Европе умирают свыше 190 000 больных раком этой локализации [3]. В России в структуре летальности от злокачественных новообразований колоректальный рак занимает 3 место (10,9%) после опухолей легкого и желудка [4]. По некоторым данным [5] заболеваемость раком ободочной кишки достигла 17 случаев на 100 000 человек. В Санкт-Петербурге количество онкологических больных за 15 лет возросло в 2 раза, а число пациентов с колоректальным раком увеличилось за это же время в 3 раза [6].
Самым частым осложнением рака ободочной кишки является острая обтураци-онная толстокишечная непроходимость, которая встречается у 20-40% больных раком ободочной кишки [7]. До 70-96,5% этих пациентов госпитализируются в Ш-ГУ стадиях заболевания [8, 9].
Большинство больных с опухолевым поражением толстой кишки — лица пожилого и старческого возраста. Как правило, они госпитализируются поздно, чаще всего с запущенными формами рака и длительно существующими явлениями кишечной непроходимости [10].
Одним из относительно редких, но чрезвычайно тяжелых осложнений опухоли толстой кишки является ее перфорация. Частота ее, по данным разных авторов, колеблется в широких пределах от 2,3 до 22,3% [8, 9, 11-13], а послеоперационная летальность достигает 23-88,9% [14, 15]. Как правило, это осложнение чаще возникает при локализации опухоли в левой половине ободочной кишки и наблюдается в 75-82% случаев [3, 7, 16].
Важным моментом оказания экстренной хирургической помощи онкологическому больному при развитии у него угрожающего жизни осложнения является тщательная оценка прогноза основного заболевания до того, как будет определен объем экстренной помощи, который должен соответствовать вероятности излечения или достижения относительно длительной ремиссии, в противном случае неадекватность проведения подобных мероприятий может лишь продлить мучительную жизнь больного [2, 17].
Цель исследования — изучить возможность применения нашей модифицированной шкалы для оценки тяжести состояния и прогноза течения заболевания у больных с осложненными формами колоректального рака в сравнении с уже существующими шкалами.
Методы. Ретроспективному анализу подверглись данные из историй болезни 168 больных с осложненным колоректальным раком, которые были оперированы в больнице Святого Великомученика Георгия (Санкт-Петербург) в период с 2001 по 2009 год. Больные были разделены на две группы: первая — 91 (54,2%) больной с колоректальным раком, осложненным перфорацией опухоли; вторая — 77 (45,8%) пациентов с колоректальным раком, осложненным острой обтурационной кишечной непроходимостью.
Для первой группы больных с перфорацией опухоли были характерны тяжелое или крайне тяжелое общее состояние, выраженные симптомы эндотоксикоза, положительные перитонеальные симптомы.
Вторая группа пациентов с колоректальным раком, осложненным острой обтура-ционной кишечной непроходимостью, характеризовалась тяжелым общим состоянием, отсутствием отхождения газов и кала в течение суток и более, тошнотой и многократной рвотой, схваткообразной болью в животе, нередко положительными перитонеальными симптомами, рентгенологическими признаками острой кишечной непроходимости (чаши Клойбера и другие).
Для оценки тяжести состояния больных и прогноза летальности нами была использована модифицированная шкала SAPS II (New Simplified Acute Physiology Score), для реанимационных больных. Общее состояние больных с помощью этой шкалы оценивается путем суммирования баллов по 15 показателям, с последующим вычислением вероятности летального исхода.
Также была изучена эффективность использования лейкоцитарного индекса интоксикации по Кальф-Калифу (ЛИИ) во времени, который отражает динамику воспаления в организме. Прогностическое значение этого индекса основывается на его существенной зависимости от тяжести эндотоксикоза.
Статистический анализ полученных данных выполнялся с помощью пакета математического анализа программы OpenOffice. Производилась проверка на нормальность распределения с помощью интеграла функции Гаусса. Статистически значимыми считались различия при оценке по критерию t Стьюдента при p Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Умершие 33,3 66,7 29,3 70,7
Таблица 3. Распределение больных по видам хирургических вмешательств
Название операции 1 группа (перфорация) 2 группа (ОКН)
Выжившие Умершие Выжившие Умершие
Обструктивная резекция толстой кишки (Гартмана) 38 9 24 9
Колостомия 4 10 12 20
Илеотрансверзостомия 0 2 0 1
Правосторонняя гемиколонэктомия 14 2 0 2
Дренирование и тампонирование брюшной плости 2 1 0 0
Илеостомия 0 1 0 0
Резекция тонкой кишки 0 1 0 2
Диагностическая лапаротомия 0 2 0 1
Ушивание перфорации тонкой кишки 0 0 0 1
Итого 58 28 36 36
Всего в 1 группе 86 72
Сравнивая результаты оценки тяжести состояния больных, удалось выявить значимые различия между умершими и выжившими больными (табл. 4). Среди больных 1-й группы значимые различия были выявлены только при использовании нашей модифицированной шкалы. У больных 2-й группы значимые различия были выявлены при использовании всех методик, однако ряд различий был найден при оценке состояния в ДБ по нашей модифицированной шкале (р Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Раковая интоксикация б (19%) 8 (20%)
Отказ от лечения 8 (24%) 7 (1б%)
Таблица 6. Показатели шкал тяжести и ЛИИ в зависимости от причины смерти
Причины смерти 1 группа (перф.) 2 группа (ОКH)
SAPS II (Баллы) SAPS II (вероятность) ЛИИ ДБ SAPS II (Баллы) SAPS II (вероятность) ЛИИ ДБ
ПОН 28±1,2** 9,5±1,0 12,9±4,0 11,1±2,0* 2б,4±1,2* 8,4±0,9* 9,б±2,1 10,0±1,4***
ОССН или ТЭЛА 24,0±2,б б,2±1,8 7,З±2,0 -5,0±4,5 25,9±2,2 8,0±1,4 б,2±2,0 -б,9±1,9
Раковая интоксикация 27,8±2,4 9,б + 2,0 б,7±2,З 0,5±1,4*** 22,9±2,4 б,0±1,2 7,8±1,9 -б,1±2,б
Отказ от лечения 19,З±1,4* З,7±0,7* 10,0±З,7* -З,4±2,2 24,б±1,5 б,7 + 1,1 9,4±1,7 -11,5±2,0
Выжившие 2З,1±0,7 б,1 + 0,4 8,1±1,1 -2,б±1,2 22,9±0,8 5,7 + 0,4 5,4±0,7 -10,2±2,2
В результате проведенного исследования были выявлены некоторые существенные данные, которые, на наш взгляд, могут быть использованы при оценке тяжести и перспектив лечения у больных с осложненным колоректальным раком.
Выявлены существенные различия по возрасту между умершими и выжившими больными, которые отражают общую тенденцию, описанную в литературе, а именно — риск летального исхода тем выше, чем больше возраст больного.
Различия в сроках пребывания в стационаре подтверждают, что пациенты, впослед-ствие умершие, имели значительно более тяжелое исходное состояние по сравнению с выжившими. Однако сроки лечения выживших больных превышают чаще всего 3-4 недели, что свидетельствует о тяжёлом течении заболевания у этих пациентов и длительности терапии. Это же подтверждается данными, полученными при изучении причин смерти. Тяжелая эндогенная интоксикация, безусловно, является одним из основных патогенетических факторов, который необходимо учитывать при прогнозировании результатов лечения наряду с сопутствующей возрастной патологией.
При оценке результатов применения прогностических шкал и ЛИИ для оценки тяжести состояния больного и прогноза его заболевания была выявлена информативность шкалы SAPS II, ЛИИ и нашей модифицированной шкалы при интоксикационном синдроме.
Обращает на себя внимание, что ЛИИ значительно повышен у всех больных в обеих группах, а значения шкалы SAPS II (вероятность летального исхода) даже у самых тяжелых больных не превышают 20%. На наш взгляд, такая вероятность даже с учетом максимальных значений недостаточна для объективной оценки перспектив лечения у этих больных. Несколько другая картина получена при применении нашей модифицированной шкалы оценки тяжести. Полученные значения для выживших и умерших от интоксикации существенно отличаются: от отрицательных (минусовых) значений ДБ до высоких положительных. Результаты представлены на рис. 1 и 2. Такое построение шкалы ДБ позволяет более уверенно использовать ее для оценки тяжести состояния и перспектив лечения у больных с осложненным колоректальным раком.
Наконец, наибольшую информативность все методы прогнозирования показывают для случаев летального исхода от ПОН. Прогнозировать с помощью этих методик риск
Рис. 1. Средние значения шкал тяжести и ЛИИ Рис. 2. Средние значения шкал тяжести и ЛИИ
у умерших от ПОН и выживших из 1-й группы у умерших от ПОН и выживших из 2-й группы
летального исхода от тромбоэмболических осложнений и ОССН до их наступления представляется мало перспективным.
Результаты проведенного исследования показывают достаточно высокую степень эффективности применяемых шкал для оценки тяжести и прогноза течения заболевания у больных с осложненными формами колоректального рака. При этом наибольшая эффективность выявлена при использовании адаптированной к конкретным условиям предложенной нами модифицированной шкалы.
Объективизация состояния больных позволяет прогнозировать вероятность летального исхода, продолжительность госпитализации, эффективность проводимого лечения [17].
Прогнозирование в хирургии — научно обоснованное предвидение результатов проводимых операций. Широко распространены на американском континенте и в некоторых европейских странах системы балльной оценки тяжести состояния хирургического больного. К ним относятся APACHE I, APACHE II, APACHE III (Acute Physiology Assessment and Chronic Health Evaluation), SAPS, SOFA и т. д. Они применяются в экстренной хирургии в ситуации крайней необходимости [18]. Говоря о наиболее популярной вследствие простоты (в ней используется всего 13 оценочных параметров) системе APACHE II, следует отметить, что по данным литературы, полученные с ее помощью прогностические данные недостоверны из-за ложного завышения частоты неудовлетворительных показателей лечения. Следует отметить, что APACHE создавалась для классификации групп пациентов, а не для индивидуального прогноза. [18, 19].
При прогрессировании перитонита и энтеральной недостаточности высокую прогностическую ценность приобретает значительное возрастание содержания в плазме крови токсических соединений промежуточного метаболизма. Выделяют три степени тяжести эндотоксикоза при ОНК, что дает возможность проводить объективную интегральную оценку состояния больных и прогнозировать течение заболевания. С учетом многофакторного характера структуры эндотоксикоза и диагностики его изменений при ОКН, выбор методов детоксикации должен быть дифференцирован с учетом фазы развития заболевания и степени эндотоксикоза [20].
Сравнение отечественных и зарубежных систем оценки тяжести состояния больных затруднено в связи с тем, что первые применяются в основном в тех лечебных учреждениях, где работают сами авторы, а вторые создаются на основе методов исследования, не имеющих широкого распространения в практической медицине России. Необходимо понимать, что системы и шкалы, которые существуют или появятся в будущем, не заменяют принятие индивидуальных решений специалистом, но помогают в принятии им лечебной тактики [21]. Доказательство информативности признаков, симптомов и их сочетаний в отношении прогноза является весьма трудоёмкой задачей и требует применения специальных статистических и математических программ обработки данных. Таким образом, проблема оценки тяжести и прогнозирования исходов лечения остается актуальной.
1. Мартынюк В. В. Рак ободочной кишки (заболеваемость, смертность, факторы риска, скрининг) // Практ. онкология. 2000. № 1. С. 3-9.
2. Гафтон Г. И., Щербаков А. М., Егоренков В. В., Гельфонд В. М. Нарушение проходимости желудочно-кишечного тракта // Практ. онкология. Т. 7, № 2. 2006. С. 77-82.
3. BorovacN. Carcinoma of the anus, rectum and colon // Med. Arch. 2003. Vol. 57, suppl. 2. P. 87-99.
4. Аксель Е. М., Давыдов М. И., Ушакова Т. И. Злокачественные новообразования желудочнокишечного тракта: Основные статистические показатели и тенденции // Современная онкология. 2001. Т. 3, № 4. С. 10-35.
5. Ривкин В. Л., Бронштейн А. С., Файн С. Н. Руководство по колопроктологии. М.: Медпрак-тика, 2001. 300 с.
6. Мерабишвили В. М. Численность и динамика контингентов онкологических больных в Санкт-Петербурге. Основные показатели оценки онкологической помощи больным / Злокачественные новообразования в Санкт-Петербурге. СПб., 1996. С. 129-138.
7. Зиневич В. П., Бабкин В.Я. Осложненные формы рака толстой кишки // Вестн. хирургии. 1991. Т. 146, № 2. С. 127-131.
8. Гринев М. В., Карачун Р. В., Бабков О. В. Современные подходы к лечению колоректального рака, осложненного острой толстокишечной непроходимостью // Скорая медицинская помощь. 2004. Т. 5, № 3. С. 79.
9. Попов Д. Е., Семёнов А. В., Григорян В. В. и др. Хирургическое лечение кишечной непроходимости у больных обтурирующим раком левых отделов толстой кишки // Вестн. С.-Петерб. ун-та. Сер. 11. 2009. Вып. 2. С. 100-107.
10. Алекперов С. Ф., Пугаев А. В., Ачкасов Е. Е. и др. Современные тенденции в хирургическом лечении обтурационной толстокишечной непроходимости опухолевого генеза // Рос. онкол. журнал. 2010. № 1. С. 54-58.
11. Ponzano C., Nardi S., Carrieri P., Basili G. Diagnostic problems, pathogenetic hypothesis and therapeutic proposals in Ogilvie’s syndrome: Review of 470 observations from the literature and presentation of 5 new cases // Minerva Chir. 1997. Vol. 52, № 11. P. 1311-1320.
12. Repse S., Calic M., Zakelj B. et al. Emergency colorectal surgery: Our results and complications // Ann. Ital. Chir. 1996. Vol. 67, № 2. P. 205-209.
13. Freeman H. P., Alshafie T. A. Colorectal carcinoma in poor blacks // Cancer. 2002. Vol. 94, № 9. P. 2327-2332.
14. Tobaruela E., Camuсa J., Enriquez-Navasces J. M. et al. Medical factors in the morbidity and mortality associated with emergency colorectal cancer surgery // Rev. Esp. Enferm. Dig. 1997. Vol. 89, № 1. P. 13-22.
15. Ceriati F., Tebala G. D., Ceriati E. et al. Surgical treatment of left colon malignant emergencies: A new tool for operative risk evaluation // Hepatogastroenterology. 2002. Vol. 49, № 46. P. 961-966.
16. Дмитриев М. О., Сотниченко Б. А., Дмитриев О. Н., Дублев Г. Н. Результаты хирургического лечения толстокишечной непроходимости опухолевой природы // Скорая медицинская помощь. 2004. Т. 5, № 3. С. 86-87.
17. Brun-Buisson C., Doyon F., Carlet J. et al. Incidence, risk factors and outcome of severe sepsis and septic shock in adults // JAMA. 1995. Vol. 274. P. 968-974.
18. Шевченко Ю. А., Кузнецов М. А., Анисимова О. В., Тальберг П. И. Прогнозирование послеоперационных осложнений в плановой хирургии // Хирургия. 2003. № 10.
19. Чернов В. Н., Белик Б. М., Пшуков Х. Ш. Прогнозирование исхода и выбор хирургической тактики при распространенном гнойном перитоните // Хирургия. 2004. № 3. С. 47.
20. Чернов В. Н., Белик Б. М. Выбор хирургической тактики и методов дезинтоксикации при острой непроходимости кишечника // Хирургия. 1999. № 5. С. 45.
21. Лебедев Н. В., Климов А. Е. Системы оценок тяжести сепсиса и эндогенной интоксикации // Хирургия. 2006. № 5. С. 53-56.
22. Свистунов Н. Н., Ивлев В. В. О возможности прогнозирования исходов острого панкреатита с тяжелым течением // Вестн. С.-Петерб. ун-та. 2009. Сер. 11. Вып. 3. С. 135-142.
Статья поступила в редакцию 10 февраля 2011 г.
Читайте также:


