Ациклические нуклеозиды для лечения герпеса
ПРОТИВОВИРУСНЫЕ ХИМИОПРЕПАРАТЫ
Существует несколько групп противовирусных препаратов, различающихся по клинико-фармакологическим характеристикам и особенностям практического использования:
противогерпетические,
противоцитомегаловирусные,
противогриппозные,
препараты расширенного спектра,
антиретровирусные.
ПРОТИВОГЕРПЕТИЧЕСКИЕ ХИМИОПРЕПАРАТЫ
К основным противогерпетическим ЛС с эффективностью, доказанной в рандомизированных клинических исследованиях, относятся четыре близких по структуре препарата из группы аналогов нуклеозидов - ацикловир, валацикловир, пенцикловир и фамцикловир. Причем валацикловир и фамцикловир представляют собой исходно неактивные соединения, которые в организме человека превращаются в ацикловир и пенцикловир, соответственно. Все эти ЛС блокируют синтез ДНК у размножающихся вирусов герпеса, но не действуют на вирусы, находящиеся в латентном состоянии.
При резистентности ВПГ и вируса varicella-zoster применяют фоскарнет в/в*.
Для местного применения используются ацикловир, пенцикловир, идоксуридин, фоскарнет и тромантадин.
В России при офтальмогерпесе применяется отечественный препарат полудан, обладающий интерфероногенными и иммуномодулирующими свойствами, однако рандомизированных клинических испытаний этого препарата не проводилось.
Аналоги нуклеозидов
Механизм действия
Ацикловир является родоначальником противогерпетических препаратов – блокаторов синтеза вирусной ДНК. Противовирусное действие оказывает активный метаболит ацикловира - ацикловира трифосфат, который образуется в клетках, пораженных вирусом герпеса. Ингибируя вирусную ДНК-полимеразу, ацикловира трифосфат блокирует синтез вирусной ДНК. Препарат обладает очень низкой токсичностью, так как не действует на ДНК-полимеразу клеток человека и неактивен в здоровых клетках.
Пенцикловир в пораженных вирусом клетках человека активируется, превращаясь в пенцикловира трифосфат, который нарушает синтез вирусной ДНК. Пенцикловир имеет длительный внутриклеточный период полувыведения (7–20 ч), что значительно выше, чем у ацикловира (менее 1 ч). Но он обладает меньшим сродством к вирусной ДНК-полимеразе, чем фосфорилированный ацикловир.
В целом, все три препарата (ацикловир, валацикловир и фамцикловир) при приеме внутрь имеют сравнимую клиническую эффективность.
Фоскарнет образует неактивные комплексы с ДНК-полимеразой герпетических вирусов и ЦМВ.
Спектр активности
Наиболее чувствительны к ацикловиру ВПГ 1 и 2 типа. Вирус varicella-zoster более чем в 20 раз, а ЦМВ в 470 раз менее чувствителен к ацикловиру, чем ВПГ 1 типа. Пенцикловир очень близок к ацикловиру по активности в отношении к ВПГ 1 и 2 типа и вируса varicella-zoster.
Резистентность к противогерпетическим препаратам является редким явлением, особенно у пациентов с нормальным иммунитетом. Ацикловирорезистентные штаммы при умеренном иммунодефиците могут встречаться у 6–8% пациентов, а у пациентов, длительно получавших иммуносупрессивную терапию, и при СПИДе резистентность возрастает до 17%. Следует учитывать, что ацикловирорезистентные штаммы также устойчивы к валацикловиру и фамцикловиру. В этом случае препаратом выбора является фоскарнет * .
* Лекарственная форма для в/в введения не зарегистрирована в России
Фармакокинетика
Для перорального применения используются три препарата: ацикловир, валацикловир и фамцикловир, а в/в вводится только ацикловир. Наиболее низкую биодоступность при приеме внутрь имеет ацикловир (15–20%), но даже суточная доза 0,8–1,0 г достаточна для подавления ВПГ. Валацикловир является валиновым эфиром ацикловира, предназначенным для приема внутрь, и имеет значительно более высокую биодоступность (54%). В процессе всасывания в ЖКТ и в печени он превращается в ацикловир.
Биодоступность фамцикловира при приеме внутрь натощак - 70–80%. В ЖКТ превращается в пенцикловир, который затем фосфорилируется в клетках, пораженных вирусом.
Пенцикловир применяют только наружно, так как при приеме внутрь он имеет очень низкую биодоступность (5%).
Ацикловир хорошо распределяется в организме. Проникает в слюну, внутриглазную жидкость, вагинальный секрет, жидкость герпетических пузырьков. Проходит через ГЭБ. При местном применении незначительно всасывается через кожу и слизистые оболочки.
Как ацикловир, так и пенцикловир экскретируются преимущественно почками, на 60–90% в неизмененном виде. Ацикловир выводится путем клубочковой фильтрации и канальцевой секреции. Препараты имеют примерно сходный период полувыведения – 2–3 ч, у детей младшего возраста - до 4 ч. При почечной недостаточности (клиренс креатинина менее 30 мл/мин) период полувыведения значительно возрастает, что требует коррекции доз и режимов введения.
Фармакокинетика фоскарнета при местном применении не исследована.
Нежелательные реакции
Ацикловир, как правило, хорошо переносится пациентами, НР развиваются редко.
Местные
Жжение при нанесении на слизистые оболочки, особенно при вагинальном применении;
флебит при в/в введении.
Системные
ЖКТ: боль или дискомфорт в животе, тошнота, рвота, диарея.
ЦНС: у 1–4% пациентов при в/в введении ацикловира отмечаются заторможенность, тремор, судороги, галлюцинации, бред, экстрапирамидные расстройства. Симптомы обычно появляются в первые 3 сут лечения, связаны с высоким уровнем ацикловира в сыворотке крови (более 25 мкг/мл) и постепенно исчезают по мере его понижения. Факторы риска: почечная недостаточность, сопутствующее применение других нейротоксичных препаратов, интерферона, метотрексата.
Почки: вследствие кристаллизации препарата в почечных канальцах у 5% пациентов при в/в введении развивается обструктивная нефропатия, проявляющаяся тошнотой, рвотой, болью в пояснице, азотемией. Факторы риска: детский возраст, быстрое в/в введение, большие дозы, высокие концентрации ацикловира в плазме, обезвоживание, заболевания почек, сопутствующее применение других нефротоксичных препаратов (например, циклоспорина). Меры профилактики: обильное питье. Меры помощи: отмена препарата, инфузионная терапия.
Другие: головная боль, головокружение (чаще у пожилых людей).
Валацикловир по переносимости близок к ацикловиру для перорального приема. Особенностью являются редкие случаи развития тромботической микроангиопатии у пациентов с иммуносупрессией (больные СПИДом, онкологические пациенты), получающих множественную фармакотерапию.
По профилю безопасности у взрослых фамцикловир близок к ацикловиру. Наиболее частыми НР являются головная боль и тошнота.
Показания
Инфекции, вызванные ВПГ 1 и 2 типа:
инфекции кожи и слизистых оболочек;
офтальмогерпес (только ацикловир);
Инфекции, вызванные вирусом varicella-zoster:
Профилактика ЦМВ инфекции после трансплантации почек (ацикловир, валацикловир).
Местная терапия
Инфекции кожи и слизистых оболочек, вызванные ВПГ.
Противопоказания
Предупреждения
Беременность. Безопасность системной терапии ацикловиром, валацикловиром и фамцикловиром беременных полностью не доказана. Назначение ацикловира в I триместре беременности не увеличивает риска возникновения врожденных дефектов, по сравнению со средним уровнем в популяции. Результаты применения валацикловира и фамцикловира при беременности носят предварительный характер и не могут быть основанием для их регулярного применения. Однако ацикловир может с осторожностью применяться у беременных внутрь как во время первичного эпизода, так и при рецидивах герпеса.
Кормление грудью. Ацикловир проникает в грудное молоко, поэтому ацикловир и валацикловир следует применять с осторожностью женщинам, кормящим грудью.
Педиатрия. Основным препаратом для применения в педиатрии является ацикловир, так как он наиболее хорошо изучен у детей. Имеются рекомендации о возможности применения валацикловира и фамцикловира у детей старше 12 лет с иммунодефицитом. Однако валацикловир нельзя применять у детей с иммунодефицитом, вызванным ВИЧ. Дозу ацикловира у детей до 12 лет лучше рассчитывать на площадь поверхности тела: 0,25 г/м 2 , вместо 5 мг/кг; 0,5 г/м 2 , вместо 10 мг/кг.
Гериатрия. Учитывая возрастное понижение функции почек, перед началом терапии, особенно внутрь в больших дозах и при в/в введении, следует оценивать клубочковую фильтрацию. Может потребоваться коррекция режима дозирования.
Нарушение функции почек. Перед применением системных противогерпетических препаратов желательно определять клубочковую фильтрацию. Это обязательно следует делать при использовании внутрь в больших дозах и при в/в введении. У пациентов с нарушением функции почек дозу следует уменьшить. У пациентов, получающих гемодиализ, валацикловир применяют в дозе, рекомендуемой при клиренсе креатинина менее 15 мл/мин, причём препарат лучше принимать после сеанса гемодиализа.
Нарушение функции печени. У пациентов с печеночной недостаточностью коррекции дозы ацикловира и валацикловира не требуется, однако опыт применения этих препаратов у пациентов с тяжелым нарушением функции печени недостаточен. При печеночной недостаточности дозу фамцикловира следует уменьшить.
СПИД. При использовании валацикловира в больших дозах (0,8–3,2 г/сут) у пациентов со СПИДом отмечено повышение частоты развития тромботической микроангиопатии. При длительной супрессивной терапии валацикловиром в дозе 0,25–1 г/сут частота её развития не повышается.
Лекарственные взаимодействия
При сочетании ацикловира с аминогликозидами или другими нефротоксичными ЛС возрастает риск неблагоприятного воздействия на почки.
При сочетании ацикловира с зидовудином увеличивается риск развития нейротоксических реакций.
При сочетании валацикловира с циметидином увеличивается концентрация в крови ацикловира.
Информация для пациентов
Применение противогерпетических препаратов следует начинать как можно раньше, после появления первых симптомов заболевания. Внутрь можно принимать независимо от приема пищи.
Следует строго соблюдать предписанный режим назначений во время всего курса лечения, не прекращать лечение раньше положенного срока. В случае пропуска дозы принять ее как можно скорее. Не принимать ее, если почти наступило время приема следующей дозы (не удваивать дозу).
Необходимо проконсультироваться с врачом, если улучшение не наступает в течение нескольких дней или появляются новые симптомы.
Пораженные участки кожи следует содержать в чистоте и по возможности не носить плотно прилегающую к ним одежду. При герпетических высыпаниях на половых органах воздерживаться от половых контактов до полного заживления изъязвлений. Прием противогерпетических препаратов не предотвращает передачу генитального герпеса при половом контакте, поэтому рекомендуется пользоваться барьерными методами контрацепции (презерватив).
Применение противогерпетических препаратов не ведет к полному излечению, так как вирус герпеса сохраняется в организме в неактивном (латентном) состоянии.
Идоксуридин
Противогерпетический препарат, который применяется только в офтальмологии для лечения и профилактики инфекций, вызванных ВПГ.
Нежелательные реакции
Раздражение, боль, зуд краснота, отек, помутнение роговицы, появление пятен или точечных дефектов на эпителии роговицы.
Аллергические реакции в редких случаях.
Показания
Профилактика рецидивов герпетического кератита в раннем послеоперационном периоде после лечебной кератопластики.
Противопоказания
Повышенная чувствительность к препарату.
Предупреждения
Не применять при глубоких формах кератита.
Соблюдать осторожность при совместном применении с глюкокортикоидами.
Неэффективен при аденовирусных конъюнктивитах.
Тромантадин
Тромантадин является производным амантадина, применяющегося для терапии гриппа. Противовирусное действие обусловлено торможением репликации герпесвирусов.
В настоящее время вместо тромантадина применяют более активные препараты из группы ациклических нуклеозидов (ацикловир и др.).
Нежелательные реакции
Показания
Инфекции кожи и слизистых оболочек, вызванные ВПГ и varicella-zoster.
Противопоказания
Аллергические реакции на препарат.
Предупреждения
Данные о безопасности применения тромантадина при беременности и кормлении грудью отсутствуют.
Generic synthetic acyclic nucleosides in causal treatment of herpes simplex relapses
Актуальность. Появление на отечественном фармацевтическом рынке воспроизведенных ациклических синтетических нуклеозидов требует оценки их эффективности и безопасности для разработки дальнейших рекомендаций по применению в клинической практике. Цель исследования — провести изучение эффективности и безопасности новой формы валацикловира, а также комплаентности лечению. Материал и методы. Проведено изучение эффективности и безопасности препарата Валвир при купировании рецидивов простого герпеса (ПГ). У всех обследованных пациентов отмечалось тяжелое течение герпетической инфекции с частотой рецидивов не менее 6—8 раз в год. В основном симптомы проявлялись в виде ограниченного зуда. Валвир назначался в стадии предвестников по 500 мг (1 таблетка) 2 раза в сутки в течение 5 дней. Результаты. Отмечено, что во всех случаях начала приема препарата на стадии предвестников ПГ вирусный процесс прерывался и клинические проявления не развивались. Все пациенты отметили положительную настроенность на терапию в дальнейшем, часть больных выразили готовность к пролонгированному приему препарата. Заключение. Валвир является высокоэффективным средством для купирования рецидивов простого герпеса с хорошим профилем безопасности.
Ключевые слова: простой герпес, лечение, ациклические нуклеозиды, валацикловир, Валвир.
Relevance. Launching of generic synthetic acyclic nucleosides to the Russian pharmaceutical market requires an assessment of their efficacy and safety in order to develop further recommendations for application in clinical practice. Objective. To study efficacy and safety of a new form of valaciclovir as well as treatment compliance. Material and methods. Efficacy and safety of Valvir in arresting herpes simplex relapses were studied. All the examined patients had severe herpetic infections with a relapse rate of at least 6—8 times a year. Limited itching was the main symptom. Valvir was administered at the premonitory phase at a dose of 500 mg (1 tablet) BID for 5 days. Results. In all cases of administration of the drug, the viral process was stopped at the premonitory phase of GS and no clinical manifestations occurred. All patients were positively disposed to further therapy; some patients expressed willingness to prolonged drug intake. Conclusion. Valvir is highly effective in arresting herpes simplex relapses and has a good safety profile.
Key words: herpes simplex, treatment, acyclic nucleosides, valacyclovir, Valvir.
Этиотропная терапия простого герпеса (ПГ) является общепризнанным подходом к лечению острых проявлений вирусной инфекции и профилактике ее обострений, входя во все международные стандарты и рекомендации. Основанием для этого служат многочисленные многоцентровые плацебо-контролируемые рандомизированные исследования, а также многолетний положительный опыт применения противовирусных средств при лечении пациентов с различными формами ПГ. Современные этиотропные противогерпетические препараты (ацикловир, валацикловир, фамцикловир) по уровню доказательности относятся к группе А [1, 2].
Однако только в 1974 г. появление первого современного аналога ациклических естественных нуклеозидов — ацикловира — позволило сделать значительный шаг вперед в этиотропной терапии герпетической инфекции. Механизм противогерпетического действия ациклических нуклеозидов, по сравнению с другими противовирусными препаратами, во многом уникален. Если опустить фармакологические тонкости, то он базируется на следующем. Во-первых, ациклические нуклеозиды комплементарны исключительно ферментам ВПГ, что обусловливает их высочайшую избирательность по отношению к вирусу без вмешательства в биохимические процессы свободных от него клеток организма. Во-вторых, герпесвирусная тимидинкиназа (гуанилаткиназа) связывается с химиопрепаратами в тысячу раз быстрее, чем клеточная — это обеспечивает накопление действующего вещества исключительно в инфицированных клетках и объясняет отсутствие мутагенных, тератогенных или цитотоксических свойств, даже при их длительном приеме. В-третьих, ДНК-полимераза герпесвирусов всегда ошибочно включает фосфорилированные ациклические нуклеозиды в концевые участки синтезируемых новых вирусных ДНК вместо естественного дезоксигуанозинтрифосфата, в результате чего нарушается репликация возбудителя.
Следующим шагом, позволившим повысить эффективность этиотропной терапии и ее комплаентность, стал синтез двух предшественников ациклических синтетических нуклеозидов — валацикловира (L-валиновый эфир ацикловира) и фамцикловира (пероральная форма препарата-предшественника пенцикловира).
Препарат валацикловир по сравнению с ацикловиром имеет более высокую биодоступность (54%) и длительность полувыведения (10—20 ч). Это в свою очередь позволяет снизить кратность приема препарата до 2 раз в сутки, что значительно удобней для пациентов.
В период действия патента единственный препарат валацикловира выпускался под торговой маркой валтрекс. Его эффективность, высокий профиль безопасности и удобство применения неоднократно показаны в многочисленных исследованиях [4—6]. Именно эти исследования позволили валацикловиру занять достойное место в терапии и профилактике герпесвирусных инфекций.
Материал и методы
Для оценки эффективности и безопасности препарата Валвир нами проведено его изучение при купировании рецидивов ПГ. Под наблюдением находились 30 пациентов, из них 19 женщин и 11 мужчин в возрасте от 25 до 46 лет. У всех пациентов отмечалось тяжелое течение герпетической инфекции с частотой рецидивов не менее 6—8 раз в год. По локализации высыпаний ПГ у 21 из них была генитальная форма инфекции, у 6 — глютеальная и у 3 — лабиальная. Все пациенты ранее, иногда неоднократно, получали лечение ациклическими синтетическими нуклеозидами, в том числе и валацикловиром, что позволяло ретроспективно оценить сравнительный клинический эффект и безопасность терапии. Диагноз ПГ ставился на основании типичной дерматологической картины. У всех пациентов обострение начиналось с появления предвестников различной степени выраженности. Симптомы инициальных проявлений рецидива носили разнообразный характер, но в основном проявлялись в виде ограниченного зуда.
Дизайн исследования
Для получения наиболее объективных результатов по эффективности и безопасности препарата Валвир было предусмотрено его назначение на стадии предвестников. Для этого на амбулаторном приеме пациентам с частыми рецидивами ПГ предлагалось при появлении первых признаков предвестников нового обострения начать лечение ациклическим нуклеозидом. В случае согласия пациента препарат Валвир выдавался на руки с подробной инструкцией по способу его применения. Схема и дозы были обычными — по 500 мг (1 таблетка) 2 раза в сутки в течение 5 дней. Также пациенту выдавался дневник наблюдения, в котором он должен был отмечать наличие симптоматики, ее выраженность, а также фиксировать динамику развития герпесвирусного процесса. Выраженность симптоматики оценивалась в баллах (от 0 до 3). В качестве симптомов фиксировались типичные предвестники рецидива ПГ: гиперемия, отечность, пузырьки, корочки и местные субъективные ощущения. В дневнике наблюдения пациент также отмечал переносимость лечения, фиксируя в нем любые побочные действия терапии в случае их возникновения. В случае рецидива пациенты сообщали о нем по телефону, а после окончания курса лечения им назначали визит. На визите мы вместе с пациентами подробно анализировали дневник наблюдений, уточняли детали и еще раз фиксировали их внимание на возможных побочных или нежелательных эффектах лечения. Также мы просили пациентов дополнительно оценить комплаентность терапии. С этой целью пациенты отвечали на вопросы, которые позволяли оценить удовлетворенность и удобство проведенного лечения. Ответы на каждый из вопросов был градуирован в баллах (от 1 до 5). Более высокая оценка соответствовала большей удовлетворенности пациента.
Результаты исследования
Данные проведенного наблюдательного несравнительного исследования показали, что во всех случаях, когда прием препарата, согласно своему механизму действия, начинался на стадии предвестников, герпесвирусный процесс прерывался и клинические проявления не развивались. Оценка динамики клинических симптомов в баллах показывала, что через 12 ч после первого приема валацикловира интенсивность субъективной симптоматики, присущей явлениям предвестников, снижалась у 36% пациентов до 1 балла, у 64% — до 2 баллов. До начала лечения у всех больных выраженность различного рода местных реакций оценивалась в 3 балла. На 2-й день терапии у 8 (26,6%) пациентов сохранялись слабо выраженные субъективные явления, а также развивалась небольшая гиперемия. Однако все эти проявления полностью исчезали к 3-му дню лечения. Формирование патогномоничной для ПГ стадии пузырьков не было ни в одном из случаев. Данные клинических результатов исследования представлены на рис. 1. При анализе переносимости терапии валацикловиром и развитии нежелательных или побочных эффектов лечения нетипичных случаев не отмечалось. У 2 пациентов возникали ощущения тошноты, а 1 больная отмечала незначительные головные боли, однако это не потребовало отмены препарата. Все описанные выше реакции укладываются в спектр побочных эффектов, присущих ациклическим синтетическим нуклеозидам.
Рис. 1. Данные результатов клинической эффективности Валвира.
При анализе комплаентности терапии, который базировался на оценке ответов на вопросы пациентов, было отмечено, что все больные удовлетворены результатами лечения. Это было связано с тем, что пациенты впервые были правильно ориентированы на своевременное начало приема противовирусного препарата. Ранее они начинали лечение при уже сформировавшихся пузырьках. Также все пациенты отметили значительное повышение качества жизни, так как быстрое купирование процесса на ранних стадиях обострения не нарушало их нормальной жизнедеятельности. Интересные данные были получены при оценке удобства терапии. Около половины пациентов высоко оценили этот пункт, вторая же половина высказывалась в пользу сокращения кратности приема препарата, так как 2-кратный прием был им не совсем удобен. Благодаря полученному эффекту от проведенного лечения все пациенты отметили положительную настроенность на лечение в дальнейшем. Более того, часть больных выразили готовность к пролонгированному приему препарата. Данные по изучению комплаентности терапии представлены на рис. 2.
Рис. 2. Результаты изучения комплаентности терапии Валвиром.
| Удовлетворенность результатом терапии | 5 баллов - 100% |
| Повышение качества жизни | 5 баллов - 87%; 4 балла - 13% |
| Удобство терапии | 5 баллов - 56%; 4 балла - 32%; 3 балла - 12% |
| Настроенность на терапию в дальнейшем | Да - 60%, Нет - 40% - выбор в пользу пролонгированного приема |
Заключение
В результате проведенного исследования было доказано, что препарат Валвир является высокоэффективным средством для купирования рецидивов ПГ и имеет хороший профиль безопасности.
При начале приема Валвира на стадии предвестников он быстро купирует клинические проявления инфекции, что говорит об остановке репликации ВПГ и препятствию в большинстве случаев развития герпетических высыпаний. По оценке пациентов, препарат Валвир значительно повышает качество жизни за счет быстрого прекращения развития герпесвирусного процесса, что дает возможность больным спокойно жить со своим заболеванием и не испытывать от него физического и морального дискомфорта.

В своей практической деятельности врачи многих специальностей встречаются с заболеваниями, вызванными вирусами семейства Herpesviridae, которые широко распространены в человеческой популяции. Они способны поражать практически все органы и системы организма хозяина, вызывая латентную, острую и хроническую формы инфекции при этом, спектр клинических проявлений, развитие которых они обусловливают, чрезвычайно широк [7]. Особого внимания заслуживает рецидивирующая форма герпетической инфекции (ГИ), относящаяся к числу наиболее распространенных психосоматических кожных заболеваний. Хроническое течение, зуд, частая локализация и характер высыпаний на лице или интимно значимых участках кожного покрова сопровождаются изменениями эмоциональной сферы. В свою очередь, состояния стресса, восприятие самим пациентом проявлений болезни оказывает влияние на интенсивность и частоту рецидивов простого герпеса (ПГ) [24].
Многочисленные исследования в области проблемы ГИ, особенно вызванные вирусами простого герпеса (ВПГ) 1 и 2 типов, не теряют своей актуальности в настоящее время [21, 16].
Серьёзной проблемой является высокая инфицированность здорового населения, преимущественно молодого, трудоспособного возраста. В мире ежегодно заражаются от 16 до 800, а в России – от 40 до 80 человек на 100 тыс. населения. В настоящее время заболеваемость ПГ крайне высока, по статистике ВОЗ, она занимает второе место среди вирусных поражений, уступая лишь гриппу. ВПГ-1 инфицировано около 90 % взрослого населения планеты, распространенность ВПГ-2 колеблется от 7 до 40 %. В США ежегодно регистрируется до 98 млн случаев лабиального герпеса и 20 млн случаев рецидивирующего герпеса гениталий, 500 тыс. случаев офтальмогерпеса и более 5 тыс. случаев герпетического энцефалита, около 1 тыс. случаев герпеса новорожденных. По мнению ведущих специалистов, в нашей стране ежегодная заболеваемость герпесом губ составляет 10 млн, герпесом кожи – 1 млн, офтальмогерпесом – 250 тыс. случаев. Рецидивирующими формами герпеса страдают от 10 до 20 % населения, а ежегодный прирост увеличивается на 15–17 % [3, 13, 23].
Литературные данные свидетельствуют, что большинство населения Земли инфицировано ВПГ-1, ВПГ-2 или тем и другим вирусом одновременно. Первичная инфекция, ассоциированная с ВПГ-1 или ВПГ-2, может протекать в клинически выраженной форме в очаге инфицирования (например, в орофациальной или генитальной области) либо как бессимптомная или нераспознанная инфекция. Генитальная форма простого герпеса может быть связана с ВПГ-1, так же как и лабиальная форма – с ВПГ-2. После первичного инфицирования у 50–75 % больных отмечается рецидивирующее течение простого герпеса. В течение первых 12 месяцев после инфицирования ВПГ-2 рецидив возникает у 80 % пациентов, ВПГ-1 – у 55 % [15, 26].
Современная медицина не располагает методами лечения, позволяющими элиминировать ВПГ из организма человека. Целью лечения герпеса является: 1) подавление репродукции ВПГ в период обострения (купирование рецидива); 2) снижение частоты и длительности рецидивов заболевания, тяжести их течения; 3) формирование адекватного иммунного ответа и его длительное сохранение с целью блокирования реактивации ВПГ в очагах персистенции.
Всё разнообразие методов терапии и профилактики обострения герпесвирусных инфекций можно сгруппировать в направления этиотропного, патогенетического и симптоматического лечения с применением химиотерапии, иммунотерапии и комплексного лечения [1, 7, 11].
Большое внимание уделяется антигерпетическим соединениям растительного происхождения, природным антиоксидантам, адаптогенам из лекарственного растительного сырья и витаминно-минеральным комплексам, ввиду изменения иммунного статуса пациентов [14, 19].
Патогенетическая терапия направлена на нормализацию функции иммунной системы организма, в том числе на активацию системы интерфероновой защиты, как правило, связанная с применением интерферонов (ИФН), индукторов ИФН и иммуномодуляторов. Специфическая иммунотерапия состоит в применении герпетической вакцины, хотя ряд исследователей считает, что надежды, возлагаемые на специфическую вакцинопрофилактику, не оправдали себя [11, 19]. Иммунотропные препараты, обладающие активностью против вируса герпеса, разнообразны и представлены в таблице.
Иммунотропные препараты, обладающие активностью против вируса герпеса
Использование противовирусной химиотерапии велико при лечении рецидивирующих форм простого герпеса с поражением кожи и слизистых оболочек. В лечении простого герпеса с применением противогерпетических химиопрепаратов можно выделить два принципиально отличающихся друг от друга подхода: 1) эпизодическое лечение – прием ациклических нуклеозидов (АН) в момент рецидива в терапевтических дозах при соблюдении кратности и длительности лечения; 2) супрессивная терапия – длительный, иногда многолетний, постоянный прием препаратов АН вне рецидива в более низких дозах [9, 25].
Согласно проведенным исследованиям, биодоступность (per os) противогерпетических препаратов из группы ациклических нуклеозидов возрастает следующим образом: ацикловир – 20 %, валацикловир – 54 % и фамцикловир – 77 % [24]. Тем не менее применение ацикловира по-прежнему остаётся востребованным среди врачей и пациентов в настоящее время, и одновременно ведутся исследования по увеличению растворимости ацикловира [5] и синтезу его производных [8].
В разные годы предпринимались многочисленные попытки повысить эффективность лечения ПГ путем комбинированной терапии. С этой целью использовались различные сочетания средств иммунного влияния, а также препаратов, отличающихся по этиопатогенетическому механизму действия [20].
Возможно сочетанное использование противовирусной терапии и глюкокортикостероидов. Выявлено, что такая комбинация эффективнее монотерапии противовирусными препаратами, особенно для лечения острой боли и коррекции различных аспектов качества жизни пациентов. Комбинация ацикловир + преднизолон значительно быстрее купирует острую боль и возвращает пациента к обычной жизнедеятельности в случае постгерпетической невралгии [2].
Наружные средства дополняют системную противовирусную терапию. Многочисленные наблюдения подтверждают, что в случае назначения таблетированных форм ациклических нуклеозидов на стадии предвестников в сочетании с наружной противовирусной терапией значительно чаще удается полностью прервать дальнейшее развитие рецидива или наблюдать его абортивное течение [20].
Местная терапия противовирусных лекарственных средств при герпесе кожи и слизистых оболочек требуется для уменьшения отёка, экссудации, боли и зуда, ускорения заживления язвочек и эрозий и сокращения длительности выделения вируса на участках поражения [22]. Применение данных лекарственных форм начинают при появлении первых признаков активации инфекции (чувство жжения, зуд и т.д.) и продолжают вплоть до эпителизации эрозий. Рано начатое местное лечение может предотвратить развитие везикул.
В комплексную терапию пациентов с простым герпесом необходимо включать местные противовирусные средства, способствующие стабилизации и разрешению процесса [12].
При анализе ассортимента противовирусных средств на российском рынке установлено, что большинство противовирусных препаратов выпускается в виде твёрдых лекарственных форм – 66 %, в виде мягких лекарственных форм – 22 %, а в форме жидких – 12 % [22], лидером же является ацикловир [6].
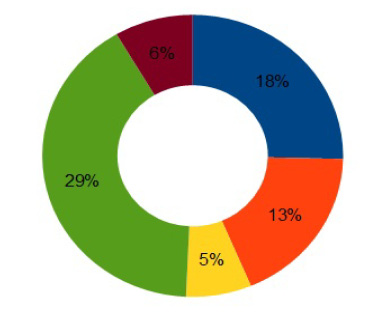

Ассортимент лекарственных форм, содержащих ацикловир
Следует отметить, что современная фармакотерапия герпеса эффективно уменьшает его клинические проявления, положительно влияет на психическое состояние пациентов и приобретает комплексный подход. Несмотря на различные достижения в лечении герпеса, ацикловир по-прежнему играет значительную роль в данном направлении и привлекает внимание исследователей по созданию комбинированных препаратов. В связи с чем актуальными являются исследования по разработке лекарственной формы комбинированного состава, обладающей противогерпесным эффектом – медицинские карандаши.
Рецензенты:
Степанова Э.Ф., д.фарм.н., профессор, профессор кафедры технологии лекарств ПМФИ – филиала ГБОУ ВПО ВолгГМУ Минздрава России, г. Пятигорск;
Хаджиева З.Д., д.фарм.н., профессор, профессор кафедры технологии лекарств ПМФИ – филиала ГБОУ ВПО ВолгГМУ Минздрава России, г. Пятигорск.
Читайте также:


