Стафилококк коагулазо-отрицательный в моче
Золотистый стафилококк (Staphylococcus aureus) – грамположительная условно-патогенная бактерия, распространенная повсеместно. В норме золотистый стафилококк могжет находиться у человека на слизистой оболочке носа, в брюшной полости и на коже.
Попав в организм человека, золотистый стафилококк вырабатывает токсины и может стать источником сепсиса при снижении иммунитета, вызывая генерализованные инфекции с очагами воспаления во внутренних органах, коже и костно-мышечной системе.
Основные источники инфекции: здоровые (носители) и больные люди, домашние и сельскохозяйственные животные, а также пища, содержащая золотистый стафилококк и его мощные токсины (чаще всего это сахаросодержащие молочные продукты, мороженное, кондитерские изделия без термообработки, салаты и т.п.).
Дети могут инфицироваться от взрослых стафолококконосителей. У детей грудного возраста возможно выделение стафилококка в посевах фекалий.
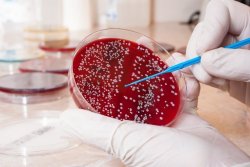
В эпидемиологических целях анализ на выявление патогенного стафилококка обязательно проводят во время ежегодных профилактических осмотров и при предварительных осмотрах для приема на работу в сферы обслуживания населения: медицины, образования, питания и торговли. В данном случае посев выполняется из носа и зева.
При наличии патогенного стафилококка в пробе обследуемого, через 18-24 часа наблюдается рост колоний золотистого цвета. В этом случае обязательно определяется количество стафилококка. Это необходимо врачу для решения вопроса о том, нужно ли проводить лечение.
Наличие золотистого стафилококка не обязательно означает инфекцию, это может быть бессимптомное носительство, например, при посеве мазков из носа и зева носительством считается количество бактерий до 10 3 КОЕ. Однако более высокие показатели говорят о том, что это уже не бессимптомное носительство, а то, что выявленный золотистый стафилококк может являться причиной заболевания.
- Для выяснения бактерионосительства или опасного инфицирования.
- Для подтверждения, что стафилококк является причиной возникшего заболевания (об этом свидетельствуют высокие показатели посева).
- Для определения целесообразности лечения.
- Для контроля за состоянием пациента после проведенного лечения.
Исследование можно пройти по направлению от лечащего врача вашей поликлиники, если есть клинические показания или на платной основе.
Лаборатория клинической микробиологии (бактериологии) Мурманской областной больницы предлагает следующие услуги по обнаружению патогенного стафилококка:
Микробиологическое (культуральное) исследование отделяемого зева на патогенный стафилококк
Микробиологическое (культуральное) исследование отделяемого носа на патогенный стафилококк
Микробиологическое (культуральное) исследование испражнений на стафилококк
Срок выполнения анализа: от 2 до 5 рабочих дней.
Подготовка к исследованию:
- Сбор материала проводится до начала лечения антибактериальными, иммунобиологическими препаратами (общего и местного значения).
- При контроле эффективности лечения (после окончания курса лечения) исследование проводится через 14 дней.
- Мазок из зева собирают натощак или через 3–4 часа после приема пищи.
- Перед взятием мазка из носа нельзя промывать носовые ходы.
- Желательно за 2–3 дня до взятия пробы находиться на диете, исключающей приём продуктов, усиливающих процессы брожения в кишечнике и молочнокислые продукты, а также алкоголь.
- За 3–4 дня до исследования необходимо отменить приём слабительных препаратов, касторового и вазелинового масла и прекратить введение ректальных свечей.
- Фекалии собираются ложечкой в стерильный одноразовый контейнер с завинчивающейся крышкой в количестве не более 1/3 объёма.
- Для получения достоверного результата - пробы фекалий храните в темном месте при температуре не выше 20—25 °С, во избежание чрезмерного размножения кишечной микрофлоры.
- Пробы фекалий не замораживайте.

Введение
Известно, что позвоночно-спинномозговая травма приводит к длительной госпитализации как в остром периоде, так и во время реабилитационного процесса после стабилизации позвоночника. Инфекция мочевыводящих путей у данной категории больных сопровождается в большинстве случаев бактериурией, при которой, как правило, наблюдается бессимптомная колонизация. Изменение динамики (нарушения) мочеиспускания, повышение внутрипузырного давления, а также использование мочевых дренажных катетеров вносят вклад в повышение риска симптоматической инфекции мочевыводящих путей [5, 7, 8]. Для минимизации последствий нейрогенного мочевого пузыря у пациентов с позвоночно-спинномозговой травмой используют интермиттирующую катетеризации, надлобковую катетеризацию, постоянный уретральный катетер Фолея и использование уропрезерватива. Однако эти методы мочеотведения увеличивают риск катетер-ассоциированных инфекций мочевых путей, что требует проведения нескольких курсов антибактериальной терапии. Частое воздействие антибиотиков увеличивает риск заражения резистентными штаммами микроорганизмов [5, 8].
В связи с этим актульно регулярное мониторирование антибиотикорезистентности в отделениях, где проходят лечение пациенты с позвоночно-спинномозговой травмой.
Цель исследования - анализ микрофлоры мочи у больных с позвоночно-спинномозговой травмой в остром, раннем, промежуточном и позднем периодах при различных способах мочевыделения и степени нарушения функции спинного мозга.
Материалы и методы
Работа основана на результатах микробиологического исследования мочи от 42 больных с позвоночно-спинномозговой травмой в остром, раннем, промежуточном и позднем периодах. Группу обследуемых составили 34 мужчины и 8 женщин. Возраст больных составил от 13 до 61 года (в среднем 34,39±1,85). По уровню повреждения позвоночника больные были распределены на три группы. Первую группу составили пациенты с травмой позвоночника в шейном отделе (С4-С7 позвонки) - 23 больных, вторую группу - в грудном отделе (Th3 -Th8 позвонки) - 6 больных, третью группу - в грудно-поясничном отделе (Th12 - L1 позвонки) - 14 больных. В 36 случаях был определен промежуточный и поздний периоды травматической болезни спинного мозга (от 6 мес. до 12 лет, в среднем - 4,0±0,7 года), у 6 больных - острый и ранний периоды (от 7 дней до 5 мес., в среднем 2,5 мес.).
Травма позвоночника сопровождалась различными двигательными нарушениями: 1) верхний парапарез, нижняя параплегия - у 20 больных; 2) спастический тетрапарез - у 2 больных; 3) нижняя параплегия - у 12 больных; 4) нижний парапарез - у 9 больных. В 42 (97,3 %) случаях были выявлены различной степени нарушения чувствительности. Среди проводниковых расстройств преобладала анестезия с уровня повреждения 27,9 % (12 больных). Среди сегментарно-корешковых нарушений больше было больных с гипестезией 30,2 % (13 больных).
Нарушения функции тазовых органов были зарегистрированы у всех обследуемых и проявлялись в виде: 1) задержки мочи - у 14 больных; 2) недержания мочи - у 16 больных; 3) затруднения мочеиспускания - у 5 больных; 4) спинального автоматизма - у 8 больных. Дренирования мочевого пузыря осуществлялось посредством уретрального катетера (10 пациентов) и эпицистостомы (4 больных). При недержании мочи уропрезервативы использовали 6 пациентов, подгузники - 10 пациентов. Нейрогенный мочевой пузырь был диагностирован в 100 % случаев.
В качестве объекта исследования использовали пробы мочи, полученные с помощью катетера. Исследования выполняли традиционным методом посева на плотные питательные среды, после инкубирования подсчитывали количество колоний каждого типа в секторах, результат выражали через десятичный логарифм величины выросших колоний (КОЕ/мл) [1]. Этиологически значимыми признавались микроорганизмы, выделенные в количестве 10 2 КОЕ/мл и выше.
Тестировались следующие антибактериальные препараты: амикацин, ампициллин, амоксициллин / клавуланат, азлоциллин, бензилпенициллин, ванкомицин, гентамицин 10 мкг и 120 мкг, имипенем, карбенициллин, ко-тримоксазол, оксациллин, тетрациклин, пиперациллин/тазобактам, стрептомицин, цефомандол, цефтазидим, цефепим, цефотаксим, цефтриаксон, ципрофлоксацин, хлорамфеникол, эритромицин.
Статистическую обработку данных производили с помощью пакета анализа данных MicrosoftEXСEL-2007. Для оценки достоверности различия средних данных использованы t-критерий Стьюдента и, дополнительно непараметрический критерий Манна-Уитни. Принятый уровень значимости - 0,05.
Результаты и обсуждение
По клиническим показаниям было проведено микробиологическое исследование мочи у 42 больных (всего 46 проб), из них у 33 больных выявлен рост бактерий хотя бы в одной из исследованных проб. Таким образом, инфекционные осложнения, подтвержденные микробиологическими исследованиями, составили 78,6 %.
В ходе исследования было выделено 62 штамма бактерий и две культуры грибов. Среди выявленных микроорганизмов превалировали грамотрицательные бактерии, большинство из которых относилось к группе энтеробактерий (46,8 %), наиболее часто выделялись штаммы Escherichiacoli - 17,7 % и Klebsiellaspp. - 12,9 % случаев. Полученные данные аналогичны наблюдениям других авторов, согласно которым чаще всего этиологическими факторами развития воспалительных процессов мочевыделительной системы у этой категории больных также выступали различные представители энтеробактерий: E. сoli, Proteusmirabilis, Proteusvulgaris, Klebsiellaaerogenes и др. [3, 6].
Была проведена оценка зависимости спектра возбудителей, обуславливающих воспалительные процессы мочевыводящих путей от особенностей мочевыделения. Оказалось, что у больных с позвоночно-спинномозговой травмой в остром периоде независимо от вида нарушения мочевыведения микроорганизмы из мочи либо не выделялись, либо выделялись в незначительном количестве (1х10 3 - 1х10 4 КОЕ/мл) штаммы микробов, не типичные для данной патологии (таблица 1). Несмотря на малочисленность групп больных с позвоночно-спинномозговой травмой в остром и раннем периодах, они были приведены в таблице для того, чтобы проследить общие тенденции воспалительных изменений мочевыводящих путей.
Особенности микробного пейзажа (видовой состав возбудителей инфекции мочевыделительной системы и антибиотикочувствительность) у больных с позвоночно-спинномозговой травмой в остром и раннем периодах в зависимости от способа мочевыведения
Аннотация научной статьи по биотехнологиям в медицине, автор научной работы — Гостев Владимир Валерьевич, Калиногорская Ольга Серафимовна, Круглов Александр Николаевич, Сидоренко Сергей Владимирович
Изучена антибиотикочувствительность 119 изолятов коагулазоотрицательных стафилококков (CoNS coagulase-negative staphylococci ), выделенных в лечебных учреждениях Санкт-Петербурга и Москвы и расцененных в местных лабораториях как устойчивые к оксациллину. Были идентифицированы следующие виды: S.epidermidis, S.haemolyticus, S.hominis, S.capitis, S.simulans, S.pettenkoferi, S.lentus, S.carnosus, S.warneri, устойчивость к оксациллину подтверждена у 79,8% изолятов. Частота ассоциированной устойчивости к не бета-лактамным антибиотикам была существенно выше у окса-циллиноустойчивых изолятов в сравнении с оксациллиночувствительными. При использовании критериев чувствительности CLSI и EUCAST показатели устойчивости различались на 1-3%. Среди оксациллиноустойчивых изолятов частота устойчивости к гентамицину, ципрофлоксацину, эритромицину, моксифлоксацину, тетрациклину и клиндамицину составляла 90, 88, 88, 63, 43 и 26% соответственно. Обнаружено два изолята S.epidermidis, устойчивых к линезолиду и проявивших сниженную чувствительность к тедизолиду, восемь изолятов проявляли сниженную устойчивость к мупироцину. МПК цефтаролина в отношении оксациллиноустойчивых CoNS варьировала от 0,5 до 2,0 мкг/мл, а в отношении чувствительных была ниже 0,25 мкг/мл. Устойчивости к тигециклину и ванкомицину выявлено не было.
Похожие темы научных работ по биотехнологиям в медицине , автор научной работы — Гостев Владимир Валерьевич, Калиногорская Ольга Серафимовна, Круглов Александр Николаевич, Сидоренко Сергей Владимирович
Antibiotic Resistance of Coagulase-Negative Staphylococci Isolated at Hospitals of St. Petersburg and Moscow
Antibiotic susceptibility of 119 coagulase-negative staphylococci isolated at hospitals of St. Petersburg and Moscow was investigated and estimated at the local laboratories as oxacillin resistant. The following species were identified: Staphylococcus epidermidis, S.haemolyticus, S. hominis, S.capitis, S.simulans, S.pettenkoferi, S.lentus, S.carnosus and S.warneri. The oxacillin resistance was confirmed in 79.8% of the isolates. The frequency of the associated resistance to non-beta-lactams was much higher in the oxacillin resistant isolates vs. the oxacillin susceptible ones. When the CLSI and EUCAST susceptibility criteria were used, 1-3% difference in the resistance levels was recorded. Among the oxacillin resistant isolates the frequency of resistance to gentamicin, ciprofloxacin, erythromycin, moxifloxacin, tetracycline and clindamycin equaled 90, 88, 88, 63, 43 and 26% respectively. Two linezolid resistant isolates of S.epidermidis with lower susceptibility to tedizolid were isolated. Eight isolates of S.epidermidis showed lower resistance to mupirocin. The MIC of ceftarolin for oxacillin resistant coagulase-negative staphylococci varied from 0.5 to 2.0 mcg/ml, while for the oxacillin susceptible ones it was lower than 0.25 mcg/ml. No resistance to tigecyclin and vancomycin was observed.
Антибиотикорезистентность коагулазоотрицательных стафилококков, выделенных в стационарах Санкт-Петербурга и Москвы
В. В. ГОСТЕВ', О. С. КАЛИНОГОРСКАЯ', А. Н. КРУГЛОВ2, С. В. СИДОРЕНКО'
1 НИИ детских инфекций Федерального медико-биологического агентства, Санкт-Петербург
2 Национальное агентство по клинической фармакологии и фармации, Москва
Antibiotic Resistance of Coagulase-Negative Staphylococci Isolated at Hospitals of St. Petersburg and Moscow
V. V. GOSTEV, O. S. KALINOGORSKAYA, A. N. KRUGLOV, S. V. SIDORENKO
Research Institute of Children's Infections, Federal Medico-Biological Agency, St. Petersburg National Agency for Clinical Pharmacology and Pharmacy, Moscow
Изучена антибиотикочувствительность 119 изолятов коагулазоотрицательных стафилококков (CoNS — coagulase-nega-tive staphylococci), выщеленнык в лечебных учреждениях Санкт-Петербурга и Москвы и расцененных в местных лабораториях как устойчивые к оксациллину. Были идентифицированы следующие виды: S.epidermidis, S.haemolyticus, S.homin-is, S.capitis, S.simulans, S.pettenkoferi, S.lentus, S.carnosus, S.warneri, устойчивость к оксациллину подтверждена у 79,8% изолятов. Частота ассоциированной устойчивости к не бета-лактамным антибиотикам была существенно выше у окса-циллиноустойчивых изолятов в сравнении с оксациллиночувствительными. При использовании критериев чувствительности CLSI и EUCAST показатели устойчивости различались на 1—3%. Среди оксациллиноустойчивык изолятов частота устойчивости к гентамицину, ципрофлоксацину, эритромицину, моксифлоксацину, тетрациклину и клиндамицину составляла 90, 88, 88, 63, 43 и 26% соответственно. Обнаружено два изолята S.epidermidis, устойчивый к линезолиду и проявивших сниженную чувствительность к тедизолиду, восемь изолятов проявляли сниженную устойчивость к мупироцину. МПК цефтаролина в отношении оксациллиноустойчивык CoNS варьировала от 0,5 до 2,0 мкг/мл, а в отношении чувствительных — была ниже 0,25 мкг/мл. Устойчивости к тигециклину и ванкомицину выявлено не бышо.
Ключевые слова: коагулазоотрицательные стафилококки, антибиотикорезистентность.
Antibiotic susceptibility of 119 coagulase-negative staphylococci isolated at hospitals of St. Petersburg and Moscow was investigated and estimated at the local laboratories as oxacillin resistant. The following species were identified: Staphylococcus epidermidis, S.haemolyticus, S. hominis, S.capitis, S.simulans, S.pettenkoferi, S.lentus, S.carnosus and S.warneri. The oxacillin resistance was confirmed in 79.8% of the isolates. The frequency of the associated resistance to non-beta-lactams was much higher in the oxacillin resistant isolates vs. the oxacillin susceptible ones. When the CLSI and EUCAST susceptibility criteria were used, 1—3% difference in the resistance levels was recorded. Among the oxacillin resistant isolates the frequency of resistance to gentamicin, ciprofloxacin, erythromycin, moxifloxacin, tetracycline and clindamycin equaled 90, 88, 88, 63, 43 and 26% respectively. Two linezolid resistant isolates of S.epidermidis with lower susceptibility to tedizolid were isolated. Eight isolates of S.epidermidis showed lower resistance to mupirocin. The MIC of ceftarolin for oxacillin resistant coagulase-negative staphylococci varied from 0.5 to 2.0 mcg/ml, while for the oxacillin susceptible ones it was lower than 0.25 mcg/ml. No resistance to tigecyclin and vancomycin was observed.
Key words: coagulase-negative staphylococci, antibiotic resistance.
Адрес для корреспонденции: 197022, Санкт-Петербург, ул. Профессора Попова, д.9. НИИ детских инфекций.
что современные представления о таксономии стафилококков существенно изменились, признак продукции коагулазы остается важнейшим в клинико-эпидемиологической классификации этих бактерий [2]. В последние годы представления о видовом разнообразии стафилококков быстро меняются благодаря описанию новых видов, часть Со№ входят в состав нормальной микро-биоты кожи и слизистых оболочек человека (8.гр1йггт1й1$, 8Маето1уИс№ БМоття, Бмагпгп, Б.ху1оз18, Б.сарШз, Б^тШат, Б.рвШпко/вп и др.), другие характерны для животных и редко встре-
чаются у человека (S.carnosus, S.lentus, S.caprae, S.felis и др.).
Все перечисленные CoNS традиционно и совершенно обоснованно рассматриваются как комменсалы, однако широкое распространением инвазивных медицинских технологий и изменение структуры пациентов (увеличение числа им-мунокомпрометированных пациентов и пациентов экстремальных возрастных групп) привели к изменению клинического значения этих бактерий. В настоящее время CoNS являются основными возбудителями инфекций, связанных внут-рисосудистыми устройствами и имплантами. Эти инфекции преимущественно распространены среди пациентов отделений реанимации, неона-тологии, трансплантологии, ожоговых, учреждений травматолого-ортопедического профиля.
Широкое распространение инфекций, вызываемых CoNS, естественно делает актуальной проблему их лечения. Сложности лечения указанных инфекций связаны с высокой частотой распространения среди CoNS метициллинорези-стентности[3], являющейся маркёром устойчивости к большинству бета-лактамных антибиотиков, а также ассоциированной устойчивости к антибиотикам других групп. Традиционно средством выбора для лечения инфекций, вызванных метициллинорезистентными изолятами, считались гликопептидные антибиотики, прежде всего ванкомицин. Однако в последнее время сформировалось представление о недостаточной эффективности ванкомицина при инфекциях, вызываемых изолятами с МПК>2,0 мкг/мл. В качестве альтернатив ванкомицину рассматривают ряд новых антибиотиков линезолид, даптомицин, цеф-таролин, тигециклин, тедизолид, а также комбинации таких хорошо известных антибиотиков как рифампицин и ко-тримоксазол. При инфекциях кожи и мягких тканей возможно местное применение мупироцина или фузидиевой кислоты.
Частота устойчивости CoNS, циркулирующих на территории России, изучена недостаточно. С определёнными сложностями связано и выявление метициллинорезистентности среди CoNS, поскольку критерии чувствительности S.aureus, предлагаемые EUCAST (European Committee on Antimicrobial Susceptibility Testing — Европейский комитет по оценке антибиоти-кочувствительности) [4], отличаются от таковых рекомендуемых CLSI (Clinical and Laboratory Standards Institution — Институт клинических и лабораторных стандартов) [5].
Цель настоящей работы — оценка достоверности детекции метициллинорезистентности среди CoNS, выделенных в лечебных учреждениях Москвы и Санкт-Петербурга, а также оценка чувствительности этих изолятов к широкому кругу антибактериальных препаратов.
Материал и методы
Бактериальные изоляты. В исследование были включены неповторяющиеся изоляты метициллинорезистентных CoNS («=119), выделенные от больных с разными формами инфекций. Изоляты были получены в 2011—2014г. из нескольких стационаров Санкт-Петербурга и Москвы. После доставки центральную лабораторию проверяли чистоту культур полученных изолятов, проводили их повторную идентификацию и оценку антибиотикочувствительности.
Анализ и статистическая обработка данных. Обработку результатов осуществляли на платформе WHONETver 5.6.,рас-считывали следующие параметры: распределение и диапазон МПК, МПК50, МПК90, среднегеометрическая МПК (МПКсг), количество и процент чувствительных изолятов (S), устойчивых (R), с промежуточной чувствительностью (I). В качестве критериев оценки клинической устойчивости/чувствительности (clinical breakpoint) использовали стандарты CLSI 2014 и EUCAST ver. 5.0. (2015). Для оценки микробиологической резистентности был использован критерий epidemi-ological cut-off (ECOFF) в соответствие с EUCAST.
Результаты и обсуждение
Изоляты, включённые в исследование, были выделены из крови при сепсисе — 61%, из хирургических ран — 19%, из мокроты — 7% и других источников (носоглоточные мазки, инфекции кожи, моча и др.) — 13%. По результатам идентификации было выявлено 9 видов: S.epi-dermidis, S.haemolyticus, S.hominis, S.capitis, S.sim-ulans, S.pettenkoferi, S.lentus, S.carnosus, S.warneri, со значительным преобладанием первых двух видов (рисунок).
Установлено, что из 119 изолятов, оцененных в лабораториях лечебных учреждений как мети-циллинустойчивые, 24 (20,2%) оказались мети-циллинчувствительными, в том числе все изоля-ты S.warneri, S.carnosus и S.lentus; 28,6% изолятов S.hominis, 23,8% — S.epidermidis и 2,8% —
Таблица 1. Критерии оценки чувствительности к антибиотикам у коагулазоотрицательных стафилококков при использовании метода серийных разведений
Антибиотик CLSI 2014, МПК, мкг/мл EUCAST v. 5,0, МПК, мкг/мл
, MD, FACP, Charles E. Schmidt College of Medicine, Florida Atlantic University;
, MD, Wellington Regional Medical Center, West Palm Beach
Last full review/revision September 2017 by Larry M. Bush, MD, FACP; Maria T. Perez, MD





Способность к тромбообразованию путем продуцирования коагулазы отличает вирулентный патоген, Staphylococcus aureus, от менее вирулентных коагулазонегативных штаммов стафилококка. Коагулазопозитивный S. aureus - один из самых распространенных и опасных для человека болезнетворных микроорганизмов из-за его высокой вирулентности и способности к формированию резистентности к антибиотикам.
Коагулазонегативные виды, такие как S. epidermidis все чаще ассоциируются с внутрибольничной инфекцией; S. saprophyticus является причиной инфекции мочевых путей. Коагулазонегативный S. lugdunensis может вызывать инвазивное заболевание с вирулентностью, аналогичной S. aureus. В отличие от большинства коагулазонегативных стафилококков, S. lugdunensis часто остается чувствительным к пенициллиназа-резистентным бета-лактамным антибиотикам (например, к метициллину).
Патогенные стафилококки распространены повсеместно. Около 30% здоровых взрослых, обычно временно, являются носителями стрептококков в носовых проходах и около 20% – на коже; отсюда стрептококки могут инфицировать самого носителя и других людей. Обсемененность пациентов стационаров и медперсонала значительно выше. Инфекция, вызванная S. aureus, чаще встречается среди бактерионосителей, чем среди лиц, которые таковыми не являются, и обычно вызвана колонизирующим штаммом.
Факторы риска
Людьми, предрасположенными к стафилококковой инфекции, являются:
Новорожденные младенцы и кормящие матери
Пациенты с гриппом, хроническими бронхолегочными заболеваниями (например, муковисцидоз, эмфизема), лейкемией, опухолями, хроническими кожными заболеваниями или сахарным диабетом
Пациенты с трансплантатами, имплантированными протезами, другими инородными телами или имплантированными внутрисосудистыми пластмассовыми катетерами
Пациенты, получающие глюкокортикоиды, иммуносупрессанты, лучевую терапию, или противоопухолевую химиотерапию
Пациенты с хронической болезнью почек и находятся на диализе
Пациенты с хирургическими разрезами, открытыми ранами или ожогами
Предрасположенным пациентам могут передаваться антибиотикорезистентные штаммы стафилококков от других пациентов, медперсонала или контактно-бытовым путем через предметы ухода за пациентами. Передача через руки персонала – наиболее распространенный способ заражения, воздушно-капельная передача также актуальна.
Болезни, вызываемые стафилококками
Стафилококки вызывают заболевание путем
Прямого проникновения в ткань
Иногда продукцией экзотоксина
Прямое проникновение в ткань является наиболее распространенным механизмом возникновения стафилококковых заболеваний, включая следующее:
Иногда стафилококками продуцируются множественные экзотоксины. Некоторые имеют локальные проявления; другие вызывают выработку цитокина из определенных Т-клеток, что ведет к серьезным системным поражениям (например, поражения кожи, шок, недостаточность органа, смерть). Лейкоцидин Пантона-Валентайна (PVL) является токсином, продуцируемым штаммами, инфицированными определенным бактериофагом. Лейкоцидин Пантон-Валентайна, как правило, присутствует в штаммах бытового метициллин резистентного стафилококка S. aureus (БМРЗС) и считается, что он опосредует способность к формированию некрозов; однако этот эффект не был доказан.
Токсин-опосредованные стафилококковые заболевания включают следующие:
Синдром токсического шока
Стафилококковый синдром ошпаренной кожи
Стафилококковое пищевое отравление
Упомянутые болезни обсуждаются далее в Р у к оводстве .
S. aureus вызываетбактериемию, которая часто приводит к появлению метастатических очагов инфекции, может возникнуть от инфекции S. aureus любой локализации, но особенно часто – от инфекции, связанной с присутствием внутрисосудистых катетеров или других инородных тел. Может также проявляться без какой-либо четко выявленной первичной локализации. S. epidermidis и другие коагулазонегативные стафилококки чаще вызывают внутрибольничную бактериемию, связанную с наличием внутрисосудистых катетеров и других инородных тел, так как они могут образовывать биопленки на этих материалах. Стафилококковая бактериемия является основной причиной заболеваемости (особенно удлинения периода госпитализации) и смертности среди ослабленных пациентов.
Инфекция кожи – наиболее распространенная форма стафилококкового заболевания. Поверхностные инфекции могут быть диффузными, с везикулярными пустулами, покрытыми коркой (импетиго), иногда в виде флегмоны или очаговыми с узловыми абсцессами (фурункулы и карбункулы). Более глубокие кожные абсцессы также широко распространены. Могут встречаться тяжелые некротизирующие инфекции кожи.




Стафилококки обычно являются причиной раневых и ожоговых инфекций, послеоперационных раневых инфекций и мастита или абсцесса груди у кормящих матерей.
Неонатальные инфекции обычно появляются у детей в течение 6 нед после рождения и включают:
Повреждения кожи с шелушением или без него
Пневмония, которая возникает в амбулаторных условиях, не является распространенной, однако может развиваться у пациентов
Пациенты, получающие кортикостероиды или иммуносупрессанты
Имеют хронические бронхолегочные или другие заболевания с высоким уровнем риска
Стафилококковая пневмония может быть первичной инфекцией, а также следствием гематогенного распространения инфекции S. aureus из других частей тела (например инфицирование внутривенного катетера, эндокардит, инфекция мягких тканей) или инъекционной наркомании. Однако S. aureus является частой причиной развития внутрибольничной пневмонии, включая вентиляторную пневмонию при ИВЛ
Стафилококковая пневмония иногда характеризуется формированием абсцессов легких, сопровождаемых быстрым развитием пневматоцеле и эмпиемы. Внебольничный MRSA часто является причиной развития тяжелой некротизирующей пневмонии.
Эндокардит может развиться у инъекционных наркоманов и пациентов с протезами клапанов сердца. Поскольку частота использования внутрисосудистых катетеров и имплантаций сердечных устройств увеличилась, S. aureus стал ведущей причиной бактериального эндокардита.
Эндокардит, вызванный S. aureus, является острым фебрильным заболеванием, которое часто сопровождается формированием висцеральных абсцессов, эмболий, перикардита, подногтевых петехий, кровоизлияний в конъюнктиву глаза, пурпуры, шумов в сердце и сердечной недостаточности, как следствие вторичного повреждения клапанов сердца.
Остеомиелит встречается наиболее часто у детей, вызывая озноб, лихорадку и боль поражённой кости. Впоследствии и мягкие ткани над зоной поражения становятся красными и отечными. Может наблюдаться суставная инфекция, что часто приводит к суставному выпоту, предполагая септический артрит, а не остеомиелит. Большинство инфекций позвонков и межпозвоночных дисков у взрослых связаны с S. aureus.
Стафилококковый синдром токсического шока может быть следствием применения вагинальных тампонов или осложнением любого типа инфекции S. aureus (например послеоперационная раневая инфекция, ожоговые инфекции, инфекции кожи). Хотя большинство случаев связано с метициллин-чувствительным S. aureus (MSSA), случаи, связанные с MRSA, становятся все более частыми.

Стафилококковый синдром ошпаренной кожи вызывается несколькими токсинами, так называемыми эксфолиатинами, и проявляется как детский эксфолиативный дерматит, характеризующийся крупными волдырями и шелушением верхнего слоя кожи. В конечном счёте происходит эксфолиация. Синдром "ошпаренной кожи" наиболее часто встречается у младенцев и детей
Стафилококковое пищевое отравление вызывается употреблением в пищу инфицированных стафилококками продуктов питания (устойчивый к высокой температуре стафилококковый энтеротоксин). Пища может быть заражена стафилококковыми носителями или людьми с выраженными заболеваниями кожи. В пище, недостаточно термически обработанной или оставленной при комнатной температуре, стафилококки активно размножаются и вырабатывают энтеротоксин. Многие продукты могут служить питательной средой, не изменяя при этом своих органолептических свойств (вкус и запах). Тяжелая тошнота и рвота начинаются спустя 2–8 ч после приема пищи, как правило, сопровождаемыми спазмами брюшной полости и диареей. Приступ непродолжительный, часто составляет 12 ч.
Диагностика
Цитобактерископия мазков, окрашенных по Граму, и посев на обогащенные питательные среды
Диагноз стафилококковой инфекции устанавливается после бактериоскопии мазков, окрашенных по Граму, и посевов инфицированного материала на питательные среды.
Необходимо провести тесты на восприимчивость, поскольку метициллин-резистентные микроорганизмы теперь повсеместно распространены и требуют альтернативной терапии.
Если подозревается стафилококковый синдром ошпаренной кожи, то следует провести посевы крови, мочи, носоглотки, отделяемого пупочного кольца, пораженной кожи или любого подозреваемого очага инфекции; интактные волдыри являются асептическими. Хотя диагноз обычно ставится клинически, биопсия зараженной кожи может помочь подтвердить диагноз.
Стафилококковое пищевое отравление обычно предполагают из-за регистрации однотипных случаев инфекции (например, в пределах семьи, среди посетителей массовых социальных учреждений или ресторанов). Подтверждение (как правило, отделом здравоохранения) подразумевает выделение стафилококков в подозрительной пище и иногда анализ на наличие энтеротоксинов.
При остеомиелите рентгенологические изменения могут не проявиться до 10–14 дней болезни, и размягчение кости, и периостальная реакция могут не выявляться и дольше. Отклонения по МРТ, КТ или сканирование радионуклида кости часто становятся очевидными раньше. Биопсия кости (открытая или перкутатная) должна быть проведена для идентификации патогена и анализа антибиотикорезистентности.
В некоторых учреждениях с высокой распространённостью метициллин - резистентных штаммов S. аureus обычно проверяют пациентов на стафилококковое носительство (активное наблюдение), используя лабораторные методы быстрой диагностики, чтобы оценить образцы мазков из носа. Некоторые учреждения проводят скрининг только у пациентов группы риска (например тех, кто поступает в отделение интенсивной терапии, у кого ранее была инфекция MRSA, кому планируются сосудистые, ортопедические оперативные вмешательства или операция на сердце).
Быстрая идентификация MRSA:
позволяет произвести изоляцию контактных носителей и, в случае необходимости предоперационной антибиотикопрофилактики против кожных микроорганизмов, назначить ванкомицин как часть их курса лечения
уменьшает распространение MRSA
может снизить частоту внутрибольничных инфекций MRSA
Однако лечение, направленное на деколонизацию (например, местное применение назального мупироцина), хотя иногда и проводится, но еще окончательно не доказало своей эффективности, так как выявлена резистентность к мупироцину. Ежедневное обмывание с хлоргексидином пациентов отделения интенсивной терапии снижает частоту инфекций, вызванных MRSA.
Лечение
Местные меры (например, санация раны, удаление катетеров)
Антибиотики выбираются с учетом тяжести заболевания и результатов антибиотикограммы
Контроль стафилококковых инфекций включает дренирование абсцесса, санацию некротической ткани, удаление инородных тел (включая внутрисосудистые катетеры) и назначение антибиотиков ( Лечение антибиотиками стафилококковых инфекций у взрослых).
Первоначальный выбор и дозировка антибиотиков зависят от
вероятности того, что задействованы резистентные штаммы
Таким образом, необходимо иметь данные о циркуляции антибиотикорезистентных штаммов в определенном регионе для стартовой терапии (и в конечном счете знать фактическую антибиотикочувствительность выделенного микроорганизма).
Лечение токсин-опосредованного стафилококкового заболевания (самым тяжелым из которых является синдром токсического шока) подразумевает деконтаминацию токсин-продуцирующих областей (ревизия хирургических ран, некрэктомия, промывание), интенсивную терапию (включая внутривенное введение жидкостей, вазопрессоры и респираторную поддержку), коррекцию водно-электролитного баланса и антибактериальные препараты. Доказательства in vitro свидетельствуют о предпочтительном назначении ингибиторов синтеза белка (например, клиндамицин по 900 мг внутривенно каждые 8 ч, линезолид 600 мг внутривенно каждые 12 ч) по сравнению с другими классами антибиотиков. В тяжелых случаях оправдано применение внутривенного иммуноглобулина.
Многие стафилококковые штаммы продуцируют пенициллиназу, фермент, который инактивирует некоторые бета-лактамные антибиотики; эти штаммы являются резистентными к пенициллину G, ампициллину и противопсевдомонадному пенициллину.
Внебольничные штаммы часто чувствительны к пенициллиназа-резистентным пенициллинам (например, метициллину, оксациллину, нафциллину, клоксациллину, диклоксациллину), цефалоспоринам, карбапенемам (например, имипенему, меропенему, эртапенему, дорипенему), тетрациклинам, макролидам, фторхинолонам, триметоприму/сульфаметоксазолу (TMP/SMX), гентамицину, ванкомицину и тейкопланину.
Изоляты MRSAстали повсеместно распространены, особенно в стационарах. Кроме того, внебольничный МRSA появился за последние несколько лет в большинстве географических регионов. Как правило, внебольничные MRSA обладают меньшей резистентностью ко многим антибиотикам, в отличие от внутрибольничных. Эти штаммы, хотя и резистентные к большинству бета-лактамов, обычно чувствительны к TMP/SMX, тетрациклинам (миноциклину, доксициклину) и часто чувствительны к клиндамицину, однако есть возможность развития резистентности к клиндамицину у штаммов с индуцируемой устойчивостью к эритромицину (эти штаммы могут быть выявлены с помощью D-теста). Ванкомицин эффективен против большинства MRSA, иногда в сочетании с рифампином и аминогликозидами при тяжелых инфекциях (таких как остеомиелит, инфекции протезированных суставов, эндокардит протезированного клапана). Назначение альтернативного препарата (даптомицин, линезолид, тедизолид, далбаванцин, оритаванцин, тигециклин, хинупристин/дальфопристин, TMP-SMX, возможно цефтаролин) следует рассматривать при лечении метициллин-резистентных штаммов S. аureus с МИК (минимальная ингибирующая концентрация) ванкомицина > 1,5 мкг/мл.
В США появились штаммы ванкомицин-резистентного S. aureus (VRSA; МИК > 16 мкг/мл) и штаммы S. aureus с умеренной чувствительностью к ванкомицину (VISA, МИК 4–8 мкг/мл). Для терапии инфекций, вызванных этими штаммами стафилококка, требуется назначение линезолида, тедизолида, хинупристина/дальфопристина, даптомицина, TMP/SMX или цефтаролина.
Поскольку распространённость метициллин - резистентных штаммов S. аureus увеличилась, стартовое лечение тяжелых стафилококковых инфекций (особенно тех, которые возникают в стенах учреждений здравоохранения) должно включать препарат с высокой активностью против метициллин-резистентного S. аureus. Таким образом, адекватными лекарственными средствами являются:
Для доказанных или подозреваемых инфекций кровотока– ванкомицин или даптомицин
Для пневмонии – ванкомицин, телаванцин или линезолид (т к даптомицин не проявляет должной активности в легких)
Читайте также:


