Реферат листериоз у человека
Листерия как род грамположительных палочковидных бактерий, некоторые виды которых являются возбудителями заболеваний животных и человека. Окраска и культивирование. Этиология и патогенез листериоза, его профилактика и лечение, прогноз на выздоровление.
| Рубрика | Биология и естествознание |
| Вид | доклад |
| Язык | русский |
| Дата добавления | 26.05.2015 |
| Размер файла | 18,3 K |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Листерия (лат. Listeria) - род грамположительных палочковидных бактерий. Некоторые виды являются возбудителями заболеваний животных и человека.
Род назван в честь основателя хирургической антисептики Джозефа Листера. В качестве инфекционного агента открыта Мурреем, Веббом и Шванном в 1924 г.
Микроорганизмы рода Listeria представляют собой палочки с закруглёнными концами, иногда почти кокки, одиночные или в коротких цепочках, реже образуют длинные нити (0,4-0,5 х 0,5-2 мкм).
Листерии ферментируют глюкозу, каталазоположительны, оксидазоотрицательны, образуют цитохромы. Листерии некислотоустойчивы. Не образуют споры и капсулы, факультативные анаэробы, хемоорганогетеротрофы.
Род Listeria состоит из 7 видов, из них патогенным считается L. monocytogenes
Листерии широко распространены во внешней среде. Встречаются в почве, воде, растениях. Чаще всего листерии выделяли из почвы тех полей, где травы не скашивались несколько лет, поскольку увядшая и разложившаяся трава способствует их размножению.
Способность листерий размножаться в почве зависит от температуры, содержания гумуса, влажности и величины pH.
Листерии живут в достаточно широком температурном диапазоне (3-45°С). Листерии - психрофилы, то есть, способны к активному размножению при низких температурах (4-10°С). Поэтому их численность активно увеличивается весной и осенью, летом же в почве отмечается значительное уменьшение концентрации листерий. Зимнее промерзание почвы не оказывает отрицательного влияния на их жизнеспособность.
Листерии требовательны к наличию в почве органических веществ. Они размножаются и длительно сохраняются в почвах с высоким процентом гумуса. В хвойных лесах они отсутствуют. Быстро погибают в пустынных и песчаных почвах. Водный баланс почвы также весьма важен для листерий. В кислых почвах листерии не размножаются, для них оптимальны значения pH, близкие к нейтральным.
Листерии выделяют также из сточных вод, речной воды, ила, навозной жижи.
2) Окраска и культивирование
Окрашиваются по Граму положительно, могут образовывать капсулу. Имеют тенденцию формировать короткие цепочки из 3-5 клеток. Могут переходить в L-форму и паразитировать внутриклеточно, что объясняет затяжные и хронические течения листериозов, возможность латентной формы инфекции и бактерионосительства.
Культура на твердой питательной среде имеет характерный запах творога. Листерии растут в виде мелких, беловатых с перламутровым оттенком, плоских, гладких блестящих колоний, на печеночном агаре колонии имеют слизистую консистенцию. В бульоне листерии вызывают небольшое помутнение среды с образованием слизистого осадка. На кровяном агаре вокруг колоний образуется узкая зона гемолиза.
Антигенная структура листерий сложная, всего выделено 16 сероваров (L.monocytogenes: серовары 7, 1/2а, l/2b, 1/2с, 3b, Зс, 4а, 4ab, 4b, 4с, 4d, 4е; L. ivanovii: серовар 5; L.murray; L. innocua серовары 6а и 6b), из них три - 4b, 1/2b, 1/2a - вызывают 90% всех листериозов человека. К факторам патогенности листерий относят листериозин О (главный фактор с выраженным токсическим эффектом), фосфатидилинозин, фосфатидилхолин, интерналин А, В, белок ActA, регуляторный белок PrfA, металлопротеаза.
Быстро погибают при высоких температурах (3 мин. при 100°С, 20 мин. при 70°С), под воздействием дезинфицирующих препаратов. При воздействии 2,5%-ного раствора формалина или едкого натра листерии погибают через 15-20 мин.
листерия бактерия лечение
3) Патогенность листерий. Листериоз
В связи с тем, что очень распространён пищевой путь распространения листериоза, Listeria monocytogenes обычно проникает в организм человека через кишечник. Через кровяное русло бактерии попадают в разные органы, преимущественно накапливаясь в селезёнке и печени. В этих органах бактерии взаимодействуют смакрофагами, и большая часть их погибает. Выжившая часть клеток размножается и распространяется через кровяное русло в органы и ткани организма.
Листерия является внутриклеточным паразитом.
К настоящему времени этапы взаимодействия листерий с эукариотической клеткой и внутриклеточной репликации довольно хорошо изучены на уровне морфологии и основных биомолекул, определяющих особенности проникновения и размножения листерий.
Листериоз - зоонозное, клинически полиморфное инфекционное заболевание, протекающее с преимущественным поражением системы мононуклеарных фагоцитов, нервных тканей или в виде ангинозно-септической формы.
Возбудитель - подвижная неспорообразующая грамположительная палочка Listeria monocytogenes.
Механизмы заражения людей многообразны. Чаще заражение происходит алиментарным путём через инфицированную воду и пищевые продукты животного происхождения, особенно при отсутствии их надёжной термической обработки и длительном хранении в условиях относительно низких температур. Возможно заражение при употреблении в пищу свежих овощей. Установлена возможность аэрогенного заражения, происходящего при обработке животного сырья (шерсти, щетины, кожи, шкур, пера, пуха). Известен контактный путь передачи, осуществляемый через порезы и ссадины на коже при попадании в них различных выделений больных животных. Выявлена возможность передачи бактерий от человека к человеку, описаны случаи заражения половым путём. Особенно опасен листериоз для беременных в связи с перинатальной передачей возбудителя от матери к ребёнку (трансплацентарно или во время родов).
Входными воротами инфекции могут быть слизистые оболочки ЖКТ и респираторного тракта, глаз, а также повреждённые кожные покровы. При лимфогенном и гематогенном распространении возбудителей возникает острое лихорадочное состояние, и происходит фиксация листерий в лимфатических узлах и внутренних органах - миндалинах, лёгких, в печени и селезёнке, почках и надпочечниках, ЦНС и др., где происходит размножение бактерий.
Воспалительный процесс в лимфатических узлах сопровождается их увеличением, но нагноение не развивается. В тяжёлых случаях листериозазаболевание приобретает черты листериозного сепсиса; при этом в лимфатических узлах и внутренних органах (включая ЦНС) формируются мелкие многочисленные некротические узелки (листериомы), в состав которых входят листерий, ретикулярные и моноцитарные клетки, ядерный детрит, изменённые полиморфноядерные лейкоциты. При беременности листериомы могут формироваться в плаценте, что приводит в последующем к инфицированию плода с развитием у него генерализованной формы инфекции. Возникновению заболевания способствуют иммунодефицитные состояния и опухоли.
У переболевших развивается стойкий постинфекционный иммунитет.
Продолжительность инкубационного периода - 2-4 недели.
Основные клинические формы: ангинозная, глазо-железистая, тифоидная, листериоз нервной системы.
· Ангинозная (мононуклеозоподобная) форма листериоза имеет следующие проявления: лихорадка, снижение аппетита, головная боль, общая слабость, ангина, увеличиваются лимфатические узлы.
· Тифоидная форма листериоза имеет такие проявления как: длительная лихорадка; сыпь от пятнистой до синячковой; ангина иконъюнктивитотсутствуют. Тифоидная форма листериоза обычно развивается у детей с иммунодефицитом, а также у новорожденных и детей первого года жизни. Листериоз нервной системы может протекать в виде менингита, энцефалита, менингоэнцефалита. Течение тяжелое. После перенесенного заболевания возможны остаточные явления в виде психических нарушений, отставания в психомоторном развитии, параличей. Наиболее частая форма листериоза у взрослых.
Инфицирование плода может произойти как внутриутробно, на любом сроке беременности (но не ранее 5-й недели), так и во время родов. Поэтому исходы инфицирования могут быть различными: самопроизвольные аборты, мертворождение, рождение детей с пороками развития - при поражении плода в первой половине беременности; или рождение ребенка с врожденным листериозом - при более позднем инфицировании.
Врожденный листериоз - один из наиболее тяжелых вариантов развития инфекционного заболевания, с высоким риском летального исхода.
Клинические проявления врожденного листериоза не специфичны. Возможны:
· нарушение аппетита (отказ от кормления)
· срыгивание или рвота
· сыпь узелковая (бугорки), пятнистая или синячковая
· поражение печени (желтуха)
· менингитыи менингоэнцефалиты (возбуждение или угнетенность сознания).
Микроскопия и выделение возбудителя. Материалы для исследования - кровь, ликвор, слизь из зева, материал увеличенных лимфатических узлов; у новорожденных дополнительно - меконий, пупочная кровь.
· Постельный режим, ограничение физической активности;
· Антибиотики тетрациклинового ряда по 0,2-0,3 г через 6 ч. в течение 7-10 дней.
При менингите - бензилпенициллин по 75 000-100 000 ЕД/кг в/в каждые 4 ч., препарат отменяют через 2 нед. после нормализации температуры тела; тобрамицин по 2 мг/кг в/в каждые 8 ч., препараты отменяют через 4 нед. после нормализации температуры тела. При глазо-железистом листериозе - эритромицин по 30 мг/кг/сут. внутрь в 4 приема, препарат отменяют через 1 нед. после нормализации температуры тела;
Альтернативные препараты: котримоксазол по 5 мг/кг триметоприма в/в каждые 6 ч., кларитромицин, ципрофлоксацин.
В 30% случаев листериоза (60% из них - пациенты с иммунодефицитными состояниями) - летальный исход.
Размещено на Allbest.ru
Листерия как род грамположительных палочковидных бактерий. Факторы вирулентности Listeria monocytogenes. Характеристика культуральных свойств бактерий. Способность листерий размножаться в почве. Резистентность и патогенность для животных и человека.
презентация [989,0 K], добавлен 05.06.2013
Пироплазмоз собак: этиология, распространение, патогенез, симптомы, диагностика, лечение, профилактика. Токсоплазмоз кошек, биология и распространение возбудителя. Особенности лечения животных больных соркоптозом. Стригущий лишай у собак и кошек.
реферат [29,0 K], добавлен 26.06.2014
Светящиеся бактерии - мелкие живые излучатели, их классификация и физиологические свойства. Спектр и интенсивность эмиссии света. Люминесцентная система бактерий, контроль за ее синтезом и активностью. Культивирование и использование светящихся бактерий.
реферат [983,8 K], добавлен 22.12.2013
Причины возникновения, симптомы, этиология, патогенез некрозно-раковых заболеваний плодово-ягодных кустов и деревьев. Правила агротехники и профилактические мероприятия для защиты растений от вирусов, бактерий, солнечных ожогов и механических повреждений.
реферат [31,2 K], добавлен 15.05.2015
Роль эндокринной системы в регуляции основных процессов жизнедеятельности животных и человека. Свойства, классификация, функции, и биологическая роль гормонов эндокринных желез. Анализ проблемы йоддефицитных заболеваний человека и животных в России.
курсовая работа [39,3 K], добавлен 02.03.2010
Паразиты человека и животных - причина появления расстройств многих органов и систем; механизм эволюционного взаимодействия гельминтов. Характеристика трематод, цестод, нематод и филярий; заболевания человека, их диагностика, лечение и профилактика.
курсовая работа [32,3 K], добавлен 07.06.2011
Предостерегающая окраска (яркая, броская, резко контрастирующая с окружающим фоном) рассчитана на то, чтобы привлечь внимание и навсегда сохраниться в памяти животных и птиц, свойственна ядовитым, обжигающим или жалящим насекомым, а также ядовитым змеям.
презентация [1,1 M], добавлен 18.02.2011
Генетическая система бактерий. Полимеразная цепная реакция. Применение генетических методов в диагностике инфекционных заболеваний. Метод молекулярной гибридизации. Особенности генетики вирусов. Системы репарации бактерий. Взаимодействие вирусных геномов.
презентация [2,6 M], добавлен 13.09.2015
Расположение и число жгутиков на поверхности клетки бактерии. Направление вращения жгутиков и основные виды таксисов. Количество колец у грамотрицательных и грамположительных бактерий. Локализация структур, ответственных за движение у спирохет.
доклад [2,4 M], добавлен 24.06.2013
Прокариоты - доядерные организмы, не обладающие типичным клеточным ядром и хромосомным аппаратом. История открытия и строение бактерий. Экологические функции бактерий. Бактерии как возбудители многих опасных заболеваний. Значение бактерий в природе.
презентация [5,4 M], добавлен 04.09.2011
Министерство аграрной политики Украины
Харьковская государственная зооветеринарная академия
Кафедра эпизоотологии и ветеринарного менеджмента
Реферат на тему:
Историческая справка, распространение, степень опасности и ущерб
Течение и клиническое проявление
Диагностика и дифференциальная диагностика
Иммунитет, специфическая профилактика
Листериоз (лат., англ. – Listeriosis ) – зоонозная болезнь животных и человека, характеризующаяся поражением центральной нервной системы, септическими явлениями, абортами, маститами или протекающая в форме бессимптомного носительства.
Историческая справка, р а спространение, степень оп а сности и ущерб
Впервые болезнь в конце XIX – начале XX в. была описана у кроликов и грызунов. Л. Котони (1918) выделил листерии из церебральной жидкости больного менингитом человека. С. Пири (1927) выявил возбудитель у грызунов и в честь английского хирурга Дж. Листера назвал болезнь лис-териозом, а возбудитель – L . monocytogenes . В 1931–1936 гг. болезнь установлена у овец, домашних птиц, коров и свиней.
Листериоз регистрируют почти в 60 странах мира. Ранее на территории России болезнь отмечали во многих регионах. Экономический ущерб определяется высокой летальностью, снижением продуктивности животных, затратами на лечебно-профилактические и карантинно-ограничительные мероприятия.
Возбудитель листериоза – Listeria monocytogenes – основной патогенный вид для животных и людей. Он вызывает аборты у коров, овец, коз и может поражать человека. Морфологически листерии – небольшие грамоположительные палочковидные бактерии с закругленными концами, спор и капсул не образуют, в молодых 10…12-часовых культурах подвижны; факультативные аэробы, хорошо растут на обычных питательных средах. На твердых средах может происходить превращение типичных для листерии колоний S -форм в R -формы. Под влиянием антибиотиков образуются L -формы колонии, а также антибиотикоустойчивые мутанты. L . monocytogenes патогенен для белых мышей, кроликов, морских свинок. Для него характерны положительная проба при нанесении культуры на конъюнктиву глаза морской свинки или кролика в виде кератоконъюнктивита. По современным представлениям у листерии сложная антигенная структура и они имеют 15 соматических и 5 жгутиковых антигенов.
Листерии длительно сохраняются во внешней среде, способны размножаться при низкой температуре, особенно в силосе. До 4 мес сохраняются в животноводческих помещениях, в сене, концентратах. При хранении в холодильнике при температуре 4 °С может происходить накопление листерии в продуктах питания (молоке, мясе, сыре). В прудовой воде при температуре 37 «С листерии сохраняются до 1 года. Листерии погибают под действием 5%-ного раствора лизола или креолина в течение 10 мин. Нагревание до 100 «С убивает листерии через 5 мин.
Листериоз представляет опасность для 12 видов домашних и 91 вида диких животных. Восприимчивы к листериозу овцы, козы, крупный рогатый скот, свиньи, лошади, кролики, куры, гуси, утки, индейки. Листерии выделены также из иксодовых клещей, из личинок оводов, блох, вшей, а также рыб, раков и лягушек. Восприимчив также человек. Болеют животные всех возрастов, но особенно чувствительны молодняк и беременные животные.
Источник возбудителя инфекции при листериозе – животные, выделяющие листерии во внешнюю среду с истечением из носовой полости, из половых органов (при абортах), абортированным плодом, с калом, мочой, молоком. В естественных условиях заражение происходит через слизистую оболочку носовой и ротовой полостей, конъюнктиву, пищеварительный тракт, а также через поврежденную кожу.
Основной резервуар возбудителя в природе – грызуны, служащие причиной заражения листериозом сельскохозяйственных животных, чаще через воду, корма, загрязненные выделениями больных. В циркуляции возбудителя листериоза между дикими животными (особенно грызунами) определенную роль играют иксодовые клещи, в организме которых листерии сохраняются до 42 дней. Листерионосительство установлено (в желудочно-кишечном тракте) у клинически здоровых животных (и человека), по различным источникам, от 5 до 90%. Ослабление резистентности организма в результате неполноценного кормления, плохих условий содержания, беременности, незаразных и паразитарных болезней может привести к возникновению листериоза. Использование навоза из неблагополучных по листериозу хозяйств для удобрения полей и огородов приводит к контаминации овощей (для человека) и кормов (для животных).
У овец болезнь носит сезонный характер и проявляется преимущественно с января по май, что связано с активизацией факторов передачи возбудителя инфекции (миграция инфицированных грызунов к хранилищам кормов, преобладание силоса в рационе животных и снижение резистентности организма). У крупного рогатого скота и свиней сезонности листериоза не обнаружено. Характерны стационарность болезни, случаи неоднократного повторения в отдельных пунктах, причина чего заключается в длительном выживании листерий во внешней среде, наличии листерионосителеи, а также в существовании природных очагов листериоза.
Листериоз проявляется спорадически, реже в виде эпизоотии. Летальность может достигать 98… 100%. Иногда (чаще у взрослых животных) болезнь протекает бессимптомно, при этом животные длительное время остаются микробоносителями. Отмечены случаи смешанной инфекции листериоза и других болезней, особенно у свиней.
Попавшие в организм листерий размножаются и распространяются по организму нейрогенными, лифмогенными и гематогенными путями. Листерий размножаются в месте первоначального внедрения, захватываются фагоцитирующими клетками, проникают в кровоток и распространяются по организму. Незавершенный фагоцитоз способствует переживанию возбудителя внутри фагоцитов и внутриклеточному размножению. Неблагоприятное воздействие на микроорганизм оказывают вырабатываемые листериями токсины. Возбудитель попадает в различные органы, в том числе в головной мозг. У взрослых животных листериозный сепсис возникает редко, чаще у них поражается центральная нервная система, а в период беременности – половая система; у молодняка развивается сепсис, а затем генерализованный гранулематоз.

Листерии являются возбудителями острой инфекционной болезни зоонозной природы, называемой листериозом. Листериоз характеризуется множественностью путей заражения, полиморфизмом клинической картины с поражением лимфатических узлов, мононуклеарной реакцией белой крови, часто с септицемией и поражением центральной нервной системы. Листерии представляют собой небольших размеров грамположительные или грамвариабельные подвижные палочки – за счёт наличия жгутиков [1].
По данным на 2010 г. листериоз зарегистрирован в 82 странах мира, в том числе и в России. Ежегодно нозоареал охватывает до 40 стран в мире, причём в Европе, в среднем, 20 стран [7]. Среди населения Европы противолистерийные антитела обнаруживаются в 22–24 % случаев. В РФ листериоз официально регистрируется с 1992 г. – заболеваемость составляет 0,02–0,06 на 100 тыс. человек [8]. В высокоразвитых странах листериоз диагностируется в 0,1 % родов. В России – в 0,009 %. Течение листериоза у беременных – легкое с маловыраженной симптоматикой, но риск развития тяжелых последствий для будущего ребенка очень высок.
Листерии – факультативные аэробы, развиваются на обычных нейтральных или слабощелочных мясопептонных средах, пышно растут при добавлении в среды глюкозы или сыворотки. На твердых средах при сплошном посеве листерии образуют сплошной тонкий и голубоватый налет. Культуры имеют характерный запах творога или молочной сыворотки. В жидких средах дают равномерное помутнение с выпадением осадка [2, 6].
Листерии высокоустойчивы во внешней среде, растут в широком интервале температур (от 1 до 45°С) и рН (от 4 до 10), хорошо переносят низкие температуры и способны размножаться при температуре 4–6°С в почве, воде, на растениях, в органах трупов. В различных пищевых продуктах (молоко, масло, сыр, мясо и др.) листерии размножаются при температуре бытового холодильника, при 70°С погибают через 20—30 мин, при 100°С – через 3–5 мин; инактивируются растворами формалина (0,5–1 %), хлорамина (3–5 %) и другими дезинфицирующими средствами [2, 6].
Основной путь заражения человека листериозом – пищевой, при употреблении продуктов питания, не прошедших термической обработки. Возможны также другие пути заражения: контактный, аэрогенный, трансмиссивный, половой, трансплацентарный. Листерии могут быть причиной внутрибольничной инфекции. Входные ворота для возбудителя – миндалины, слизистые оболочки глаз, дыхательных путей, полости рта, а также микротравмы кожных покровов [4].
Профилактика листериоза включает в себя контроль за пищевыми продуктами, санитарно-просветительную работу среди населения, особенно в группах риска. Из рациона беременных женщин следует исключить продукты пищевой индустрии для быстрого питания, не прошедшие длительной термической обработки, а также брынзу, мягкие сыры и сырое молоко [3].
Исследование пищевых продуктов животного происхождения импортного и отечественного производства выявило значительную контаминацию их листериями. В настоящее время всё более актуальной становится проблема пищевого листериоза. В связи с этим в России в 2001 г. введён в действие гигиенический норматив ГН 2.3.2. Министерства здравоохранения РФ, регламентирующий безопасность продуктов питания в отношении возбудителя листериоза [7].
Качественное автоматизированное определение листерий в пищевых продуктах и объектах внешней среды основано на технологии фермент-связанного флуоресцентного анализа [5]. Средство измерения: автоматический иммуноферментный анализатор.
Проведение исследований. Наборы для определения: Listeria monocytogenes Xpress, Listeria monocytogenes II, Listeria Duo, основанные на технологии ИФА.
Тест L. monocytogenes Xpress предназначен для иммуноферментного определения антигенов листерий в продуктах питания и образцах внешней среды. На внутреннюю поверхность наконечника нанесены антитела к L. monocytogenes. Реактивы, необходимые для анализа, находятся в лунках стрипа. Все этапы анализа выполняются автоматически. Наконечник переносит реакционную смесь в лунку с антителами к антигенам L. monocytogenes, мечеными биотином (конъюгатом). Эти антитела связываются с антигенами L. monocytogenes, которые связаны с антителами на стенке наконечника. Наличие биотина определяется после инкубации со стрептавидином, меченым щелочной фосфатазой. Несвязанные компоненты удаляются на дальнейших этапах отмывки. На конечном этапе определения реакционная смесь циркулирует в лунке с субстратом (4–метил-умбелиферилфосфат). Фермент конъюгата катализирует гидролиз субстрата до флуоресцирующего продукта (4–метил-умбелиферона). В конце анализа прибор автоматически анализирует результат и рассчитывает тестовое значение. Оно интерпретируется до окончательного результата (положительный или отрицательный) при сравнении с набором стандартных значений, хранящихся в памяти прибора (пороговых значений).
Существуют методы качественного определения бактерий вида L. monocytogenes в продуктах питания и образцах окружающей среды с использованием анализатора за 24 ч. и 48ч. Прибор автоматически анализирует полученные значения, сравнивает их с внутренними контрольными значениями. При пределах значения теста меньше 0,05 результат интерпретируется как отрицательный (Negative); при значении больше или равном 0,05 – как положительный (Positive). Все положительные результаты теста требуют подтверждения. Тест Listeria Duo предназначен для одновременного качественного определения и дифференциации Listeria monocytogenes и Listeria spp. в пищевых продуктах и образцах внешней среды [5].
Цель работы – провести анализ документов на факт регистрации выявления Listeria monocytogenes в пищевых продуктах, отобранных на территории Пермского края за 2015–2016 гг.; а так же провести сравнительный анализ полученных данных за 2015 и 2016 годы.
Выявление Listeria monocytogenes в пищевых продуктах
Количество случаев выявления возбудителя из взятых проб

С 2009 по 2015 гг. в хозяйствах Алматинской области РК проводили исследования по обнаружению возбудителя листериоза у 1 % животных. Ежегодно в стационарно неблагополучных хозяйствах области проводили бактериологические исследования биоматериала от больных и патматериала от павших животных по обнаружению возбудителя листериоза. Диагностические исследования проводились с использованием бактериологических, биохимических, серологических и генетических методов, постановкой биопробы.
Листериоз – инфекционная болезнь человека и многих видов животных, которая чаще всего встречается у овец и свиней, реже у крупного рогатого скота и коз, промысловых животных, пушных зверей, кроликов, домашних и диких птиц, лошадей, лисиц, хорьков, кур. Листериоз протекает либо в септической форме (кролики, морские свинки, мыши, поросята), либо с явлениями нервного синдрома и значительным расстройством центральной нервной системы (свиньи, крупный рогатый скот, овцы, лисы). Листериоз может сопровождаться абортами у крупного рогатого скота, овец и коз. Листериозу свойственны природная очаговость и стационарность.
В естественных условиях листериозом поражаются все виды домашних и диких животных. Основным резервуаром возбудителя в природе являются некоторые виды диких животных, но особенно грызуны. Листерии длительное время могут не только сохраняться во внешней среде – почве, навозе, воде, на растениях, но и размножаться, даже при низких (+ 4 °С) температурах. Некачественный силос является благоприятной средой для размножения листерий, особенно в его поверхностных слоях. Загрязненные листериями водоемы опасны в эпизоотологическом и эпидемиологическом отношении. Человек листериозом заражается в результате контакта с инфицированными грызунами, либо с сельскохозяйственными животными, особенно со свиньями, через поврежденную кожу; через пищеварительный тракт – при употреблении в пищу не подвергавшихся термической обработке ранних овощей, собранных с участков, где использованы для полива необеззараженные сточные воды и навоз. В результате инфицирования поражается нервная система и головной мозг человека. Внедрение листерий в организм человека может привести к развитию сепсиса, поражению отдельных органов и систем, а также к бессимптомному заболеванию. У женщин при поражении листериозом отмечаются аборты листериозной этиологии. Заболевание человека возможно также после употребления инфицированной пищи, в частности молока и мяса больных животных. Распространение листерий в организме происходит нейрогенным, лимфогенным, гематогенными путями. Листерии, распространяясь различными путями, преодолевая защитный барьер, проникают в головной мозг. У человека листериоз протекает в форме моноцитарной ангины и листериозного менингита, который во многих случаях заканчивается смертельно. Поражается центральная нервная система, отмечаются приступы судорог, возбуждение. Температура тела в начальный период заболевания повышена, а затем снижается. При листериозе у различных видов животных, а также у человека отмечается значительное повышение числа моноцитов в крови (отсюда и название Listeria monocytogenes). Гистологическое исследование мозга указывает на моноцитарную инфильтрацию.
В хозяйствах Алматинской области листериоз сельскохозяйственных животных встречается. По нашим данным, в стационарно неблагополучных хозяйствах, имеющих крупный и мелкий рогатый скот, листериоз обнаруживается у 10–30 % исследованных животных. В Казахском научно-исследовательском ветеринарном институте из 10 проб, предоставленных из хозяйств Алматинской области РК в 2009 год выделен возбудитель листериоза в двух случаях (от 7 месячного теленка, 2-летней коровы), в 2011 году – в двух случаях (от 3-летней коровы, годовалой овцы); в 2014 году – в трех случаях (от 6 месячного теленка, овцы, 8 месячного ягненка); а в 2015 году – в двух случаях (от коровы и быка-производителя).
Диагноз на листериоз ставят на основании комплекса эпизоотологических данных и результатов лабораторного исследования. Решающее значение принадлежит бактериологическому исследованию – выделению культуры листерий. Бактериологическая диагностика включает микроскопическое исследование исходного материала, посевы на питательные среды, идентификацию выделенных культур по культурально-морфологическим, биохимическим, молекулярно-биологическим и серологическим свойствам, а также постановку биологической пробы на лабораторных животных.
Материалы и методы исследования
Для бактериологического исследования на листериоз отбирается: головной мозг, доля печени, почка.
В патологическом материале с подозрением на листериоз – в паренхиматозных органах павших животных характерные патологоанатоми- ческие изменения: изменен цвет паренхимы печени, мягкой консистенции, бывает разложившаяся; селезенка кровенаполнена, темного цвета; паренхима почки мягкой консистенции, цвет изменен. Предоставленные патматериалы были отобраны от трупов животных. Заболевание протекало в острой форме и закончилось гибелью животных.
Бактериологические исследования проводили путем посева суспензии из головного мозга и паренхиматозных органов на физиологическом растворе в соотношении 1:5 на питательные среды МПБ (мясо-пептонный бульон), МПА (мясо-пептонный агар). При приготовлении сред для лучшего роста листерий добавляли 3 % сыворотки крови КРС, 3 % глюкозы и 2 % глицерина. Посевы культур выращивали в термостате при 25 °С. Из головного мозга и печени готовили мазки-отпечатки. Мазки из суточных колоний листерий и мазки-отпечатки окрашивали по Граму.
Биохимические свойства выделенной культуры листерий, каталазную и лецининазную активность определяли общепринятыми методами, биопробу ставили на белых мышах и морских свинках. Для окончательной идентификации выделенных культур, выполняли генетические исследования по секвенированию 16S rRNA гена бактерии.
Предназначенные для идентификации 24 – часовые бульонные культуры, выращенные при 25 °С, бактериологической петлей засевали частым штрихом на 2 пробирки МПА, так, чтобы получить рост по всей поверхности агара, выращивали при комнатной температуре 24 – 30 часов. Затем агаровую культуру смывали небольшим количеством физраствора, чтобы получить густую взвесь (1–1,5 млрд м.к. (микробных клеток) в 1 мл) для постановки РА – реакция агглютинации, пластинчатая реакция для серологической диагностики листериоза.
Для серологической идентификации выделенной культуры листерий использовали поливалентную листериозную агглютинирующую сыворотку, которая представляет собой смесь кроличьих листериозных агглю- тинирующих сывороток и содержит антитела Н-АВ и О-II, V, VI, VII, IX. Для проведения РА на чистое обезжиренное предметное стекло наносили две капли: каплю поливалентной сыворотки и каплю физиологического раствора (физраствора). К обеим каплям на стекле добавляли по одной капле смыва суточной культуры, смесь тщательно перемешивали бактериологической петлей, после чего стекла плавно покачивали круговыми движениями. Одновременно для контроля исследовали на стекле каплю сыворотки с добавлением капли физраствора.
Результаты исследования и их обсуждение
Через 24 ч культивирования посевов в термостате при 25 °С в МПБ наблюдалось легкое равномерное помутнение бульона, на МПА выросли колонии мелкие, росинчатые, блестящие, вязкой консистенции, в проходящем свете наблюдали нежный рост колоний – мелкие выпуклые беловатые колоний как беловатый налет на агаре.
Для выделения листерий из патматериала использовали МПБ, МПА с добавками. Через 24 ч при появлении сплошного роста колоний бактериоло- гической петлей производили пересев на селективную диагностическую среду Palkam. Через 24 часа инкубирования на селективной среде Pаlcam отмечался обильный рост мелких, серовато-зелёных или оливково-зелёных колоний с чёрным ореолом, диаметром 0,5–1,0 мм. Через 48 часов колонии диаметром 1,0–2,0 мм приобретали зеленую окраску с углубленными центрами, окруженными чёрным ореолом. При появлении сплошного роста колоний листерий производили пересев бактериологической петлей из зон наибольшего почернения среды штрихами на 2–3 чашки Петри с селективной дифференциально-диагностической средой для получения изолированных колоний. Бактериальную массу из выросших изолированных колоний использовали для окрашивания по Граму, проведения молекулярно-генетических исследований.
В окрашенных по Граму препаратах бактерии рода листерия установлены в виде коротких палочек, располагающихся одиночно и попарно. Возбудитель листериоза представляет собой грамположительные с закругленными концами палочки, которые могут быть полиморфными. Характерной особенностью листерий является то, что некоторые 2 бактерий располагаются по отношению друг к другу в виде римской цифры V или летящей чайки (важный дифференцирующий признак). Суточная культура листерий, выделенная от теленка, представлена на рис. 1.

Рис. 1. Культура листерий в мазке, окрашенном по Граму
На рис. 1 видны мелкие грамположительные палочки с закругленными концами, которые являются полиморфными, располагаются по одиночке, попарно или группой клеток. Видны бактерий листерий, располагающихся в виде римской цифры V и летящей чайки.
Дальнейшую идентификацию возбудителя листериоза проводили путем определения подвижности методом висячей капли 12-часовой бульонной культуры, выращенной при комнатной температуре. Для установления подвижности листерий культуры выращивали на ПЖА при комнатной температуре, так как при культивировании при 37 °С термолабильные жгутики у листерий разрушаются и подвижность их прекращается. На ПЖА отмечался характерный рост по линии укола в виде зонтика, в культуре листерий были подвижны.
При хранении патологического материала в холодильнике при + 4 °С происходит размножение и накопление листерий. Поэтому в качестве дополнительного диагностического метода использовали исследуемый материал в течение 30 дней для проведения повторных исследований через каждые 10 дней путем посева на МПБ и МПА. В трех повторностях посевов изолята выросли культуры листерий с характерными культурально-морфологическими признаками.
Изучением биохимических свойств установлено, что при посеве суточных культур на среды Гисса листерии ферментировали с образованием кислоты без газа глюкозу, рамнозу, салицин, левулезу, несколько медленнее -сахарозу, растворимый крахмал и глицерин; не ферментировали арабинозу, дульцит, инулин, сорбит; не образовывали индола и сероводорода, не разжижали желатин, не восстанавливали нитраты в нитриты. Определение каталазной активности листерий: к 1 мл суточной бульонной культуры и агаровой культуре добавляли 1 мл свежеприготовленной 5 %-ной перекиси водорода. Вследствие присутствия фермента каталазы у выращиваемой культуры перекись водорода разлагается с образованием кислорода (пузырьков газа). В наших опытах в пробирочной и пластинчатой реакциях агглютинации наблюдалось газообразование (бурлило), поэтому выделенная культура предварительно идентифицирована как Listeria.
Видовую идентификацию проводили методом определения лецитиназной активности листерий. К среде ГРМ № 1, содержащей 5 % вытяжки желтка куриного яйца в 50 % содержании питательного агара, добавляли порошкообразный активированный уголь до концентрации 0,5 %. Для определения лецитиназной активности исследуемую культуру и контрольный штамм листерий пересевали штрихами в 2 чашки среды ГРМ № 1 (без активированного угля) и 2 чашки с добавлением активированного угля. Инкубировали 48 ч при температуре 25 °С, после чего чашки просматривали в проходящем свете и определяли наличие активности в присутствии активированного угля. Эталонный штамм Listeria ivanovii давала плотную зону помутнения независимо от присутствия активированного угля, Listeria monocytogenes образовывала аналогичную зону помутнения в присутствии активированного угля и не образовывала в отсутствие угля. Это биохимическое свойство отличает Listeria monocytogenes от других видов рода Listeria.
Способом усовершенствования идентификации и таксономической классификации бактериальных разновидностей является получение нуклеотидной последовательности 16S rRNA гена путем секвенирования ДНК бактерий. Данный метод позволит провести генетическую идентификацию рода Listeria путем генотипирования.
Методом ПЦР был амплифицирован фрагмент ДНК протяженностью около 1100 п.н.. ПЦР была выполнена универсальными праймерами 16SrRNA-190F 5’– ATTAGCTAGTAGGTGGGGTAA-3 и 16SrRNA-1100R- 5’ TTACTAGCGATTCCGACTTCA в общем объеме 25 мкл. ПЦР смесь содержала 15 нг ДНК, 2.5х смеси, 5 пмоль каждого праймера и деионизированную воду 10 мкл. Программа амплификации ПЦР включала начальную денатурацию 94 °С в течение 3 минут; 27 циклов: 94 °С – 30 секунд, 60 °С – 30 секунд, 72 °С – 30 секунд; заключительную элонгацию 7 минут при 72 °С. ПЦР программа была выполнена с применением амплификатора Mastercycler Gradient, (Eppendorf).
Перед проведением реакции секвенирования для полученных фрагментов ДНК применяли ферментативный метод очистки. При ферментативном методе ПЦР продукты очищали от остатков олигонуклеотидов методом дефосфорилирования с помощью щелочной фосфатазы (SAP – Shrimp Alkaline Phosphatase, SibEnzyme) и эндонуклеазы Exonuclease I (Fermentas).
После ферментативной очистки ПЦР продукты были использованы для выполнения реакции секвенирования, очистки и разделения на автоматическом генетическом анализаторе ABI 3500.
Нуклеотидные последовательности 16S rRNA гена идентифицируемого штамма Listeria monocytogenes от 6 месячного теленка были проанализированы в программном обеспечении SeqScape 2.6.0 (Applide Biosystems).
С учетом полученных результатов, были проведены дальнейшие исследования по проверке чистоты представленного штамма, которые были осуществлены на основе анализа ферограммы нуклеотидной последовательности 16S rRNA гена. Было установлено, что у анализируемого штамма отсутствует смешение сигналов, что свидетельствует об отсутствии в предоставленной культуре посторонних видов бактерий. На рис. 2 в представлена ферограмма фрагмента нуклеотидной последовательности анализируемого гена Listeria monocytogenes.
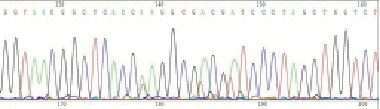
Рис. 2. Ферограмма фрагмента нуклеотидной последовательности гена 16S r RNA
Из рис. 2 видно, что проведенный анализ позволяет сделать выводы об отсутствии перекрестной контаминации культуры Listeria monocytogenes посторонними бактериями.
Последовательности нуклеотидов, полученные с применением прямого и обратного праймеров были объединены в общую последовательность, используя программное обеспечение SeqMan. Последовательности праймеров и плохо разделенные концевые участки были удалены из анализа. В результате проведенного анализа была получена нуклеотидная последовательность протяженностью около 700 п.н. Полученная нуклеотидная последовательность была проанализирована с применением базы данных NCBI утилиты BLAST. Нуклеотидная последовательность и результаты идентификации представлены в таблице и на рис. 3.
Результат идентификации гена 16S rRNA Listeria monocytogenes
Последовательность фрагмента 16S r RNA гена
Идентификация нуклеотидных последовательностей в международной базе данных (http://www.ncbi.nlm.nih.gov/) алгоритм BLAST
Инвентар-ный номер GeneBank (Accesion number) или коллекционный номер штамма
TAAAGAGAGTTTGATCCTGGCTCAGGACGAACGCTGGCGGCGTGCCTAATACATGCAAGTCGAACGAACGGAGGAAGAGCTTGCTCTTCCAAAGTTAGTGGCGGACGGGTGAGTAACACGTGGGCAACCTGCCTGTAAGTTGGGGATAACTCCGGGAAACCGGGGCTAATACCGAATGATAAAGTGTGGCGCATGCCACGCTTTTGAAAGATGGTTTCGCTATCGCTTACAGATGGGCCCGCGGTGCATTAGCTAGTTGGTAGGGTAATGGCCTACCAAGGCAACGATGCATAGCCGACCTGAGAGGGTGATCGGCCACACTGGGACTGAGACACGGCCCAGACTCCTACGGGAGGCAGCAGTAGGGAATCTTCCGCAATGGACGAAAGTCTGACGGAGCAACGCCGCGTGTATGAAGAAGGTTTTCGGATCGTAAAGTACTGTTGTTAGAGAAGAACAAGGATAAGAGTAACTGCTNGTCCCTTGACGGTATCTAACCAGAAAGCCACGGCTAACTACGTGCCAGCAGCCGCGGTAATACGTAGGTGGCNAGCGTNGTCCGGATGGATTGGGCGTNAAGCGCGCGCAGGCGGTCTTTTAAGTCTNATGTGAAAGCCCCCGGCTGAACCGGGNNGGGTCATTGGAAACTGGAAGACTNGAGTGCNGAAGAGGAGAGTGGAATTCCACGTGTAGCGGTGAAATGCGTAGATATGTGGAGGAACACCAGTGGCGAAGGCGACTCTCTGGTCTGTNACTGACG CTGAGGCGCG AAAGCGTGGG
Listeria monocytogenes 07PF0776 strain 07PF0776
Listeria monocytogenes strain NCTC 10357
Listeria innocua strain ATCC 33090
Из таблицы следует, что данные Международного банка GeneBank [6] показывают высокую степень однородности нуклеотидной последовательности 16S rRNA изучаемого штамма с разновидностями рода Listeria (99 %).
Как видно из рис. 3, анализируемый штамм находится на одной филогенетической ветви с разновидностями рода Listeria.
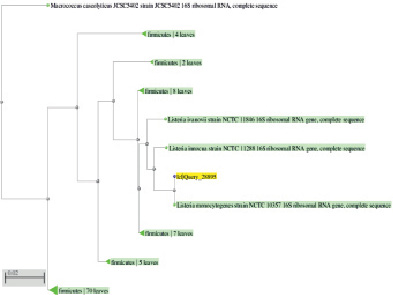
Рис. 3. Филогенетическое древо, построенное на основании фрагмента гена 16S rRNA
Определение патогенности листерий. Биопробу ставили на 3 белых мышах массой 16-18 г, которым подкожно вводили по 0,2 мл суточной бульонной культуры Listeria monocytogenes. На 3 сутки опытные животные пали. При бактериологическом исследовании патматериала от павших белых мышей чистая культура листерий высевалась из печени, сердца.
На 2 морских свинках ставили конъюнктивальную пробу введением в конъюнктивальный мешок по 0,05 мл суточной бульонной культуры Listeria monocytogenes. У морских свинок на 3 сутки развился кератоконъюнктивит и светобоязнь.
В результате проведенных исследований установлено, что эпизоотическая культура Listeria monocytogenes, полученая из патматериала от теленка, коровы, быка-производителя, обладала типичными культурально-морфологическими, биохимическими и антигенными свойствами и по результатам серологических исследований отнесена к 1-му серотипу. По биологическим свойствам эпизоотический изолят был идентичен эталонному музейному штамму. Методом генотипирования была установлена однородность нуклеотидной последовательности 16S rRNA изучаемого штамма с разновидностями рода Listeria (совпадение 99 %).
Таким образом, диагноз на листериоз был поставлен на основании клинико-эпизоотологических данных, характерных культуральных и морфологических свойств, тинкториальных свойств, биохимических свойств (отношение к белкам, углеводам, каталазной, лецитиназной активности и т.д.), молекулярно – генетических свойств (проведения генотипирования методом ПЦР), положительной реакции агглютинации с поливалентной и типовой листериозными сыворотками и отсутствием агглютинации в контроле с физраствором, а также в результате изучения биологических свойств с постановкой биопробы на лабораторных животных.
Во время изолированного содержания, при формировании новых групп в хозяйствующих субъектах или населенных пунктах необходимо проводить клиническое обследование животных и при необходимости (при выявлении признаков поражения нервной системы, абортов, повышенной температуры тела) бактериологические и серологические исследования на листериоз. Систематически проводить уничтожение грызунов, кровососущих насекомых и клещей. Вести строгий учет случаев абортов, мертворождения и падежа животных и направлять патологический материал на исследование в ветеринарную лабораторию.
Читайте также:


