Подострый склерозирующий панэнцефалит что это такое
Что такое подострый склерозирующий панэнцефалит

Это – вызываемая вирусом кори медленная инфекция. Латентный период может составлять до 8 лет. Дебютирует расстройствами поведения и личности. Позже проявляются прогрессирующие зрительные, мышечно-тонические и когнитивные нарушения, пароксизмальные состояния. Для постановки диагноза применяется КТ или МРТ головного мозга, электроэнцефалография, анализ цереброспинальной жидкости, выявление в ликворе и крови специфических антител. Этиотропное лечение включает антивирусные средства. Симптоматическая терапия – противоэпилептические препараты.
Общие сведения о патологии
Причины
Это классическая медленная инфекция центральной нервной системы. Инфекционный агент – вирус кори. После перенесенной естественной коревой инфекции, он сохраняется в организме в персистирующем состоянии. Чаще всего выявляется у детей, которые перенесли болезнь в возрасте до 2 лет. Латентный период составляет 6-8 лет. После чего появляется быстро прогрессирующий панэнцефалит. Обуславливающие персистенцию факторы на сегодняшний день неизвестны. Некоторые неврологи предполагают, что провоцирующим моментом становится измененная иммунологическая реактивность. Она обуславливает неполную элиминацию вируса.
Механизм развития
Патогенез до конца не изучен. Триггеры, активирующие вирус, не определены. Спустя многолетний латентный период корь, персистирующая в церебральных клетках, начинает активную репликацию . Это вызывает повсеместное воспалительное изменение в тканях головного мозга. Такой процесс носит название подострый панэнцефалит. В него вовлечены подкорковые ганглии, белое вещество, мозговые оболочки и кора. Очаги размещены неравномерно. В этих зонах происходит отмирание нейронов и компенсаторное разрастание глиальной ткани. Для поздних стадий характерна диффузная демиелинизация с глиозом. В пораженных нейронах имеются специфические включения. Диагностика с помощью помеченных антител позволяет обнаружить в них антиген коревого вируса.
Классификация
У всех больных течение стадийное. Но симптоматическая картина при этом вариабельна. Для ее уточнения и построения прогнозов необходимо правильно определить фазу. Классифицируется ПСП на 4 стадии:
- Первая по-другому называется психотическая или начальная. Для нее характерны нарастающие изменения в интеллекте и поведении больного. На этом этапе болезнь сложно дифференцировать с психиатрическими патологиями. Она продолжается 2-12 месяцев до появления мышечно-тонических нарушений.
- На второй стадии возникают двигательные расстройства. Это могут быть пароксизмальные эпизоды – абсансы, судорожные приступы, атонические падения или гиперкинезы. Позже присоединяются неврологические симптомы. Стадия занимает около 6-12 месяцев.
- Для третьей стадии свойственно быстрое прогрессирование деменции, усиление ригидности мышц. Судорожный синдром ослабляется. Период течения около нескольких месяцев.
- Термальная или коматозная четвертая стадия начинается, когда происходит полный распад психических функций. Возникает кахексия, децеребрационная ригидность. Больной впадает в кому. Эта стадия заканчивается летальным исходом.
Клиническая картина
Эта патология начинается с постепенно углубляющихся поведенческих расстройств. К ним относится:
- Агрессия;
- Раздражительность;
- Неряшливость;
- Упрямство;
- Равнодушие к окружающим.

Преобладает простые эмоции - эгоизм и жадность. Возникают психопатоподобные реакции, инсомнии. Школьники испытывают трудности в обучении. К концу начальной стадии имеются ярко выраженные мнестические расстройства, снижение интеллекта, афазии или дизартрии. Симптоматические проявления прогрессируют.
Позже присоединяется экстрапирамидная симптоматика:
- Торсионная дистония.
- Непроизвольные движения в форме атетоза.
- Тремор.
- Гемибаллизм.
- Смешанные расстройства мышечного тонуса.
- Миоклония.
У пациента отмечаются эпизоды отключения сознания, так называемые абсансы, генерализованные судорожные приступы. Возникают атонические пароксизмы. Развернутая клиника сопровождается пирамидальными нарушениями – патологическими рефлексами, парезами, мозжечковой атаксией. Усиливается когнитивная дисфункция. Для нее характерны: амнезия, апраксия, алексия, аграфия, агнозия. У половины больных отмечается расстройство зрения. Это связано с развитием коревого хориоретинита и поражением зрительного нерва в затылочной доле.
Со временем гиперкинезы сменяются паркинсонизмом. Смешанные изменения тонуса переходят в тотальную ригидность мышц. В дополнение к экстрапирамидным расстройствам возникает вегетативная симптоматика:
- Гипергидроз.
- Сальность кожи.
- Лабильность давления.
- Гиперсаливация.
Усиливающаяся децеребральная ригидность приводит к исчезновению судорожных пароксизмов. Наступает полный распад личности. На этой фазе больной часто насильственно плачет или смеется, страдает от расстройств дыхания, глотания, гипертермических кризов. В термальной стадии конечности согнуты, продуктивного контакта нет. Отмечены сгибательные контрактуры. Сознание угнетается до состояния комы. Происходят трофические поражения тканей.
Осложнения ПСП
Длительное лежачее состояние приводит к пролежням. Зрительные нарушения могут вызывать амавроз. При инфицировании возникают местные воспалительные изменения. Это опасно попаданием инфекции в кровоток и сепсисом. Из-за обездвиженности и дыхательных расстройств возникает застойная пневмония. Дисфагия может вызвать попадание пищи в дыхательное горло. Начинается аспирационная пневмония. Эти причины становится наиболее частыми факторами, вызывающими смерть пациента.
Методы диагностики
Подострый склерозирующий панэнцефалит чаще всего диагностируют на поздних стадиях. Это связано с неспецифичностью симптомов, полиморфизмом и изолированными психотическими изменениями. При постановке диагноза невролог собирает анамнез. Опираться можно на информацию о перенесенной в детстве кори, изменение неврологического статуса. Также показательны данные ЭЭГ и нейровизуализация. Необходимо провести анализ на наличие противокоревых антител. Биопсия головного мозга не является показателем. Локализация поражения мозаична. Поэтому забор материала может произойти из неповрежденного участка. Перечень диагностических способов включает:
- Анализ крови на противокоревые антитела. Он показывает повышение в сыворотке антител до 1:4-1:128. Тогда как норма – 1:200 – 1:500. Повышение титра в цереброспинальной жидкости и крови – важнейший диагностический признак.
- Люмбальная пункция с дальнейшим исследованием цереброспинальной жидкости. При анализе обнаруживается умеренное повышение концентрации белка. Значительно нарастает содержание гамма-глобулинов, имеются специфические олигоклональные IgG. Для коревой этиологии также характерно резкое увеличение коревых антител.
- К методам нейровизуализации относится КТ или МРТ. Они показывают множественное диффузное поражение церебральных тканей, атрофию коры. Иногда отмечается гидроцефалия. Спустя 4 месяца с дебюта ПСП можно обнаружить разрушение белого вещества. В половине случаев поражение базальных ганглиев видно на второй стадии болезни.
- Во время электроэнцефалографии повышена медленноволновая активность. Она возникает с интервалом 6-8 часов. Чередуется с этапами снижения биоэлектрической активности. Комплексы синхронны, симметричны и носят двусторонний характер.
Терапия
Специфического лечения для этого заболевания не существует. Очень важен правильный уход. Необходимо предупредить вторичные инфекции. Применяются противовирусные препараты в качестве этиотропной терапии. Это могут быть такие препараты, как инозин пранобекс, рибавирин, производные интерферона. По мнению многих неврологов это - малоэффективно. Симптоматическое лечение включает:
- Антиконвульсанты. Диазепам или препараты вальпроевой кислоты эффективной в отношении миоклоний.
- Миорелаксанты (баклофен, толперизон) необходимы для снятия спастического гипертонуса.
- При нарушении дыхания необходим перевод на ИВЛ.
Такие меры позволяют продлить жизнь пациента.
Врачебный прогноз

Прогноз этой патологии неутешительный. У 80% пациентов подострый склерозирующий панэнцефалит длится 1-3 года и приводит к смерти пациента. У 10% отмечается молниеносное течение. Увеличить продолжительность жизни больного до 10 лет удается лишь в 10% случаев.
Меры профилактики
Наилучшая профилактика – недопустимость заболевания корью. Специфические превентивные меры включают плановую вакцинацию кори у детей. При отсутствии медотвода прививка делается в 12 месяцев.
Подострый склерозирующий панэнцефалит (ПСПЭ) — прогрессирующее нейродегенеративное, обычно смертельное заболевание ЦНС. Оно вызывается вирусом кори и относится к медленным вирусным инфекциям. Заболевание начинается спустя годы (обычно до 8 лет) после перенесенной кори.
Заболеваемость в развитых странах составляет 1 случай на 1 млн населения, в Индии — до 21 на 1 млн, что связано с уровнем доступности медицинской помощи. Имеющиеся эпидемиологические данные говорят о том, что вакцинация против кори обладает прямым защитным эффектом против ПСПЭ. Чаще поражаются мальчики и мужчины, обычно в возрасте до 20 лет.
Патогенез
В данный момент существует две теории относительно этиологического агента ПСПЭ: согласно одной, заболевание вызывает мутантный вирус кори, также названный вирусом подострого склерозирующего панэнцефалита; возможно, однако, что все патогенные вирусы кори способны инфицировать ЦНС, а развитие ПСПЭ в дальнейшем зависит от иммунного ответа хозяина.
Скорее всего, вирус кори попадает в структуры ЦНС во время первого инфицирования корью и персистирует до развития панэнцефалита. В большей мере поражаются нейроны и олигодендроциты, однако как именно вирус проникает в них — не вполне понятно, ведь эти клетки не экспрессируют известных клеточных рецепторов к вирусу кори. Как показали экспериментальные модели, после проникновения в нейроны вирус может распространяться на соседние структуры транснейронально.
На ранних стадиях в процесс вовлекаются затылочные области, в дальнейшем изменения распространяются на передние отделы коры, и, в последнюю очередь, на подкорковые, стволовые структуры и спинной мозг. На поздних стадиях можно наблюдать картину распространенной деструкции как белого, так и серого вещества головного мозга и признаки атрофии коры.
Гистологически наблюдаются воспалительные изменения в паренхиме и оболочках мозга, демиелинизация, множественные вирусные включения в нейронах, олигодендроцитах и астроцитах, потеря нейронов и астроглиоз.
Клиника
В клиническом течении болезни выделяют 4 стадии:
I стадия характеризуется нарушениями поведения в виде повышенной раздражительности, тревожности, психопатоподобных реакций, падением успеваемости, утомляемостью, расстройствами речи и нарушениями сна. Часто ошибочно диагностируется как психиатрическая патология. Продолжается 2–12 месяцев.
II стадия начинается с появления двигательных расстройств (гиперкинезов), пароксизмальных эпизодов (миоклонических приступов, обычно генерализованных, абсансов, атонических падений). Стадия продолжается 6–12 месяцев.
III стадия протекает с исчезновением миоклонуса, пирамидными и экстрапирамидными расстройствами, прогрессированием деменции, постепенным ослаблением судорожного синдрома. Длится несколько месяцев.
IV стадия (терминальная) — децеребрационная ригидность, декортикация, вегетативное состояние.
В половине случаев возникают офтальмологические изменения в виде некротизирующего ретинита. Также нередки нарушения зрения в виде корковой слепоты.
Диагностические критерии Dyken для диагностики подострого склерозирующего панэнцефалита
- Типичное клиническое течение с прогрессирующими изменениями психического статуса и стереотипными генерализованными миоклоническими приступами
- Характерные изменения ЭЭГ (в виде стереотипных периодических высокоамплитудных дизритмических комплексов, которые связаны с миоклоническими судорогами.
- Повышение отношения содержания глобулинов к уровню альбумина более 20 % в ЦСЖ.
- Возрастание титров антител к вирусу кори в ЦСЖ.
- Типичные гистопатологические находки (а также результаты ПЦР) при исследовании биоптата/аутопсии.
Лучевые признаки
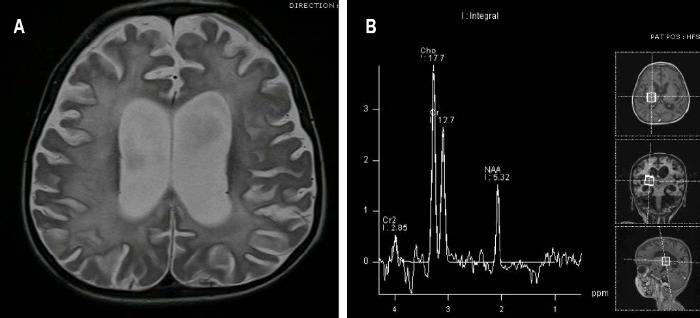
На ранних стадиях процесса может не выявляться никаких изменений. МРТ является методом выбора.
Сигнальные характеристики
- пораженные области демонстрируют повышение МР сигнала на T2ВИ/FLAIR изображениях;
- нередко наблюдается также их контрастное усиление в T1ВИ после внутривенного контрастирования;
- атрофия головного мозга проявляет себя выраженностью борозд, истончением извилин и равномерным компенсаторным расширением желудочков;
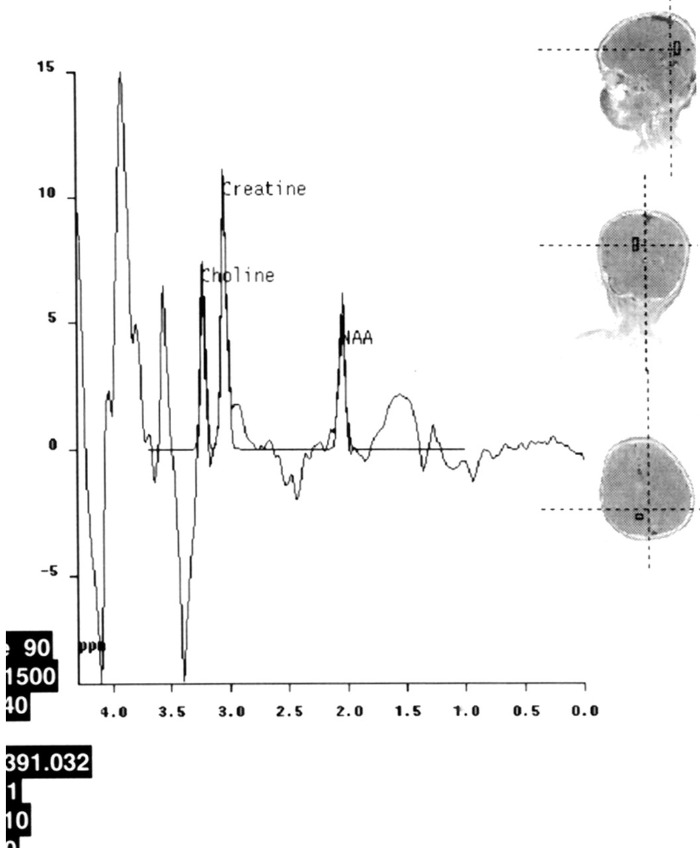
- при проведении МР-спектроскопии может обнаруживаться:
— отсутствие или снижение пика N-ацетиласпартата;
— повышение пика холина и мио-инозитола;
— повышение пика лактата;
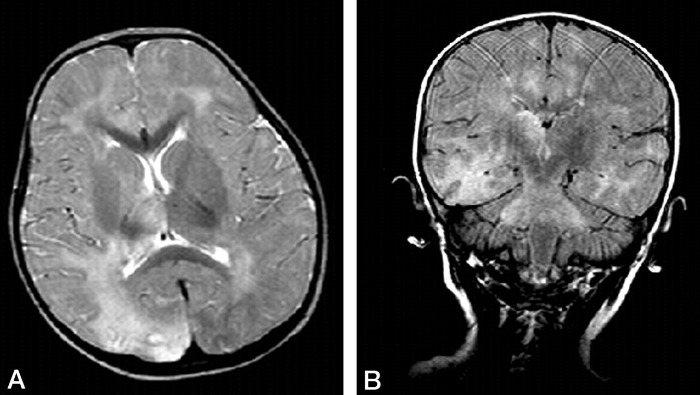
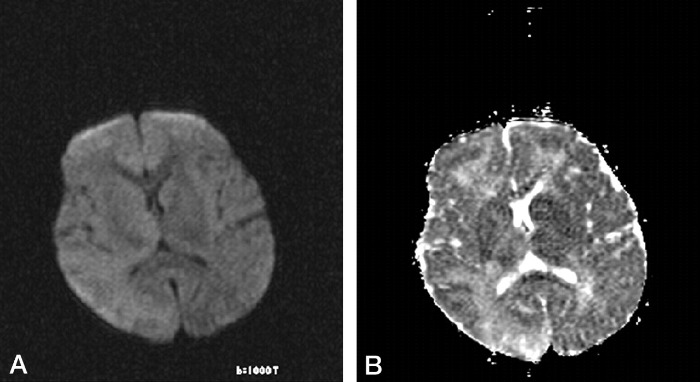
Излюбленная локализация изменений: перивентрикулярное и субкортикальное белое вещество; базальные ядра, мозолистое тело, таламусы и спинной мозг поражаются реже. С прогрессированием процесса появляются признаки атрофии полушарий, мозжечка и продолговатого мозга, вплоть до тотальной потери белого вещества на терминальной стадии. Серое вещество вовлекается в сравнительно меньшей мере.
Помните, что выраженность лучевых проявлений может не коррелировать с клинической картиной.
Дифференциальная диагностика
Диагностика этой крайне редкой патологии в начальной стадии представляет большие трудности. В ретроспективном исследовании, включавшем данные о 307 пациентах, отмечено, что в 78,8 % случаев при первичном обращении выставлялся другой диагноз: эпилепсия, абсансная эпилепсия, синдром Леннокса-Гасто, метахроматозная лейкодистрофия, болезнь Вильсона-Коновалова, васкулит, спиноцеребеллярная атаксия, кататоническая шизофрения, гемипаркинсонизм, болезнь Шильдера и даже симуляция. Лист дифференциальных диагнозов с разными проявлениями ПСПЭ можно увидеть в таблице 1.
Таблица 1 | Лист дифференциальных диагнозов при диагностике ПСПЭ. 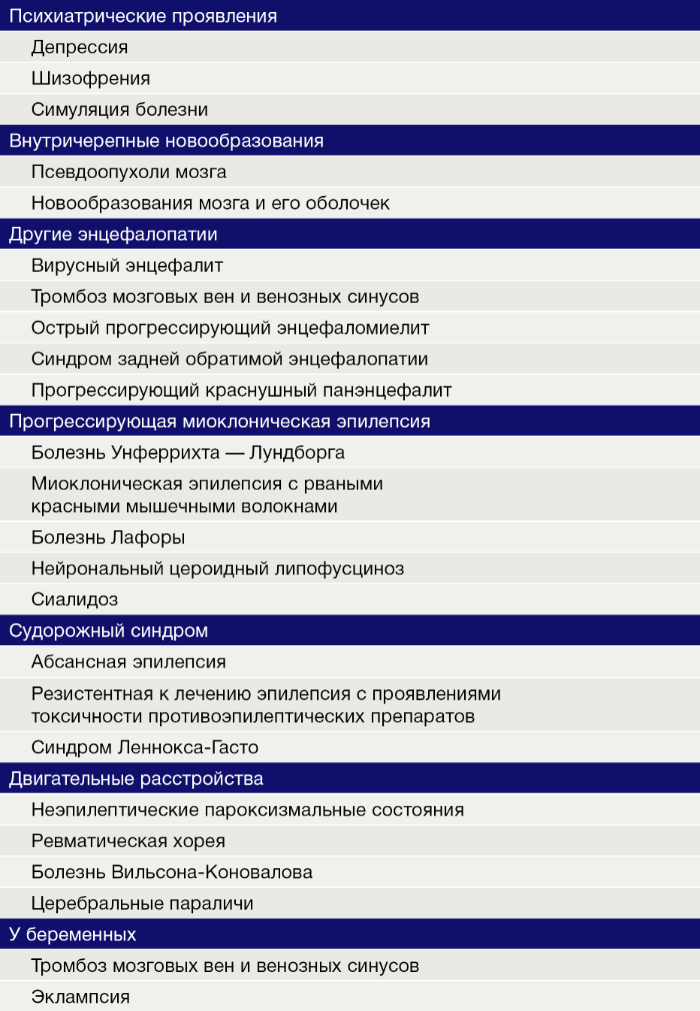
Лечение
Специфическое лечение на данный момент не разработано.
Изопринозин был одним из первых препаратов, показавших эффективность в стабилизации болезни. Однако во многих других исследованиях положительное действие препарата оказалось не доказанным. Разные исследователи применяли также интравентрикулярное введение альфа-интерферона, бета-интерферона и рибавирина, а также комбинации двух и трех препаратов. Пока, однако, не накоплено достаточно данных об их эффективности.
В качестве симптоматической терапии назначают антиконвульсанты, эффективные в отношении миоклоний (диазепам, производные вальпроевой кислоты). Для снятия спастического гипертонуса применяют миорелаксанты (толперизон, баклофен). Нарушения дыхания на заключительных стадиях заболевания являются показанием к переводу пациентов на ИВЛ.
Источники
- Garg R. K. Subacute sclerosing panencephalitis //Journal of neurology. — 2008. — Т. 255. — №. 12. — С. 1861-1871.
- Sener R. N. Subacute sclerosing panencephalitis findings at MR imaging, diffusion MR imaging, and proton MR spectroscopy //American Journal of Neuroradiology. — 2004. — Т. 25. — №. 5. — С. 892-894.
- Alkan A. et al. Early-and late-state subacute sclerosing panencephalitis: chemical shift imaging and single-voxel MR spectroscopy //American journal of neuroradiology. — 2003. — Т. 24. — №. 3. — С. 501-506.
- Jafri S. K. et al. Spectrum of MRI brain findings in subacute sclerosing panencephalitis //Asia Pacific Journal of Clinical Trials: Nervous System Diseases. — 2017. — Т. 2. — №. 4. — С. 124.
- Корниенко, В. Н.; Пронин, И. Н. Диагностическая нейрорадиология: 2 изд. в 3-х т. М.: ИП Андреева, 2008, 1: 445.
В 1933 г. американский врач Дж. Даусон описал тяжелое прогрессирующее дегенеративное заболевание детей и подростков. Наиболее ранними признаками болезни служили общее недомогание, утрата аппетита, постепенная потеря веса, жалобы на головокружения и головные боли. К ним вскоре присоединялись повышенная раздражительность и необыкновенная забывчивость, что сразу же, естественно, начинало сказываться на учебе. Ребенок становился плаксивым, плохо воспринимал и запоминал школьный материал, а позднее оказывался и вовсе не способным усваивать новое.
Болезнь прогрессирует — быстро снижается интеллект, расстраивается речь, изменяется письмо. Появляются мелкие подергивания мышц конечностей; возникает двоение в глазах. Состояние все более ухудшается: нарушаются координация сложных движений, походка и целенаправленные движения; слабеет мышечная сила; больной перестает узнавать обычные предметы. Спустя несколько недель или месяцев ухудшение зрения прогрессирует до слепоты, развивается недержание мочи, появляются быстрые, неритмичные, постоянно возобновляющиеся непроизвольные короткие сокращения отдельных мышц, а также толчкообразные быстрые излишние движения. Нередко последние этапы заболевания протекают на фоне развивающегося резкого истощения. Смерть обычно наступает через несколько месяцев после начала заболевания, которое, как подмечено, в более раннем возрасте носит особенно быстро прогрессирующий характер.
У детей старшего возраста болезнь может протекать с периодами улучшений, продолжающимися иногда до нескольких недель, а то и месяцев. В таких случаях общая продолжительность страдания увеличивается до 8 и даже до 10 лет, однако неизбежно заканчивается смертью.
Причины этого заболевания, известного под названием "подострый склерозирующий панэнцефалит" (сокращенно — ПСПЭ), долгое время оставались неизвестными. Но вот с середины 60-х гг. ПСПЭ начинает привлекать пристальное внимание вирусологов.
Этому есть свое объяснение. Еще Дж. Даусон, внимательно изучая различные внутренние органы погибших от ПСПЭ детей, обнаружил и описал появление в клетках головного мозга каких-то телец, не встречавшихся в мозговых клетках при других болезнях. Ученый не прошел мимо этой находки, он знал, что подобного рода образования, называемые тельцами включений, нередко образуются в клетках разнообразных тканей при разных вирусных заболеваниях: оспе, бешенстве, герпесе, кори, эпидемическом конъюнктивите, гриппе, эктромелии, аденовирусной инфекции и др. Тельца включений представляют собой скопления размножающихся вирусных частиц. Они достигают значительных размеров (от 0,2 до 25 микронов) и могут быть круглой, овальной, удлиненной или эллипсовидной формы. Их расположение в клетке тоже неодинаково. Так, например, при бешенстве и оспе тельца включений формируются в цитоплазме клеток, при герпесе и желтой лихорадке — в ядрах. Характер расположения, вид, свойства (отношение к красителям) телец включений служат характерными показателями некоторых вирусных заболеваний, а их большие размеры делают их легко доступными для обнаружения в обычном световом микроскопе. Именно такое место заняли тельца включений при бешенстве и при оспе в лабораторной диагностике этих вирусных заболеваний.
Вот почему в эпоху пристрастного изучения медленных вирусных инфекций тельца включений при ПСПЭ, описанные еще в 1933 г., заинтересовали вирусологов.
Каждому известно: первое, что интересует врача, выслушавшего жалобы больного, это анализ крови. Кровь, питающая клетки организма кислородом и снабжающая их всем необходимым для жизни, выводит углекислоту и шлаки и, таким образом, постоянно присутствует во всех даже самых отдаленных уголках нашего организма. Ей, как говорится, есть до всего дело. И несмотря на упорное стремление поддерживать свой состав на постоянном уровне, кровь, конечно же, быстрее всех других органов реагирует на различные неполадки, происходящие в нашем теле.
Поэтому прежде всего вирусологи решили заглянуть в кровь больных ПСПЭ детей. Ведь если ПСПЭ — вирусное заболевание, то наверняка организм ответит образованием антител на вирус-возбудитель.
Заглянули и. поразились. В крови детей, больных ПСПЭ, обнаружили высокие титры противокоревых антител.
Для того чтобы оценить всю неожиданность этой находки, надо напомнить, что у нас с вами, читатель, в крови тоже присутствуют противокоревые антитела (мы ведь переболели в детстве корью). И в нашем организме титр таких антител, то есть то крайнее разведение, когда их противовирусная активность еще определяется, соответствует примерно 1:40. В крови же детей, страдающих ПСПЭ, титр противокоревых антител нередко достигает 1:16.000!
Этот факт не говорил, он кричал! Как глубоко был прав Дж. Даусон: скрупулезное изучение клеток головного мозга погибших от ПСПЭ показало — клетки действительно содержали тельца включений, которые как две капли воды были похожи на включения, характерные для вируса кори. Пошли дальше, и из мозговой ткани больных приготовили сверхтонкие срезы, которые можно рассматривать не только в световом, но даже и в электронном микроскопе. Этот прибор позволил выявить внутри таких телец включений большие скопления кореподобных вирусных частиц. Наконец, последнее косвенное доказательство причастности вируса кори к этому фатальному заболеванию получили с помощью метода флюоресцирующих антител: обычные (не сверхтонкие) срезы мозговых клеток погибших от ПСПЭ детей обрабатывают сыворотками, содержащими антитела к различным вирусам, а эти антитела помечены ярко светящимся веществом. Ясно, что свечение будет наблюдаться только в том случае, если антитела свяжутся с вирусом.
Посмотрите на приведенную схему, и вы легко поймете, что антитела, не соответствующие данному вирусу, при отмывании среза клеток уйдут (будут смыты с него), а если сыворотка содержит как раз те антитела, которые соответствуют находящемуся в клетке вирусу, то они свяжутся с ним, и отмыванием их уже нельзя удалить из клеток. Значит, в таком препарате мы увидим свечение.
. Срезы мозговой ткани больных ПСПЭ обрабатывали различными сыворотками, но пораженные мозговые клетки светились ярким изумрудным светом только в том случае, если сыворотка была противокоревой.
Можно было только радоваться быстрому успеху исследований. Казалось, до получения прямого доказательства коревой природы заболевания остается всего один шаг — нужно лишь выделить из пораженной мозговой ткани коревой вирус. Но именно здесь ученых подстерегали большие трудности. И шаг растянулся на годы напряженнейших поисков в различных лабораториях мира.
При ПСПЭ поражения обнаруживают только в центральной нервной системе: прежде всего разрастается опорная ткань мозга — так называемая глия, что особенно резко выражено в белом веществе мозговых полушарий; распадаются миелиновые волокна, происходит жировое перерождение нервных клеток, вокруг сосудов мозга видны очаги воспаления.
Итак, поражения — в мозговой ткани, тельца включений — в мозговых клетках. Тогда, надеясь извлечь из пораженных мозговых клеток вирус, их принимаются разрушать, полученные суспензии освобождают от клеточных обломков и вводят животным. Безуспешно. Заражают теми же материалами клеточные культуры. И это не приносит никакого успеха.
Цель казалась уже близкой, когда начали из кусочков мозговой ткани получать клеточные культуры, обрабатывая ткань раствором трипсина. Клетки в культурах росли, сливались между собой в гигантские многоядерные клетки, в них видели характерные коревые включения, но. не видели вируса.
Еще одна интересная находка: пораженными мозговыми клетками попробовали заразить белых африканских хорьков — и у животных развился хронический энцефаломиелит.
Но появившийся лучик надежды готов был вот-вот погаснуть, потому что из мозга больных хорьков вирус не удавалось выделить никакими ухищрениями. Особую досаду это вызывало потому, что было обнаружено удивительное сходство клинических признаков болезни, характера поражений в мозгу и даже типа электроэнцефалограмм у таких животных и у людей больных ПСПЭ.
Настоящий успех в поиске выпал на долю группы исследователей из Национального института неврологических заболеваний в г. Бетезде (США). Коллектив американских вирусологов, руководимый Луизой Хорта-Барбоза, применил так называемый метод смешанных культур клеток: в матрасах вырастили однослойную культуру раковых клеток человека HeLa1 и на этот ковер поместили мозговые клетки, предварительно приготовленные обработкой трипсином кусочков мозговой ткани больного ребенка.
Прошло несколько дней, и клетки HeLa начали сморщиваться, отъединяться друг от друга, а затем и вовсе распадаться.
Кто виноват? Вирус кори!
Действительно, в питательной среде такой двойной культуры клеток накапливалось все больше и больше вируса кори, который можно было очень просто определить, заражая чувствительные к нему новые клеточные культуры или, еще проще, посмотрев такую питательную среду в электронном микроскопе.
Открытие коревой природы ПСПЭ знаменовало собой важную веху в истории изучения всей проблемы медленных инфекций. Вспомните открытие у вируса висны структуры и свойств обычных вирусов. А главное — способности вызывать дегенерацию клеточных культур, что присуще широкому кругу инфекционных вирусов — возбудителей острых лихорадочных заболеваний.
Так была окончательно сорвана маска с третьего лика вирусов!
Но вернемся к ПСПЭ. Это редкое заболевание, поражающее, как мы уже говорили, преимущественно детей и подростков. Однако нет правил без исключения: известны случаи этой болезни у людей в возрасте до 1 года и. в возрасте 58 лет. Частота болезни примерно равна 1 заболеванию на 1.000.000 жителей. При этом подмечено, что лица мужского пола болеют в 4 раза чаще, чем лица женского пола. И что еще характерно — из общего числа заболевших 85% случаев приходится на детей из сельской местности.
У большинства больных симптомы заболевания развиваются в возрасте 5 — 15 лет, и заболевают только те дети, которые ранее перенесли корь. Вы легко догадываетесь, что последнее утверждение сразу же ставит два нелегких вопроса, и на них надо давать ответы.
Прежде всего сохранение вируса кори в организме после перенесенного заболевания (латентная коревая инфекция) хорошо объясняет длительный, практически пожизненный противокоревой иммунитет (соглашение-то все же джентльменское!). Длительную латентную инфекцию подтверждают также и случаи ПСПЭ, развивающиеся иногда через много лет после кори. Например, описан случай ПСПЭ, развившийся спустя 17(!) лет после перенесенной коревой инфекции. И наконец, инфекционный вирус кори уже, как вы помните, выделяли из организма внешне здоровых людей. Еще в 1965 г. американская исследовательница Г. Эндерс-Рюкле выделила инфекционный вирус кори из клеток селезенки и лимфатических узлов внешне здорового 46-летнего мужчины, в детстве перенесшего корь и погибшего от несчастного случая. Мало того, ученая показала, что вирус кори после заражения им обезьян сохраняется в организме этих животных до 2 месяцев и ничем не проявляет при этом своего присутствия.
Справедливости ради напомним, что тогда, в 1965 г., эти результаты встретили, мягко говоря, весьма прохладный прием. Но вот спустя 4 года, после открытия коревой природы ПСПЭ, сразу вспомнили об этих работах, и их результаты по праву заняли достойное место среди аргументов в пользу доказательств длительной персистенции вируса кори после перенесенного заболевания.
Суммируя все ответы на первый вопрос, надо согласиться, что нет оснований отвергать длительную (а может быть, и пожизненную) персистенцию вируса кори после перенесенного заболевания. Но, ответив на первый вопрос, мы должны сразу задать себе.
вопрос второй: если корью (а мы все это прекрасно знаем) переболевают практически все и, следовательно, вирус кори персистирует в организме всех этих людей, то почему же, к счастью, столь редки (1:1.000.000) случаи заболевания ПСПЭ?
Так или иначе, но признаем откровенно, что конкретные причины развития ПСПЭ не установлены, и над их выяснением уже не первый год напряженно трудятся вирусологи у нас в стране и за рубежом. Вместе с тем уже сегодня имеются очень важные факты, которые хотя и не до конца срывают покрывало с загадки ПСПЭ, но все же делают поиски достаточно целенаправленными.
Несколько лет назад в США были проведены детальные эпидемиологические исследования ПСПЭ. Для этого в различных районах страны тщательно отбирали только тех детей, заболевших ПСПЭ после 1966 г., у которых это заболевание было точно подтверждено и клиническим обследованием, и результатами лабораторных анализов.
Очень важно, что при этом отборе для каждого больного ребенка отыскивали соответствующий контроль — ребенка того же возраста и пола и проживающего в абсолютно тех же условиях (ведь все познается в сравнении!). Учитывались также все члены семьи, родители и близкие друзья больных и контрольных детей. Всего таким образом для обследования отобрали 43 больных ПСПЭ и 38 соответствующих им контрольных детей. Кроме того, обследованием были охвачены 176 братьев и сестер больных детей и 114 братьев и сестер контрольных детей. Все отобранные дети были тщательнейшим образом осмотрены, опрошены по заранее разработанной схеме и внимательно обследованы. И вот что удалось установить.
Оказалось, что больные ПСПЭ дети перенесли корь в значительно более раннем возрасте, чем контрольные дети. Так, из 43 больных ПСПЭ 31 ребенок переболел корью в возрасте в среднем 15 месяцев, остальные 12 детей вообще перенесли корь до 12-месячного возраста. А что же у контрольных?
В контрольной группе детей не было ни одного случая заболевания корью до года, и средний возраст заболевших составлял 48 месяцев. Итак, дети, перенесшие клинически выраженную корь лишь в двухлетнем возрасте, не заболели в дальнейшем ПСПЭ. Эти факты вновь заставляют нас вернуться к иммунологическим нарушениям при ПСПЭ. То, что при этом заболевании у ребенка нарушена функция (или функции) органов и тканей, ответственных за выработку иммунитета, можно считать твердо установленным. Судите сами, ведь в крови титр противокоревых антител 1:16 000, а организм все-таки не может справиться с инфекционным процессом.
Вот еще один пример того, что при вирусных заболеваниях антитела далеко не исчерпывают иммунологической вооруженности организма. Предполагают, что в случае ПСПЭ происходят какие-то поломки в механизмах клеточного иммунитета, хотя функция антителообразования при этом не только не снижается, а, как мы видим, даже патологически усиливается.
Давно и хорошо известно, что мать передает плоду через плаценту антитела ко многим возбудителям инфекционных болезней, чем и объясняется относительная невосприимчивость к ним детей в возрасте от 0 до 6 — 12 месяцев. К этому надо добавить еще и известную незавершенность развития у новорожденных органов и тканей, ответственных за выработку иммунитета. Отсюда понятно, что заражение ребенка в этот период вызовет и неполную иммунологическую реакцию самого организма ребенка, не столь энергичный отпор, который, видимо, слабо вооружит такой организм, например, в отношении вируса кори в будущем.
В каждой семье хорошо знают: чем раньше переболеет ребенок корью, тем легче он ее перенесет. Действительно, корь у детей старшего возраста чревата серьезными осложнениями.
Но, как мы теперь видим, детей очень раннего возраста следует особенно оберегать от кори. Это означает более внимательное отношение к случаям заболеваний корью в окружении ребенка. Это не означает рекомендации полной изоляции малютки; но, наверное, ребенку до двух лет рано еще сопровождать маму в кино, в магазины или без особой нужды разъезжать в общественном транспорте.
- 1. В 1952 г. в американской больнице умирала от рака шейка матки молодая негритянка Хелена Лейк (Helena Lake). Из кусочка взятой у больной перед смертью опухолевой ткани обработкой трипсином приготовили клеточную культуру. Эти клетки, названные по двум первым буквам имени и фамилии этой женщины, размножаются до сих пор и широко используются для культивирования в них вирусов во всех вирусологических лабораториях мира.
Читайте также:


