Научные статьи по стафилококкам

Предположительным местом длительного переживания и массивного размножения S. aureus являются апокриновые железы, расположенные в передних отделах носовых ходов, а также в подмышечных ямках и паховых складках, что определяет факт преимущественного обнаружения S. aureus на этих участках кожи и слизистых оболочек. При этом именно передняя часть носовых ходов обычно рассматривается как основная экологическая ниша для S. aureus, что связано с высокой степенью сродства микроорганизмов данного вида с расположенным там эпителиоцитами.
По данным разных авторов, носительство S. aureus в носовых ходах выявляется от 1/3 до 2/3 взрослой человеческой популяции, при этом, если постоянно свободными от носительства оказываются примерно 34% обследованных, то на долю временных носителей приходится 16%, а постоянное носительство транзиторного и резидентного типов может быть диагностировано соответственно в 29 и 25% случаев [8,9]. Значение носовых ходов как основного места обитания и размножения S. aureus подтверждается и его существенным количественным присутствием в данной экологической нише. Данные по детской популяции отличаются еще большим разнообразием - от 3-4 до 62% у часто болеющих детей [1].
Антропогенное воздействие на окружающую среду оказывает сильное влияние на направленность эволюции взаимодействия паразита и хозяина. Установлено, что наряду с нарастанием резистентности паразита к техногенной нагрузке, идет и другой процесс - постепенное усиление иммунодепрессивного состояния хозяина. В максимальной степени антропогенные нарушения экологического равновесия выражены в основной среде обитания человека - атмосфере. Неблагоприятные изменения воздушной среды в наибольшей мере истощают адаптационные возможности человеческого организма [16].
Рядом исследователей [14] изучались персистентные характеристики стафилококков в местах загрязнения сероводородсодержащим газом. При этом было выявлено, что в районах с наибольшей антропогенной нагрузкой число резидентных бактерионосителей стафилококков, а также количественный показатель антилизоцимной активности микроорганизмов были наиболее высокими. Изучение уровней резидентного бактерионосительства в районе Карачаганского нефтегазоконденсатного месторождения выявило его минимальную величину в местах, наиболее удаленных от месторождения. По мере приближения к нему этот показатель возрастал, при этом была установлена корреляция между числом бактерионосителей и предельно допустимой концентрацией сероводорода и диоксида серы.
В работе, проведенной В.О. Крамарь (2008), установлено, что стафилококки, колонизирующие слизистые оболочки жителей города Волгограда, проживающих в районах с интенсивной антропогенной нагрузкой, имели более высокие персистентные характеристики, чем выделенные в условно чистом районе. Так, показатели АЛА стафилококков, выделенные в чистом районе, были минимальные (2,13±0,76 мкг/мл) и достоверно отличались от таковых в группах сравнения (экологически неблагополучный район) - 3,13±0,61мкг/мл. Способность S. aureus, циркулирующих в экологически неблагополучных районах города, инактивировать бактериальную составляющую препарата интерферон (антиинтерфероновая активность) также оказалась выше. Так, среднее значение АИА у S. aureus, выделенных в экологически благополучном районе, составило 2,91±1,81 у.е., что было достоверно ниже, чем в районе с высокой антропогенной нагрузкой (4,99±1,79 у.е.). При оценке антикомплементарной активности автором было установлено, что среднепопуляционный показатель изучаемых культур золотистого стафилококка был низким и не превышал 10 у.е.[3].
Для определения резидентного стафилококкового бактерионосительства в целях индикации атмосферного загрязнения наиболее удачным является детский контингент в возрасте 8-12 лет (Студеникин, 1989), так как отсутствие у детей контакта с производственными вредностями, вредных привычек (алкоголь, курение) облегчает подбор сопоставимых групп, а недостаточность адаптивных механизмов объясняет повышенную чувствительность детей к воздействию токсических факторов.
Учитывая вышеизложенное, О.В. Бухариным с соавторами (1997) была дополнена концепция микроэкологического мониторинга, которая включает в себя следующие положения:
1. Стафилококки (индикаторные виды для воздушной среды) усиливают персистентные свойства под воздействием химических поллютантов.
2. Дети 8-12 лет - наиболее чувствительная часть популяции для формирования бактерионосительства, могут служить биоиндикатором мониторирования.
3. По мере усиления техногенного пресса на популяцию прослойка стафилококковых (резидентных) бактерионосителей возрастает.
4. Показателем антропогенной нагрузки на организм служит коэффициент резидентного стафилококкового бактерионосительства (КРСБ), отражающий соотношение уровня стафилококкового резидентного бактерионосительства у детей в исследуемом районе и аналогичного показателя чистой (фоновой) зоны.
5. КРСБ более 3,0 отражает экологически неблагополучную ситуацию [1].
Таким образом, представленные материалы позволяют предположить, что стафилококковое бактерионосительство, оцененное по персистентным характеристикам штаммов, объективно отражает уровень техногенной нагрузки исследуемой территории, а значит, является косвенным показателем загрязнения воздушной среды.
Рецензенты:
Хижняк С.В., д.б.н., доцент, профессор кафедры ботаники, физиологии и защиты растений Красноярского государственного аграрного университета, г. Красноярск;
Винник Ю.С., д.м.н., профессор, заведующий кафедрой общей хирургии Красноярского государственного медицинского университета им. проф. В.Ф. Войно-Ясенецкого, г. Красноярск.
Стафилококки во многом усугубляют проблему внутрибольничных инфекций в хирургических, педиатрических и гинекологических стационарах. Из раневого отделяемого пациентов, в зависимости от специфики стационара и вида проводимых оперативных вмешательств, стафилококки выделяются от 30 до 83% случаев. При этом повсеместно устанавливается стремительная адаптация стафилококков к антибиотикам. Стафилококк обусловливает до 54% случаев сепсиса. Чрезвычайная острота и важность проблемы стафилококковых инфекций обусловлена широким распространением во всех развитых странах. Выраженная гетерогенность этих микроорганизмов, громоздкая схема определения биологических свойств стафилококков не позволяет идентифицировать различные виды в исследуемых объектах традиционными методами. Все эти факторы определяют несомненную актуальность изучения различных аспектов стафилококковых инфекций гистоиммунологическими методами.
Из 14 видов, присутствующих на эпителиальных барьерах человека различных структур организма, только три являются патогенными. Наиболее важную роль в патологии человека играет S. аureus, который является коагулазоположительным. Инфекции, вызываемые S. аureus, включают более 100 нозологических форм, в стационарах он является вторым после синегнойной палочки. В носоглотке стафилококк постоянно обнаруживается у 20% людей, у 60% - эпизодически, и только каждый 5-й обладает защитой, сопровождающейся невозможностью носительства стафилококка. Несмотря на высокую патогенность, многочисленные ферменты и опаснейшие токсины, нормальная иммунная защита здорового человека предупреждает и сдерживает микробную контаминацию и пролиферативную активность стафилококков. Эпидемиологическое значение стафилококковых инфекций заключается в том, что самые опасные и устойчивые стафилококки, как это не парадоксально, находятся в стационарах.
Гнойные очаги в соответствующих органах устраняются оперативными вмешательствами, также в лечении стафилококковой инфекции используются антистафилококковые антитела и иммуноглобулины. Принципиальная возможность возникновения болезни может быть спровоцирована снижением иммунной защиты, изменением барьерных свойств эпителиальных пластов эпидермиса и слизистых оболочек различных систем органов.
Стафилококки внедряются в организм через кожные и слизистые покровы, распространяются воздушно-капельным путём. Сахарный диабет, авитаминоз, алиментарная дистрофия, травмы кожи профессионального характера способствуют развитию стафилококковой инфекции.
Воспалительный процесс обусловливает задержку стафилококков в зоне внедрения вследствие частичного фагоцитоза макрофагами. S. аureus воздействует на иммунную систему в целом и барьерные свойства эпителия в частности, образуя токсины, характеризующиеся летальным, гемолитическим и некротическим действием.
Лечение стафилококка - задача сложная, но реальная.
В профилактике стафилококковой инфекции в стационарах большое значение имеет соблюдение всех санитарно-гигиенических требований, тем более, что перенесённая стафилококковая инфекция не оставляет после себя длительного иммунитета.
Из вышеизложенного следует, что самым главным аспектом в системе эпидемиологического контроля за стафилококковой внутрибольничной инфекцией остаётся разработка мер профилактики снижения иммунологического гомеостаза барьерных тканей организма.
Известно, что стафилококк не является внутриклеточным паразитом, так как он не способен в течение длительного времени существовать и размножаться внутри макрофагов. Находясь на поверхности фагоцитирующих клеток в пороговых количествах, он может быстро размножаться и вызывать инфекцию. Вторичное его фагоцитирование искажает действительные показатели его выживания и создаёт ложные представления о пролиферации внутри макрофагов. Интенсивность фагоцитоза находится в коррелятивной зависимости от вирулентности штамма стафилококка. Макрофаги с поглощенными ими клетками вирулентного штамма стафилококка могут подвергаться деградации, что обусловлено продукцией вирулентным штаммом бактерий низкомолекулярных токсинов, поражающих макрофаги. Иммунопрофилактика и иммунотерапия стафилококковых инфекций пока находится на стадиях иллюзорных идей и концепций. Взаимодействие между клеточными элементами иммунофагоцитарной системы занимает одну из ключевых позиций.
Установлено, что активное образование цитокинов в ответ на внешнее воздействие в зоне внедрения в покровные ткани или тканевого повреждения на несколько часов отстаёт от продукции клетками медиаторов воспаления небелковой природы.
Хотя первоначально считали, что цитокины синтезируются только Т-клетками и макрофагами, в последнее десятилетие обнаружено, что они продуцируются также структурными элементами кожи - кератиноцитами, фибробластами и эндотелиоцитами собственных пластинок слизистых оболочек и сосочкового слоя эпидермиса кожи. . Индуцируют синтез цитокинов моноцитами/макрофагами и кератиноцитами в эпителиальных пластах непосредственно при стафилококковой инфекции сами контаминирующие стафилококки. Считаем, что при сложившейся эпидемиологической ситуации по стафилококковым внутрибольничным инфекциям, одним из важнейших путей решения проблемы профилактики и лечения этих социально значимых заболеваний, является иммуногистохимическое изучение иммунобиологической активности эпителиальных барьеров.
Одним из защитных факторов является высокая пролиферативная активность эпителиальных клеток. На первом этапе формирования иммунного ответа необходимы монокины, которые являются индукторами пролиферации и презентации антигена: IL-I, IL-3, IL-6, IL-12, TNFa, IL-10. Одновременно IL-I и TNFa являются активным индуктором синтеза IL-6. Продуцируемый макрофагами TNFa в цитокиновом каскаде запускает синтез других провоспалительных цитокинов IL-I, IL-6, IL-8. По классификации Кашкина в группе цитокинов эффекторов и регуляторов воспаления выделена подгруппа губительно действующих на изменённые клетки, усиливающие пролиферацию и дифференцировку клеток воспаления, эндотелиальных клеток, эпителиальных клеток эпидермиса, а также фибробластов и тучных клеток собственной пластинки. С этих позиций несомненный интерес представляет IL-3, который по физико-химическим характеристикам является гликопротеином с молекулярной массой 25-32 кД. Основным источником его являются Th 1 и Th 2, а также кератиноциты и тучные клетки. Иммунобиологическая активность проявляется в том, что он усиливает выживаемость, пролиферацию и дифференцировку мультипотентных стволовых клеток крови, выживаемость и пролиферативную активность тучных клеток, особенно ассоциированных со слизистыми оболочками, синтез в них протеаз, пролиферацию макрофагов и экспрессию на мембране белков МНС-II. Это далеко не полный перечень возможностей IL-3.
Также непосредственное отношение к барьерным свойствам эпителиальных пластов имеет IL-I0, протеин с молекулярной массой 19-21 кД, вырабатываемый кератиноцитами и другими клетками, в основном, лимфоцитами. Его главная роль сводится к стимуляции тимоцитов и усилению пролиферации мультипотентных гемопоэтических стволовых клеток. Фибробласты и кератиноциты также являются источником цитокина M-CSF, гликопротеина с м.м. 80-100 кД или протеогликана с м.м. 130-160 кД. Действие этого цитокина сводится к усилению пролиферации и дифференцировке унипотентных костномозговых стволовых клеток-предшественников моноцитов. GM-CSF, гликопротеин с молекулярной массой 20-30 кД вырабатывается фибробластами и кератиноцитами и усиливает пролиферацию и дифференцировку костномозговых клеток предшественников нейтрофилов, моноцитов, мегакариоцитов и эритроцитов и их поступление в кровь. IL-I, IL-3, IL-4, IL-11 и другие цитокины способны стимулировать пролиферацию и дифференцировку клеток-предшественников различных типов или мультипотентные клетки на более ранних этапах дифференцировки. Поэтому IL-3 получил название неспецифический иммуногемопоэтин (мульти -CSF). Поэтому цитокины, которые продуцируют клетки покровных тканей в ответ на раздражение микробными производными назвали медиаторами доиммунного воспаления.
Приведённые данные свидетельствуют о сложной, многокомпонентной, взаиморегулируемой структуре системы цитокинов. Особенности её функционирования обеспечивают определённую последовательность включения спектра цитокинов, ответственных за различные этапы и направления защитных механизмов и патологических процессов в организме.
Результаты и особенности санации мупироцином (бактробан) интраназальных носителей стафилококка в условиях крупного стационара: стафилококки, назальное носительство, мупироцин (бактробан), санация.
Гнойные менингиты у новорожденных (этиология, патогенез, клиника, диагностика, лечение): Менингиты, вызванные грамположительными микроорганизмами
Проблема антибиотикотерапии тяжелых инфекций, вызываемых полирезистентными грамположительными микроорганизмами. Тейкопланин (Таргоцид): сравнительная оценка антимикробной активности, клиническое значение: (1)
Современные проблемы антибиотикорезистентности в педиатрической клинике: Метициллинорезистентные S.aureus и мультирезистентные S.aureus
Результаты и особенности санации мупироцином (бактробан) интраназальных носителей стафилококка в условиях крупного стационара: Результаты и обсуждение
Тейкопланин. Новые возможности лечения грамположительных инфекций в стационаре: (1)
Опыт применения мупироцина при назальном носительстве золотистого стафилококка у медицинского персонала: Обсуждение результатов
Фторхинолоны: значение, развитие исследований, новые препараты, дискуссионные вопросы: tabone
Сравнительная активность меропенема и других антибиотиков в отношении возбудителей нозокомиальных инфекций: (1)
Беталактамные соединения. Взаимосвязь структуры и биологической активности: Введение
Фармакоэпидемиологический подход при лечении больных острым синуситом: tabone
Эффективность меропенема в лечении абдоминального сепсиса у хирургических больных: Заключение
Особенности микрофлоры зева у детей в отделениях интенсивной терапии: tabeight
Опыт применения мупироцина при назальном носительстве золотистого стафилококка у медицинского персонала: Материал и методы
Противотуберкулезный антибиотик пролонгированного действия рифабутин. Антимикробный спектр, особенности фармакодинамики и фармакокинетики: Заключение
Новые полусинтетические макролиды. Кларитромицин значение в современной терапии бактериальных инфекций: Антимикробная активность
Кафедра микробиологии Российской медицинской академии последипломного образования, Москва
Первые сообщения об инфекциях, вызванных резистентными к метициллину штаммами Staphylococcus aureus (MRSA), появились в 1960 г. в Англии. Вскоре они были зарегистрированы во многих европейских странах, в Австралии, а позднее - в США, Японии, некоторых странах Африки и Азии. Помимо S.aureus резистентность к метициллину была выявлена и у коагулазонегативных стафилококков (CNS). Есть данные [1] о том, что более 50% штаммов CNS являются резистентными к метициллину, причем в основном они представлены S.epidermidis (MRSE).
MRSA и MRCNS являются типичными представителями так называемой оппортунистической микрофлоры и вызывают инфекции обычно у определенной категории больных и в определенных условиях. Это, главным образом, пожилые люди, длительно пребывающие в больнице и страдающие основными тяжелыми заболеваниями. Чаще всего они долгое время принимали антибиотики. Инфекция развивается у послеоперационных, нейрохирургических, урологических, легочных и других больных со сниженной иммунной резистентностью. Чаще страдают лица, находящиеся на аппаратах искусственного дыхания, имеющие трахеотомические трубки, внутривенные или урологические катетеры.
Заболевания нередко носят эпидемический характер и чаще всего возникают в палатах интенсивной терапии или в послеоперационных блоках. Способствуют распространению заболевания нарушения гигиенических условий, носительство MRSA или MRSE у персонала и т.п.
Клинические проявления заболеваний, вызванных MRSE или MRSA, не отличаются от проявлений нозокомиальных инфекций , вызванных чувствительными к метициллину стафилококками. Тяжесть течения различна и в основном зависит от исходного статуса больного. Инфекция MRSA нередко носит инвазивный характер и может сопровождаться бактериемией.
Основным виновником эпидемических вспышек является MRSA, однако описаны тяжелые случаи инфекции, вызванные MRSE. В то же время MRCNS, наряду с MRSA, могут быть резервуаром генетического материала резистентности к метициллину/ оксациллину .
Для резистентных к метициллину штаммов (МРШТ) стафилококков характерна гетерогенность популяции: один и тот же штамм может содержать резистентные и чувствительные клетки. При этом степень гетерогенности варьирует в зависимости от ряда факторов. На экспрессию резистентности в лабораторных условиях оказывает влияние температура и длительность инкубации, размер инокулята, осмотический фактор, рН и даже освещенность. Эти обстоятельства следует учитывать при выделении метициллинорезистентных клеток из исходного материала.
Следует сказать, что природа резистентности к метициллину выяснена не окончательно. Наиболее вероятной и наиболее доказанной причиной являются изменения, возникающие в специфических пенициллинсвязывающих белках (ПСБ) клеточной стенки стафилококков. У МРШТ образуется новый ПСБ - ПСБ2а или ПСБ2', замещающий другие ПСБ и обладающий слабым сродством к беталактамам , в частности к метициллину, что и приводит к появлению устойчивости к нему отдельных клеток или всей популяции стафилококков [1]. Процесс этот у МРШТ кодируется геном mec A, располагающимся на хромосоме и отсутствующим у чувствительных штаммов. Однако есть сообщения о том, что mec A может располагаться на транспозонах и соответственно включаться не только в хромосомы, но и в плазмиды [2], что способствует более широкому его распространению. Существуют также предположения о возможной роли гиперпродукции пенициллиназ, а у отдельных вариантов - ферментов, гидролизующих метициллин.
У МРШТ наблюдается перекрестная устойчивость к беталактамам, относящимся, в первую очередь, к изоксазолиловой группе (оксациллин, клоксациллин и др.). Причем резистентность к метициллину может усиливаться в присутствии других беталактамов. Вот почему некоторые японские исследователи рекомендуют отказываться от использования даже новых беталактамов для профилактики послеоперационных осложнений, либо ограничить их назначение 3-5 днями.
Штаммы MRSA в целом мало отличаются от чувствительных. Они обладают теми же факторами патогенности (наличие плазмокоагулазы и ДНКазы, продукция фибринолизина, гемолизина, энтеротоксина и др.) и степень их вирулентности близка к таковой чувствительных штаммов S.aureus. Около 60-80% MRSA типируются фагами Международного набора, главным образом фагами I и III групп.
Отличительной чертой МРШТ является слабый и медленный их рост, что следует иметь в виду при выделении их в лаборатории.
Эпидемические МРШТ проявляют множественную резистентность к антибиотикам, в том числе к аминогликозидам , эритромицину , имипенему , клиндамицину . Данные по чувствительности к рифампицину расходятся, иногда до прямо противоположных. Так, по наблюдениям одних исследователей (Нидерланды, 1993) 90% MRSA были чувствительны к рифампицину, а по наблюдениям других (Испания, 1993) для 90% штаммов МПК рифампицина составляла 256 мг/л. Наиболее чувствительны МРШТ к ванкомицину и тейкопланину , однако уже известны штаммы, резистентные и к этим антибиотикам. Высокую активность проявил в отношении MRSA новый антибиотик для местного применения - мупироцин , полученный из Pseudomonas fluorescens , но и к нему у ряда МРШТ наблюдается устойчивость.
В связи с тем, что метициллин в настоящее время отечественной промышленностью не производится и изъят из номенклатуры в лабораторных тестах с целью выделения МРШТ используют оксациллин, исходя из перекрестной с метициллином к нему устойчивости.
Выделение МРШТ из исследуемого материала связано с рядом трудностей, которые объясняются особенностями этих культур (гетерогенность популяции и слабый рост). Наибольшее распространение получила селективная плотная питательная среда [3], содержащая 6 мг/л оксациллина и 5% NaCl. К среде добавляют 1% маннита и индикатор, позволяющий учитывать его ферментацию с образованием кислых продуктов (феноловый красный или бромтимоловый синий). На среду производят массивный посев исследуемого материала, помня, что в нем может быть малое количество резистентных клеток. Посевы инкубируют при 37њС и первые результаты учитывают через 24 часа. При необходимости сроки инкубации продлевают до 72 часов. Shanson [4] считает, что снижение температуры инкубации до 30њС способствует лучшей селекции устойчивых клеток. При этом и срок выращивания сокращается до 18 часов.
Для дальнейшей работы отбирают колонии, окрашенные в желтый цвет и окруженные желтой зоной, что свидетельствует о ферментации маннита, свойственной S.aureus и многим другим видам стафилококков. Однако следует иметь в виду, что S.epidermidis не ферментирует маннит. В этом случае идентификации вида помогает изучение других свойств (например, продукция фосфатазы).
С целью установления идентичности штаммов MRSA, циркулирующих в данном госпитале (отделении, палате), проводят их фаготипирование и изучение антибиотикограмм. Чаще эпидемические штаммы лизируются фагами 29/ 77/84 или 80/85 из Международного набора. Введение дополнительных фагов, в частности 88А и 932, увеличивает возможность установления идентичности MRSA. Весьма желательно использовать генетические методы исследования.
В тех случаях, когда исходный материал предположительно содержит малое количество стафилококков (материал от носителей, смывы с окружающей среды и т.п.), первоначальный посев параллельно производят и на среды обогащения: жидкую питательную среду с 7 или 10% NaCl. Для последующего выделения чистых культур используют плотную селективную среду с оксациллином и маннитом (можно с обычным содержанием NaCl).
При выделении стафилококков с неселективных для МРШТ сред определяют их резистентность к оксациллину/метициллину. Предложено несколько тестов определения чувствительности к метициллину, но ни один из них не является безупречным. Исследователи расходятся в рекомендациях по выбору сред, концентрации NaCl и оксациллина/метициллина, температуре и срокам выращивания, считая, что их метод приводит к наибольшей экспрессии МРШТ.
При оценке чувствительности стафилококков к оксациллину целесообразно пользоваться рекомендациями Национального Комитета по клиническим и лабораторным стандартам США (NCCLS).
В лабораторной рутинной практике резистентными считают штаммы, для которых МПК оксациллина/метициллина составляет 4 мг/л и более.
Для лечения инфекций, вызванных МРШТ, чаще всего используют ванкомицин или тейкопланин.
Ванкомицин вводят внутривенно в дозе 2 г в день, разделяя ее на 2 или 4 введения. Несмотря на то, что большинство МРШТ чувствительны к ванкомицину, описаны и резистентные к нему штаммы. Впервые была описана инфекция, вызванная ванкомицинорезистентным штаммом S.haemolyticus, а позднее - S.epidermidis, при этом для одного из штаммов последнего вида МПК ванкомицина была выше 200 мг/л. По данным японских исследователей, ванкомицин эффективен только у 20-30% больных при стафилококковой инфекции, обусловленной МРШТ. При введении ванкомицина возможны аллергические реакции, гипотензия, покраснение кожи, чувство жжения, тромбофлебиты . При нарушении выделительной функции почек могут наблюдаться нефро- и ототоксические реакции.
Спектр действия тейкопланина близок к таковому ванкомицина, однако его активность в отношении S.epidermidis несколько ниже. Кроме того, к тейкопланину чаще возникает резистентность, чем к ванкомицину. К преимуществам тейкопланина относятся возможность его внутримышечного, а не только внутривенного введения, при этом ежедневная доза 400 мг может вводиться один раз в сутки, что снижает частоту побочных явлений (тромбофлебита и др.). Хотя тейкопланин, как и ванкомицин, обладает ото- и нефротоксичностью, практически при терапевтическом уровне антибиотика в крови эти реакции не проявляются. Обычно они сводятся к аллергическим местным проявлениям.
Рифампицин при стафилококковой инфекции, вызванной МРШТ, применяется редко. Однако широко рекомендуются его комбинации с ванкомицином. При экспериментальном остеомиелите крыс, вызванном MRSA, хорошие результаты были получены при использовании комбинаций рифампицина с ципрофлоксацином [5]. Недавно опубликована работа [6] о синергидном действии на MRSA и MRSE фосфомицина с оксациллином. Ко-тримоксазол , так же как и фузидин , применяется редко, чаще всего - в комбинации с другими препаратами и в тех случаях, когда оказываются не эффективны другие антибиотики. Для лечения кожных инфекций более целесообразно использовать мупироцин.
Принципиальное значение имеет профилактика инфекций, вызываемых МРШТ, в лечебных учреждениях. В первую очередь это относится к выявлению и санации носителей, главным образом из числа персонала, который является основным распространителем инфекции.
Для элиминации МРШТ из полости носа за рубежом широкое применение получил мупироцин в виде мази. По данным ряда исследователей, он приводил к исчезновению МРШТ в 90-97% случаев. Примечательно, что одновременно наблюдалось и снижение выделения МРШТ из других мест (подмышечных впадин, кистей рук и т.п.). Снижение носительства у персонала сопровождалось также уменьшением высеваемости МРШТ у больных в данном отделении. После прекращения применения мупироцина МРШТ не высевались продолжительное время (от 5 до 20 недель). Мупироцин хорошо переносился больными, однако и к нему возникала резистентность. Так, по данным английских исследователей, было выделено 3% CNS, резистентных к этому антибиотику. Не исключено, что в дальнейшем резистентность к нему будет возрастать.
Системная профилактика антибиотиками применяется реже. Некоторые исследователи предложили использовать комбинации фузидина с ко-тримоксазолом или рифампицином.
Большое значение приобретают асептические и антисептические мероприятия. Аппаратура нуждается в тщательной обработке, катетеры в периодической смене. Имеются специальные катетеры, импрегнированные антисептическими веществами (сульфадиазин серебро, хлоргексидин и др.). Введение гентамицина или цефуроксима в цементирующее вещество при операциях на бедре или при протезировании суставов снижает возможность развития инфицирования МРШТ [1]. Для снижения носительства МРШТ на кожных покровах используют также антисептики, как хлоргексидин или триклозан, в частности в виде добавок к мылу.
В палатах следует соблюдать и общегигиенические мероприятия. Одним словом, контроль за окружающей средой и медперсоналом - основное условие для снижения внутрибольничных инфекций, вызываемых МРШТ стафилококков.
АНТИБИОТИКИ И ХИМИОТЕРАПИЯ, 1998-N6, стр. 29-31.
2. Baguero F. Origin and genetics of methicillin-resistant Staphylococcus aureus. In: Methicillin-resistant Staphylococcus aureus. Intern Сlinic Pract Ser 1993; 13-16.
3. Mackie and McCarthney. Staphylococcus. In: Practical medical microbiology 1996; 252-253.
4. Shanson D.C. Detection of methicillin-resistant Staphylococcus aureus and laboratory problems resulting from outbreaks. In: Methicillin-resistant Staphylococcus aureus. Intern Clinic Pract Ser 1993; 17-20.
5. Henry N. Treatment of methicillin-resistant Staphylococcus aureus experimental osteomyelitis with ciprofloxacin or vancomycin alone or in combination with rifampin. Amer J Med 1987; 82: 4A: 73-75.
6. Ferrara A. Effect of different combinations of sparfloxacin, oxacillin and fosfomycin against methicillin-resistant staphylococci. Eur J Clin Microbiol. Infect Dis 1997; 16: 7: 535-537.

В последние годы не угасает интерес к эпидемиологии стафилококков как этиологических агентов многих инфекционных заболеваний, поcкольку стафилококковое бактерионосительство служит причиной формирования серьезных осложнений в условиях госпитализации.
Особую актуальность этот вопрос приобретает в связи с широким распространением и циркуляцией как в природной популяции, так и госпитальной среде метициллинрезистентных штаммов золотистого стафилококка (MRSA). Принципиально важным для дифференциации таких штаммов является исследование генных комплексов, входящих в состав стафилококковых хромосомных кассет mec (staphylococcal chromosome cassette mec, SCCmec), а также определение генов, детерминирующих синтез энтеротоксинов A, B, C и др., токсина синдрома токсического шока (TSST).
Для большинства стафилококков естественной средой обитания является поверхность кожи человека, слизистые, где они персистируют, не причиняя вред организму хозяина. Однако, как показывают работы последних лет [1, 3], при хронических дерматозах происходят изменения микробиоценозов кожи, в частности, возрастает степень обсемененности кожи представителями рода Staphylococcus, особенно S.aureus. В этой связи встает вопрос об этиопатогенетической роли этих бактерий в развитии кожных патологий. Поскольку основными поражающими факторами воздействия стафилококков на эукариотические клетки и ткани являются секретируемые факторы вирулентности и патогенности (токсины), целью настоящей работы явилось исследование вариабельности геномных комплексов стафилококков, выделенных с кожи людей при хронических дерматозах.
Материал и методы исследования
Бактериальные штаммы. В работе были использованы 185 штаммов стафилококков, из них – 91 штамм S. aureus (49,1 %), полученные от лиц в возрасте от 18 до 80 лет, находящихся в стационаре областного кожно-венерологического диспансера г. Ульяновска с хроническими дерматозами: псориаз (57/144, 39,6 %), экзема (68/144, 47,2 %), атопический дерматит (19/144, 13,2 %).
Забор материала осуществляли с пораженных и интактных участков кожи ватным тампоном, смоченным 0,85 % раствором хлористого натрия. Смывы в количестве 0,1 мл засевали на селективные питательные среды, через 48 часов подсчитывали количество выросших колоний и пересчитывали на 1 см 2 кожи (Иванов, 1984). Результаты пересчитывали на КОЕ/см 2 . Первичную родовую и видовую идентификацию стафилококков осуществляли на основании морфологии колоний, окраски по Граму, данных каталазного и коагулазного тестов. Качественное и количественное исследование микробиоценозов кожи осуществляли на базе бактериологической лаборатории городской клинической больницы № 1 г. Ульяновска (зав. лабораторией – Волгина Т.И.). Полученные данные подвергали статистической обработке с использованием пакета прикладных программ Microsoft Еxcel 2003.
Видовая идентификация стафилококков прямым масс-спектрометрическим профилированием. Свежие бактериальные клетки (1–2 колонии) переносили в 300 мкл деионизированной воды, перемешивали и добавляли 900 мкл этанола. Осадок после центрифугирования (15 мин×14000 об/мин) растворяли в 20 мкл смеси 50 % ацетонитрила (АЦН), 35 % муравьиной кислоты. Полученный в результате последующего центрифугирования супернатант анализировали времяпролетной МАЛДИ масс-спектрометрией. Все использованные реактивы, включая воду, были аналитической чистоты или специальные для масс-спектрометрии.
В качестве матрицы применяли a-циано-4-гидроксикоричную кислоту ( a -cyano-4-hydroxycinnamic acid, a-CHCA, BrukerDaltonics, Германия) в виде насыщенного раствора в смеси 50 % АЦН, 2,5 % трифторуксусной кислоты (ТФУ). Для сокристаллизации матрицы и образца 1 мкл аналита наносили на ячейки стальной мишени для масс-спектрометрии (MSP 96 target ground steel, BrukerDaltonics, Германия), давали подсохнуть 1–2 минуты и сверху наслаивали 2 мкл насыщенного раствора матрицы. Кристаллы оставляли на воздухе в течение 5–10 мин до полного высыхания. Влажность и температуру при этом не контролировали.
Масс-спектрометрический анализ осуществляли с помощью времяпролетного МАЛДИ масс-спектрометра MicroflexTM (BrukerDaltonics, Германия), оснащенного азотным лазером 337 нм. Все измерения проводили в линейном режиме, детектируя положительные ионы. Для накопления масс-спектров мощность лазерного излучения устанавливали на уровне минимального порогового значения, достаточного для десорбции-ионизации образца. Параметры масс-спектрометра оптимизировали для диапазона m/z от 2000 до 20000. Внешнюю калибровку проводили с использованием точных значений масс известных белков E. coli.
Для записи, обработки и анализа масс-спектров использовали программное обеспечение компании Bruker Daltonics (Германия): flexControl 2.4 (Build 38) и flexAnalysis 2.4 (Build 11). Точность измерения масс составляла ± 2 Да. Видовую идентификацию бактерий проводили путем сопоставления получаемых масс-спектров с имеющимися базами данных с помощью программного пакета MALDI Biotyper 2.0 (Bruker Daltonics, Германия).
Генетическое тестирование стафилококков
Для установления наличия генов, детерминирующих синтез стафилококковых энтеротоксинов (гены sea – sed, sei – sej), токсина синдрома токсического шока (ген tsst) и лейкоцидина (гены lukS – lukF) применена традиционная ПЦР с использованием предложенных ранее праймеров [9, 10].
Амплификацию исследуемых фрагментов ДНК выполняли в реакционной смеси, содержащей 10 мМ Tris-HCl, pH 9,0; 50 мM KCl; 2 мM MgCl2, по 250 мкМ каждого дНТФ, 1 едTaq-полимеразы (Promega, USA) и по 10 пмоль каждого праймера в объеме 25 мкл. Реакцию амплификации проводили в программируемом термостате DNA EngineTetrad 2 (MJ Research, USA), используя следующий профиль амплификации: 94 ° С – 5 мин., 30 циклов: 94 ° С – 1 мин, 60 ° С – 1 мин, 72 ° С – 1 мин. Продукты реакции анализировали в 2 % агарозном геле.
Результаты исследования и их обсуждение
Согласно данным бактериологического и масс-спектрометрического тестирования установлен видовой состав стафилококков, выделяемых от пациентов с дерматитами. Среди проанализированных 185 штаммов, 91 штамм (49,1 %) принадлежал к виду S. aureus, 28 штаммов (15,1 %) – к S. epidermidis, 30 штаммов (16,2 %) составили S. hominis, 18 (9,7 %) штаммов – S. haemolyticus, S. capitis– 4 (2 %), на такие виды как S. saprophyticus, S. warneri, S. pattenkoferi приходилось по 0,5 %. Также результаты генетического типирования показали наличие среди выделенных штаммов Micrococcus luteus и Corynebacteriumaurim ucosum в 0,5 % случаев.
Исследуемые штаммы продемонстрировали наличие гена mecA в 15 случаях из 185 (8,1 %), причем данный признак был обнаружен только среди коагулазоотрицательных стафилококков: S. hominis – 7 штаммов из 30 (23,3 %); S. epidermidis – 4 штамма из 28 (14,3 %); S. haemolyticus – 4 штамма из 18 (22,2 %).
Наличие стафилококковой хромосомной кассеты SCCmec у коагулазоотрицательных стафилококков, по мнению некоторых авторов [4], свидетельствует о ее участии в функции горизонтального обмена генами. Считается, что первыми стафилококками, получившими SCCmec, были S. haemolyticus, и только в последующем произошла передача этого элемента другим коагулазоотрицательным стафилококкам и S. aureus [2].
Полученные результаты по отсутствию гена mecA среди изученных штаммов S. aureus согласуются с данными литературы. Cобранные нами штаммы относятся к внебольничной популяции стафилокококков, среди которых процент устойчивых к метициллину штаммов составляет не более 30 %, тогда как ген mecA, кодирующий устойчивость к метициллину, обнаруживается преимущественно среди госпитальных стафилококков – до 40 %.
Следующую группу молекулярных маркеров составили расположенные на МГЭ гены, детерминирующие синтез энтеротоксинов A, B, C и др., токсина синдрома токсического шока, т.е. те гены, продукты которых обладают суперантигенной активностью (PTSAgs) и могут оказать влияние на состояние иммунореактивности макроорганизма. Определение наличия генов PTSAgs позволяет выявить патогенный потенциал и охарактеризовать отдельные штаммы. Проведенные исследования показали наличие генов, детерминирующих токсинообразование стафилококков у 40,5 % изученных штаммов (75 клинических изолятов). Следует отметить, что частота встречаемости указанных генов у штаммов золотистого стафилококка составила 86,7 %, у коагулозоотрицательных штаммов – 13,3 % случаев.
Обнаружена значительная вариабельность в наборе генов, детерминирующих синтез этих токсинов у клинических изолятов стафилококков. Так, изученные штаммы имели от одного до четырех генов в различных сочетаниях. В геноме 35 изолятов обнаружен только один ген из sea – sei. У 20 штаммов преобладали по два гена и у 20 – от трех до четырех генов. При этом установлено, что коагулазоотрицательные штаммы, несущие mec A, не обладали ни одним из перечисленных генов. В целом из общего количества генетических детерминант токсинообразования преобладали гены seg – 26,8 %, seh – 17,1 % случаев.
Исходя из значительной видовой вариабельности грамположительной флоры в микробиоценозе кожи исследуемых больных, была проанализирована частота встречаемости генов, определяющих токсинообразование стафилококков в зависимости от видовой принадлежности штаммов.
Так, наибольшим разнообразием генов обладали штаммы золотистого стафилококка, среди которых преобладал ген seg. В связи с тем, что среди коагулазоотрицательных штаммов стафилококков наибольшую частоту встречаемости показали гемолитический и эпидермальный стафилококки, а доля остальных оказалась незначительна, то анализ генов, детерминирующих токсинообразование, осуществляли только у этих видов стафилококков, что показало у S. haemolyticus наличие только генов seb и sed, у эпидермального стафилококка только seh.
Значительный интерес представлял анализ полученных результатов в зависимости от участка кожи, с которого были выделены микроорганизмы. В соответствии с этим все полученные штаммы разделили на две группы: 1-я – штаммы, выделенные с чистых участков кожи, 2-я – штаммы, выделенные с пораженных участков кожи (рис. 1).
Таким образом, наиболее значимые различия по частоте встречаемости детерминант токсинообразования можно отметить для генов sea (14,7 % в 1-й группе и 7,3 % во 2-й) и sei (11,7 % в первой группе, 19,1 % – во второй). Причем ген sea достоверно чаще обнаруживался в стафилококках, изолированных на чистых участках кожи, тогда как ген sei – на пораженных. Частота встречаемости данного признака в указанных группах в зависимости от вида микроорганизмов показала различия только для S. aureus (рис. 2). Для остальных видов из рода Staphylococcus, наиболее часто обнаруживаемых на коже, результаты следующие: S. epidermidis показал ген энтеротоксина sei в одном случае с чистого участка кожи. А S. haemolyticus – наличие 1 случая из двух, наличие гена sed – в одном из четырех случаев.
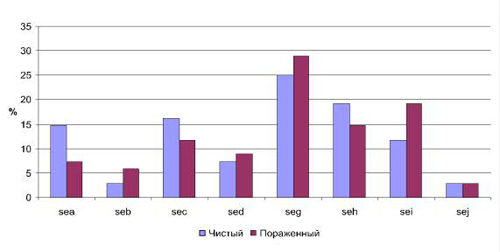
Рис. 1. Частота встречаемости энтеротоксинов a, b, c, d, g, h, I, j в зависимости от участка кожи
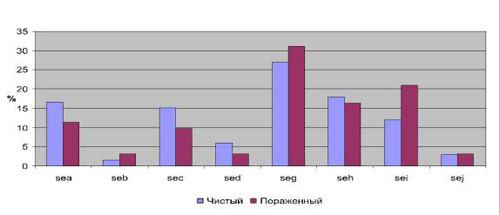
Рис. 2.Частота встречаемости детерминант токсинообразования у S. aureus, выделенных с чистого и пораженного участка кожи
Ген TSST обнаружен только в 10,8 % случаев от всего количества исследуемых штаммов, причем в двух случаях параллельно с наличием хромосомной кассеты mecA у S. epidermidis. При этом в 55 % случаев ген TSST обнаруживали у штаммов, выделенных с чистых участков кожи, в 45 % случаев – с пораженных участков.
Сравнительный анализ хромосомной ДНК стафилококков, выделенных при хронических кожных патологиях, показал, что изученные штаммы Staphylococcus spp. обнаруживают значительную вариабельность в наборе генетических детерминант, характеризующих их патогенный потенциал.
Кассета mecA, рассматриваемая как фактор устойчивости к метициллину, была обнаружена в 8,1 % случаев и только среди коагулазоотрицательных стафилококков.
Гены токсинообразования наиболее часто встречались среди коагулазоположительных стафилококков (S. aureus). Наиболее часто в проанализированной выборке встречались гены seg – 26,8 %, и seh – 17,1 % случаев.
Штаммы, изолированные с разных участков кожи, значимо отличались по частоте обнаружения маркеров генов энтеротоксинов A, С и I.
Таким образом, молекулярно-генетический анализ ДНК и генотипирование стафилококков может иметь теоретическое и практическое значение в целях обеспечения более качественной диагностики стафилококковой инфекции, эффективного мониторинга и лечения.
Нестеров А.С., д.м.н., профессор, зав. Циклом кожных и венерических болезней кафедры инфекционных и кожно-венерических болезней медицинского факультета Ульяновского государственного университета, г. Ульяновск;
Читайте также:


