Методы определения чувствительности стафилококков к антибиотикам
Решедько Галина Константиновна,
к.м.н., ассистент кафедры клинической фармакологии
Смоленской государственной медицинской академии
214019, г.Смоленск, ул.Крупской, 28, а/я № 5.
Тел.: +7(0812) 61 13 01, 61 13 27, Факс: (0812) 61 12 94,
E-Mail: galina@antibiotic.ru
В лекции рассмотрены основные методы определения чувствительности in vitro микроорганизмов к антимикробным препаратам (диско-диффузионный, Е-тестов, методы разведения). Отражены подходы к эмпирическому и этиотропному назначению антибиотиков в клинической практике. Обсуждены вопросы интерпретации результатов определения чувствительности с клинической и микробиологической точек зрения.
В настоящее время в клинической практике существуют два принципа назначения антибактериальных препаратов: эмпирическое и этиотропное. Эмпирическое назначение антибиотиков основано на знаниях о природной чувствительности бактерий, эпидемиологических данных о резистентности микроорганизмов в регионе или стационаре, а также результатах контролируемых клинических исследований. Несомненным преимуществом эмпирического назначения химиопрепаратов является возможность быстрого начала терапии. Кроме того, при таком подходе исключаются затраты на проведение дополнительных исследований.
|
Однако при неэффективности проводимой антибактериальной терапии, при нозокомиальных инфекциях, когда затруднительно предположить возбудителя и его чувствительность к антибиотикам стремятся проводить этиотропную терапию. Этиотропное назначение антибиотиков предполагает не только выделение возбудителя инфекции из клинического материала, но и определение его чувствительности к антибиотикам. Получение корректных данных возможно только при грамотном выполнении всех звеньев бактериологического исследования: от взятия клинического материала, транспортировки его в бактериологическую лабораторию, идентификации возбудителя до определения его чувствительности к антибиотикам и интерпретации полученных результатов.
|
Вторая причина, обусловливающая необходимость определения чувствительности микроорганизмов к антибактериальным препаратам - это получение эпидемиологических данных о структуре резистентности возбудителей внебольничных и нозокомиальных инфекций. В практике эти данные используют при эмпирическом назначении антибиотиков, а также для формирования больничных формуляров.
Методы определения чувствительности бактерий к антибиотикам делятся на 2 группы: диффузионные и методы разведения.
|
При определении чувствительности диско-диффузионным методом на поверхность агара в чашке Петри наносят бактериальную суспензию определенной плотности (обычно эквивалентную стандарту мутности 0,5 по McFarland) и затем помещают диски, содержащие определенное количество антибиотика. Диффузия антибиотика в агар приводит к формированию зоны подавления роста микроорганизмов вокруг дисков. После инкубации чашек в термостате при температуре 35 о -37 о С в течение ночи учитывают результат путем измерения диаметра зоны вокруг диска в миллиметрах (рис. 1).
Рисунок 1. Определение чувствительности микроорганизмов диско-диффузионным методом.
Определение чувствительности микроорганизма с помощью Е-теста проводится аналогично тестированию диско-диффузионным методом. Отличие состоит в том, что вместо диска с антибиотиком используют полоску Е-теста, содержащую градиент концентраций антибиотика от максимальной к минимальной (рис. 2). В месте пересечения эллипсовидной зоны подавления роста с полоской Е-теста получают значение минимальной подавляющей концентрации (МПК).
Рисунок 2. Определение чувствительности микроорганизмов с помощью Е-тестов.
Несомненным достоинством диффузионных методов является простота тестирования и доступность выполнения в любой бактериологической лаборатории. Однако с учетом высокой стоимости Е-тестов для рутинной работы обычно используют диско-диффузионный метод.
Методы разведения основаны на использовании двойных последовательных разведений концентраций антибиотика от максимальной к минимальной (например от 128 мкг/мл, 64 мкг/мл, и т.д. до 0,5 мкг/мл, 0,25 мкг/мл и 0,125 мкг/мл). При этом антибиотик в различных концентрациях вносят в жидкую питательную среду (бульон) или в агар. Затем бактериальную суспензию определенной плотности, соответствующую стандарту мутности 0,5 по MсFarland, помещают в бульон с антибиотиком или на поверхность агара в чашке. После инкубации в течение ночи при температуре 35 о -37 о С проводят учет полученных результатов. Наличие роста микроорганизма в бульоне (помутнение бульона) или на поверхности агара свидетельствует о том, что данная концентрация антибиотика недостаточна, чтобы подавить его жизнеспособность. По мере увеличения концентрации антибиотика рост микроорганизма ухудшается. Первую наименьшую концентрацию антибиотика (из серии последовательных разведений), где визуально не определяется бактериальный рост принято считать минимальной подавляющей концентрацией (МПК). Измеряется МПК в мг/л или мкг/мл (рис. 3).
|
Рисунок 3. Определение значения МПК методом разведения в жидкой питательной среде.
На основании получаемых количественных данных (диаметра зоны подавления роста антибиотика или значения МПК) микроорганизмы подразделяют на чувствительные, умеренно резистентные и резистентные (рис. 4). Для разграничения этих трех категорий чувствительности (или резистентности) между собой используют так называемые пограничные концентрации (breakpoint) антибиотика (или пограничные значения диаметра зоны подавления роста микроорганизма).
Рисунок 4. Интерпретация результатов определения чувствительности бактерий в соответствии со значениями МПК.
Пограничные концентрации не являются неизменными величинами. Они могут пересматриваться, в зависимости от изменения чувствительности популяции микроорганизмов. Разработкой и пересмотром критериев интерпретации занимаются ведущие специалисты (химиотерапевты и микробиологи), входящие в специальные комитеты. Одним из них является Национальный комитет по клиническим лабораторным стандартам США (National Committee for Clinical Laboratory Standards - NCCLS). В настоящее время стандарты NCCLS признаны в мире и используются как международные для оценки результатов определения чувствительности бактерий при многоцентровых микробиологических и клинических исследованиях.
Существуют два подхода к интерпретации результатов определения чувствительности: микробиологический и клинический. Микробиологическая интерпретация основана на анализе распределения значений концентраций антибиотика, подавляющих жизнеспособность бактерий. Клиническая интерпретация основана на оценке эффективности антибактериальной терапии.
Клинически к чувствительным относят бактерии (с учетом параметров, полученных in vitro), если при лечении стандартными дозами антибиотика инфекций, вызываемых этими микроорганизмами, наблюдают хороший терапевтический эффект.
При отсутствии достоверной клинической информации подразделение на категории чувствительности базируется на совместном учете данных, полученных in vitro, и фармакокинетики, т.е. на концентрациях антибиотика, достижимых в месте инфекции (или в сыворотке крови).
К резистентным (устойчивым) относят бактерии, когда при лечении инфекции, вызванной этими микроорганизмами, нет эффекта от терапии даже при использовании максимальных доз антибиотика. Такие микроорганизмы имеют механизмы резистентности.
Клинически промежуточную резистентность у бактерий подразумевают в случае, если инфекция, вызванные такими штаммами, может иметь различный терапевтический исход. Однако лечение может быть успешным, если антибиотик используется в дозировке, превышающей стандартную, или инфекция локализуется в месте, где антибактериальный препарат накапливается в высоких концентрациях.
С микробиологической точки зрения к бактериям с промежуточной резистентностью относят субпопуляцию, находящуюся в соответствии со значениями МПК или диаметра зон, между чувствительными и резистентными микроорганизмами. Иногда штаммы с промежуточной резистентностью и резистентные бактерии объединяют в одну категорию резистентных микроорганизмов.
Необходимо отметить, что клиническая интерпретация чувствительности бактерий к антибиотикам является условной, поскольку исход терапии не всегда зависит только от активности антибактериального препарата против возбудителя. Клиницистам известны случаи, когда при резистентности микроорганизмов, по данным исследования in vitro, получали хороший клинический эффект. И наоборот, при чувствительности возбудителя может наблюдаться неэффективность терапии.
В определенных клинических ситуациях, когда недостаточно результатов исследования чувствительности обычными методами, определяют минимальную бактерицидную концентрацию.
Минимальная бактерицидная концентрация (МБК) - наименьшая концентрация антибиотика (мг/л или мкг/мл), которая при исследовании in vitro вызывает гибель 99,9% микроорганизмов от исходного уровня в течение определенного периода времени.
|
Значение МБК используют при терапии антибиотиками, обладающими бактериостатическим действием, или при отсутствии эффекта от антибактериальной терапии у особой категории больных. Частными случаями для определения МБК могут быть, например, бактериальный эндокардит, остеомиелит или генерализованные инфекции у пациентов с иммунодефицитными состояниями.
В заключение хотелось бы отметить, что на сегодняшний день не существует методов, которые позволили бы с абсолютной достоверностью прогнозировать клинический эффект антибиотиков при лечении инфекционных болезней. Однако, данные результатов определения чувствительности могут служить хорошим ориентиром клиницистам для выбора и коррекции антибактериальной терапии.
Таблица 1. Критерии интерпретации чувствительности бактерий

Различные штаммы стафилококков присутствуют у большинства людей и являются частью нормальной микробиоты кожных покровов, слизистых оболочек и нижнего отдела кишечника. Важное значение со стороны клинической практики и эпидемиологического надзора имеет бактерионосительство S. aureus, являющегося возбудителем многих инфекционных заболеваний человека. Стафилококками продуцируется большое количество факторов патогенности и токсинов. В настоящее время у стафилококков выделено и изучено более 30 различных экзотоксинов, эндотоксинов и суперэнтеротоксинов. Факторы патогенности микробов различными механизмами действуют на иммунную систему человека, что приводит к снижению сопротивляемости организма и развитию как острых, так и хронических форм заболеваний стафилококкового генеза. По данным литературных источников, приблизительно 40 % людей являются постоянными носителями S. аureus на слизистых оболочках крыльев носа, зева, коже подмышечных впадин и промежности, оставшуюся часть популяции относят к транзиторным и случайным носителям [1].
Важное клиническое значение бактерионосительства определяется типичностью процесса транслокации (переноса) стафилококков с наружных кожных покровов и слизистых оболочек во внутреннюю среду организма хозяина с развитием широкого спектра заболеваний [2, 3, 4]. Неблагоприятные факторы окружающей среды влияют не только на макроорганизм, но и на колонизирующие его микроорганизмы. В частности, усиливают действие механизмов агрессии потенциально патогенных бактерий и способность противостоять действию антибактериальных препаратов. Следовательно, стафилококки представляют опасность как для самого бактерионосителя, так и в эпидемиологическом плане, попадая в окружающую среду [5].
Ещё одна причина неэффективности лечения инфекций с помощью антибиотиков – стратегия, которую применяют многие практикующие врачи. Зачастую не проводится бактериологическое исследование и верификация возбудителя инфекции с последующим исследованием его чувствительности к антибиотикам. Получается нонсенс: лечение без диагностики [7]. Теряется время, пациент страдает не только от инфекции, но и от побочных эффектов антибиотика.
Цель работы – изучить наличие в микробиоме зева гемолитических штаммов стафилококков у здоровых молодых людей в открытом коллективе и определить чувствительность выделенных штаммов к антибактериальным препаратам, применяемым в практическом здравоохранении.
Материалы и методы исследования
Результаты исследования и их обсуждение
В результате исследования от 350 практически здоровых студентов без клинических признаков патологии носоглотки и верхних дыхательных путей было выделено 23 гемолитических штамма, идентифицированных как представители рода Staphylococcus spp.
У 7 % студентов без клинических признаков патологии носоглотки и верхних дыхательных путей выявлены гемолитические штаммы Staphylococcus spp. (рис. 1).
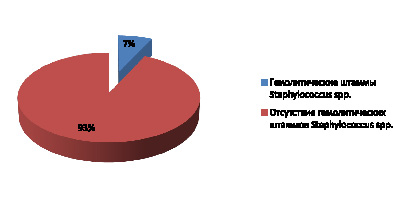
Рис. 1. Частота выявления гемолитических штаммов Staphylococcus spp. в микробиоме зева студентов, %
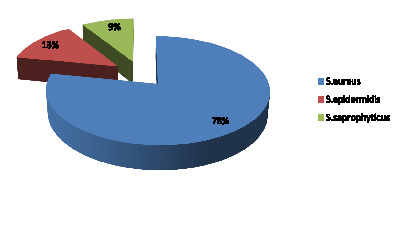
Рис. 2. Частота выявления видов Staphylococcus spp. в микробиоме зева студентов, %
Культуры, выделенные со слизистой оболочки зева, были представлены гемолитическими штаммами S. aureus – 18, S. epidermidis – 3, S. saprophyticus – 2 изолята (рис. 2). MRSA штаммы Staphylococcus spp. не выявлены.
Выделенные штаммы S. aureus в 100 % случаев чувствительны к следующим антибактериальным препаратам: пенициллину, ванкомицину, линезолиду, эритромицину, левофлоксацину, фузидину, клиндамицину, гентамицину, доксоциклину, оксациллину, рифампицину, ципрофлоксацину. В 6 и 50 % были устойчивы к левомицетину и ко-тримаксозолу соответственно (рис. 3).
Штаммы S. epidermidis чувствительны на 100 % к пенициллину, ванкомицину, линизолиду, эритромицину, левофлоксацину, левомицетину и ко-тримаксозолу. К фузидину, левомицетину чувствительны 33 % выделенных штаммов данного микроорганизма, к гентамицину и оксациллину чувствительны 27 %, к рифампицину 77 и 100 % не чувствительны к ципрофлоксацину (рис. 4).
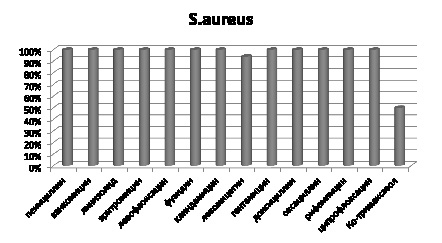
Рис. 3. Чувствительность выделенных штаммов S. aureus к антибиотикам, %
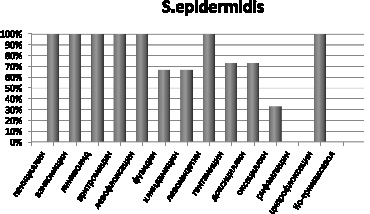
Рис. 4. Чувствительность выделенных штаммов S. epidermidis к антибиотикам, %
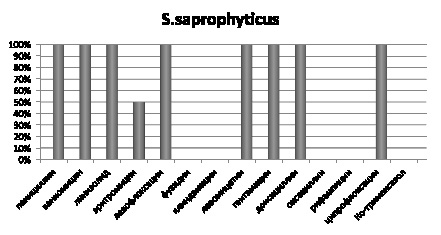
Рис. 5. Чувствительность выделенных штаммов S. saprophyticus к антибиотикам, %
Изоляты S. saprophyticus чувствительны на 100 % к пенициллину, ванкомицину, линизолиду, левофлоксацину, левомицетину, гентамицину, доксоциклину и ципрофлоксацину, на 50 % к эритромицину, и не чувствительны к фузидину, клиндамицину, оксациллину, рифампицину и ко-тримаксозолу (рис. 5).
Выводы
Получены данные о вариантах и частоте носительства условно-патогенных и патогенных стафилококков (7 %) в микробиоте зева молодых людей, при котором не установлено формирование патологических процессов в зеве, что свидетельствует о динамическом равновесии биоценоза и не требует активной эрадикации стафилококков.
Рецензенты:
Питательные среды для определения чувствительности к антибиотикам (AST)
Каждой группе микроорганизмов требуется специальная среда для оптимального определения их чувствительности к антибиотикам. Данная линейка питательных сред разработана в соответствии с руководствами CLSI ® и EUCAST ® по стандартизации результатов и оптимизации точности определения чувствительности к антибиотикам.
- Получение данных для подходящего антимикробного лечения
- Среды для определения чувствительности к антибиотикам диско-диффузионным методом или с помощью наборов реагентов для определения чувствительности микроорганизмов к антибиотикам Etest ®
- Соответствие требованиям CLSI ® и EUCAST ®
- Эффективное обеспечение роста прихотливых и неприхотливых патогенных микроорганизмов для получения достоверных результатов определения чувствительности к антибиотикам
- Возможность подтверждения результатов, полученных с помощью карт для определения чувствительности микроорганизмов к антибиотикам VITEK ® 2 AST
Хотите узнать больше ?
Важность определения чувствительности к антибиотикам
Растущая устойчивость многих патогенных микроорганизмов к антибактериальным препаратам — сейчас одна из наиболее серьезных проблем здравоохранения на глобальном уровне. Микроорганизмы, устойчивые к антимикробным препаратам, обуславливают высокую заболеваемость, смертность и экономическое бремя. Помимо идентификации микроорганизма, вызывающего инфекционное заболевание, необходимо определить чувствительность и резистентность к антибиотикам, чтобы прогнозировать ответ возбудителей на конкретные антимикробные препараты. Это позволяет начать наиболее подходящую терапию и принять меры по предотвращению распространения инфекции. Кроме того, лабораториям необходимо выявлять тенденции и особенности формирования резистентности у клинически значимых микроорганизмов. Это улучшит наше понимание и способность бороться с резистентностью, в том числе с помощью скоординированной рациональной противомикробной терапии, политики инфекционного контроля и профилактических мер.
Качественные среды для разнообразных потребностей определения чувствительности к антибиотикам
Компания bioMérieux предлагает линейку высококачественных стандартизованных питательных сред для определения чувствительности к антибиотикам. Эта линейка была разработана в соответствии с рекомендациями EUCAST ® (Европейского комитета по определению чувствительности к антибиотикам) и CLSI ® (Института клинических и лабораторных стандартов, Инк.), согласно которым каждая питательная среда должна идеально подходить для определения в условиях in vitro особенностей поведения конкретного микроорганизма в условиях in vivo. Питательные среды обеспечивают возможность роста патогенных микроорганизмов, и их состав подобран таким образом, чтобы оказывать минимальное влияние на результаты определения чувствительности к антибиотикам. Эта линейка совместима с диско-диффузионным тестированием и, для улучшения производительности, со стрипами Etest ® .
Агар Мюллера-Хинтона Е способствует росту неприхотливых бактерий (энтеробактерий, неферментообразующих грамотрицательных бактерий, стафилококков и энтерококков), обнаруживаемых при патологии человека.
- Соответствие рекомендациям CLSI ® и EUCAST ®
- Совместимость с Etest ®
- Улучшенный метод определение штаммов МРЗС с геном mecC
Мюллер-Хинтон агар 2 + 5% бараньей крови (MHS) – питательная среда для определения чувствительности пневмококков и других стрептококков к антибиотикам и сульфаниламидам для штаммов, рост которых требует наличие крови в среде.
Тимин-тимидин (ингибитор сульфонамида) в низкой концентрации предотвращает рост вокруг дисков, что позволяет точнее измерять зоны ингибирования
- Соответствует требованиям CLSI ®
- Совместимость с Etest ®
Повышение производительности при использовании с Etest ®
Питательные среды компании bioMérieux для определения чувствительности к антибиотикам утверждены для использования со стрипами Etest ® . Данные экономичные, простые в использовании индикаторные полоски получили широкое признание благодаря своим рабочим характеристикам для определения по шкале минимальной ингибирующей концентрации (МИК) антибактериальных препаратов. Полоски Etest ® дают даже более точные результаты определения чувствительности к антибиотикам, чем автоматизированные системы, такие как VITEK ® 2 и диско-диффузионный метод. Благодаря своей повышенной эффективности они позволяют:
- Подтверждать результаты первичного определения чувствительности к антибиотикам, например с помощью анализатора VITEK ® 2
- Тестировать новые препараты
- Тестировать сложные для определения микроорганизмы
- Определять низкие уровни резистентности, гетерорезистентности
- Определять или подтверждать фенотипы устойчивости к антимикробным препаратам
- Определять МИК в расширенном диапазоне
В утвержденном Сертификате совместимости, доступном в технической библиотеке четко указана совместимость продукта, гарантирующая соблюдение требований сертификации.








АНТИБИОТИКОРЕЗИСТЕНТНОСТЬ ВЫДЕЛЕННЫХ СТАФИЛОКОККОВ
Стафилококковые инфекции кожи — многочисленные фурункулезы, карбункулезы, фолликулиты и другие заболевания — могут причинять немало проблем. При генерализованном, обширном процессе без антибиотиков не обойтись. Однако гораздо чаще заболевание протекает локально, и высыпания в основном концентрируются на каком-то одном участке.
Стафилококки в основном устойчивы ко многим антибиотикам или быстро к ним адаптируются.
Чувствительность микроорганизмов к антибиотикам определяют методами:
серийных разведений в жидкой или на плотной питательной среде;
диффузии в агар с применением дисков, содержащих антибиотики.
Исследованию на чувствительность к антибиотикам подвергается не исследуемый клинический материал (гной, мокрота, моча и т.д.), а микроб-возбудитель, выделенный в чистой культуре из этого материала. Поэтому исследуемый материал должен быть взят до начала антимикробной терапии.
По степени чувствительности к антимикробным препаратам микроорганизмы принято разделять на три группы: чувствительные, промежуточные и устойчивые (резистентные). Существует два подхода к интерпретации этих понятий.
Клинический подход, основанный на оценке эффективности антибактериальной терапии.
Микробиологический подход основан на анализе концентраций антибиотика в питательной среде.
Методы, применяемые в бактериологической лаборатории для определения чувствительности (устойчивости) возбудителей к антимикробным препаратам, принято разделять на две группы:
Методы серийных разведений антибиотика в питательной среде:
• разведение химиопрепарата в жидкой питательной среде;
• разведение химиопрепарата в плотной питательной среде.
Наиболее прост и доступен метод определения чувствительности с помощью дисков, пропитанных антибиотиками (дискодиффузионный метод). В стерильные чашки Петри, расположенные на горизонтальной поверхности, разливают по 15-20 мл плотной питательной среды(чаще всего 2 % агар на переваре Хоттингера, содержащий 0,11 - 0,13 % аминного азота). На поверхность застывшего и слегка подсушенного агара наливают 1 мл суспензии суточной культуры микроба-возбудителя, эквивалентную стандарту мутности 0,5 по Мак-Фарланду. Бактериальную взвесь равномерно распределяют по поверхности агара, а ее избыток удаляют пастеровской пипеткой. На поверхности засеянного агара пинцетом раскладывают диски с антибиотиками – по 5 – 6 дисков на каждую чашку на расстоянии 25 мм от центра чашки. См. рис 1.4
Рис. 1 Диско-диффузионный метод
Коммерческие диски диаметром 6 мм изготавливают из специального картона, а концентрация антибиотика в диске соответствует рекомендациям ВОЗ (Всесоюзная организация здравоохранения). В настоящее время за рубежом производят диспенсеры, позволяющие одновременно размещать на чашке с плотной питательной средой 6,8 12 дисков с антимикробными препаратами. Для размещения 6 дисков используют стандартную чашку Петри диаметром 90-100 мм, а для размещения 8 и 12 дисков применяют специальные чашки большого диаметра. Чашки выдерживают при 35-37 0 С 18 – 24 ч, после чего учитывают результаты опыта путем измерения зон задержки роста микробов вокруг дисков, включая диаметр самого диска с помощью прозрачной линейки.На результаты определения чувствительности микроорганизмов к антибактериальным препаратам влияют:
• толщина слоя питательной среды в чашке Петри (4 мм),
• скорость роста исследуемых штаммов,
• величина посевной дозы,
• скорость диффузии антибиотиков из дисков в питательную среду и другие факторы
Дискодиффузный метод позволяет разделить исследуемые возбудители в зависимости от диаметра зоны задержки роста на питательной среде: при зоне диаметром до 10 мм штамм расценивается как устойчивый; 11 – 15 мм – как малочувствительный, 15 – 25 мм – как чувствительный. Зоны, превышающие 25 мм, свидетельствуют о высокой чувствительности микроорганизма к данному антибиотику. Однако нельзя считать этот метод количественным. [4,6]
В своих исследованиях мы использовали девять разных антибиотиков: неомицин, полимиксин, ципрофлоксацин, рифампицин, олеандомицин, оксациллин, ампицилин, амоксицилин, цефазолин. И три разных вида стафилококков (не типированных до вида): st белый и st желтый - взяты смывом с поверхности кожи лица, st 15 - проба из незаживающей раны. Результаты представлены в таблице 1.
Таблица 1. Результаты изучения антибиотикорезистентности исследуемых микроорганизмов
Купить МУК 4.2.2886-11 — бумажный документ с голограммой и синими печатями. подробнее
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Документ устанавливает методы идентификации патогенных биологических агентов, обнаруженных в продовольственном сырье и пищевых продуктах, парфюмерно-косметической и другой продукции, объектах окружающей среды, клиническом (биологическом) материале, и устанавливает методы определения чувствительности выделенных микроорганизмов к антимикробным препаратам
Оглавление
1. Область применения
2. Нормативные ссылки
3. Общие положения
4. Сущность метода
5. Отбор, подготовка проб (культур) и внесение бактериальной суспензии
6. Аппаратура, материалы и реактивы
7. Проведение испытаний
7.1. Идентификация микроорганизмов с применением планшетов
7.1.1. Экспресс-идентификация микроорганизмов
7.1.2. Идентификации энтеробактерий и других грамотрицательных оксидазоотрицательных бактерий
7.1.3. Идентификация неферментируюших грамотрицательных оксидазоположительных бактерий
7.1.4. Идентификация грамположительных кокков и палочек
7.1.5. Идентификация грибов и дрожжей
7.1.6. Идентификация стафилококков
7.1.7. Идентификация стрептококков
7.2. Определение чувствительности микроорганизмов к антибиотикам на планшетах
7.2.1. Определение минимальных подавляющих концентраций антимикробных препаратов (МПК) и детекция множественной устойчивости микроорганизмов к антибиотикам
7.2.2. Определение чувствительности грибов и дрожжей к антибиотикам
7.2.3. Экспресс-определение чувствительности бактерий к антибиотикам
7.2.4. Определение чувствительности бактерий к антибиотикам
7.2.5. Определение чувствительности аэробных бактерий к антибиотикам
7.3. Методики исследований с применением различных типов стрипов
Приложение 1. Перечень микроорганизмов, идентифицируемых на планшетах
Приложение 2. Типы планшет (стрипов) и их назначение
| Дата введения | 30.06.2011 |
|---|---|
| Добавлен в базу | 01.09.2013 |
| Актуализация | 01.02.2020 |
- Раздел Экология
- Раздел 11 ЗДРАВООХРАНЕНИЕ
- Раздел 11.020 Медицинские науки и условия по обеспечению охраны здоровья в целом
- Раздел 11 ЗДРАВООХРАНЕНИЕ
| 30.06.2011 | Утвержден | Главный государственный санитарный врач Российской Федерации |
|---|---|---|
| Издан | Роспотребнадзор | 2011 г. |
| Разработан | ООО СИ-ЛАБ | |
| Разработан | ФГУП ГНЦ ПМБ Роспотребнадзора | |
| Разработан | ФГУЗ Центр гигиены и эпидемиологии в г. Москве | |
| Разработан | ФГУЗ Федеральный центр гигиены и эпидемиологии Роспотребнадзора |
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:
Государственное санитарно-эпидемиологическое нормирование Российской Федерации
4.2. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Идентификация микроорганизмов и определение чувствительности их к антибиотикам с применением автоматизированной системы для биохимического анализа
Методические указания МУК 4.2.2886-11
Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека
4.2. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Идентификация микроорганизмов и определение чувствительности их к антибиотикам с применением автоматизированной системы для биохимического анализа
Методические указания МУК 4.2.2886-11
* Пластиковые расходные материалы (наконечники для пипетки, контейнер для стерилизации и хранения наконечников, 2- и 4-камерные кюветы).
Допускается применение других материалов, реактивов, питательных сред с аналогичными по назначению и свойствам характеристиками, адаптированных к системе, и разрешенных к применению в установленном порядке,
7. Проведение испытаний
7. L Идентификация микроорганизмов с применением планшетов
7. L L Экспресс-идентификация микроорганизмов
Для экспресс-идентификации в течение 5—6 ч 113 наиболее клинически значимых аэробных грамотрицательных оксидазоот-рицательных бактерий и грампозитивных бактерий применяют планшеты соответствующего назначения (4 теста/планшет; 23 биохимические реакции; 1 контроль).
Приготовьте бактериальную суспензию из 24-часовой культуры микроорганизмов, выращенной строго на кровяном агаре без добавок. Если проводить культивирование на иной среде, то это приведет к изменению биохимических характеристик исследуемых микроорганизмов и, как следствие, к ложным результатам. Суспензию со значением мутности 2,0 по МакФарланду необходимо приготовить в 5 мл физиологического раствора. Перенесите полученную суспензию в 4-камерную кювету.
Внесите по 100 мкл бактериальной суспензии в следующие лунки планшета:
А1: В12 определение 1 Cl : D12 определение 2 El : F12 определение 3 Gl : Н12 определение4
Добавьте по 2 капли парафинового масла в следующие лунки (здесь и далее порядок расположения лунок указан согласно приведенной ниже схеме планшета):
А 4+5+6, В 4+5, С 4+5+6, D 4+5, Е 4+5+6, F 4+5, G 4+5+6, Н 4+5
Накройте планшет специальной перфорированной пленкой, которая прилагается к набору. Использование перфорированной пленки гарантирует проникновение кислорода, необходимого для реакций. В то же время газовый обмен между ячейками планшета, нарушающий протекание реакций, становится невозможным.
Инкубируйте 5—6 ч при 37 °С.
По окончании инкубации снимите покрывающую планшет пленку и добавьте по 2 капли реактивов в следующие лунки:
* пептидазный реагент — в лунки А 1+2+3, В 2, С 1+2+3, D 2, Е 1+2+3, F 2, G 1+2+3, Н 2;
* индольный реагент — в лунки BL,D1,FI,H1.
Подождите не менее 5 мин (но не более 30 мин) для развития
71.2. Идентификации энтеробактерий и других грамотрицательных оксидазоотрицательных бактерий
Для идентификации энтеробактерий и других грамотрицательных оксидазоотрицательных бактерий за 18—24 ч применяют планшеты соответствующего назначения (4теста/планшет; 21 биохимическая реакция; 4 контроля).
Приготовьте бактериальную суспензию из 24-часовой культуры микроорганизмов, выращенной на кровяном агаре (с эритроцитами барана) или на простом питательном агаре. Если проводить культивирование на иной среде, то это приведет к изменению биохимических характеристик исследуемых микроорганизмов и, как следствие, к ложным результатам. Суспензию со значением мутности 0,5 (строго не более!) по МакФарланду необходимо приготовить в 5 мл физраствора. Перенесите полученную суспензию в 4-камерную кювету.
Внесите по 100 мкл бактериальной суспензии в следующие лунки планшета:
А1: В12 определение 1 Cl : D12 определение 2 El : F12 определение 3 Gl : Н12 определение 4
Добавьте по 2 капли парафинового масла в следующие лунки: В 1+2 определение 1 D 1+2 определение 2 F 1+2 определение 3 Н 1+2 определение 4
Накройте планшет Е специальной перфорированной пленкой, которая прилагается к набору. Использование перфорированной пленки гарантирует проникновение кислорода, необходимого для реакций. В то же время газовый обмен между ячейками планшета, нарушающий протекание реакций, становится невозможным. Инкубируйте 18—24 ч при 37 °С.
По окончании инкубации снимите покрывающую планшет пленку и добавьте по 2 капли реактивов в следующие лунки:
ты должны быть считаны в тот же день, на следующий день считывание невозможно.
7.1.3. Идентификация неферментирующих грамотрицательных оксидазоположительных бактерий
Для идентификации неферментирующих грамотрицательных оксидазоположительных бактерий за 18—24 ч применяют планшеты соответствующего назначения (3 теста/планшет; 27 биохимических реакций; 5 контролем).
Приготовьте бактериальную суспензию из 24-часовой культуры микроорганизмов, выращенной строго на кровяном агаре (с эритроцитами барана) без добавок. Если проводить культивирование на иной среде, то это приведет к изменению биохимических характеристик исследуемых микроорганизмов и, как следствие, к ложным результатам.
Суспензию со значением мутности 0,5 по МакФарланду необходимо приготовить в 5 мл физраствора. Перенесите 1,0 мл приготовленной суспензии в 6 мл предварительно приготовленной среды NF-Susmed и перемешайте. Перенесите полученную суспензию в стерильную (стерилизация паром под давлением при 121 °С) 2-камерную кювету.
Внесите по 100 мкл бактериальной суспензии в следующие лунки планшета:
А1 : Н4 определение 1 А5 : Н8 определение 2 А9 : Н12 определение 3
Добавьте по 2 капли парафинового масла в следующие лунки: Bl-Hl; А2, В2 определение 1 В5-Н5; А6, В6 определение 2 В9-Н9; А10, В10 определение 3
Накройте планшет специальной перфорированной пленкой, которая прилагается к набору. Использование перфорированной пленки гарантирует проникновение кислорода, необходимого для реакций. В то же время газовый обмен между ячейками планшета, нарушающий протекание реакций, становится невозможным.
Инкубируйте 18—24 ч строго при 28—30 в С. Если бактериальный рост недостаточен, то инкубируйте еще 24 ч.
По окончании инкубации снимите покрывающую планшет пленку и добавьте по 2 капли индола в следующие лунки:
7.1.4. Идентификация грамположительных кокков и палочек
Для идентификации грамположительных кокков и палочек (бактерии родов Staphylococcus, Streptococcus, Enterococcus, Coryne-bacteria, Listeria и др.) за 18—24 ч применяют планшеты соответствующего назначения (2 теста/планшет; 44 биохимических реакции; 4 контроля).
Приготовьте бактериальную суспензию из 24-часовой культуры микроорганизмов, выращенной строго на кровяном агаре (с эритроцитами барана) без добавок. Если проводить культивирование на иной среде, то это приведет к изменению биохимических характеристик исследуемых микроорганизмов и, как следствие, к ложным результатам. Медленнорастущие бактерии, такие как бактерии родов Streptococcus, Gardnerella и некоторые виды рода Corinebacteria необходимо выращивать в течение 48 ч в атмосфере 5 % СОг
Суспензию со значением мутности 2,0 по МакФарланду необходимо приготовить в 6 мл физраствора.
Внесите по 100 мкл бактериальной суспензии в следующие лунки планшета:
А1 : D12 определение 1 El: Н12 определение 2
Добавьте по 2 капли парафинового масла в следующие лунки: А12—D12 определение 1 Е12—Н12 определение 2
Накройте планшет специальной перфорированной пленкой, которая прилагается к набору. Использование перфорированной пленки гарантирует проникновение кислорода, необходимого для реакций. В то же время газовый обмен между ячейками планшета, нарушающий протекание реакций, становится невозможным.
Инкубируйте 18—24 ч при 37 °С. Если бактериааьный рост недостаточен, то инкубируйте еще 24 ч.
По окончании инкубации снимите покрывающую планшет пленку и добавьте по 2 капли пептидазного реагента в следующие лунки:
7.1.5. Идентификация грибов и дрожжей
Для идентификации клинически значимых грибов/дрожжей за 24 ч применяют планшеты соответствующего назначения (4 тес-та/планшет; 21 биохимическая реакция; 3 контроля).
Приготовьте суспензию из 24—48-часовой культуры микроорганизмов, выращенной строго на агаре Сабуро с 2 %-й глюкозой.
Если проводить культивирование на иной среде, то это приведет к изменению биохимических характеристик исследуемых микроорганизмов и, как следствие, к ложным результатам. Суспензию со значением мутности 0,5 по МакФарланду необходимо приготовить в 6 мл реактива Candida-Susmed. Перенесите полученную суспензию в 4-камерную кювету.
Внесите по 100 мкл суспензии в следующие лунки планшета:
А1 : В12 определение 1
Cl : D12 определение 2
El : F12 определение 3
Gl: Н12 определение 4
Накройте планшет специальной перфорированной пленкой, которая прилагается к набору. Использование перфорированной пленки гарантирует проникновение кислорода, необходимого для реакций. В то же время газовый обмен между ячейками планшета, нарушающий протекание реакций, становится невозможным.
Инкубируйте 24 ч при 25—30 °С.
7 1.6. Идентификация стафилококков
Для идентификации клинически значимых стафилококков за 6 и 18—24 ч применяют планшеты соответствующего назначения (4 теста/планшет; 21 биохимическая реакция; 2 контроля).
Приготовьте бактериальную суспензию из 24-часовой культуры микроорганизмов, выращенной строго на кровяном агаре (с эритроцитами барана) без добавок. Если проводить культивирование на иной среде, то это приведет к изменению биохимических ха-
рактеристик исследуемых микроорганизмов и, как следствие, к ложным результатам.
Для 6-часовой инкубации необходимо приготовить суспензию со значением мутности 2,0 по МакФарланду в 5 мл физраствора. Для 18—24-часовой инкубации необходимо приготовить суспензию со значением мутности 0,5 по МакФарланду в 5 мл физраствора.
Полученную суспензию перенесите в 4-камерную кювету.
Внесите по 100 мкл суспензии в следующие лунки планшета:
А1: В12 определение 1
Cl : D12 определение 2
El: F12 определение 3
Gl : Н12 определение 4
Добавьте по 2 капли парафинового масла в следующие лунки:
Накройте планшет специальной перфорированной пленкой, которая прилагается к набору. Использование перфорированной пленки гарантирует проникновение кислорода, необходимого для реакций. В то же время газовый обмен между ячейками планшета, нарушающий протекание реакций, становится невозможным.
В зависимости от выбранного метода инкубируйте 6 или 18—24 ч при 37 °С.
7.1.7. Идентификация стрептококков
Для идентификации клинически значимых стрептококков и энтерококков за 20—24 ч применяют планшеты соответствующего назначения (4 теста/планшет; 24 биохимические реакции).
Приготовьте бактериальную суспензию из 24-часовой культуры микроорганизмов, выращенной строго на кровяном агаре (с
эритроцитами барана) без добавок. Если проводить культивирование на иной среде, то это приведет к изменению биохимических характеристик исследуемых микроорганизмов и, как следствие, к ложным результатам.
Бактериальную суспензию со значением мутности 1,0 по МакФарланду необходимо приготовить в 5 мл физраствора. Полученную суспензию перенесите в 4-камерную кювету.
Внесите по 100 мкл суспензии в следующие лунки планшета:
А1: В12 определение 1
Cl: D12 определение 2
El : F12 определение 3
G1 : Н12 определение 4
Добавьте по 2 капли парафинового масла в следующие лунки:
Накройте планшет специальной перфорированной пленкой, которая прилагается к набору. Использование перфорированной пленки гарантирует проникновение кислорода, необходимого для реакций. В то же время газовый обмен между ячейками планшета, нарушающий протекание реакций, становится невозможным.
Инкубируйте 20—24 ч при 37 °С.
7.2. Определение чувствительности микроорганизмов к антибиотикам на планшетах
7.2. L Определение минимальных подавляющих концентраций антимикробных препаратов (МПК) и детекция множественной устойчивости микроорганизмов к антибиотикам
Перечень антимикробных препаратов, чувствительность к которым можно определять с помощью планшетов, указан в инструкциях по применению соответствующих типов планшет и включает в себя следующие антибиотики: азитромицин, амоксициллин/кла-вулановая кислота, ампициллин, пенициллин, бацитрацин, цеф-триаксон, цефуроксим, ципрофлоксацин, кларитромицин, клин-
дамицин, колистин, доксициклин, эритромицин, имипинем, ме-ропенем, моксифлоксацин, метронидазол, абактам, ванкомицин, пиперациллин, хлорамфеникол, гентамицин, стрептомицин, тетрациклин, триметоприм, налидиксовая кислота.
Для определения минимальных подавляющих концентраций (МПК) антимикробных препаратов и детекции множественной устойчивости микроорганизмов к антибиотикам за 18—24 ч применяют планшеты соответствующего назначения:
— подтверждающий тест (1 тест/планшет, 2 контроля) для фенотипической детекции ESBL ф-лактамазы) у соответствующих грамотрицательных бактерий за 18—24 ч;
-для детекции множественной устойчивости (1 тест/планшет, 1 контроль) стафилококков (MRSA), энтерококков (VRE) и пневмококков за 18—24 ч;
- для определения минимальной подавляющей концентрации (1 тест/планшет, 1 контроль) антимикробных агентов с высокой активностью в отношении анаэробов за 18—24 ч.;
— для определения минимальной подавляющей концентрации (1 тест/планшет, 1 контроль) антимикробных агентов в отношении пневмококков и гемофильных бактерий за 18—24 ч;
- ддя определения минимальной подавляющей концентрации (1 тест/планшет, 1 контроль) антимикробных агентов в отношении кампилобактерий за 18—24 ч;
“ для исследования множественной лекарственной устойчивости (1 тест/планшет, 1 контроль) неферментирующих бактерий, вызывающих развитие цистита за 18—24 ч.
Для всех типов указанных выше планшет применяется одна схема работы.
Приготовьте бактериальную суспензию из 24-часовой культуры микроорганизмов, выращенной строго на кровяном агаре (с эритроцитами барана) без добавок. Если проводить культивирование на иной среде, то это приведет к изменению биохимических характеристик исследуемых микроорганизмов и, как следствие, к ложным результатам.
Необходимо приготовить суспензию со значением мутности 0,5 по МакФарланду в 5 мл физраствора.
Для определения грамотрицательных бактерий необходимо перемешать 50 мкл приготовленной суспензии в 11 мл бульона Мюллера-Хинтона II.
И29 Идентификация микроорганизмов и определение чувствительности их к антибиотикам с применением автоматизированной системы для биохимического анализа: Методические указания.—М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора, 2011 .—39 с.
Читайте также:


