Как разводить таблетки бактериофаг дизентерийный
Действующее вещество
Бактериофаг дизентерийный поливалентный
Инструкция по медицинскому применению - РУ № ЛС-002003
Дата последнего изменения: 27.04.2017
Раствор для приема внутрь и ректального введения.
Препарат представляет собой смесь стерильных фильтратов фаголизатов Shigella flexneri 1, 2, 3, 4 и 6 сероваров и Shigella sonnei.
Консервант - 8-гидроксихинолина сульфат - 0,0001 г/мл (содержание расчетное);
или 8-гидроксихинолина сульфата моногидрат - 0,0001 г/мл (в пересчете на 8-гидроксихинолина сульфат, содержание расчетное).
Представляет собой прозрачную жидкость желтого цвета различной степени интенсивности, допускается зеленоватый оттенок. Определяют визуально.
Препарат вызывает специфический лизис бактерий возбудителей бактериальной дизентерии.
Лечение и профилактика бактериальной дизентерии, вызванной Shigella flexneri сероваров 1, 2, 3, 4, 6 и Shigella sonnei.
Важным условием эффективной фаготерапии является предварительное определение фагочувствительности возбудителя.
Гиперчувствительность к компонентам препарата.
Применение данного медицинского препарата при беременности и в период кормления грудью возможно при наличии инфекций, вызванных фагочувствительными штаммами бактерий (по рекомендации врача).
Препарат предназначен для приема внутрь и ректального введения. Для лечения препарат принимают внутрь 3 раза в день натощак за 1 ч до приема пищи с первого дня заболевания в течение 7-10 дней.
Рекомендуемые дозировки препарата
| Возраст | Доза на 1 прием (мл) | |
| перорально | ректально | |
| 0-6 мес. | 5 | 10 |
| 6-12 мес. | 10-15 | 20 |
| от 1 года до 3 лет | 15-20 | 20-30 |
| от 3 до 8 лет | 20-30 | 30-40 |
| от 8 лет и старше | 30-40 | 50-60 |
При дизентерии, характеризующейся слабовыраженным колитическим синдромом, и в период реконвалесценции рекомендуется сочетание двукратного приема внутрь с однократным ректальным введением разовой возрастной дозы препарата в виде клизмы после опорожнения кишечника.
В профилактических целях препарат рекомендуется применять во время групповых заболеваний в организованных коллективах и семьях. Оптимальная схема использования - ежедневный прием разовой возрастной дозы. Продолжительность приема препарата определяется условиями эпидситуации.
Применение препарата возможно в сочетании с другими лекарственными средствами, в том числе с антибиотиками.
При помутнении препарат не применять!
Вследствие содержания в препарате питательной среды, в которой могут развиваться бактерии из окружающей среды, вызывая помутнение препарата, необходимо при вскрытии флакона соблюдать следующие правила:
- тщательно мыть руки;
- обработать колпачок спиртсодержащим раствором;
- снять колпачок, не открывая пробки;
- не класть пробку внутренней поверхностью на стол или другие предметы;
- не оставлять флакон открытым;
- вскрытый флакон хранить только в холодильнике.
При использовании малых доз (2-8 капель) препарат необходимо отбирать стерильным шприцем в объеме 0,5-1 мл.
Препарат из вскрытого флакона при соблюдении условий хранения, вышеперечисленных правил и отсутствии помутнения может быть использован в течение всего срока годности.
Влияние на способность управлять транспортными средствами, механизмами
Раствор для приема внутрь и ректального введения во флаконах по 20 или 100 мл. По 4 или 10 флаконов по 20 мл или 1 флакон по 100 мл с инструкцией по применению в пачке из картона.
В соответствии с СП 3.3.2.1248-03 при температуре от 2 до 8°С. Допускается транспортирование при температуре от 9 до 25°С не более 1 месяца.
Препарат хранят в соответствии с СП 3.3.2.1248-03 в недоступном для детей месте при температуре от 2 до 8°С.
Срок годности 2 года. Препарат с истекшим сроком годности применению не подлежит.
Отпускается без рецепта.
Цены в аптеках Москвы
| Серия Годен до | Цена, руб. | Аптеки | |||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Метилцеллюлоза | 0,5÷4,0 |
| Лактоза | 5,0÷25,0 |
| Сорбит | 5,0÷15,0 |
| Кальция карбонат | 55,0÷75,0 |
| Натрия альгинат | 5,0÷12,0 |
| Кальция или магния стеарат | 0,25÷1,0 |
Недостатками известного технического решения фармацевтической композиции в виде таблеток без оболочки на основе Секстафага ® (Пиобактериофага поливалентного) или бактериофага сальмонеллезного являются низкая распадаемость в воде очищенной и достаточно низкая биологическая доступность.
Задача, решаемая изобретением, состоит в увеличении биологической доступности антибактериальной фармацевтической композиции для перорального применения, содержащей бактериофаги, и расширении сферы ее применения.
Технический результат, обеспечивающий решение указанной задачи, состоит в улучшении распадаемости в воде очищенной, в увеличении биологической доступности и в расширении спектра фармакологического действия фармацевтической композиции для профилактики и лечения заболеваний, вызванных микроорганизмами из ряда патогенных и условно-патогенных бактерий: Staphylococcus (S. aureus, S. epidermidis, S. saprophyticus, S. cohnii), Streptococcus (S. pneumoniae, S. haemolyticus, S. agalactiae, S. pyogenes,), Enterococcus (E. faecalis, E. faecium), Proteus (P. vulgaris, P. mirabilis), Pseudomonas aeruginosa, энтеропатогенные Escherichia coli различных серогрупп, Klebsiella pneumoniae, Salmonella групп ABCDE (гр. A - S. paratyphi А; гр. В - S. paratyphi B, S. typhimurium, S. heidelberg; гр. С - S. newport. S. choleraesuis, S. oranienburg, S. infantis; гр. D - S. enteritidis, S. dublin; гр. E - S. anatum, S. newlands), Shigella (Sh. flexneri 1, 2, 3, 4 и 6 сероваров, Sh. sonnei).
Указанный технический результат достигается тем, что обладающая антибактериальной активностью фармацевтическая композиция для перорального применения, содержащая бактериофаги: Секстафаг ® (Пиобактериофаг поливалентный), или Интести-бактериофаг, или сальмонеллезный групп A, B, C, D, E, или дизентерийный поливалентный, согласно изобретению содержит бактериофаг в количестве 1,5-3 масс. %, в качестве целевых добавок уменьшенное количество натрия альгината 0,5÷4,5 масс. % и дополнительно содержит пектин, композиция расфасована в твердые капсулы при следующем соотношении компонентов, масс. %:
| Бактериофаг Секстафаг ® (Пиобактериофаг | |
| поливалентный), или Интести-бактериофаг, или | |
| Бактериофаг сальмонеллезный групп ABCDE, или | |
| Бактериофаг дизентерийный поливалентный | 1,5÷3,0 |
| Метилцеллюлоза | 0,5÷5,0 |
| Лактоза | 5,0÷35,0 |
| Сорбит | 2,5÷5,0 |
| Кальция карбонат | 50,0÷75,0 |
| Натрия альгинат | 0,5÷4,5 |
| Пектин | 0,5÷15,0 |
| Кальция или магния стеарат | 0,25÷1,0 |
При этом совокупность отличительных признаков обеспечивает улучшение показателя распадаемости в воде очищенной, увеличение биологической доступности и расширение спектра фармакологического действия фармацевтической композиции для профилактики и лечения заболеваний, вызванных микроорганизмами из ряда патогенных и условно-патогенных бактерий.
Новые признаки состоят в наличии бактериофага в количестве 1,5-3 масс. %, натрия альгината в количестве 0,5÷4,5 масс. % и дополнительно пектина 0,5÷15,0 масс. %, при следующем соотношении компонентов, масс. %:
| Бактериофаг Секстафаг ® (Пиобактериофаг | |
| поливалентный), или Интести-бактериофаг, или | |
| Бактериофаг сальмонеллезный групп ABCDE, или | |
| Бактериофаг дизентерийный поливалентный | 1,5÷3,0 |
| Метилцеллюлоза | 0,5÷5,0 |
| Лактоза | 5,0÷35,0 |
| Сорбит | 2,5÷5,0 |
| Кальция карбонат | 50,0÷75,0 |
| Натрия альгинат | 0,5÷4,5 |
| Пектин | 0,5÷15,0 |
| Кальция или магния стеарат | 0,25÷1,0 |
Основным показателем качества лекарственных препаратов бактериофагов является биологическая доступность, которая зависит от показателя распадаемости в воде очищенной лекарственных форм бактериофагов, а также от стабильности бактериофагов в кислой среде желудочного сока.
Проведен фармацевтический тест для определения биологической доступности бактериофагов по показателю распадаемости в воде очищенной фармацевтических композиций, полученных по прототипу в виде таблеток, а также полученных по предлагаемому изобретению в виде капсул. У фармацевтической композиции с комплексным поливалентным Секстафагом, полученной по прототипу (патент №2410084, опубл. 27.01.2011) в виде таблеток, показатель распадаемости в воде очищенной составляет 48,5±3,4 мин (норма по ГФ XIII издания не более 15 мин). У фармацевтической композиции с комплексным поливалентным Секстафагом, полученной по предлагаемому изобретению в виде капсул, показатель распадаемости в воде очищенной составляет 16,8±1,3 мин (норма по ГФ XIII издания не более 30 мин). Установлено, что для композиции, полученной по предлагаемому изобретению, распадаемость выше в 2,9 раза в сравнении с композицией, полученной согласно прототипу, что говорит о повышении биологической доступности препаратов бактериофагов в предлагаемом изобретении (таблица 1).

Изучение стабильности фармацевтических композиций, полученных по прототипу, а также полученных по предлагаемому изобретению, показало, что желудочная резистентность бактериофагов в кислой среде выше в фармацевтической композиции предлагаемого изобретения, чем у фармацевтической композиции, полученной по прототипу. Показатель литической активности для композиции по предлагаемому изобретению сохраняется на исходном уровне (титр выше 10 -3 ) после выдерживания в кислой среде в течение 1 часа, в отличие от фармацевтической композиции, полученной по прототипу (таблица 2).

* Секстафаг ® (Пиобактериофаг поливалентный) представляет собой смесь стерильных очищенных фаголизатов бактерий Staphylococcus spp., Streptococcus spp., Proteus spp., Pseudomonas aeruginosa, энтеропатогенных Escherichia coli различных серогрупп, Klebsiella pneumoniae, или
** Интести-бактериофаг поливалентный представляет собой смесь стерильных очищенных фаголизатов бактерий Staphylococcus spp., Enterococcus spp., Proteus spp., Pseudomonas aeruginosa, энтеропатогенных Escherichia coli различных серогрупп, Salmonella групп A, B, C, D, Shigella (Sh. flexneri 1, 2, 3, 4, 6 сероваров, Sh. sonnei), или
*** Бактериофаг сальмонеллезный групп A, B, C, D, E представляет собой смесь стерильных фильтратов фаголизатов наиболее распространенных сальмонелл (гр. А - S. paratyphi А; гр. В - S. paratyphi В, S. typhimurium, S. heidelberg; гр. С - S. newport. S. choleraesuis, S. oranienburg, S. infantis; гр. D - S. dublin, S. enteritidis; гр. E - S. anatum, S. newlands), или
**** Бактериофаг дизентерийный поливалентный представляет собой смесь стерильных фильтратов фаголизатов бактерий Shigella (Sh. flexneri 1, 2, 3,4 и 6 сероваров, Sh. sonnei).
Таким образом, фармацевтическая композиция предлагаемого состава обеспечивает увеличение биологической доступности препаратов бактериофагов.
Фармакокинетические исследования фармацевтических композиций, полученных по прототипу, а также полученных по предлагаемому изобретению, относительно жидкой формы бактериофага - раствор для приема внутрь, местного и наружного применения, показали лучшую биологическую доступность бактериофагов из композиции, полученной по предлагаемому изобретению. После однократного перорального введения белым мышам указанных фармацевтических композиций по результатам анализа биологических жидкостей (сывороток крови и мочи) лабораторных животных установлено, что относительная биологическая доступность у препарата по предлагаемому изобретению в 1,7÷1,8 раза выше, чем у препарата, полученного согласно прототипу (таблица 3).

Смах - максимальная концентрация фага в биологическом материале животного;
БОЕ/мл или БОЕ/г - количество бляшкообразующих единиц в 1 мл или 1 г биологического материала животного;
Tmax, ч - время достижения максимальной концентрации бактериофагов в биологическом материале животного;
Т0, ч - время полного выведения фага из организма животного;
AUC0-8 - площадь под фармакокинетической кривой, начиная с нулевого значения времени до времени отбора образца биологического материала через 8 ч после введения препарата; расчет площади под фармакокинетической кривой (AUC0-8) производился по методу обычных трапеций;
f - степень всасывания (относительная биодоступность); параметр f рассчитывался по формуле: f=AUCкомпозиция/AUCжидкая форма.
Таким образом, результаты фармакокинетических исследований подтверждают более высокую биологическую доступность бактериофагов по предлагаемому изобретению, чем по прототипу.
Предлагаемую фармацевтическую композицию получают следующим образом.
Пример 1. Получение фармацевтической композиции, содержащей бактериофаги, для перорального применения.
1) Комплексный поливалентный бактериофаг Секстафаг® (Пиобактериофаг поливалентный) представляет собой смесь стерильных очищенных фаголизатов бактерий Staphylococcus spp., Streptococcus spp., Proteus spp., Pseudomonas aeruginosa, энтеропатогенных Escherichia coli различных серогрупп, Klebsiella pneumoniae или
2) Комплексный поливалентный бактериофаг Интести-бактериофаг представляет собой смесь стерильных очищенных фаголизатов бактерий Staphylococcus spp., Enterococcus spp., Proteus spp., Pseudomonas aeruginosa, энтеропатогенных Escherichia coli различных серогрупп, Salmonella групп A, B, C, D, Shigella (Sh. flexneri 1, 2, 3, 4, 6 сероваров, Sh. sonnei), или
3) Бактериофаг сальмонеллезный групп A, B, C, D, E представляет собой смесь стерильных фильтратов фаголизатов наиболее распространенных сальмонелл (гр. А - S. paratyphi А; гр. В - S. paratyphi В, S. typhimurium, S. heidelberg; гр. С - S. newport. S. choleraesuis, S. oranienburg, S. infantis; гр. D - S. dublin, S. enteritidis; гр. E - S. anatum, S. newlands), или
4) Бактериофаг дизентерийный поливалентный представляет собой смесь стерильных фильтратов фаголизатов бактерий Shigella (Sh. flexneri 1, 2, 3, 4 и 6 сероваров, Sh. sonnei).
Стерильные фильтраты фаголизатов комплексных поливалентных бактериофагов с титром не менее 10 -5 концентрируют в 10-100 раз с помощью мембранной ультрафильтрации до титра по Аппельману не менее 10 -6 . Затем полученные концентраты подвергают стерилизующей фильтрации через микропористые мембраны (капсулы) с размером пор 0,45; 0,2 мкм и используют для приготовления фармацевтической композиции. Целевые добавки перед введением в бактериофаг предварительно стерилизуют в сушильно-стерилизационном шкафу.
К концентрированному бактериофагу добавляют смесь метилцеллюлозы 3,0 г, сорбита 5,0 г и лактозы 30,0 г. После получения гомогенной гелеобразной массы добавляют смесь кальция карбоната 52,0 г, натрия альгината 4,0 г и пектина 2,0 г. После гомогенизации полученную густую пастообразную массу выкладывают в кассеты, накрывают стерильной тканью и высушивают в сублимационной установке до влажности 1-4%. Сухую массу гранулируют, опудривают стерильной массой целевых добавок (вспомогательных антифрикционных веществ - 1,0 г магния стеарата (или кальция стеарат)), тщательно перемешивают и расфасовывают в твердые капсулы.
Пример 2. Получение фармацевтической композиции, содержащей бактериофаги, для перорального применения.
Проводят подготовку бактериофагов и целевых добавок для сушки и опудривания, как описано в примере 1. К концентрированному бактериофагу добавляют смесь метилцеллюлозы 5,0 г, сорбита 3,0 г и лактозы 35,0 г. После получения гомогенной гелеобразной массы добавляют смесь кальция карбоната 50,0 г, натрия альгината 4,5 г и пектина 0,5 г. После гомогенизации полученную густую пастообразную массу выкладывают в кассеты, накрывают стерильной тканью и высушивают в сублимационной установке до влажности 1-4%. Сухую массу гранулируют, опудривают стерильной массой целевых добавок (вспомогательных антифрикционных веществ - 0,25 г магния стеарата (или кальция стеарат)), тщательно перемешивают и расфасовывают в твердые капсулы.
Пример 3. Получение фармацевтической композиции, содержащей бактериофаги, для перорального применения.
Проводят подготовку бактериофагов и целевых добавок для сушки и опудривания, как описано в примере 1. К концентрированному бактериофагу добавляют смесь метилцеллюлозы 0,5 г, сорбита 2,5 г и лактозы 5,0 г. После получения гомогенной гелеобразной массы добавляют смесь кальция карбоната 75,0 г, натрия альгината 0,5 г и пектина 15,0 г. После гомогенизации полученную густую пастообразную массу выкладывают в кассеты, накрывают стерильной тканью и высушивают в сублимационной установке до влажности 1-4%. Сухую массу гранулируют, опудривают стерильной массой целевых добавок (вспомогательных антифрикционных веществ - 0,25 г магния стеарата (или кальция стеарат)), тщательно перемешивают и расфасовывают в твердые капсулы.
Антибактериальная фармацевтическая композиция для перорального применения, содержащая бактериофаги: Секстафаг ® (Пиобактериофаг поливалентный), или Интести-бактериофаг, или сальмонеллезный групп A, B, C, D, E, или дизентерийный поливалентный, с использованием в качестве целевых добавок метилцеллюлозы, сорбита, лактозы и кальция карбоната, кальция или магния стеарата, согласно изобретению композиция содержит бактериофаг в количестве 1,5-3 масс. %, уменьшенное количество натрия альгината 0,5÷4,5 масс. %, дополнительно содержит пектин 0,5÷15,0 масс. %, композиция расфасована в твердые капсулы при следующем соотношении компонентов, масс. %:
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
Человек живет впостоянном контакте исложнейшем взаимодействии снеисчислимым множеством микроорганизмов. Жить без микробов невозможно, ноисмногими изних— тоже. Ежегодно, посамым скромным оценкам, неучитывающим недоступные для статистики ВОЗ данные многих развивающихся стран, погибает отпневмонии 3,9млн человек, отдиареи— 1,6млн, оттуберкулеза— 1,6млн [1].
Человек живет в постоянном контакте и сложнейшем взаимодействии с неисчислимым множеством микроорганизмов. Жить без микробов невозможно, но и с многими из них — тоже. Ежегодно, по самым скромным оценкам, не учитывающим недоступные для статистики ВОЗ данные многих развивающихся стран, погибает от пневмонии 3,9 млн человек, от диареи — 1,6 млн, от туберкулеза — 1,6 млн [1].
С учетом нарастающей резистентности флоры к антибиотикам, вероятности аллергических и токсических реакций возникает проблема: что применять вместо антибиотиков или в комплексе с ними?
Бактериофаги — древнейшие вирусы, наиболее распространенный в биосфере биологический объект. Чистая природная вода содержит в 1 мл 2×108 фагов, на каждую бактериальную единицу приходится не менее 10 фаговых [5, 6].
Длительное время фаги изучали на примере фагов , размножающихся на Escherichia (Е.) coli штамма В. Внедрение и совершенствование электронной микроскопии позволили говорить о разнообразии форм фагов. Принципиально фаг вне зависимости от вида построен из белковой или липопротеиновой оболочки, внутри которой заключены ДНК ( чаще, реже), еще реже 1- или РНК и ферменты. Выделяют головку фага (возможны нитчатая, сферическая, полигональная, плеоморфная формы фага), где и заключены генетическая информация и ферменты, и хвост фага, прикрепляющийся за счет специфических рецепторов на поверхности клетки. Фаг является облигатным внутриклеточным паразитом, он растворяет оболочку клетки, впрыскивает в клетку свой геном. Последний полностью за счет транскриптаз переключает метаболизм клетки, и начинается синтез ДНК или, соответственно, РНК фага, и капсида. За 1–24 ч образуется 100–300 новых фагов. Клетка разрушается, выделившиеся в окружающее пространство фаги инфицируют новые клетки. Экспоненциальное размножение фагов завершается только после уничтожения специфических для них клеток. Во внешней среде фаги способны переживать десятилетия [7].
В многочисленных отечественных и зарубежных публикациях продемонстрирована эффективность применения бактериофагов, генетически модифицированных, в лечении поверхностной и системной инфекций [8, 9]. Лечение фагами привлекательно по следующим причинам:
2. Бактериофаги — естественные природные средства. Бактериофаг не может длительно циркулировать в макроорганизме — длительность его жизни лимитирована наличием .
При применении бактериофагов следует учитывать, что специфичность фагов может ограничивать их применение в острых случаях.
Соотношение бактериофаго- и антибиотикотерапии представлено в таблице 1.
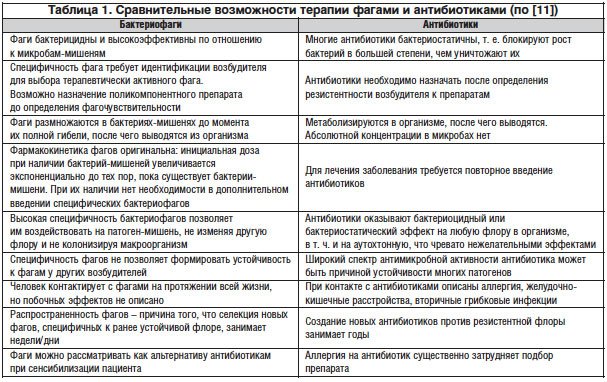
В эксперименте [14, 15] была показана эффективность фагов в лечении кожных инфекций и внутримышечных абсцессов (Pseudomonas (Ps.) aeruginosa, Staphylococcus (S.) aureus). В клинической практике эффективность лечения инфекций ран, инфицированных пострадиационных некрозов была продемонстрирована K. Markoishwili et al. [16] и другими представителями школы грузинского ученого Г. Элиавы.
В нашей стране для наружного применения используют комплексные фаговые препараты. Препарат пиобактериофаг поливалентный (Секстафаг®) для приема внутрь (20 мл 3 р./сут, 7–15 дней), местно или наружно способен лизировать стафило- и стрептококки, патогенные кишечные и синегнойные бактерии (Proteus mirabilis, Proteus vulgaris, Klebsiella pneumoniae). Это позволяет применять его при заболеваниях уха, горла, носа, дыхательных путей, легких и плевры (воспалении пазух носа, среднего уха, ангине, фарингите, ларингите, трахеите, бронхите, пневмонии, плеврите). Секстафаг®, являясь эффективной альтернативой антибиотикам, может также применяться с ними комплексно. Крайне важно, что препарат может применяться при заболеваниях у новорожденных и детей грудного возраста (омфалит, гастроэнтероколит), беременных и рожениц. Все это подчеркивает безопасность препарата.
Гель Отофаг применяют местно в дозировке 1–2 мл: для профилактики рецидивов заболеваний — 2–3 р./сут в течение 7–10 дней, при наличии бактериального воспалительного заболевания — 2–3 р./сут в течение 7–14 дней.
Применение фагов как профилактического, лечебного и противорецидивного средства продемонстрировало свою эффективность в самой частой педиатрической группе: пациенты с инфекционной патологией верхних дыхательных путей (риносинуситы, тонзиллиты, ларингиты, фарингиты). Обычно эти инфекции трактуются как вирусные, хотя достаточно часто причиной бывают и бактерии, или бактериальная флора активируется в процессе манифестации вирусной инфекции.
Подавляющее большинство всех случаев острых заболеваний детей, особенно младшего возраста, вызваны острой респираторной инфекцией (ОРИ). Первичная заболеваемость детей и подростков по г. Москве за колебалась от 1680,2‰ до 1763,6‰3. Заболеваемость болезнями органов дыхания за этот же период составила 1147,4–1188,8‰. Общий экономический ущерб от заболеваний гриппом детей и взрослых в 2008 г. составил 375,2 млрд руб. Заболеваемость ОРВИ детей и подростков до 17 лет в 8,3 раза выше, чем взрослых. Так, при совместных исследованиях с [17] было показано, что на первом году жизни частота эпизодов ОРИ составляет 1535,9:1000, у детей достигает 3796,29:1000. Даже если первоначально заболевание разворачивается как вирусное, то впоследствии часто присоединяется бактериальная флора или активируется собственная, что требует взвешенного решения о выборе препарата или сочетании антибиотиков с иными препаратами, бактериофагами.
Инфекционный ринит дебютирует первоначально, как правило, как вирусный с типичным водянистым или отделяемым. Появление отделяемого, лихорадки, боли в области придаточных пазух говорит о присоединении бактериальной флоры. В качестве профилактики такого развития заболевания можно обсуждать местное применение поливалентного бактериофага.
Присоединение бактериальной инфекции с ее распространением на придаточные пазухи носа приводит к синуситу. Любые нарушения цилиарного клиренса, вентиляции, местного или системного иммунного ответа создают условия для хронизации синусита, вылечить который без воздействия на первоначальные причины невозможно. Признаки синусита:
- сохранение симптомов респираторной инфекции на протяжении 7–10 дней;
- дневной кашель и ринорея;
- заложенность носа;
- нередко низкий субфебрилитет;
- средний отит (у 60–70% больных);
- беспокойство;
- головные боли.
К признакам тяжелого течения синусита или его осложнений относятся гнойная ринорея, лихорадка выше 39ºС и периорбитальный отек. При остром и подостром синусите чаще обнаруживают Streptococcus pneumoniae, реже — Haemophilus (H.) influenzae, Moraxella catarrhalis, Streptococcus pyogenes (β-гемолитический). Хронический синусит чаще полимикробный, вызывается α-гемолитическим стрептококком, S. aureus, коагулазонегативными стафилококками, нетипичными H. influenzae, а также Moraxella catarrhalis и анаэробными бактериями (Peptostreptococcus spp., Prevotella, Bacteroides, Fusobacterium spр.), после многих курсов антибиотиков (или у иммунокомпрометированных пациентов) — Pseudomonads. Эти сведения еще раз заставляют оценить место и роль поливалентных бактериофагов в комплексном лечении синуситов.
При лечении риносинуситов препаратом пиобактериофаг путем его местного введения в пазухи отмечено значительное улучшение, нормализовались показатели завершенности фагоцитоза, что указывало на снижение интенсивности воспаления с восстановлением адекватного иммунного ответа слизистых оболочек носа. Таким образом, препарат пиобактериофаг поливалентный (Секстафаг®) обладает противовоспалительными и иммунорегуляторными свойствами, что проявляется нормализацией показателей местного иммунитета. В то же время применение антибиотиков при лечении больных хроническим гнойным риносинуситом сопровождается сохранением признаков воспаления в виде активации нейтрофильного звена иммунной системы, увеличением внеклеточной пероксидазной активности и угнетением процесса фагоцитоза с нарушением механизмов завершенности в клетках [18]. Пиобактериофаг при местном введении в пазухи улучшает показатели завершенности фагоцитоза, что свидетельствует о снижении интенсивности воспаления с восстановлением адекватного иммунного ответа слизистых оболочек носа [19].
При обследовании пациентов с компенсированной формой хронического тонзиллита S. aureus выделен у 92,5%. Чувствительность культур золотистого стафилококка к стафилококковому бактериофагу оказалась очень высокой (97,4%). По результатам монотерапии специфическим бактериофагом и комбинированного лечения зарегистрированы клиническое улучшение и уменьшение высеваемости S. aureus со слизистой оболочки миндалин [26].
Обострения хронического ларингита сопровождается обсеменением слизистой гортани патогенной микрофлорой. Использование в комплексном лечении таких пациентов специфического бактериофага в виде инстилляций в гортань, а в случае тяжелого обострения — в виде приема внутрь позволяет существенно сократить продолжительность лечения, значительно повышая его качество, достичь более длительной ремиссии болезни и снизить частоту обострений [27].
Эффективность бактериофаготерапии у иммунокомпрометированных пациентов доказана в зарубежных исследованиях [28].
Бактериофаги продемонстрировали эффективность при лечении инфекции, находящейся под биопленкой. Биопленка — плотная колония микроорганизмов на поверхности биологических или небиологических сред, окружающих себя секретируемым экстрацеллюлярным полимером, практически непроницаемым для антибиотиков. Способность бактерий образовывать биопленку — важнейшее условие их выживания на поверхности тканей или медицинских объектов (катетеры, имплантаты). свойства биопленок позволили выдвинуть идею о кооперированных микробных группах как аналогах многоклеточных организмов и социобиологических общностей [29]. Разрушение биопленки возможно при применении фагов [30]. В частности, обработка катетеров перед их постановкой коагулазонегативными фагами резко снижает вероятность образования биопленки Staphylococcus epidermidis [31].
Применение бактериофагов известно также при собственно кишечных инфекциях [32] и при сепсисе, вызванном кишечной инфекцией Ps. aeruginosa [33]. При этом в эксперименте прием бактериофага per os привел к 67% выживаемости в экспериментальной группе животных и к 0% в контрольной.
Особое внимание привлекает возможность бактериофаготерапии при внутренних и системных инфекциях. Большинство таких исследований принадлежит отечественным ученым. Показано, что совместное применение бактериофагов и антибиотиков в лечении детей с осложненной инфекцией мочевыводящих путей значительно эффективней, чем изолированная антибиотикотерапия [34].
[35] пролечено 36 детей в возрасте от 14 дней до 3 лет с тяжелыми заболеваниями бронхолегочной системы с наличием в мокроте синегнойной и кишечной палочек, клебсиеллы, энтерококка, стафилококка, которые, будучи нозокомиальной флорой, в большинстве случаев были нечувствительны к большинству известных антибиотиков. Путем ингаляций вводили моно- или поливалентные бактериофаги, пиобактериофаг. Курс антибактериальной терапии сократился с 13–17 до 8–11 дней. Элиминация возбудителя и уменьшение воспаления в трахеобронхиальном дереве подтверждались контрольным бактериологическим посевом и цитологическим исследованием мокроты: эффективность составила 88,8%. Использование поливалентных фагов явилось более оправданным по сравнению с монофагами на фоне элиминации основного бактериального агента в меньшей мере происходила параллельная контаминация другими, не менее вирулентными, микробами. Таким образом, применение небулайзеротерапии бактериофагами в комплексном лечении острых и хронических обструктивных бронхолегочных заболеваний, включая муковисцидоз, показало высокую клиническую эффективность, позволило сократить сроки лечения дорогостоящими антибиотиками широкого спектра, уменьшить риск развития кандидоза. В эксперименте на животных, моделирующем лечение муковисцидоза, введение бактериофага при тяжелой пневмонии, вызванной Ps. aeruginosa, сопровождалось резким повышением выживаемости в подопытной группе [36].
Есть много нерешенных проблем, которые сводятся к организации многоцентровых исследований по принципам доказательной медицины, соотношению антибиотиков и бактериофагов при лечении.
В любом случае можно утверждать, что это направление перспективно и достаточно обнадеживающе, особенно при инфицировании резистентными штаммами.
Разнообразие лекарственных форм бактериофагов (таблетки, гели, растворы) позволяет применять их как перорально, так и наносить на раневые поверхности, вводить в полости организма. Препараты бактериофагов широко применяются в педиатрии, акушерстве и гинекологии, офтальмологии Например, назначение по поводу кесарева сечения препарата Секстафаг®, предварительно адаптированного к флоре, циркулирующей в конкретном учреждении, приводило к снижению осложнений (18,7%) в большей степени (26,7%), чем в группе женщин, получавших антибиотикопрофилактику.
История изучения бактериофагов и анализ их применения в медицине позволяют с уверенностью сказать, что бактериофаги могут оказаться чрезвычайно востребованными в лечении самых разнообразных инфекционных заболеваний человека, особенно при антибиотикорезистентных возбудителях. Каждый препарат, тем более обладающий качествами живого и вводимый в организм человека, имеет свои положительные и вероятностные отрицательные эффекты. В частности, литический эффект фагов, приводящий к разрушению клеточной стенки микроба, сопровождается выбросом в кровь большого количества эндотоксинов, что приводит к эффекту септицемии. Обсуждается необходимость приема активированного угля или иных адсорбентов. Более перспективным направлением кажется генетическая инженерия фага, которая сохраняла бы свой , но фаг был бы . Такой фаг мог бы использоваться в клинической практике как эффективный антимикробный агент, лишенный побочных эффектов [37]. Кроме того, бактериофаги, как и любые другие вирусы, способны переносить гены вирулентности от одной бактерии к другой [38].
В настоящее время в большинстве публикаций указывается на безопасность фаготерапии; хорошо организованные двойные слепые рандомизированные контролируемые исследования позволят определить безопасность и эффективность фагов как альтернативы антибиотикам при инфекциях с полирезистентной флорой [39]. Дальнейшее изучение возможностей бактериофаготерапии будет зависеть от объективной заинтересованности медицинского сообщества, проведения многоцентровых независимых исследований, развития вирусологии с ее возможностями получения новых чистых препаратов фагов.
1 Сборник среднемосковских основных показателей деятельности учреждений Департамента здравоохранения г. Москвы за М., 2009. 87 с.
2 Выбор инфекционного агента для опытов не был случайным: отец был известным микробиологом, написавшим монографию о сибиреязвенной палочке, переведенную и на немецкий язык.
3 Департамент здравоохранения г. Москвы. Доклад о состоянии здоровья населения г. Москвы в 2008 г.
Только для зарегистрированных пользователей
Читайте также:
- Стафилококк мыть руки с мылом
- Схема патогенеза при сальмонеллезе
- Кому делали прививку от дизентерии при беременности
- Рифампицин при стафилококке отзывы
- Может ли стафилококк поражать печень
 Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Copyright © Иммунитет и инфекции





