Действие ципрофлоксацина на золотистый стафилококк
Антибактериальные препараты из группы фторхинолонов занимают одно из ведущих мест в лечении различных бактериальных инфекций, в том числе в амбулаторных условиях. Однако столь популярные в настоящее время ципрофлоксацин, офлоксацин, ломефлоксацин
Антибактериальные препараты из группы фторхинолонов занимают одно из ведущих мест в лечении различных бактериальных инфекций, в том числе в амбулаторных условиях. Однако столь популярные в настоящее время ципрофлоксацин, офлоксацин, ломефлоксацин, пефлоксацин обладают высокой активностью в отношении грамотрицательных возбудителей, умеренной активностью против атипичных возбудителей и малоактивны в отношении пневмококков и стрептококков, что значительно ограничивает их применение, особенно при респираторных инфекциях.
В последнее десятилетие в клиническую практику стали входить новые препараты из этой группы — т. наз. новые фторхинолоны, которые сохраняют высокую активность против грамотрицательных возбудителей, свойственную их предшественникам, и при этом значительно более активны против грамположительных и атипичных микроорганизмов. Одним из таких препаратов является левофлоксацин (таваник). По химической структуре он представляет собой левовращающий изомер офлоксацина. Широкий спектр антибактериальной активности, высокая безопасность, удобные фармакокинетические свойства обусловливают возможность его широкого применения при различных инфекциях.
Левофлоксацин обладает быстрым бактерицидным действием, поскольку проникает внутрь микробной клетки и подавляет, так же как и фторхинолоны первого поколения, ДНК-гиразу (топоизомеразу II) бактерий, что нарушает процесс образования бактериальной ДНК. Ферменты клеток человека не чувствительны к фторхинолонам, и последние не оказывают токсического действия на клетки макроорганизма. В отличие от препаратов прежнего поколения новые фторхинолоны ингибируют не только ДНК-гиразу, но и второй фермент, ответственный за синтез ДНК, — топоизомеразу IV, выделенную у некоторых микроорганизмов, прежде всего грамположительных. Считается, что именно воздействием на этот фермент объясняется высокая антипневмококковая и антистафилококковая активность новых фторхинолонов.
Левофлоксацин обладает клинически значимым дозозависимым постантибиотическим эффектом, достоверно более длительным по сравнению с ципрофлоксацином, а также длительным (2-3 часа) субингибирующим действием.
Под действием левофлоксацина отмечено повышение функции полиморфноядерных лимфоцитов у здоровых добровольцев и ВИЧ-инфицированных пациентов. Показано его иммуномодулирующее воздействие на тонзиллярные лимфоциты у больных хроническим тонзиллитом. Полученные данные позволяют говорить не только об антибактериальной активности, но и о синергическом противовоспалительном и антиаллергическом действии левофлоксацина.
Левофлоксацин характеризуется широким антимикробным спектром, включающим грамположительные и грамотрицательные микроорганизмы, в том числе внутриклеточные возбудители (табл. 1).
При сравнении эффективности различных антибактериальных препаратов в отношении возбудителей респираторных инфекций было выявлено, что левофлоксацин в отношении противомикробной активности превосходит остальные препараты. К нему оказались чувствительны все штаммы пневмококка, в том числе пенициллинрезистентные, при сравнительно более низкой чувствительности пневмококков к препаратам сравнения: офлоксацин — 92%, ципрофлоксацин — 82%, кларитромицин — 96%, азитромицин — 94%, амоксициллин/клавуланат — 96%, цефуроксим — 80%. К левофлоксацину оказались также чувствительны все штаммы моракселлы катаралис, гемофильной палочки и метициллин чувствительного золотистого стафилококка, 95% штаммов клебсиеллы пневмонии.
Возможность широкого клинического использования левофлоксацина и других новых фторхинолонов заставляет задуматься об опасности развития резистентности к ним. Хромосомные мутации являются основным механизмом, обеспечивающим устойчивость микробов к фторхинолонам. При этом происходит постепенное накопление мутаций в одном или двух генах и ступенчатое снижение чувствительности. Развитие клинически значимой резистентности пневмококков к левофлоксацину наблюдается после трех мутаций, а следовательно, представляется маловероятным. Это подтверждается и экспериментальными данными: левофлоксацин вызывал спонтанные мутации в 100 раз реже, чем ципрофлоксацин, независимо от чувствительности тестируемых штаммов пневмококка к пенициллину и макролидам. Широкое использование препарата в последние годы в США и Японии не привело к росту резистентности к нему. По данным K. Yamaguchi et al., 1999, чувствительность бактерий к левофлоксацину за пять лет, т. е. с момента начала его широкого применения, не изменилась и превышает 90% как для грамотрицательных, так и для грамположительных возбудителей.
Больший риск развития антибиотикорезистентности связан не с пневмококками, а с грамотрицательными бактериями. В то же время, по некоторым данным, применение левофлоксацина в отделениях интенсивной терапии не сопровождается значимым ростом резистентности грамотрицательной кишечной флоры.
Левофлоксацин хорошо всасывается в желудочно-кишечном тракте. Его биодоступность составляет 99% и более. Так как левофлоксацин почти не подвергается метаболизму в печени, это способствует быстрому достижению максимальной его концентрации в крови (значительно более высокой, чем у ципрофлоксацина). Так, при назначении добровольцам стандартной дозы фторхинолона значения его максимальной концентрации в крови при приеме левофлоксацина составляли 2,48 мкг/мл/70 кг, ципрофлоксацина — 1,2 мкг/мл/70 кг.
После приема разовой дозы левофлоксацина (500 мг) его максимальная концентрация в крови, равная 5,1 ± 0,8 мкг/мл, достигается через 1,3-1,6 часа, при этом бактерицидная активность крови против пневмококков сохраняется до 6,3 часа независимо от их чувствительности к пенициллинам и цефалоспоринам. Более длительное время, до 24 часов, сохраняется бактерицидное действие крови на грамотрицательные бактерии семейства Enterobacteriacae.
Период полувыведения левофлоксацина составляет 6-7,3 часа. Около 87% принятой дозы препарата выделяется с мочой в неизмененном виде в течение последующих 48 часов.
Левофлоксацин быстро проникает в ткани, при этом уровни тканевых концентраций препарата выше, чем в крови. Особенно высокие концентрации устанавливаются в тканях и жидкостях респираторного тракта: альвеолярных макрофагах, слизистой бронхов, бронхиальном секрете. Левофлоксацин также достигает высоких концентраций внутри клеток.
Длительный период полувыведения, достижение высоких тканевых и внутриклеточных концентраций, а также наличие постантибиотического действия — все это позволяет назначать левофлоксацин один раз в сутки.
Биодоступность левофлоксацина снижается при одновременном приеме с антацидами, сукральфатом, препаратами, содержащими соли железа. Интервал между приемом этих лекарственных средств и левофлоксацина должен составлять не менее 2 часов. Других клинически значимых взаимодействий левофлоксацина выявлено не было.
Существует много публикаций, посвященных результатам клинических исследований эффективности применения левофлоксацина. Ниже представлены наиболее значимых из них.
В многоцентровом рандомизированном исследовании, включившем 590 пациентов, сравнивалась эффективность и безопасность двух режимов лечения: левофлоксацина в/в и/или перорально в дозе 500 мг в сутки и цефтриаксона в/в 2,0 г в сутки; и/или цефуроксима перорально 500 мг два раза в сутки в комбинации с эритромицином или доксициклином у больных с внебольничной пневмонией. Длительность терапии 7–14 дней. Клиническая эффективность составила 96% в группе левофлоксацина и 90% в группе, получавшей цефалоспорины. Эрадикация возбудителей была достигнута соответственно у 98 и 85% больных. Частота нежелательных действий в группе левофлоксацина составляла 5,8%, а в группе сравнения 8,5%.
В другом большом рандомизированном исследовании сравнивалась эффективность лечения больных с тяжелой пневмонией левофлоксацином 1000 мг в сутки и цефтриаксоном — 4 г в сутки. Первые дни левофлоксацин назначили в/в, затем перорально. Результаты лечения в обеих группах оказались сопоставимы, но в группе цефтриаксона наблюдалась достоверно более частая смена антибиотика в первые дни лечения — из-за недостаточного клинического эффекта.
Сопоставимые результаты были получены и при сравнении групп пациентов, получавших лечение левофлоксацином и коамоксиклавом.
Эффективность монотерапии левофлоксацином изучалась у более чем 1000 пациентов с внебольничной пневмонией. Клиническая и бактериологическая эффективность составляли здесь 94 и 96% соответственно.
Фармакоэкономические исследования показали, что общие затраты на лечение пациентов левофлоксацином и комбинацией цефалоспорина и макролида сопоставимы или даже несколько ниже в группе левофлоксацина.
У пациентов с обострением хронического бронхита сравнивалась эффективность лечения левофлоксацином в дозе 500 мг в сутки перорально и цефуроксимом аксетила внутрь 500 мг два раза в сутки. При этом клиническая и бактериологическая эффективность не различалась в зависимости от групп и составляла 77–97%.
Таким образом, в настоящее время можно считать доказанной высокую эффективность левофлоксацина при респираторных инфекциях нижних дыхательных путей. Результаты проведенных исследований позволили включить левофлоксацин как препарат первого ряда или альтернативный в схему лечения пациентов с внебольничной пневмонией и обострениями хронического бронхита (табл. 2).
В последние годы левофлоксацин стал более широко использоваться и при других инфекционных заболеваниях. Так, появились сообщения, касающиеся его успешного применения у больных с острыми синуситами. Левофлоксацин в 100% случаев активен против наиболее часто встречающихся бактериальных возбудителей этого заболевания; по эффективности он сопоставим с амоксициллином/клавуланатом в больших дозах и значительно превосходит цефалоспорины, котримоксазол, макролиды и доксициклин.
Среди возбудителей урологических инфекций наблюдается рост резистентности к широко используемым антибактериальным препаратам. Так, за период с 1992 по 1996 год отмечено увеличение устойчивости E. Coli и S. saprophyticus к котримоксазолу — на 8–16% и к ампициллину — на 20%. Устойчивость к ципрофлоксацину, нитрофуранам и гентамицину возрасла за этот же период на 2%. Применение левофлоксацина у пациентов с осложненными мочевыми инфекциями в дозе 250 мг в сутки оказалось эффективным у 86,7% пациентов.
Выше приводились фармакокинетические показатели высокого содержания левофлоксацина в тканях. Это наряду с антимикробным спектром препарата послужило основанием для его использования с целью профилактики инфекционных осложнений при эндоскопических методах лечения и диагностики, например при ретроградной холангиопанкреатографии и для периоперационной профилактики в ортопедии.
Применение левофлоксацина в этих ситуациях представляется перспективным и требует дальнейшего изучения.
Левофлоксацин считается одним из самых безопасных антибактериальных препаратов. Однако при его назначении существует ряд ограничений.
У пациентов с нарушением функции печени корригировать дозу препарата не нужно, но нарушение функции почек при снижении клиренса креатинина (менее 50 мл/мин) требует уменьшения дозы препарата. Дополнительный прием левофлоксацина после проведения гемодиализа или амбулаторного перитониального диализа не требуется.
Левофлоксацин не применяется у беременных и кормящих женщин, у детей и подростков. Препарат противопоказан пациентам, у которых в анамнезе имеются нежелательные реакции на лечение фторхинолонами.
У больных пожилого и старческого возраста при приеме левофлоксацина не выявлено повышенного риска развития нежелательных побочных реакций и не требуется коррекции доз.
Контролируемые клинические исследования показали, что побочные реакции при применении левофлоксацина возникают редко и большей частью не являются серьезными. Существует зависимость между дозой препарата и частотой развития НД: при суточной дозе 250 мг их частота не превышает 4,0–4,3%, при дозе 500 мг/ сут. — 5,3–26,9%, при дозе 1000 мг/сут. — 22–28,8%. Наиболее часто наблюдались симптомы желудочно-кишечной диспепсии — тошнота и диарея (1,1–2,8%). При внутривенном введении возможно покраснение места инъекции, иногда наблюдается развитие флебитов (1%).
Левофлоксацин выпускается в двух формах: для внутривенного введения и приема внутрь. Применяется по 250-500 мг один раз в сутки, при тяжелых инфекциях возможно назначение по 500 мг два раза в сутки. При внебольничной пневмонии длительность лечения составляет 10-14 дней, при обострении хронического бронхита — 5-7 дней.
- S. pneumoniae
- Стрептококки
- Стафилококки
- Хламидии
- Микоплазма
- Легионелла
- H. parainfluenzae
- M. catarrhalis
- K. pneumoniae
- B. pertussis
- Иерсинии
- Сальмонеллы
- Citrobacter spp.
- E. coli
- Enterobacter spp., Acinetobacter spp.
- P. mirabilis, vulgaris
- Neisseria spp.
- C. perfringens
- B. urealyticus
- Энтерококки
- Листерии
- Peptococcus
- Peptostreptococcus
- S. spp.
- S. marcescens
- H. influenzae
- P. aeruginosa
- C. difficile
- Pseudomonas spp.
- Фузобактерии
- Грибы
- Вирусы
- M. morgani
Кафедра клинической фармакологии Российского государственного медицинского университета, Отделение медицинской генетики Республиканской детской клинической больницы, Москва
Бактериологическая эффективность оказалась ниже клинической. У 12 больных флора не изменилась, у 5 детей отмечалось временное исчезновение из мокроты P.aeruginosa с последующим возобновлением ее роста, а у 1 ребенка синегнойная палочка сменилась золотистым стафилококком. У 3 из 5 больных с ассоциацией возбудителей удалось добиться эрадикации синегнойной палочки с сохранением стафилококка, а у 2 отмечалось исчезновение золотистого стафилококка с сохранением псевдомонады. Появление резистентных к ЦФЛ штаммов золотистого стафилококка на фоне повторных курсов ЦФЛ отмечено у 4 детей, а резистентных штаммов синегнойной палочки - у 3-х. В процессе лечения ЦФЛ у 9 больных отмечались характерные для этого антибиотика побочные эффекты в виде диспептических явлений (снижение аппетита, боли в животе, диарея), транзиторного повышения аминотрансфераз и щелочной фосфатазы, головной боли, фотодерматоза, артралгии и всего 1 случай острой артропатии (препарат пришлось отменить). Отмена препарата потребовалась у 3-х больных с выраженной диареей или головной болью. Ввиду редкой встречаемости приводим наше наблюдение хинолоновой артропатии.
Больная Ш. 16 лет со смешанной формой муковисцидоза, гомозигота по DF-508, хронический носитель синегнойной палочки. В январе 1998 г. после 5-летнего перерыва ЦФЛ в дозе 500 мг x2 раза был применен с профилактической целью. На 5-й день антибиотикотерапии появились боли и припухлость голеностопных суставов. Жалобы были расценены как проявление инфекционно-аллергического артрита . В связи с чем назначен индометацин (ЦФЛ при этом отменен), после чего симптоматика полностью разрешилась через 5-6 дней. Однако в сентябре того же года ЦФЛ был назначен вновь и через 2-3 дня появились жалобы, аналогичные прежним - боль и припухлость голеностопных суставов. Вместе с тем были и отличия в клинических проявлениях: боли носили настолько выраженный характер, что девочка не могла ходить, а артрологическая симптоматика сохранялась около 3 недель после отмены ЦФЛ. Последнее отчасти объяснялось тем, что назначенный в связи с артритом диклофенак натрия (вольтарен) был вскоре отменен из-за возникшего легочного кровотечения. Больная осмотрена через 10 месяцев после второго эпизода хинолоновой артропатии: область суставов не изменена, движения в них в полном объеме, рост 166 см. Медикаментозное происхождение артропатии подтверждается в данном случае возвратом симптоматики после повторного назначения препарата, а доброкачественный характер хинолоновой артропатии - ее полным обратным развитием и, следовательно, мы имеем дело не с повреждением хряща, а с реакцией синовиальной оболочки (острая синовиопатия).
Известно, что линейный рост определяется состоянием не суставного хряща, а эпифизарной пластинки. Как видно из таблицы, долговременный рост детей, получавших ЦФЛ (в отдельных случаях в совокупности более года), не отличался от среднерасчетного и, следовательно, этот монофторхинолон не оказывает повреждающего действия на хрящ ростковой зоны. Дети, больные муковисцидозом, если и растут плохо, то вследствие гипоксии, остеопении, снижения физической активности, неадекватного лечения ферментными препаратами или получения глюкокортикостероидов.
| Таблица. Годовая скорость роста на протяжении 5 лет у больных муковисцидозом детей, получавших ципрофлоксацин | |||||
| Число пациентов | Возраст, годы | Средняя общая продолжительность лечения, дни | Доза ципрофлоксацина, мг/кг | Скорость роста за год у больных муковисцидозом, см | Скорость роста среднерасчетная |
| 6 | 2-8 | 159 (91-247) | 20-30 | 6,7 (3,8-8,8) | 7 |
| 16 | 9-15 | 180 (28-455) | 20-50 | 5,2 (1-8,7) | 5 |
Таким образом, как однократное, так и многократное повторное применение ЦФЛ у детей с муковисцидозом разного возраста (в том числе и грудного), не оказывает губительного эффекта на хрящевую ткань сустава и ростковой зоны. Этому клинико-экспериментальному расхождению есть, по крайней мере, 3 объяснения. Во-первых, у животных хондротоксический эффект развивался при использовании ЦФЛ в дозе 100-150 мг/кг, у детей же она не превышает 50 мг/кг. Во-вторых, имеются видовые и генетические различия коллагена у человека и животных [6] и, следовательно, должны быть межвидовые и межиндивидуальные различия в чувствительности к ФХ. В-третьих, существует разнохарактерность роста и развития животных и человека, что относится прежде всего к темпам и направленности роста. Это различие становится особенно заметным, когда сравниваются периоды от рождения до наступления зрелости у человека и животных. У собак это примерно 1 год, а у человека - 18 лет. Следовательно, 1 день роста (и лечения фторхинолонами) у щенков примерно соответствует 18 дням у детей [7]. К тому же рост скелета человека не просто растянут во времени, он неравномерен - с чередованием периодов интенсивного роста и относительно спокойного развития, т.е. кривая роста имеет не линейный, а синусоидальный (фазовый) характер. При этом наибольшая энергия роста отмечается в период внутриутробного развития и на первом году жизни, а также в период пубертатного скачка. В меньшей степени активизация роста наблюдается в возрасте 5-7 лет. Примерно у половины детей в препубертатном возрасте отмечаются сезонные колебания роста. Другой биологической закономерностью является чередование направлений роста: антенатально - церебральный тип роста, постнатально - рост прежде всего дистальных отделов (верхняя часть лица, нижние конечности), за исключением пубертата, когда наиболее интенсивно растет туловище (позвоночник). Следует добавить, что позвоночник человека (в отличие от позвоночника животных) является опорным суставным органом и, следовательно, должен поражаться фторхинолонами наравне с другими опорными суставами, но в клинике этого не наблюдается.
Таким образом, использование меньших, чем в эксперименте, доз ЦФЛ, разнородность состава и характера роста костно-хрящевой ткани человека и экспериментальных животных могут объяснить различие в частоте и тяжести артротоксического действия ФХ. Обсуждая эффективность ЦФЛ, правомерен вопрос - как выделить его собственную роль в применяемых комбинациях с аминогликозидами (АМГ) и цефалоспоринами (ЦФС). В принципе этот вклад известен, хотя его и нельзя подсчитать в % [8].
ЦФЛ, с одной стороны, повышает чувствительность бактерий к действию нейтрофилов, а с другой стороны, активирует нейтрофилы (например, повышает в них уровень внутриклеточного супероксида) и делает их более способными к фагоцитозу и бактериолитической активности. Происходит это вследствие того, что ЦФЛ накапливается в макро- и микрофагах в концентрациях в 15-20 раз больших, чем во внеклеточной среде. В то же время у гентамицина отношение клеточной концентрации к внеклеточной составляет (в зависимости от возраста) всего 0,72-0,84, а у ЦФС (цефотаксим) еще меньше - 0,61. Следует также отметить, что АМГ плохо проникают в дыхательные пути.
Очень важной особенностью ЦФЛ является и то, что даже в субингибиторных концентрациях он тормозит адгезию кишечной палочки, стрептококка, стафилококка к эпителиальным клеткам, уменьшая тем самым их способность к колонизации, а также ингибирует (in vivo и in vitro) экспрессию факторов патогенности синегнойной палочки (экзотоксин типа А, эластаза, щелочная протеаза), снижая тем самым ее агрессивность (вирулентнсть), при этом отмечается также замедление бактериального роста.
Кроме того, ЦФЛ действует на бактериальную клетку как в фазе активности, так и в фазе покоя, что дает возможность использовать его именно при хронических гнойных инфекциях, вызываемых "медленными (в метаболическом отношении) бактериями". Все названные качества отличают ЦФЛ от АМГ и ЦФС. Известно также, что в присутствии терапевтических экстрацеллюлярных концентраций АМГ (например, амикацина) достигаются более высокие внутриклеточные концентрации ЦФЛ.
Феномен накопления ЦФЛ клетками противомикробной защиты важен по крайней мере по трем следующим обстоятельствам.
1. Существуют микроорганизмы с облигатным (например, хламидии , микоплазма , легионелла ) и факультативным (например, золотистый стафилококк, синегнойная палочка) внутриклеточным расположением и, следовательно, не доступны для большинства антибиотиков.
2. У детей вероятность внутриклеточного персистирования, по-видимому, выше, чем у взрослых. Это может быть, в частности, связано с особенностями системы фагоцитоза в раннем онтогенезе. Так, полиморфноядерные лейкоциты (ПЯЛ) новорожденных уничтожают захваченные бактерии (стафилококк, стрептококк) менее полно, чем ПЯЛ взрослых. Легче происходит сбой и в лизосомном переваривании захваченных бактерий, например, при парентеральном введении жировых эмульсий.
3. Нейтрофилы, накопливая ЦФЛ, играют роль "повозки", доставляющей этот антибиотик "в очаг воспаления", в результате чего максимальные концентрации в бронхиальном секрете и легочной ткани в 2-4 раза превышают сывороточные.
Таким образом, собственный вклад ЦФЛ при комбинированной терапии выделяем и доказуем, и в сочетании с АМГ и ЦФС он играет роль не второго "пристяжного" антибиотика, а роль ведущую и поэтому успехом или неудачей в лечении мы обязаны в первую очередь ЦФЛ.
2.Артротоксический эффект ципрофлоксацина единичен и так же преходящ, как и другие его побочные эффекты. Он возникает по типу острой артропатии (синовиопатии) вследствие индивидуальной гиперчувствительности к препарату.
3.Годовая скорость роста детей с муковисцидозом, получавших на протяжении 5 лет до 35 курсов ЦФЛ, сохраняется на уровне среднерасчетной и, следовательно, этот ФХ не оказывает повреждающего действия (острого или отсроченного) на ростковую зону хряща даже в наиболее критические периоды развития ребенка (грудной и пубертатный возраст).
4.По общему числу и характеру побочных эффектов, в том числе благоприятности течения артропатии, ЦФЛ можно считать вполне безопасным препаратам, годным к применению у детей.
АНТИБИОТИКИ И ХИМИОТЕРАПИЯ, 2000-N4, стр. 14-17.
2. Смирнова Е.Ю. Опыт применения ципрофлоксацина у детей, больных муковисцидозом. Антибиотики и химиотер 1993; 38: 2-3: 42-43.
3. Капранов Н.И. Применение ципрофлоксацина у детей, больных муковисцидозом. Там же 1997; 42: 6: 39-41.
4. Капранов Н.И., Шабалова А.А. Применение ципрофлоксацина у детей при лечении тяжелых инфекций. М 1999;45.
5. Мазурин А.В. Пропедевтика детских болезней 1985; 33.
6. Павлова В.Н. Кн. Хрящ. 1988.
7. Schaad U.B. Use of the quinolones in pediatrics. In: The quinolones 1988; 351-367.
8. Падейская Е.Н., Яковлев В.П. Антимикробные препараты группы фторхинолонов в клинической практике 1998.
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.

Читайте в новом номере
Работа посвящена вопросам эффективности лечения хронического синусита. Раскрыты основные принципы и приоритеты в выборе антибактериальной терапии на основе собственного исследования авторов.
Цель исследования: повысить эффективность лечения полипозного синусита с учетом влияния персистирующей стафилококковой инфекции на возникновение и течение этого заболевания.
Материал и методы: на основе клинико-лабораторных, иммунологических и аллергологических показателей у 105 пациентов с хроническим полипозным риносинуситом выполнен сравнительный анализ различных схем лечения полипозного синусита (топический стероид и антигистаминный препарат; топический стероид, антигистаминный препарат и антибактериальный препарат, курсом раз в полгода).
Результаты и обсуждение: распространенность среди пациентов с полипозным синуситом персистирующей стафилококковой инфекции составляет 71%, частота встречаемости пациентов, сенсибилизированных к антигенам Staphylococcus aureus, – 55,2%. Установлено, что полипозный синусит, ассоциированный с носительством золотистого стафилококка, сопровождается в 1,5 раза более тяжелым клиническим течением. Эта закономерность объясняется более выраженным эозинофильным воспалением при полипозном синусите, ассоциированном с колонизацией Staph. аureus. Сенсибилизация к Staph. аureus также приводит к увеличению выраженности эозинофильного воспаления при полипозном синусите по сравнению с несенсибилизированными пациентами. Присоединение антибиотика к схеме лечения больных с полипозным синуситом значительно улучшает течение заболевания и в 1,5 раза снижает выраженность эозинофильного воспаления у всех пациентов с полипозным синуситом, и в 2 раза − у носителей и больных, сенсибилизированных к антигенам Staph. аureus.
Заключение: больные полипозным синуситом, сенсибилизированные к антигенам Staph. aureus, более резистентны к стандартной противорецидивной терапии топическими стероидами и антигистаминными препаратами, чем несенсибилизированные пациенты, и требуют проведения бактериологического мониторинга и периодической антибактериальной терапии.
Ключевые слова: полипозный синусит, антибактериальная терапия, золотистый стафилококк, сенсибилизация к золотистому стафилококку, рецидив полипозного синусита, левофлоксацин, хронический синусит, эозинофильное воспаление, антигены стафилококка, лечение полипозного синусита.
Для цитирования: Кунельская Н.Л., Туровский А.Б., Колбанова И.Г., Попова И.А. Антибактериальная терапия хронического синусита. РМЖ. 2016;21:1411-1416.
Antibacterial treatment for chronic sinusitis
Kunel'skaya N.L., Turovskiy A.B., Kolbanova I.G., Popova I.A.
L.I. Sverzhevskiy Scientific Research Institute for Ear, Nose, and Throat Diseases, Moscow
The paper discusses treatment efficacy of chronic sinusitis and uncovers major principles and priorities in antibacterial therapy choice based on authors’ study.
Aim: to improve treatment efficacy of sinusitis with nasal polyps with respect to the effect of persistent Staphylococcus infection on the development and course of the disease.
Patients and methods: the study included 105 patients with chronic sinusitis and nasal polyps who underwent clinical examination and laboratory, immunological, and allergy tests. Comparative analysis of different treatment regimens (topical steroid plus antihistamine or topical steroid plus antihistamine plus antibacterial agent every 6 months) was performed.
Results: the prevalence of persistent Staphylococcus infection among the patients with nasal polyps was 71%. The occurrence of sensitization to Staph. aureus antigens wass 55.2%. It was demonstrated that clinical course of nasal polyps associated with Staph. aureus carriage is more severe due to the eosinophilic inflammation as a result of Staph. аureus colonization. Moreover, sensitization to Staph. aureus antigens enhances eosinophilic inflammation in nasal polyps as compared with non-sensitized persons. Additional antibacterial agent significantly improves disease course and reduces eosinophilic inflammation severity by 1.5-times in all patients with nasal polyps and twice in carriers and persons sensitized to Staph. аureus antigens.
Conclusions: patients with nasal polyps sensitized to Staph. aureus antigens are more resistant to standard treatment with topical steroids and antihistamines than non-sensitized patients thus requiring bacteriological monitoring and periodic antibacterial therapy.
Key words: nasal polyps, antibacterial therapy, Staphylococcus aureus, sensitization to Staphylococcus aureus, recurrence of nasal polyps, levofloxacin, chronic sinusitis, eosinophilic inflammation, Staphylococcus antigens, treatment of nasal polyps.
For citation: Kunel'skaya N.L., Turovskiy A.B., Kolbanova I.G., Popova I.A. Antibacterial treatment for chronic sinusitis // RMJ. 2016. № 21. P. 1411–1416.
В статье изложено антибактериальная терапия хронического синусита

Современное понимание патогенетических основ развития хронического риносинусита (ХРС) позволяет на сегодняшний день отнести эту патологию к гетерогенной группе заболеваний носа и околоносовых пазух, которые характеризуются воспалением и ремоделированием тканей.
В соответствии с европейской классификацией ХРС подразделяется на хронический риносинусит с полипами и хронический риносинусит без полипов [1]. Диагноз ХРС устанавливается при наличии по крайней мере 2-х симптомов из следующих: заложенность носа, носовая секреция и/или постназальный синдром, головные и/или лицевые боли, снижение обоняния в течение более чем 12 нед. за последний год. Согласно последним данным, различные формы ХРС отличаются также процессом ремоделирования верхних дыхательных путей. Гистологически ХРС без полипов характеризуется фиброзом слизистой оболочки и базальной мембраны, в то время как полипозный риносинусит (ПРС) сопровождается выраженным отеком с отложением альбумина и развитием псевдокист.
Процесс ремоделирования слизистой оболочки полости носа и околоносовых пазух при хроническом воспалении создает условия для ослабления защитных механизмов и в большинстве случаев делает ее более восприимчивой к воздействию различных видов микроорганизмов [2].
При хронических синуситах микробная флора отличается большим разнообразием и спектр возбудителей несколько смещается в пользу анаэробной флоры. Так, по данным ряда авторов, в 52% случаев выделяются аэробы (различные стрептококки – 21%, гемофильная палочка – 16%, синегнойная палочка – 15%, золотистый стафилококк и моракселла − по 10%). Анаэробным возбудителям принадлежит 48% случаев (Prevotella – 31%, анаэробные стрептококки – 22%, Fusobacterium − 15% и др.). Выделение энтеробактерий при синуситах может быть объяснено кишечным дисбактериозом, который рассматривается в настоящее время как побочное действие антибиотикотерапии. По причине дефицита бифидобактерий и молочнокислых бактерий происходит беспрепятственное заселение условно-патогенной микрофлорой не только кишечника, но и других сообщающихся с внешней средой полостей организма. Этим же обстоятельством объясняется выявление грибов рода Candida [3].
Т.Н. Леонтьева и соавт. (1988) при обследовании 200 больных ПРС выявили стафилококковую обсемененность слизистой оболочки полости носа у 70,7% больных ПРС и у 81,5% больных полипозно-гнойным риносинуситом (ПГРС). При ПРС выявлялись в основном условно-патогенные штаммы. В 13,7% определялась стрептококковая флора, представленная в большей степени зеленящим стрептококком и встречающаяся одинаково часто как при ПРС, так и при ПГРС. E. сoli высевалась из отделяемого полости носа в 10,5% случаев. По результатам исследования авторы приходят к выводу, что S. aureus способствует более тяжелому течению заболевания с частыми рецидивами. Флора околоносовых пазух (ОНП) как сапрофитирующая, так и патогенная крайне разнообразна, причем микробный пейзаж варьирует в зависимости от тяжести и продолжительности заболевания.
Для возникновения инфекционного процесса ведущее значение, наряду с вирулентностью возбудителя, имеет состояние макроорганизма. Оно определяется сложным комплексом факторов и механизмов, тесно связанных между собой, а также чувствительностью и резистентностью к инфекции. Наиболее значимыми факторами являются неблагоприятный аллергический фон, частые полипотомии полости носа, нерациональное назначение антибактериальных препаратов, как в виде местной терапии, так и в виде общей антибиотикотерапии.
Особое внимание в последнее время уделяется способности микроорганизмов собираться в сообщества, т. е. формировать биопленки. Доказано, что биопленки оказывают серьезное влияние на свойства и потенциальные возможности образующих их патогенов. В первую очередь речь идет о защитном матриксе, своеобразной среде внутри микроколоний, способности микроорганизмов к элементарным видам взаимодействия между собой. В биопленке бактерия способна продуцировать такие факторы устойчивости, которые не продуцируют планктонные микроорганизмы, не говоря о лабораторных штаммах, а матрикс, окружающий микроколонии, служит защитным барьером, благодаря которому бактерии в биопленке более устойчивы к внешнесредовым влияниям и действию защитных факторов организма. Биопленкообразование широко изучено на золотистом стафилококке. Продемонстрировано, что S. aureus может не только обсеменять слизистую полости носа, но и формировать биопленку на слизистой оболочке, в особенности у пациентов с полипами.
Недавние исследования были посвящены изучению роли биопленок в персистенции S. aureus: биопленки выступают в качестве резервуара для микроорганизмов и позволяют им быстро внедряться в слизистую оболочку [4]. Используя флуоресцентную гибридизацию in situ пептидно-нуклеиновых кислот, было продемонстрировано наличие внутриклеточно расположенного S. aureus в ткани полипов от пациентов с аспирин-индуцированными заболеваниями дыхательной системы [5]. Также было выявлено, что данный микроорганизм располагается интраэпителиально в слизистой полипов, но не присутствует в назальном эпителии пациентов с хроническим риносинуситом без полипоза и у здоровых добровольцев. S. aureus не только выживает, но и размножается внутри эпителиальных клеток назальных полипов [6]. Данные исследований подчеркивают способность S. aureus к персистенции в условиях нарушенного механизма защиты слизистой оболочки. Как известно, Th2 сдвиг воспалительной реакции поддерживает программирование так называемых М2 макрофагов в ткани полипов, у которых, как было показано, снижена способность к фагоцитированию и внутриклеточному лизису S. aureus [7].
Кроме того, предполагается, что S. aureus высвобождает энтеротоксин в ткань полипа лишь в небольшом количестве, что приводит к постоянной стимуляции местной иммунной системы и изменению как врожденного [6], так и адаптивного иммунитета [8]. Все это позволяет бактерии в течение длительного времени выживать в пораженных дыхательных путях. Нами было проведено собственное исследованиею
Цель исследования: повысить эффективность лечения ПРС с учетом изученного влияния персистирующей стафилококковой инфекции на возникновение и течение этого заболевания.
В результате проведенного исследования выявлена высокая распространенность среди пациентов ПРС персистирующей стафилококковой инфекции, которая составляет 71%, и высокая частота встречаемости пациентов, сенсибилизированных к антигенам Staph. aureus, – 55,2%. Установлено, что ПРС, ассоциированный с носительством золотистого стафилококка, сопровождается в 1,5 раза более тяжелым клиническим течением, нежели ПРС без носительства (6±0,64 балла и 4±0,84 соответственно) и большей частотой обострений гнойного воспаления ОНП за год (2,7±0,79 и 1,8±0,67 соответственно).
Описанная закономерность объективно объясняется более выраженным эозинофильным воспалением при ПРС, ассоциированным с колонизацией Staph. аureus, чем при ПРС, ассоциированным с инфицированием прочими микроорганизмами (Str. pneumoniae, Str. viridans, Staph. epidermidis, E. coli, K. pneumoniae, H. influenzae, P. аeruginosa), что выражается повышенным количеством эозинофилов в крови (7,98±2,86 и 5,98±3,20 соответственно), в мазках со слизистой оболочки полости носа (13,3±6,20 и 7,87±5,22 соответственно) и средним уровнем эозинофильного катионного протеина (17,5±5,10 и 11,3±6,07 мкг/мл соответственно). Сенсибилизация к Staph. аureus также приводит к увеличению выраженности эозинофильного воспаления при полипозном синусите по сравнению с несенсибилизированными пациентами: повышение количества эозинофилов в крови (8,26±2,97 и 4,32±1,59 соответственно), в мазках со слизистой оболочки полости носа (13,3±5,54 и 4,8±3,89 соответственно) и повышение среднего уровня эозинофильного катионного протеина (17,6±4,66 и 8,0±6,64 мкг/мл соответственно).
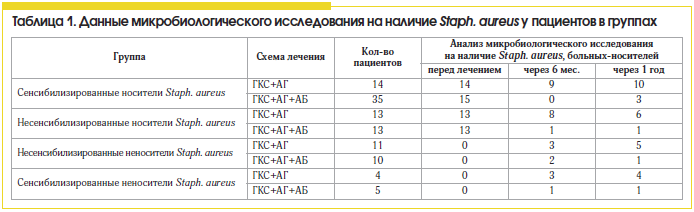
В группах, получавших лечение без антибиотика, положительная эрадикация микрофлоры была достигнута только в 28,5% у сенсибилизированных носителей и в 54% случаев – у несенсибилизированных носителей, что можно расценивать как спонтанную эрадикацию возбудителя на фоне нормализации носового дыхания и аэрации в ОНП, при условии отсутствия сенсибилизации (табл. 1). Обращает на себя внимание тот факт, что у всех пациентов, сенсибилизированных к стафилококку, не получавших антибактериальную терапию и не являвшихся носителями, через год был выявлен рост микрооганизма в значимой концентрации (>104). Это свидетельствует о необходимости проведения бактериологического мониторинга у всех сенсибилизированных к стафилококку пациентов.
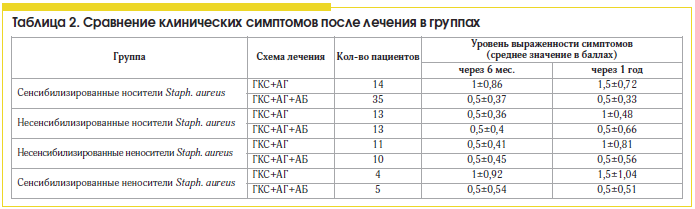
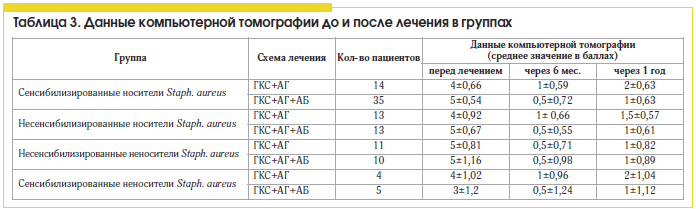
Сравнивая различные схемы лечения ПРС, мы установили, что больные полипозным синуситом, сенсибилизированные к антигенам Staph. aureus, более резистентны к стандартной противорецидивной терапии (табл. 2 и 3) топическими стероидами и антигистаминными препаратами, чем несенсибилизированные пациенты, и требуют проведения антибактериальной терапии.
Как известно, выбор антибиотика зависит от определенных факторов: срока последнего обострения (менее 6 мес.); результатов микробиологического исследования; тяжести течения заболевания; наличия осложнений. Все пациенты с хроническим синуситом в несколько раз чаще применяют антибактериальные препараты, что значительно повышает риск встречи с резистентной флорой. Уже этот фактор служит показанием к назначению антибиотиков, резистентность к которым минимальна.
В этом аспекте понятен повышенный интерес оториноларингологов к респираторным фторхинолонам, в частности к левофлоксацину – высокоэффективному в отношении респираторной флоры, с практическим отсутствием резистентных штаммов в России, который, к тому же в терапевтических концентрациях способствует ингибированию синтеза биопленки.
В нашем исследовании применение антибиотиков в составе комплексной терапии ПРС, ассоциированного с персистирующей стафилококковой инфекцией, приводит к статистически достоверному (в 2 раза) уменьшению выраженности эозинофильного воспаления и улучшению клинических показателей заболевания (клинических симптомов, картины компьютерной томографии околоносовых пазух) и снижению частоты гнойных осложнений по сравнению со стандартной противорецидивной терапией.
Фторхинолоны − это полностью синтетические препараты, которые не имеют природного аналога. Одной из последних разработок препаратов данной группы является левофлоксацин. Левофлоксацин обладает быстрым бактерицидным действием, поскольку проникает внутрь микробной клетки и подавляет, так же как и фторхинолоны первого поколения, ДНК-гиразу (топоизомеразу II) бактерий, что нарушает процесс образования бактериальной ДНК. Ферменты клеток человека не чувствительны к фторхинолонам, и последние не оказывают токсического действия на клетки макроорганизма. В отличие от препаратов прежнего поколения новые фторхинолоны ингибируют не только ДНК-гиразу, но и второй фермент, ответственный за синтез ДНК, − топоизомеразу IV, выделенную у некоторых микроорганизмов, прежде всего грамположительных. Считается, что именно воздействием на этот фермент объясняется высокая антипневмококковая и антистафилококковая активность новых фторхинолонов.
Левофлоксацин обладает клинически значимым дозозависимым постантибиотическим эффектом, достоверно более длительным по сравнению с ципрофлоксацином, а также длительным (2−3 ч) субингибирующим действием [9].
Под действием левофлоксацина отмечено повышение функции полиморфноядерных лимфоцитов у здоровых добровольцев и ВИЧ-инфицированных пациентов. Показано его иммуномодулирующее воздействие на тонзиллярные лимфоциты у больных хроническим тонзиллитом. Полученные данные позволяют говорить не только об антибактериальной активности, но и о синергическом противовоспалительном и антиаллергическом действии левофлоксацина. Левофлоксацин характеризуется широким антимикробным спектром, включающим грамположительные и грамотрицательные микроорганизмы, в т. ч. внутриклеточные возбудители [10]. При сравнении эффективности различных антибактериальных препаратов в отношении возбудителей респираторных инфекций было выявлено, что по противомикробной активности левофлоксацин превосходит остальные препараты. К нему оказались чувствительны все штаммы пневмококка, в т. ч. пенициллин-резистентные, при сравнительно более низкой чувствительности пневмококков к препаратам сравнения: офлоксацин − 92%, ципрофлоксацин − 82%, кларитромицин − 96%, азитромицин − 94%, амоксициллин/клавуланат − 96%, цефуроксим − 80%. К левофлоксацину оказались также чувствительны все штаммы моракселлы катаралис, гемофильной палочки и метициллин-чувствительного золотистого стафилококка, 95% штаммов клебсиеллы пневмонии [11]. Важным преимуществом левофлоксацина, наряду с хорошей переносимостью, является возможность однократного приема в течение суток.
Перечисленные характеристики препарата обусловливают чрезвычайно важное в практическом отношении свойство левофлоксацина – высокую комплаентность. Сокращение кратности приема и длительности лечения играют ключевую роль в формировании лучшей приверженности протоколам антибиотикотерапии.
Таким образом, левофлоксацин высокоактивен относительно основных возбудителей бактериального синусита. Как показали исследования, чувствительность пневмококка, гемофильной палочки, моракселлы к левофлоксацину превышает 99%. Отмечается также низкий уровень устойчивости золотистого стафилококка (его метициллин-резистентных штаммов) и других возбудителей синусита.
Читайте также:


