Чувствительность стафилококков к антимикробным препаратам
Решедько Галина Константиновна,
к.м.н., ассистент кафедры клинической фармакологии
Смоленской государственной медицинской академии
214019, г.Смоленск, ул.Крупской, 28, а/я № 5.
Тел.: +7(0812) 61 13 01, 61 13 27, Факс: (0812) 61 12 94,
E-Mail: galina@antibiotic.ru
В лекции рассмотрены основные методы определения чувствительности in vitro микроорганизмов к антимикробным препаратам (диско-диффузионный, Е-тестов, методы разведения). Отражены подходы к эмпирическому и этиотропному назначению антибиотиков в клинической практике. Обсуждены вопросы интерпретации результатов определения чувствительности с клинической и микробиологической точек зрения.
В настоящее время в клинической практике существуют два принципа назначения антибактериальных препаратов: эмпирическое и этиотропное. Эмпирическое назначение антибиотиков основано на знаниях о природной чувствительности бактерий, эпидемиологических данных о резистентности микроорганизмов в регионе или стационаре, а также результатах контролируемых клинических исследований. Несомненным преимуществом эмпирического назначения химиопрепаратов является возможность быстрого начала терапии. Кроме того, при таком подходе исключаются затраты на проведение дополнительных исследований.
|
Однако при неэффективности проводимой антибактериальной терапии, при нозокомиальных инфекциях, когда затруднительно предположить возбудителя и его чувствительность к антибиотикам стремятся проводить этиотропную терапию. Этиотропное назначение антибиотиков предполагает не только выделение возбудителя инфекции из клинического материала, но и определение его чувствительности к антибиотикам. Получение корректных данных возможно только при грамотном выполнении всех звеньев бактериологического исследования: от взятия клинического материала, транспортировки его в бактериологическую лабораторию, идентификации возбудителя до определения его чувствительности к антибиотикам и интерпретации полученных результатов.
|
Вторая причина, обусловливающая необходимость определения чувствительности микроорганизмов к антибактериальным препаратам - это получение эпидемиологических данных о структуре резистентности возбудителей внебольничных и нозокомиальных инфекций. В практике эти данные используют при эмпирическом назначении антибиотиков, а также для формирования больничных формуляров.
Методы определения чувствительности бактерий к антибиотикам делятся на 2 группы: диффузионные и методы разведения.
|
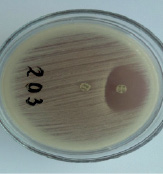
При определении чувствительности диско-диффузионным методом на поверхность агара в чашке Петри наносят бактериальную суспензию определенной плотности (обычно эквивалентную стандарту мутности 0,5 по McFarland) и затем помещают диски, содержащие определенное количество антибиотика. Диффузия антибиотика в агар приводит к формированию зоны подавления роста микроорганизмов вокруг дисков. После инкубации чашек в термостате при температуре 35 о -37 о С в течение ночи учитывают результат путем измерения диаметра зоны вокруг диска в миллиметрах (рис. 1).
Рисунок 1. Определение чувствительности микроорганизмов диско-диффузионным методом.
Определение чувствительности микроорганизма с помощью Е-теста проводится аналогично тестированию диско-диффузионным методом. Отличие состоит в том, что вместо диска с антибиотиком используют полоску Е-теста, содержащую градиент концентраций антибиотика от максимальной к минимальной (рис. 2). В месте пересечения эллипсовидной зоны подавления роста с полоской Е-теста получают значение минимальной подавляющей концентрации (МПК).
Рисунок 2. Определение чувствительности микроорганизмов с помощью Е-тестов.
Несомненным достоинством диффузионных методов является простота тестирования и доступность выполнения в любой бактериологической лаборатории. Однако с учетом высокой стоимости Е-тестов для рутинной работы обычно используют диско-диффузионный метод.
Методы разведения основаны на использовании двойных последовательных разведений концентраций антибиотика от максимальной к минимальной (например от 128 мкг/мл, 64 мкг/мл, и т.д. до 0,5 мкг/мл, 0,25 мкг/мл и 0,125 мкг/мл). При этом антибиотик в различных концентрациях вносят в жидкую питательную среду (бульон) или в агар. Затем бактериальную суспензию определенной плотности, соответствующую стандарту мутности 0,5 по MсFarland, помещают в бульон с антибиотиком или на поверхность агара в чашке. После инкубации в течение ночи при температуре 35 о -37 о С проводят учет полученных результатов. Наличие роста микроорганизма в бульоне (помутнение бульона) или на поверхности агара свидетельствует о том, что данная концентрация антибиотика недостаточна, чтобы подавить его жизнеспособность. По мере увеличения концентрации антибиотика рост микроорганизма ухудшается. Первую наименьшую концентрацию антибиотика (из серии последовательных разведений), где визуально не определяется бактериальный рост принято считать минимальной подавляющей концентрацией (МПК). Измеряется МПК в мг/л или мкг/мл (рис. 3).
|
Рисунок 3. Определение значения МПК методом разведения в жидкой питательной среде.
На основании получаемых количественных данных (диаметра зоны подавления роста антибиотика или значения МПК) микроорганизмы подразделяют на чувствительные, умеренно резистентные и резистентные (рис. 4). Для разграничения этих трех категорий чувствительности (или резистентности) между собой используют так называемые пограничные концентрации (breakpoint) антибиотика (или пограничные значения диаметра зоны подавления роста микроорганизма).
Рисунок 4. Интерпретация результатов определения чувствительности бактерий в соответствии со значениями МПК.
Пограничные концентрации не являются неизменными величинами. Они могут пересматриваться, в зависимости от изменения чувствительности популяции микроорганизмов. Разработкой и пересмотром критериев интерпретации занимаются ведущие специалисты (химиотерапевты и микробиологи), входящие в специальные комитеты. Одним из них является Национальный комитет по клиническим лабораторным стандартам США (National Committee for Clinical Laboratory Standards - NCCLS). В настоящее время стандарты NCCLS признаны в мире и используются как международные для оценки результатов определения чувствительности бактерий при многоцентровых микробиологических и клинических исследованиях.
Существуют два подхода к интерпретации результатов определения чувствительности: микробиологический и клинический. Микробиологическая интерпретация основана на анализе распределения значений концентраций антибиотика, подавляющих жизнеспособность бактерий. Клиническая интерпретация основана на оценке эффективности антибактериальной терапии.
Клинически к чувствительным относят бактерии (с учетом параметров, полученных in vitro), если при лечении стандартными дозами антибиотика инфекций, вызываемых этими микроорганизмами, наблюдают хороший терапевтический эффект.
При отсутствии достоверной клинической информации подразделение на категории чувствительности базируется на совместном учете данных, полученных in vitro, и фармакокинетики, т.е. на концентрациях антибиотика, достижимых в месте инфекции (или в сыворотке крови).
К резистентным (устойчивым) относят бактерии, когда при лечении инфекции, вызванной этими микроорганизмами, нет эффекта от терапии даже при использовании максимальных доз антибиотика. Такие микроорганизмы имеют механизмы резистентности.
Клинически промежуточную резистентность у бактерий подразумевают в случае, если инфекция, вызванные такими штаммами, может иметь различный терапевтический исход. Однако лечение может быть успешным, если антибиотик используется в дозировке, превышающей стандартную, или инфекция локализуется в месте, где антибактериальный препарат накапливается в высоких концентрациях.
С микробиологической точки зрения к бактериям с промежуточной резистентностью относят субпопуляцию, находящуюся в соответствии со значениями МПК или диаметра зон, между чувствительными и резистентными микроорганизмами. Иногда штаммы с промежуточной резистентностью и резистентные бактерии объединяют в одну категорию резистентных микроорганизмов.
Необходимо отметить, что клиническая интерпретация чувствительности бактерий к антибиотикам является условной, поскольку исход терапии не всегда зависит только от активности антибактериального препарата против возбудителя. Клиницистам известны случаи, когда при резистентности микроорганизмов, по данным исследования in vitro, получали хороший клинический эффект. И наоборот, при чувствительности возбудителя может наблюдаться неэффективность терапии.
В определенных клинических ситуациях, когда недостаточно результатов исследования чувствительности обычными методами, определяют минимальную бактерицидную концентрацию.
Минимальная бактерицидная концентрация (МБК) - наименьшая концентрация антибиотика (мг/л или мкг/мл), которая при исследовании in vitro вызывает гибель 99,9% микроорганизмов от исходного уровня в течение определенного периода времени.
|
Значение МБК используют при терапии антибиотиками, обладающими бактериостатическим действием, или при отсутствии эффекта от антибактериальной терапии у особой категории больных. Частными случаями для определения МБК могут быть, например, бактериальный эндокардит, остеомиелит или генерализованные инфекции у пациентов с иммунодефицитными состояниями.
В заключение хотелось бы отметить, что на сегодняшний день не существует методов, которые позволили бы с абсолютной достоверностью прогнозировать клинический эффект антибиотиков при лечении инфекционных болезней. Однако, данные результатов определения чувствительности могут служить хорошим ориентиром клиницистам для выбора и коррекции антибактериальной терапии.
Таблица 1. Критерии интерпретации чувствительности бактерий

Основными возбудителями хронического тонзиллита и фарингита являются Streptococcus pneumoniae и Staphylococcus aureus, распространенность которых составляет 70-75% [4]. Среди прочих возбудителей выделяют Haemophilus influenzae, Streptococcus pyogenes, Moraxella catarrhalis, Streptococcus viridans и др. В последнее время также часто встречаются случаи фарингомикоза, обусловленные Candida albicans.
Этиотропным методом лечения хронических заболеваний верхних дыхательных путей является системная антибиотикотерапия, которая базируется на знании типичных возбудителей или на тестировании чувствительности культуры конкретных микроорганизмов, выделенных из очага поражения. Растущая в последние годы резистентность этих микроорганизмов ко многим основным антибиотикам является главной проблемой в рациональной антибиотикотерапии бактериальных инфекций. Сейчас почти 10% штаммов этих возбудителей в России не чувствительны к пенициллину и его производным, антибиотикам цефалоспоринового ряда первого и второго поколения [5; 8].
Применяемые в терапии антимикробные препараты могут вызвать иммунодепрессивное и аллергизирующее действие, подавлять репаративные процессы, а также могут привести к появлению устойчивых к антибиотикам штаммов. Поэтому проблема лечения гнойно-воспалительных заболеваний ЛОР органов все еще остается актуальной.
Целью работы явился анализ чувствительности микроорганизмов, выделенных от больных с хроническими заболеваниями верхних дыхательных путей, к противомикробным препаратам для разработки методов рациональной антибиотикотерапии при данной патологии.
Материалы и методы. Были обследованы 50 больных (35 женщин и 15 мужчин), из них с хроническим фарингитом — 25 человек, с хроническим тонзиллитом - 15, с фарингомикозом - 10. Изучение спектра микроорганизмов и антибиотикочувствительность проводили с использованием классических бактериологических методов исследования. Мазки из зева брали с помощью стерильных ватных тампонов в асептических условиях до назначения антибактериальной терапии. После взятия биоматериала тампоны помещали в полужидкие транспортные среды Amies, после чего материал сразу же отправляли на исследование в бактериологическую лабораторию. Для выделения бактериальной микрофлоры посевы производили на желточно-солевой агар, кровяной агар, на среду Эндо и для выделения патогенных грибов - на среду Сабуро.
Результаты исследования
Основными возбудителями хронического фарингита, тонзиллита и фарингомикоза в 40% случаев явились стрептококки (S. pneumoniae - 26%, S. pyogenes A - 8%, S. intermedius - 6%), в 60% - стафилококки (S. aureus - 41%, коагулазонегативные стафилококки S. epidermidis - 19%). При микологическом исследовании материала у больных фарингомикозом наряду с выше указанными возбудителями в 100% случаев были выделены Candida albicans.
Основными возбудителями хронического фарингита в 50% случаев являются стрептококки и стафилококки, а хронического тонзиллита — стрептококки (в 30%) и стафилококки (в 70%).
Как показал анализ антибиотикограмм (рис. 1), у больных с хроническим фарингитом стафилококки в 80-84% случаев были наиболее чувствительны к меропенему, фузидину и канамицину, в 72-76% наблюдений - к цефалотину, цефазолину и гентамицину, в 64-68% случаев - к цефалексину, цефуроксиму, цефаклору и эритромицину. Наименьшая чувствительность (в 16-36% случаев) выявлена к бензилпенициллину, оксациллину, линкомицину, ванкомицину, ципрофлоксацину и рифампицину.
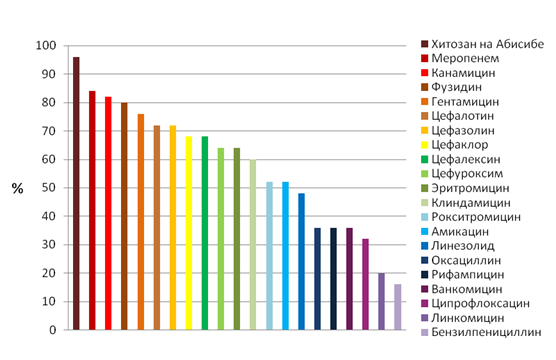
Рис. 1. Чувствительность стафилококков к антибиотикам при хроническом фарингите
Стрептококки, выделенные от пациентов с хроническим фарингитом, оказались чувствительны в 80-90% к гентамицину, стрептомицину, меропенему, а наименьшая чувствительность выявлена в 20-40% случаев к бензилпенициллину, ампициллину, эритромицину, тетрациклину (рис. 2).
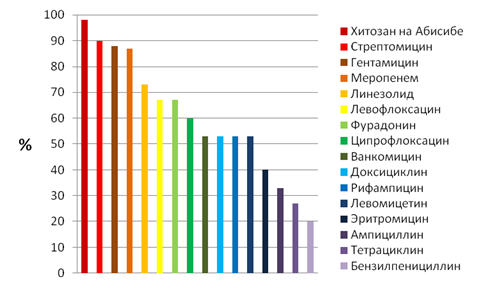
Рис. 2. Чувствительность стрептококков к антибиотикам при хроническом фарингите
Антибиотикограмма у больных с хроническим тонзиллитом показала, что стафилококки в 90-100% случаев были наиболее чувствительны к меропенему, гентамицину и канамицину, а в 8-36% случаев выявлена минимальная чувствительность к бензилпенициллину, оксациллину и линкомицину (рис. 3).
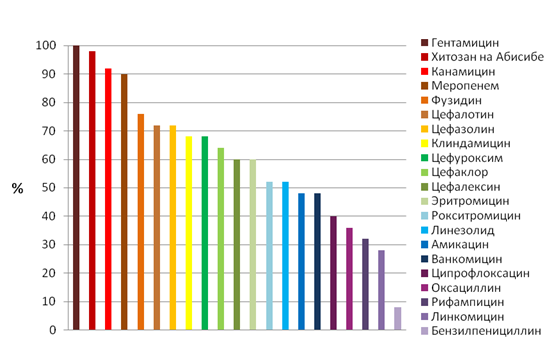
Рис. 3. Чувствительность стафилококков к антибиотикам при хроническом тонзиллите
Стрептококки оказались чувствительны в 80-97% к гентамицину, стрептомицину, линезолиду и меропенему, а в 50% и менее случаев выявлена чувствительность к бензилпенициллину, левомицетину, эритромицину, тетрациклину (рис. 4).
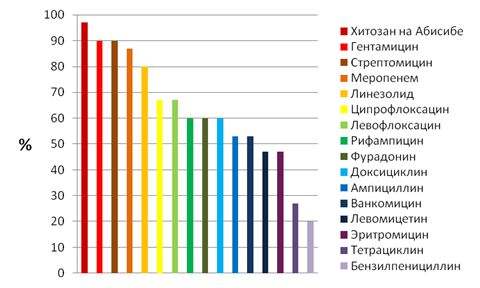
Рис. 4. Чувствительность стрептококков к антибиотикам при хроническом тонзиллите
При фарингомикозе дрожжевые грибы рода Candida оказались чувствительны только к амфотерицину В, нистатину и клотримазолу, а к флуконазолу, интраконазолу и кетоназолу установлена абсолютная резистентность (рис. 5).
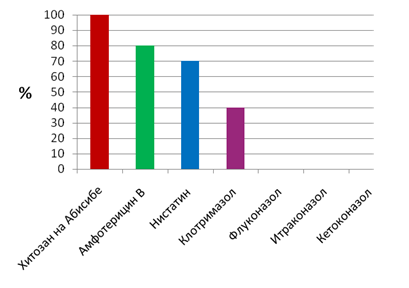
Рис. 5. Чувствительность кандид к противогрибковым препаратам при фарингомикозе
На основании проведенных исследований показано, что при хроническом фарингите, тонзиллите и фарингомикозе выявлена высокая чувствительность выделенных стафилококков (96-98%), стрептококков (97-98%) и дрожжевых грибов рода Candida (100%) к хитозану на Абисибе (рис. 1-5).
Заключение
Основными возбудителями хронических заболеваний верхних дыхательных путей являются стрептококки (S. pneumoniae - 26%, S. pyogenes A - 8%, S. intermedius - 6%), стафилококки (S. aureus - 41%, коагулазонегативные стафилококки S. epidermidis — 19%), а также дрожжевые грибы рода Candida. Большинство возбудителей проявляют высокую резистентность к антибактериальным препаратам широкого спектра действия, таким как бензилпенициллин и оксациллин.
На основании проведенных исследований для лечения пациентов с хроническим тонзиллитом и фарингитом можно рекомендовать следующие антибиотики: меропенем, гентамицин, канамицин, фузидин, стрептомицин, цефалотин, цефазолин, цефалексин, цефуроксим, цефаклор, линезолид. Наибольшей фунгицидной активностью обладали амфотерицин В, нистатин, клотримазол.
Наряду с антимикробными препаратами необходимо уделить внимание препарату природного происхождения - хитозану на Абисибе, к которому чувствительны 96-100% всех выделенных патогенных микроорганизмов, включая Candida albicans. На основании полученных результатов этот противомикробный препарат может быть рекомендован при хронических заболеваниях верхних дыхательных путей.
Рецензенты:
Демидова М.А., д.м.н., профессор, зав. кафедрой управления и экономики фармации Тверской ГМА, г. Тверь;
Портенко Г.М. д.м.н., профессор, зав. кафедрой оториноларингологии Тверской ГМА, г. Тверь.

Различные штаммы стафилококков присутствуют у большинства людей и являются частью нормальной микробиоты кожных покровов, слизистых оболочек и нижнего отдела кишечника. Важное значение со стороны клинической практики и эпидемиологического надзора имеет бактерионосительство S. aureus, являющегося возбудителем многих инфекционных заболеваний человека. Стафилококками продуцируется большое количество факторов патогенности и токсинов. В настоящее время у стафилококков выделено и изучено более 30 различных экзотоксинов, эндотоксинов и суперэнтеротоксинов. Факторы патогенности микробов различными механизмами действуют на иммунную систему человека, что приводит к снижению сопротивляемости организма и развитию как острых, так и хронических форм заболеваний стафилококкового генеза. По данным литературных источников, приблизительно 40 % людей являются постоянными носителями S. аureus на слизистых оболочках крыльев носа, зева, коже подмышечных впадин и промежности, оставшуюся часть популяции относят к транзиторным и случайным носителям [1].
Важное клиническое значение бактерионосительства определяется типичностью процесса транслокации (переноса) стафилококков с наружных кожных покровов и слизистых оболочек во внутреннюю среду организма хозяина с развитием широкого спектра заболеваний [2, 3, 4]. Неблагоприятные факторы окружающей среды влияют не только на макроорганизм, но и на колонизирующие его микроорганизмы. В частности, усиливают действие механизмов агрессии потенциально патогенных бактерий и способность противостоять действию антибактериальных препаратов. Следовательно, стафилококки представляют опасность как для самого бактерионосителя, так и в эпидемиологическом плане, попадая в окружающую среду [5].
Ещё одна причина неэффективности лечения инфекций с помощью антибиотиков – стратегия, которую применяют многие практикующие врачи. Зачастую не проводится бактериологическое исследование и верификация возбудителя инфекции с последующим исследованием его чувствительности к антибиотикам. Получается нонсенс: лечение без диагностики [7]. Теряется время, пациент страдает не только от инфекции, но и от побочных эффектов антибиотика.
Цель работы – изучить наличие в микробиоме зева гемолитических штаммов стафилококков у здоровых молодых людей в открытом коллективе и определить чувствительность выделенных штаммов к антибактериальным препаратам, применяемым в практическом здравоохранении.
Материалы и методы исследования
Результаты исследования и их обсуждение
В результате исследования от 350 практически здоровых студентов без клинических признаков патологии носоглотки и верхних дыхательных путей было выделено 23 гемолитических штамма, идентифицированных как представители рода Staphylococcus spp.
У 7 % студентов без клинических признаков патологии носоглотки и верхних дыхательных путей выявлены гемолитические штаммы Staphylococcus spp. (рис. 1).
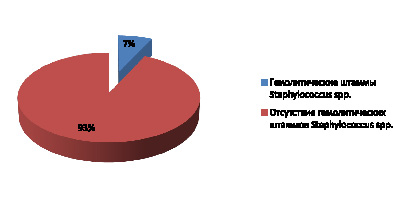
Рис. 1. Частота выявления гемолитических штаммов Staphylococcus spp. в микробиоме зева студентов, %
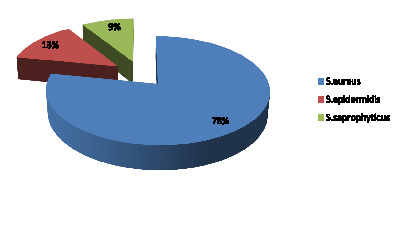
Рис. 2. Частота выявления видов Staphylococcus spp. в микробиоме зева студентов, %
Культуры, выделенные со слизистой оболочки зева, были представлены гемолитическими штаммами S. aureus – 18, S. epidermidis – 3, S. saprophyticus – 2 изолята (рис. 2). MRSA штаммы Staphylococcus spp. не выявлены.
Выделенные штаммы S. aureus в 100 % случаев чувствительны к следующим антибактериальным препаратам: пенициллину, ванкомицину, линезолиду, эритромицину, левофлоксацину, фузидину, клиндамицину, гентамицину, доксоциклину, оксациллину, рифампицину, ципрофлоксацину. В 6 и 50 % были устойчивы к левомицетину и ко-тримаксозолу соответственно (рис. 3).
Штаммы S. epidermidis чувствительны на 100 % к пенициллину, ванкомицину, линизолиду, эритромицину, левофлоксацину, левомицетину и ко-тримаксозолу. К фузидину, левомицетину чувствительны 33 % выделенных штаммов данного микроорганизма, к гентамицину и оксациллину чувствительны 27 %, к рифампицину 77 и 100 % не чувствительны к ципрофлоксацину (рис. 4).
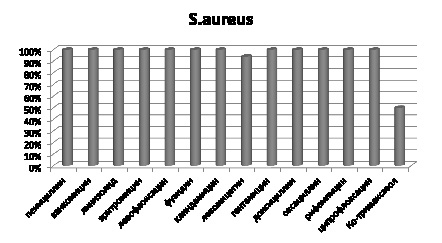
Рис. 3. Чувствительность выделенных штаммов S. aureus к антибиотикам, %
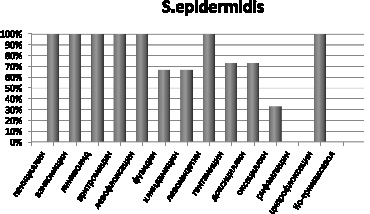
Рис. 4. Чувствительность выделенных штаммов S. epidermidis к антибиотикам, %
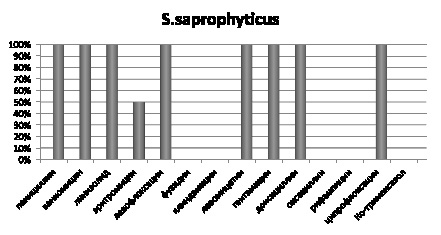
Рис. 5. Чувствительность выделенных штаммов S. saprophyticus к антибиотикам, %
Изоляты S. saprophyticus чувствительны на 100 % к пенициллину, ванкомицину, линизолиду, левофлоксацину, левомицетину, гентамицину, доксоциклину и ципрофлоксацину, на 50 % к эритромицину, и не чувствительны к фузидину, клиндамицину, оксациллину, рифампицину и ко-тримаксозолу (рис. 5).
Выводы
Получены данные о вариантах и частоте носительства условно-патогенных и патогенных стафилококков (7 %) в микробиоте зева молодых людей, при котором не установлено формирование патологических процессов в зеве, что свидетельствует о динамическом равновесии биоценоза и не требует активной эрадикации стафилококков.
Рецензенты:
| Подготовка к исследованию: |