Бактериофаг от золотистого стафилококка и клебсиеллы

Дисбиотические нарушения в настоящее время широко распространены в России и за рубежом. Особенно часто встречается дисбиоз кишечника, от которого, по данным различных исследователей, в той или иной степени страдает до 90 % населения страны [1]. Самым многочисленным как по видовому разнообразию, так и в количественном отношении является ассоциативный симбиоз микробных сообществ толстого кишечника [3]. У детей первого года жизни с высокой частотой и в этиологически значимых количествах выделяются клебсиеллы и золотистый стафилококк, что делает этот возраст уязвимым для развития эндогенных гнойно-воспалительных процессов различной локализации [2]. Микробиоценоз кишечника характеризуется неустойчивостью, связанной с микробной сукцессией при формировании микробиоты, особенностями иммунной системы, неадекватным иммунным ответом организма на заселение кишечника УПМ [1; 3]. Однако мало изученными остаются вопросы, связанные с распространенностью и взаимодействием генетических маркеров патогенности среди клебсиелл и стафилококков, персистирующих совместно в кишечном биотопе. Низкая эффективность эмпирического использования антибиотиков в сочетании с их побочным иммуносупрессивным эффектом приводит к подавлению нормальной микрофлоры кишечника и последующим формированием дисбиозов. Среди альтернативных антимикробных препаратов особый интерес представляют бактериофаги. В то время как антибиотики воздействуют на широкий спектр бактерий, в том числе и на нормальную микрофлору, бактериофаги обладают выраженной специфичностью [6].
Цель исследования. Оценить патогенный потенциал аутоштаммов Klebsiella spp. в ассоциации со Staphylococcus aureus, изолированных от детей первого года жизни с дисбиозами кишечника посредством детекции генетических детерминант патогенности.
Материалы и методы исследования
Для ПЦР-амплификации использовали коммерческий набор AmpliSens-200-1 (ФГУН ЦНИИЭ Роспотребнадзора, Россия). ПЦР проводили с ДНК-матрицы (3 мкл), прямого и обратного праймеров (1 мкл). ДНК амплифицировали в соответствии с протоколом [2]. Электрофорез ПЦР-фрагментов ДНК клебсиелл проводили с использованием 1,0 %-го агарозного геля в 1 % трис-ацетатном буфере в течение 60 мин при 100 В, окрашивали бромистым этидием (1%) и просматривали с помощью УФ-просвечивания. Выделенные гены были идентифицированы и определены на основе размера фрагмента ДНК продукта [2] при его соответствии с длиной маркерного фрагмента. Исследования проводились в течение 2012–2014 гг. Для статистической обработки результатов использовали Excel из пакета MS Office 2003.
Результаты исследования
и их обсуждение
В обследованной группе детей первого года жизни Klebsiella spp. была выделена в 60 % случаев, в том числе в ассоциации с золотистым стафилококком – в 40 %. Также был выявлен микроэкологический дисбаланс, который характеризовался дефицитом бифидобактерий (63,1±4,8), лактобацилл (6,8±2,5), нормальной кишечной палочки (11,7±3,2) на фоне высокой плотности бактерий рода Klebsiella (>104 КОЕ/г). В мазках 60 % аутоштаммов клебсиелл имели плотную полисахаридную капсулу, которая способствовала усилению гидрофобности клеточной стенки и препятствует проникновению фагов и АБП в клетку. Клебсиеллы чаще встречались в ассоциациях с Enterococcus spp. (78,6±4,1), Staphylococcus aureus (40,8±4,9); реже – с E. coli со слабой ферментативной активностью (26,2±4,4), Clostridium spp. (25,2±4,3) и грибами рода Candida (15,5±3,6). Далее по частоте убывания регистрировались E.coli с гемолитической активностью (13,6±3,4), коагулазонегативные виды стафилококка (4,9±2,2), Proteus spp. (3,0±1,7), Enterobacter spp. (2,0±1,4), Citrobacter frendii (2,0±1,4).
Установлено, что исследуемые штаммы клебсиелл (n=100) были чувствительны практически ко всем тестируемым антибиотикам. Процент штаммов чувствительных к β-лактамным антибиотикам составлял 85±3,5 % (цефтазидим), 83±3,8 % (амоксициллин), 89±3,1 % (цефотаксим). Исключение составил ампициллин, к которому были резистентны 70±4,5 % штаммов. Полученные данные подтверждают факт природной устойчивости клебсиелл к ампициллину. Также был высок процент штаммов чувствительных к амикацину и норфлоксацину (по 92±2,7 % случаев соответственно).
Результаты чувствительности штаммов Klebsiella spp. (n=156) к коммерческим препаратам бактериофагов представлены в табл. 1.
Характеристика чувствительности аутоштаммов Klebsiella spp к бактериофагам, (%)




Стерильный очищенный фильтрат фаголизатов бактерий рода Staphylococcus (с активностью по Аппельману - не менее 10 -5 ) - до 1 мл.
Представляет собой прозрачную жидкость желтого цвета различной интенсивности, возможен зеленоватый оттенок.
Препарат вызывает специфический лизис бактерий Staphylococcus.
Лечение и профилактика гнойно-воспалительных и энтеральных заболеваний, вызванных бактериями рода Staphylococcus у взрослых и детей:
заболевания уха, горла, носа, дыхательных путей и легких (воспаления пазух
носа, среднего уха, ангина, фарингит, ларингит, трахеит, бронхит, пневмония, плеврит);
хирургические инфекции (нагноения ран, ожоги, абсцесс, флегмона, фурункулы, карбункулы, гидроаденит, панариции, парапроктит, мастит, бурсит, остеомиелит);
урогенитальные инфекции (уретрит, цистит, пиелонефрит, кольпит, эндометрит, сальпингоофорит);
энтеральные инфекции (гастроэнтероколит, холецистит), дисбактериоз кишечника;
генерализованные септические заболевания;
гнойно-воспалительные заболевания новорожденных (омфалит, пиодермия, конъюнктивит, гастроэнтероколит, сепсис и др.);
другие заболевания, вызванные стафилококками.
При тяжелых проявлениях стафилококковой инфекции препарат назначается в составе комплексной терапии.
С профилактической целью препарат используют для обработки послеоперационных и свежеинфицированных ран, а также для профилактики внутрибольничных инфекций по эпидемическим показаниям.
Важным условием эффективной фаготерапии является предварительное определение чувствительности возбудителя к бактериофагу и раннее применение препарата.
Индивидуальная непереносимость или чувствительность к любому из компонентов препарата.
Целесообразно применение препарата при наличии инфекций, вызванных фагочувствительными штаммами стафилококков (по рекомендации врача).
Препарат используют для приема внутрь (через рот), ректального введения, аппликаций, орошений, введения в полости ран, вагины, матки, носа, пазух носа и дренированные полости. Перед употреблением флакон с бактериофагом необходимо взболтать и просмотреть. Препарат должен быть прозрачным и не содержать осадка.
Первые клинические эксперименты с бактериофагами начались сто лет назад, и казалось, что этот новый метод терапии обречен на успех: с научной точки зрения он выглядел безупречным, и результаты применения выглядели многообещающими.
Почему же в последующие десятилетия интерес к терапевтическому применению бактериофагов в мире упал? Почему он возник вновь, и почему эта замечательная идея до сих пор не реализована в полной мере? И практические врачи, и их пациенты сегодня должны четко представлять не только суть, но и все сильные и слабые стороны этого перспективного вида терапии
Бактериофаги – это не обычные лекарства. Они не являются простыми химическими веществами, как антибиотики и большинство других препаратов, но их вряд ли можно считать и полноценными живыми организмами, так как они, как и все остальные вирусы, могут размножаться только в клетке-хозяине. По сути, это нанороботы с генетической программой, способные проникнуть внутрь бактериальной клетки и там размножиться, разрушив ее.
Поэтому к бактериофагам не всегда применимы стандартные для фармакологии нормы и подходы. И хотя фаговые препараты сегодня производятся и используются в медицине, наши знания о многообразии этих вирусов, механизмах их взаимодействия с бактериями и конкуренции с себе подобными пока недостаточны, чтобы в полной мере использовать их мощный терапевтический потенциал.
Безопасно и эффективно
Фаготерапия родилась едва ли не сразу после открытия самих бактериофагов, однако широкие испытания этих противобактериальных средств начали проводиться в СССР только в конце 1930-х гг. В результате была доказана эффективность препаратов бактериофагов как профилактического средства при борьбе с эпидемиями дизентерии и холеры, а использование их при лечении ран и гнойно-воспалительных процессов показало их потенциал как альтернативы антибиотикам.
Однако результаты исследований тех времен были зачастую противоречивы: иногда фаги сразу подавляли развитие инфекционных процессов, но иногда оказывались бесполезными. Специалисты сразу поняли, в чем причина: лечение было успешным лишь тогда, когда использовались фаги, способные инфицировать именно тот бактериальный штамм, который и вызвал заболевание. Поэтому при возникновении эпидемии требовалось выделить инфекционный агент, проверить на нем имеющиеся фаговые препараты и запустить в производство в качестве препарата наиболее эффективный бактериофаг.
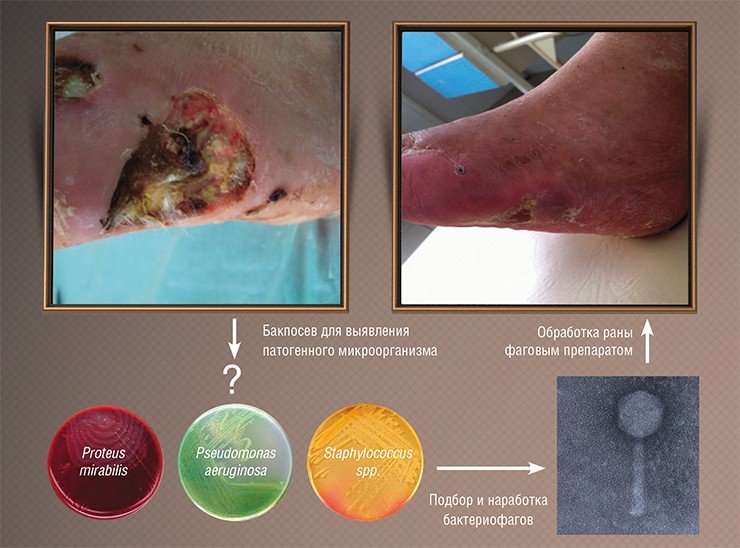
К сожалению, результаты подобных исследований, проводившихся в СССР, не были должным образом документированы и описаны в научной литературе, к тому же они проводились по схемам, не соответствующим принятым на сегодня протоколам клинических испытаний. Тем не менее главные результаты этой работы были бесспорны: фаги доказали свою безопасность и высокую эффективность в реальных условиях и с тех пор используются в нашей стране в клинической практике наряду с обычными лекарственными средствами.

С появлением антибиотиков интерес к фагам на Западе был утрачен, но после появления антибиотикоустойчивых штаммов бактерий в разных странах начали разрабатывать фаговые препараты и проводить испытания, которые, по сути, повторяли исследования, уже проведенные в СССР. Результаты этих работ вновь подтвердили безопасность препаратов бактериофагов, что, в частности, отметило и Управление по контролю за качеством пищевых продуктов и лекарственных препаратов США (FDA).
В Великобритании успешно проведены эксперименты по лечению бактериофагами хронического отита, вызванного нечувствительной к антибиотикам синегнойной палочкой Pseudomonas aeruginosa, а в рамках проекта Phagoburn семь медицинских центров Франции, Бельгии и Швейцарии проводят клинические испытания коктейля фагов для предотвращения инфекций при ожогах. Об испытаниях собственных оригинальных коктейлей фагов для лечения широкого спектра заболеваний сообщает и ряд американских фирм (Intralytix, Enbiotix, AmpliPhi). Правда ни одно из этих масштабных клинических испытаний пока не доведено до конца.
В России препараты бактериофагов можно приобрести в обычной аптеке. Но при этом нужно понимать, что в отличие от других лекарств с точной химической формулой и концентрацией действующих компонентов препарат бактериофага представляет собой нестандартный раствор, содержащий живые вирусные частицы. Даже препарат с одним и тем же названием, но произведенный на разных предприятиях или в разное время, может содержать отличающиеся комбинации и (или) пропорции фагов.
Поэтому покупать препарат бактериофага, чтобы лечиться самостоятельно, не стоит. Назначить лечение и выбрать лекарство должен специалист. Спектр заболеваний, которые можно лечить бактериофагами широк: трофические язвы, ожоговые и раневые инфекции, инфекции органов дыхания, мочеполовой системы и желудочно-кишечного тракта, остеомиелит и т. п. Возбудителями болезней во всех этих случаях служат такие печально известные бактерии, как золотистый стафилококк, включая лекарственно устойчивые штаммы, синегнойная палочка, патогенные формы кишечной палочки, сальмонеллы, протеи, стрептококки и др. В принципе в природе можно найти бактериофаг против любой бактерии, включая возбудителей чумы и сибирской язвы. Можно применять бактериофаги и для профилактики бактериальных инфекционных болезней, например, они были успешно использованы в детских садах и школах для предотвращения эпидемии дизентерии.

Основная же и главная причина неудач – неумелый подбор фагов для лечения конкретных пациентов. Каждый конкретный фаг эффективен против одного или максимум нескольких штаммов бактерий, а у разных пациентов схожая по внешнему проявлению инфекция, например, ангина может быть вызвана разными штаммами стрептококка. Чтобы вылечить больного, необходимо выделить культуру патогена и протестировать ее на чувствительность к конкретным фагам. То есть терапия бактериофагами должна проводиться с использованием принципов персонализированной медицины, к чему современная медицина практически не готова.

На пути к персонализированной Фаготерапии
Опыт СССР, Грузии и Польши показал, что для успешного применения бактериофагов нужны не только клиника, но и производственно-лабораторный участок, располагающий коллекцией фагов и специалистами, способными идентифицировать бактерии, подбирать и выделять бактериофаги для конкретного пациента.
Но в таком случае имеет ли смысл масштабное производство фаговых препаратов? Ответ – да, потому что проблема узкой специфичности фагов частично решается производством фаговых коктейлей из нескольких (иногда десятков) разных фагов, поражающих разные штаммы целевого возбудителя. Ведь подобрать для больного нужный фаговый коктейль быстрее и проще, чем тестировать отдельные фаги из большой коллекции.
И все же не надо думать, что бактериофаги полностью заменят антибиотики – эти препараты дополняют друг друга, и применяться они должны в разных ситуациях. Когда больной находится в тяжелом состоянии, и есть уверенность, что причиной служит бактериальная инфекция, времени на эксперименты и подбор препаратов нет. Единственно правильное решение в этой ситуации – антибиотик широкого спектра действия.
Но в ситуации хронической инфекции или инфекции, вызванной бактериями со множественной устойчивостью к антибиотикам, предпочтение следует отдавать бактериофагу. В случае таких затяжных болезней, как отит, у врача есть время, чтобы использовать фаговый коктейль или специально подобрать фаг. Или же, когда после операции больной поражается антибиотикоустойчивым бактериальным штаммом, и его состояние быстро ухудшается, фаготерапия может стать единственным спасением.
Богатый опыт применения бактериофагов в клинической практике, накопленный за последние сто лет, свидетельствует о перспективности фаговых медицинских технологий. Дальнейшая работа специалистов из множества компаний, работающих сегодня в этой области, и применение методов синтетической биологии обязательно приведут к созданию препаратов с несравненно большей эффективностью по сравнению с современными фаговыми коктейлями.
Тем не менее, биотехнологи, также как ученые и медики, надеются, что безвредные и эффективные препараты все же займут свое законное место в арсенале терапии инфекционных заболеваний.
Алешкин А. В. Бактериофаги в инфекционной патологии: прошлое, настоящее и будущее // Лекции по исследованию и применению бактериофагов. 2016. Ульяновск. С. 11—51.
Козлова Ю. Н., Репин В.Е., Анищенко В.В., Власов В.В. и др. Штамм бактериофага Pseudomonas aeruginosa, используемый в качестве основы для приготовления асептического средства против синегнойной палочки. // Патент РФ №2455355. 2012.
Козлова Ю. Н., Морозова В. В., Тикунова Н. В. и др. Штамм бактериофага Staphylococcus aureus SA20, обеспечивающий разрушение биопленок, образуемых бактериями рода Staphylococcus // Патент РФ № 2565824. 2015.
Морозова В. В., Козлова Ю. Н., Тикунова Н. В. и др. Штамм бактериофага Citrobacter freundii CF17, способный лизировать патогенные штаммы Citrobacter freundii // Патент РФ № 2565559. 2015.
Тикунова Н. В., Морозова В. В. Фаговый дисплей на основе нитчатых бактериофагов: применение для отбора рекомбинантных антител // Аcta Naturae. 2009. № 3. С. 6—15.
Тикунова Н. В. и Власов В. В. Бактериофаги – враги наших врагов // Наука из первых рук. 2013. № 2(50). С. 58—69.
Покровская М. П. Каганова Л. С., Морозенко М. А. и др. Лечение ран бактериофагом. М.: НАРКОМЗДРАВ СССР, МЕДГИЗ. 1941. 57 с
Górski A. et al. Phages targeting infected tissues: novel approach to phage therapy. // Future Microbiol. 2015. V. 10. P. 199—204.
Międzybrodzki R. et al. Clinical aspects of phage therapy // Adv. Virus. Res. 2012. V. 83. P. 73—121.
В публикации использованы иллюстрации из книги Лечение ран бактериофагом. М.: НАРКОМЗДРАВ СССР, МЕДГИЗ. 1941. 57 с.
Доктор вирус
Эра антибиотиков подходит к концу. Заменят ли их бактериофаги?
Эра антибиотиков подходит к концу. Колоссальный потенциал их воздействия на микробов обесценен человеческим легкомыслием. Теперь многие ученые возлагают надежды на бактериофаги – природные вирусы – разрушители бактерий. Это лекарство буквально лежит у нас под ногами.
Сенсация пришла, откуда не ждали, – с берегов Антарктиды. Пока российские полярники бурили 4-километровый ледяной панцирь над антарктическим озером Восток, стремясь добраться до древних микроорганизмов, шведские исследователи из Университета Упсалы обнаружили бактерии нового типа в морской воде у берегов полярного континента. На первый взгляд это были бактерии самой обычной кишечной палочки, попавшей в океан, судя по всему, вместе с бытовыми отходами соседней чилийской станции Arturo Prat. А необычным в них было то, что эти бактерии способны запросто нейтрализовать активность практически всех известных науке антибиотиков.
Дешево и эксклюзивно
Но еще через 10 лет был открыт пенициллин, который оказался эффективнее в борьбе с микробами. Ведь антибиотики способны уничтожать целые группы разных микроорганизмов, а бактериофаг поражает только один. И чтобы лечить бактериофагом, не обойтись без предварительных точных анализов. Фаги не выдержали конкуренции, их исследование было приостановлено почти повсеместно.
Но не в России. Наши ученые не прекращали исследовать бактериофаги и применять это доступное и недорогое средство в хирургии, при лечении острых кишечных инфекций, дисбактериозов и прочих бед. Приверженцы фаговой терапии утверждают: бактериофагами без каких-либо ограничений и осложнений можно лечить почти все болезни, кроме тех, что вызваны вирусами и простейшими.
Сейчас волна интереса к фагам поднимается и на Западе, хотя там их используют не в лечебных целях, а скорее в профилактических. В США Управление по контролю за качеством пищевых продуктов и лекарственных препаратов (FDA) признало безопасность и целесообразность фагов в качестве БАДов, предотвращающих размножение нежелательных бактерий на сырах, кисломолочных продуктах и мясных полуфабрикатах, – словом, рекомендовало использовать в качестве консервантов. В июне 2011-го отечественный Роспотребнадзор созвал ученый совет, на котором была подписана резолюция о внедрении бактериофагов как нового класса пищевых добавок.
– У бактериофагов могут быть хорошие перспективы, – говорит биолог Андрей Алешкин из лаборатории биологии бифидобактерий Московского НИИ эпидемиологии и микробиологии (МНИИЭМ) им. Г.Н. Габричевского. – Например, их можно использовать и для борьбы со стойкими внутрибольничными инфекциями. Золотистый стафилококк – это большая проблема, в том числе и родильных домов. Можно обкормить рожениц антибиотиками или бесконечно закрываться на мойку, а можно обработать поверхности и инструментарий аэрозольным фагом, даже не нарушая режима учреждения. Роспотребнадзор делает так называемые контрольные смывы на предприятиях пищевой отрасли, в детских учреждениях, больницах, поэтому спектр бактерий, живущих там, известен. И к нему можно подобрать действенный бактериофаг.
Враг моего врага
Сейчас уже известно, что бактериофаг – это вирус, состоящий из ДНК и белковой оболочки. Как и все вирусы, он размножается только в живых клетках хозяина. При этом, в отличие от антибиотиков, бактериофаги не нарушают нормальную микрофлору организма. Они способны присоединяться только к единственному типу микробов, а остальным не причиняют вреда. Проникнув внутрь болезнетворной клетки, ДНК фага начинает воспроизводство себе подобных. Размножившись, бактериофаги разрывают оболочку клетки-хозяина и атакуют другие микробы.
Первым делом в 20-х годах прошлого века стафилококковым фагом начали лечить кожные заболевания. А Феликс Д'Эрелль на посту инспектора службы здравоохранения Лиги Наций использовал фаговую терапию в борьбе со вспышками инфекционных заболеваний на Среднем Востоке и в Индии.
В то же время грузинский последователь Д'Эрелля Георгий Элиава при поддержке наркома советской тяжелой промышленности Серго Орджоникидзе основал в Тбилиси Институт исследования бактериофагов. Институт имел большую научную и производственную базу со своими клиниками, он стал всемирным центром фаговой терапии инфекционных заболеваний. В 1937-м по приказу Берии Георгий Элиава был расстрелян как враг народа, но его институт продолжал работать вплоть до распада СССР.
Изначально бактериофаги выпускали в жидком виде. Затем были разработаны таблетки с кислотоустойчивым покрытием, удобные для употребления и транспортировки, а также концентрат, линимент и гель. При этом сейчас в России используют как препараты с одним действующим вирусом, так и комбинированные (от 2 до 8 видов бактериофагов).
– Чаще всего мы используем бактериофаги при кишечной инфекции, – рассказывает педиатр-инфекционист Татьяна Москалева, которая назначает эти препараты больным детям практически ежедневно. – Они хорошо работают, когда известен возбудитель болезни и проверена его чувствительность к фагам. Тогда лекарство действует направленно, сохраняется нормальная флора, а побочные эффекты практически отсутствуют. Претензии у меня разве что к органолептическим свойствам – уж больно они невкусные. Вот сальмонеллезный бактериофаг в таблетках – приемлемый. А жидкие формы имеют очень неприятный вкус и запах, и это создает сложности при лечении маленьких детей.
Врачи признают, что при вспышках таких инфекций, как пневмония, они скорее будут назначать пациентам интенсивные антибиотики. Но в ряде случаев антибиотики бессильны, а помогают именно фаги. Например, в период подъема заболеваемости дифтерией в 1990-х годах в России многие не болели сами, но являлись носителями инфекции – лежали в больнице месяцами без какого-либо лечебного эффекта. Антибиотики не срабатывали, и на помощь пришли бактериофаги. Та же ситуация сейчас с сальмонеллезом: те люди, которые сами не болеют, но переносят бактерии, чаще излечиваются не антибиотиками, а фагами.
Вместо или вместе
Когда в лаборатории консультативно-диагностического центра при МНИИЭМ им. Г.Н. Габричевского пациенту делают анализ микрофлоры и находят какой-нибудь микроб, то обязательно проводят пробы на чувствительность этого микроба и к спектру антибиотиков, и к спектру бактериофагов. Бактериофагом стоит лечиться только при высокой чувствительности к нему бактерий, но даже в этом случае врачи не могут гарантировать лечебного эффекта.
– В организме не так все просто, как в чашке Петри из лаборатории, – говорит Татьяна Москалева. – Микроб может быть покрыт пленкой, и бактериофаг не сумеет к нему присоединиться. Или может иметь место симбиоз нескольких микробов, тогда реакция тоже будет другой.
За долгую историю фаговой терапии российские исследовательские центры собрали богатую базу (ею сейчас очень интересуются западные микробиологи). Крупнейший музей микроорганизмов, в том числе и фагов, хранится в Научном центре экспертизы средств медицинского применения Минздравсоцразвития России. Здесь поддерживаются в жизнеспособном состоянии тысячи штаммов болезнетворных бактерий, к ним же были выведены вирусы, которые до сих пор используются для производства препаратов бактериофагов.
– В этом может быть проблема, – говорит Андрей Алешкин. – Фаги могут разрушать только тот микроб, против которого они выведены. Фаги, которые производят в России с 1995 года, адресованы тем штаммам бактерий, которые хранятся в музее. А как насчет современных микробов?
В принципе же селекция бактериофагов значительно проще и дешевле, чем производство новых антибиотиков. Каждый тип бактерий имеет свои фаги, и они могут быть выделены в любом месте существования этих бактерий: из сточных вод, фекалий или почвы.
Есть, впрочем, и доводы против фаговой терапии, один звучит так: фаги, встраиваясь в геном бактериальной клетки, могут переносить генетический материал от одной бактерии к другой, а это ведет к развитию защитного механизма у микробов.
– Лабораторные опыты показывают, что такое возможно, но на практике в нашей стране это не подтверждалось, – объясняет Андрей Алешкин. – Иначе после применения бактериофага появилась бы суперинфекция с нетипичной для данного вида возбудителя симптоматикой. Чтобы исключить это, нужно использовать фаги только после определения их чувствительности к выделенной от пациента микрофлоре. Нужно очищать препараты от умеренных фагов, которые, встроившись в бактерию, не разрушают ее, а какое-то время сосуществуют с ней. Необходимо продолжать исследования и обмениваться данными с производителями.
Ученые ведут работы над генно-инженерными препаратами – планируется использовать только ДНК фага без оболочки, чтобы максимально увеличить эффективность. Создают комбинированные препараты – бактериофаги сочетают с бактериоцинами (ферментами бактерий), с интерфероном. А еще фаги применяют в тандеме с антибиотиками, чтобы многократно увеличить шансы победы над болезнью.
– Ставить крест на антибиотиках все-таки еще рано, – разъясняет профессор Михаил Фаворов. – Они будут становиться все более дорогими и менее доступными, но решающую роль в борьбе с бактериями пока что играть продолжат, возможно, при участии вспомогательных средств, вроде бактериофагов. А для разработки научно обоснованной стратегии использования фагов в медицине было бы важно проведение всеобъемлющего стандартизированного клинического испытания фагосодержащих медицинских препаратов. Пока результаты таких испытаний не опубликованы ни у нас, ни за рубежом.
Я в отчаянии.Моему ребенку нет и месяца — нашли золотистый стафилококк 10 в 5 и клебсиеллу пневмонию 10 в 7 степени, устойчивые к бактериофагам и чувствительные только к некоторым антибиотикам.Врач говорит, что надо выжидать.Прошу Вашей помощи!
Прежде чем ответить на этот вопрос, предлагаем вашему вниманию письмо от находящегося в отчаянном состоянии молодого мужчины после нескольких курсов лечения антибиотиками и бактериофагами:

Несмотря на кажущееся нам разнообразие антибиотиков, большинство из них попадает в три основные группы в зависимости от мишени: ингибиторы синтеза клеточной стенки бактерий (бета-лактамы), антибиотики, ингибирующие синтез белка (тетрациклины, аминогликозиды, макролиды), и фторхинолоны, ингибирующие синтез ДНК бактерий.
Первый антибиотик – пенициллин, когда-то спасший миллионы жизней во время Второй мировой войны, относится к группе бета-лактамов. Успех пенициллина был таким, что его не только продавали без рецепта, но и добавляли в зубные пасты для профилактики кариеса.
Эйфория ушла, когда в конце 1940-х годов многие штаммы золотистого стафилококка перестали реагировать на пенициллин, и потребовалось принятие срочных мер для создания новых химических производных пенициллина, таких как ампициллин или амоксициллин.
Основным источником резистентности стало распространение генов бета-лактамазы: фермента, расщепляющего ядро молекулы пенициллина. Эти гены не образовались заново, ведь плесневые грибки, производящие пенициллин, и бактерии сосуществовали друг с другом в природе миллионы лет.
Впрочем, полностью синтетические фторхинолоны, появившиеся в клинической практике в начале 1980-х, уже через десять лет повторили судьбу пенициллина. В частности, в докладе ВОЗ отмечается, что широко распространенная инфекция кишечной палочки, которая традиционно лечилась фторхинолонами, антибиотиками широкого спектра действия, уже выработала 100 процентую резистентность.
На протяжении последних десятилетий проходило соревнование химиков-синтетиков и бактерий: на рынок выходили новые и новые группы бета-лактамных антибиотиков (цефалоспорины нескольких поколений, монобактамы, карбапенемы), устойчивые к расщеплению, а бактерии обзаводились бета-лактамазами нового класса со все более широким спектром действия.
Но, если пока еще MRSA хоть иногда и поддается с большими побочными для организма излечению, то вот гонорея рискует превратиться в неизлечимую болезнь. Об этом предупреждает главный врач Англии Салли Дэвис. Совсем недавно она направила во все аптеки и всем врачам общей практики письма, где уточняется стратегия лечения этого венерического заболевания.
Дело в том, что начиная с сентября 2015 года на севере Англии наблюдалась вспышка гонореи с высокой степенью устойчивости к антибиотикам. Эта инфекция начала быстро приобретать иммунитет к новым антибактериальным препаратам, что сокращает возможности врачей. Им рекомендуют с максимальной тщательностью выбирать лекарства.
Исследование, опубликованное в журнале BMJ Open, показало, что врачи продолжают прописывать страдающим от гонореи антибиотики, которые уже перестали действовать против ее возбудителя, и тем самым повышают сопротивляемость микроорганизмов. Например, ципрофлоксацин власти не рекомендуют выписывать уже с 2005 года, но при этом в 2007 году его включали в 42 процента рецептов, в 2011 году — в 20 процентов.
Статистика наблюдений беспристрастно фиксирует, что в Австрии, Австралии, Канаде, Франции, Японии, Норвегии, Словении, Южной Африке, Швеции и Великобритании уже подтверждена неэффективность лечения гонореи третьим поколением фторхинолонов.

Откуда берется устойчивость.

MRSA. (Фото: NIAID)
MRSA - далеко не самый страшный больничный патоген. Он относится к группе грам-положительных бактерий, а значит имеет толстую клеточную стенку, в которую хорошо проникают молекулы разных веществ. Например, ванкомицин.
Настоящий ужас у врачей вызывают грам-отрицательные Escherichia coli, Pseudomonas aeruginosa и Acinetobacter baumannii. У этих бактерий клеточная стенка покрыта липидной мембраной, в которую вещества попадают через узкие каналы.
Escherichia coli (abbreviated as E. Coli)This giant inflatable E.coli sculpture was made for the KREBS Fest, presented at University of Sheffield. Эта бактерия вызывает настоящий ужас у врачей!
Когда бактерия чувствует присутствие антибиотика, она снижает количество таких каналов, что сразу же понижает эффективность лечения. К этому надо добавить переносимые на плазмидах транспортеры, которые откачивают наружу чудом попавшие внутрь клетки молекулы лекарства, и гены бета-лактамаз (гены устойчивости обычно переносятся комплексами, что дополнительно усложняет борьбу с бактериями).
Именно для борьбы с такими инфекциями антибиотик колистин до последнего времени оставался единственным доступным средством лечения.

Почему так мало новых антибактериальных препаратов.
Но дело не только в этом. Отсутствие новых антибиотиков - следствие нескольких фатально совпавших причин, прежде всего экономических.
Во-первых, новые антибиотики, в отличие от каких-нибудь иммуномодуляторов, нужны относительно небольшому числу пациентов, причем живут эти пациенты преимущественно в бедных странах. Во-вторых, курс лечения антибиотиком занимает несколько недель, а не годы, как, например, гипотензивными средствами. В-третьих, устойчивость может сделать дорогой препарат нерентабельным уже через несколько лет после начала применения. В общем, на них не заработаешь.

Бактериофаги
В микромире фаги играют роль естественных ограничителей численности бактерий, и количество фагов колеблется в зависимости от количества бактерий. Если число нужных фагу бактерий снижается, то и фагов становится меньше, иначе им негде будет размножаться. Поэтому фаги ограничивают, но не уничтожают полностью популяцию бактерий.
Ученые называют фаги по имени бактерий: стафилококковый фаг, клебсиельный фаг, то есть каждой бактерии соответсвует определенный фаг.Каждый бактериофаг способен заражать только определенные виды бактерий.
Хотя производители бактериофагов и рекламируют их применение для предупреждения и лечения многих инфекционных заболеваний чуть ли ни как панацею и замену антибиотикам, но, как показывает практика, в организме человека вирусы действуют на бактерии несколько иначе(не так активно), чем в пробирке.
Как оказалось, применение фагов по сути ничем не отличается от использования антибиотиков: единственной мутации в белке-рецепторе на поверхности бактерии достаточно, чтобы фаг перестал на нее садиться. Попросту говоря, бактерии быстро научились приспосабливаются не только к антибиотикам, но и к фагам,становясь устойчивыми к их действию.
Глава исследовательской группы геномной эпидемиологии Франк Ареструп из Датского технического университета зявляет:

Использование бактериофагов — вирусов осложняется тем, что бактерии способны передавать друг другу гены,обеспечивающие сопротивляемость вирусам.Кроме того, процедура сопряжена со множеством потенциальных побочных эффектов.
Когда действие фагов заканчивается, иммунная система входит в рабочий режим не сразу.
Фаги не сочетаются с рядом пробиотиков (бифидумбактерин, лактобактерин) и пребиотиков (нормазе, хилак-форте), так как кислая среда последних нейтрализует их.
Фаги блокируются бактериями в коллоидной среде( в коллоидном растворе). Например,снижение бактерицидности фагов при наличии большого количества слизи в толстой кишке. Бактерии выделяют большое количество полисахаридов и живут в этой массе, в которую фагам проникнуть очень сложно.
Все это, в итоге, не может представлять фаговую терапию как стандартный и повсеместный способ лечения, как об этом часто любят заявлять компании, производящие данную продукцию.
Многие ведущие ученые считают, что именно степень реакции иммунной системы на вирус или бактерию и определяет в конечном итоге исход течения болезни.
Ни антибиотики, ни бактериофаги не имеют такого потенциала,чтобы одновременно и патогенные бактерии уничтожать, и иммунную систему укреплять, и интоксикацию организма снимать.
Читайте также:


