Все белки вич 1 что это
1 декабря – Всемирный день борьбы со СПИДом. Каждый год к этой дате внимание учёных и людей всего мира обращается к новым достижениям в исследованиях ВИЧ.
Когда было установлено, что причиной СПИДа является вирус иммунодефицита человека (ВИЧ), казалось, что создание вакцины – дело ближайшего будущего. C тех пор прошло более 25 лет и, несмотря на огромные материальные и интеллектуальные ресурсы, затраченные за это время, вакцина против ВИЧ-инфекции все ещё не создана.
Создание вакцин – история
Чтобы понять проблемы, осложняющие разработку вакцин против ВИЧ-1, поучительно рассмотреть обстоятельства успешной разработки вакцин в прошлом. Создание вакцины против оспы – одно из наиболее ярких достижений в истории медицины. Почему 200 лет назад, в отсутствии современных знаний, создание вакцины против оспы так быстро увенчалось успехом, в то время как создание вакцины против СПИДа остается нерешённой задачей уже более четверти века? Ответ заключается в том, что сама природа дала проницательному наблюдателю чёткие указания. Эдвард Дженнер обратил внимание на то, что молочницы, ранее переболевшие коровьей оспой, не заболевали оспой натуральной. Это наблюдение позволило установить факт перекрёстной иммунологической реакции двух родственных вирусов, позволяющий использовать вирус коровьей оспы для защиты от оспы натуральной.
Известные подходы
Для создания вакцин против ВИЧ были испробованы практически все известные подходы, однако все они оказались бесперспективны.
Использование аттенуированного или инактивированного вируса связано с опасностью инфицирования, иммунитет ограничен очень узким кругом вирусных изолятов, а продолжительность иммунитета достаточна мала и не генерируется ЦТЛ.
Использование полноразмерных вирусных антигенов для создания рекомбинантных вакцин также осложнено: во-первых, требуется использование большого числа рекомбинантных антигенов ВИЧ-1, многие из которых достаточно сложно получить с использованием генноинженерных систем их синтеза; во-вторых, ВИЧ-1 имеет множество изменённых штаммовых вариантов, что также делает малоэффективным использование полноразмерных антигенов, в-третьих, полноразмерные вирусные антигены, являются потенциальными онкогенами и содержат районы, которые могут либо ингибировать протективный иммунитет, либо индуцируют развитие иммунопатологии.
Все эти проблемы ограничивают возможность использования традиционных подходов для создания вакцин против ВИЧ-1 и требуют разработки новых нетрадиционных подходов.
Новое поколение вакцин
На наш взгляд, одним из наиболее перспективных и обещающих подходов к созданию нового поколения надёжных и безопасных вакцин против ВИЧ-1 связан с созданием искусственных полиэпитопных вакцин на основе специально отобранных В- и Т-клеточных эпитопов. Такие вакцины должны содержать только те эпитопы, которые необходимы для формирования специфического иммунитета, и должны быть лишены недостатков, которые присущи субъединичным вакцинам и вакцинам, разрабатываемым на основе аттенуированного или инактивированного вируса. Искусственные полиэпитопные конструкции имеют потенциал, который позволяет улучшить иммунный ответ против ВИЧ-1 по сравнению с иммунитетом, индуцируемым при естественной ВИЧ-инфекции.
Как получают искусственные полиэпитопные иммуногены?
Вначале проводится анализ структуры вирусных белков и отбираются наиболее важные в иммунологическом плане эпитопы. При этом отбрасываются те эпитопы, которые могут вызвать нежелательные последствия. Затем осуществляется компьютерный дизайн искусственной белковой молекулы и рассчитывается соответствующая нуклеотидная последовательность искусственного гена. Ген синтезируют в пробирке путём химико-ферментативного синтеза и встраивают в подходящую векторную молекулу для его экспрессии в клетках бактерий, животных или растений. Данный подход использовался нами при конструировании двух искусственных полиэпитопных конструкций TBI и TCI.
Искусственные иммуногены - TBI и TCI
Первый полученный нами искусственный иммуноген был белок TBI. Он включает четыре Т-клеточных эпитопа и пять В-клеточных нейтрализующих эпитопов и сконструирован в виде белка с заранее заданной третичной структурой. Белок TBI прежде всего проектировался для индукции В-клеточного ответа, поэтому предсказанная структура эпитопов в составе белковой молекулы должна была обеспечить их распознавание иммунной системой и высокий уровень ответа. И действительно, созданный нами искусственный белок сохранил иммунологическую активность, поскольку его узнавали антитела из сыворотки больных ВИЧ-1. Кроме того, впервые для белка с гипотетически заданной третичной структурой были выращены кристаллы. Поскольку известно, что только природные белки способны к кристаллизации, этот факт является подтверждением того, что белок TBI по своей структуре подобен природным белкам. И самое главное – у мышей и обезьян, иммунизированных белком TBI, регистрируется появление ВИЧ-специфических антител, обладающих способностью нейтрализовать ВИЧ-1 на культуре клеток человека.
При конструировании белка TCI были выбраны эпитопы, высоко консервативные для 3-х основных субтипов ВИЧ-1, что может позволить обойти высокую вариабильность вируса. Чтобы выбранные эпитопы не обладали способностью индуцировать аутоиммунные реакции, были исключены нежелательные эпитопы, которые потенциально могут индуцировать антитела, обладающие перекрёстной специфичностью с нормальными клеточными белками. В результате белок TCI имеет более 80 оптимально отобранных эпитопов и является самым представительным среди известных полиэпитопных конструкций.
Кандидатные вакцины
КомбиВИЧвак представляет собой комбинацию двух искусственных иммуногенов, один из которых - белок TBI. Вакцина сконструирована в виде вирусоподобных частиц. На её поверхности расположено большое число молекул TBI, что позволяет значительно увеличить иммуногенность вакцинной конструкции. Один из основных показателей эффективности вакцины – способность индуцировать антитела, которые не только узнают, но и нейтрализуют вирус. Наши результаты показали, что сыворотки мышей, иммунизированных КомбиВИЧвак, эффективно подавляют репликацию вируса на культуре клеток, инфицированных вирусом ВИЧ-1, причём на том же уровне, что и сыворотки, полученные от ВИЧ-инфицированного человека. Т.о., кандидатная вакцина КомбиВИЧвак обладает рядом уникальных свойств: она объединяет В- и Т-клеточные иммуногены в одной конструкции, индуцирует как гуморальный, так и клеточный иммунный ответ, а эпитопы, входящие в состав её полиэпитопных иммуногенов, являются консервативными и представлены разными белками ВИЧ-1.
Лариса Ивановна Карпенко,
д.б.н., зав. лабораторией разработки средств иммунопрофилактики
Сергей Иванович Бажан,
д.б.н., зав. теоретическим отделом,
Александр Алексеевич Ильичёв,
д.б.н., профессор, зав. отделом иммунотерапевтических препаратов
О ВИЧ/СПИДе. Этиология ВИЧ-инфекции. Введение.
ВИЧ-инфекция - это заболевание, вызываемое вирусом иммунодефицита человека, длительное время персистирующим в лимфоцитах, макрофагах, клетках нервной ткани, в результате чего развивается медленно прогрессирующее поражение иммунной и нервной системы, проявляющееся вторичными инфекциями, опухолями, подострым энцефалитом и другими патологическими изменениями, приводящими к гибели больного.
ВИЧ-инфекция - это смена стадий, последнюю из них обозначают термином СПИД - синдром приобретенного иммунодефицита человека, являющуюся заключительной, терминальной стадией процесса.
Возбудитель и эпидемиология ВИЧ-инфекции
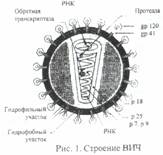
Возбудитель ВИЧ-инфекции - вирус иммунодефицита человека, принадлежит к подсемейству лентивирусов, семейства ретровирусов. Выделяют два типа вируса -ВИЧ-1 и ВИЧ-2. Вирусная частица представляет собой форму, близкую к сферической, со средним диаметром 100-120 нм, состоящую из ядра, окруженное оболочкой. Ядро содержит РНК и ферменты - обратную транскриптазу (ревертазу), интегразу, протеазу. Наличие обратной транскриптазы обеспечивает обратную направленность потока генетической информации: не от ДНК к РНК, а наоборот, от РНК к ДНК.
В составе вириона имеется оболочка и нуклеоид. Наружная оболочка пронизана вирусными белками: трансмембранным и внешним глико-протеидами. Белки выполняют функцию детерминанты и участвуют в прикреплении к мембране клетки-хозяина, С внутренней стороны оболочки расположен каркас, образованный белком р 17, окружающий внутреннюю структуру вириона - нуклеоид (сердцевина). Собственно оболочка сердцевины образована белком р 24. Внутри нуклеоида располагается геном вируса, состоящих из 2 цепочек РНК, окруженных белками р 7 и р 9 .
Жизненный цикл ВИЧ включает в себя процессы специфической сорбции вируса на CD 4(+) - лимфоцитах за счет процессов диффузии мембран, синтез ДНК копии генома и дальнейшей ее интеграции в хромосому клетки-хозяина.
При попадании ВИЧ в клетку под действием фермента обратной транскриптазы происходит образование ДНК ВИЧ, встраивающейся в ДНК клетки-хозяина, которая в дальнейшем продуцирует вирусные частицы.
ВИЧ не стоек в окружающей среде. Полностью инактивируется нагреванием при температуре 56°С в течение 30 мин, быстро погибает при кипячении (1-3 мин), а также под воздействием дезинфицирующих средств н концентрациях, обычно используемых в практике. ВИЧ в то же время устойчив к ультрафиолетовым лучам и ионизирующей радиации.
Источником заражения является человек, инфицированный ВИЧ как в стадии бессимптомного носителъства, так и развернутых клинических проявлений болезни. Вирус обнаруживается в крови, сперме, спинномозговой жидкости, грудном молоке, менструальной крови, влагалищном секрете, которые являются факторами передачи ВИЧ-инфекции. В слюне, слезной жидкости, моче ВИЧ находится в небольшом количестве, недостаточном для заражения.
Пути передачи ВИЧ-инфекции - половой (гетеро- и гомосексуальный), парентеральный и вертикальный.
Вертикальный путь передачи может быть от инфицированной матери ребенку во время беременности и родов, а также во время грудного вскармливания, возможно также заражение матери от ВИЧ-инфецированного ребенка при его вскармливании.
Патогенез ВИЧ-инфекции.
При попадании ВИЧ в клетку, РНК под воздействием ревертазы превращается в ДНК, которая встраивается в ДНК клетки-хозяина, продуцируя новые вирусные частицы - копии РНК вируса, оставаясь в клетке пожизненно. Ядро окружено оболочкой, в составе которой имеется белок g р 120, обуславливающий прикрепление вируса к клеткам организма человека, имеющим рецептор - белок CD 4 .
ВИЧ адсорбируется на клетках, в состав мембраны которых входит белок CD 4. Это Т-лимфоциты с фенотипом CD 4(+) , макрофаги, В-лимфоциты, клетки нейроглии (вследствие этого происходит поражение центральной нервной системы), клеток слизистой оболочки кишечника, дендритных клеток. Прежде всего поражаются С D 4(+)-лимфоциты, являющиеся центральной фигурой иммунного ответа. Причиной снижения Т-хелперов является не только прямое цитопатическое действие вируса, но и слияние неинфицированных клеток с инфицированными и образование синтиция.
Одновременно происходит нарушение функции В-лимфоцитов. повышается количество иммуноглобулинов, циркулирующих иммунных комплексов, что ведет к большему снижению С D 4(+) - лимфоцитов. Все перечисленные механизмы и формируют различные клинические проявления заболевания. В результате поражения центральных звеньев иммунной системы человек, инфицированный ВИЧ, становится беззащитным перед возбудителями различных инфекций, в первую очередь, условно-патогенными (оппортунистическими) микроорганизмами, которые не представляют угрозы для практически здорового человека.
В связи с прогрессированием вторичного иммунодефицитного состояния формируются опухолевые и аутоиммунные процессы, в патологический процесс всегда вовлекается ЦНС, куда проникает вирус вместе с инфицированными моноцитами. Поражение клеток нейроглии приводит к трофическим повреждениям нейронов, ткани мозга, нарушению мозговой деятельности, и в конечном итоге развитию СПИД-деменции (слабоумию).
Российская классификация ВИЧ-инфекции, 2006 год (В.В. Покровский)
Продолжительность клинических проявлений во второй стадии может варьировать от нескольких дней до нескольких месяцев, однако обычно они регистрируется в течение двух-трех недель.
В целом продолжительность стадии первичных проявлений ВИЧ-инфекции составляет один год с момента появления симптомов острой инфекции или сероконверсии.
Длительность субклинической стадии составляет от двух-трех до 20-ти и более лет, но в среднем она продолжается 6-7 лет. Скорость снижения уровня С04-лимфоцитов в этот период в среднем составляет 50-70x106/л в год.
В зависимости от тяжести вторичных заболеваний выделяют стадии 4А, 4Б, 4В.
4А обычно развивается через 6-10 лет от момента заражения. Для нее характерны бактериальные, грибковые и вирусные поражения слизистых и кожных покровов, воспалительные заболевания верхних дыхательных путей. Обычно стадия 4А развивается у пациентов с уровнем С04-лимфоцитов 500-350x106/л (у здоровых лиц число С04-лимфоцитов колеблется в пределах 600-1900x106/л).
4Б чаще возникает через 7-10 лет от момента заражения. Кожные поражения в этот период носят более глубокий характер и склонны к затяжному течению. Начинают развиваться поражения внутренних органов. Могут отмечаться потеря веса, лихорадка, локализованная саркома Капоши, поражение периферической нервной системы. Обычно стадия 4Б развивается у пациентов с уровнем С04-лимфоцитов 350-200x106/л.
4В преимущественно выявляется через 10-12 лет от момента заражения. Она характеризуется развитием тяжелых, угрожающих жизни вторичных заболеваний, их генерализованным характером, поражением ЦНС. Обычно стадия 4В имеет место при уровне С04- лимфоцитов менее 200x106/л.
Несмотря на то, что переход ВИЧ-инфекции в стадию вторичных заболеваний является проявлением истощения защитных резервов организма зараженного человека, этот процесс имеет обратимый характер (по крайней мере, на какое-то время). Спонтанно или вследствие проводимой терапии клинические проявления вторичных заболеваний могут исчезать. Поэтому в стадии вторичных заболеваний выделяют фазы прогрессирования (при отсутствии противоретровирусной терапии или на фоне противоретровирусной терапии) и ремиссии (спонтанной, после ранее проводимой противоретровирусной терапии или на фоне противоретровирусной терапии).
Вирус иммунодефицита человека (ВИЧ) отнесен к семейству ретровирусов (Retroviridae), подсемейству медленных вирусов (Lentivirus).
В настоящее время описаны 2 серотипа вируса: ВИЧ-1 и ВИЧ-2, различающиеся по структурным и антигенным характеристикам. Наибольшее эпидемиологическое значение имеет ВИЧ-1, который доминирует в современной пандемии и имеет наибольшее распространение на территории Российской Федерации. По данным электронной микроскопии, вирионы ВИЧ имеют округлую форму диаметром 100-120 нм. Наружная мембрана вируса построена из белков клетки хозяина и пронизана собственными белками вируса, которые обозначены как оболочечные белки.
Вирусная частица представляет собой ядро (cor), окруженное оболочкой. Ядро содержит двойную вирусную РНК, обратную транскриптазу (ревертазу), интегразу, протеазу. Различают два основных белка оболочки - трансмембранный гликопротеин с молекулярной массой 41 кД (gр41) и внешний гликопротеин - 120 кД (gр120) (табл. 1).
Таблица 1. Группы белков ВИЧ-1 и ВИЧ-2
| Группа белков | ВИЧ -1 | ВИЧ -2 |
| Белки оболочки вируса | gр160, 120, 41 кД | gp140, 105, 36 кД |
| Белки сердцевины | p55, 24, 17 кД | p56, 26, 18 кД |
| Ферменты вируса | p66, 51, 31 кД | p68 кД |
Примечание. Молекулярная масса белков выражена в килодальтонах - кД; gp - гликопротеины; р - протеины.
Нуклеоид вируса имеет округлую форму, но принимает продолговатую после отпочковывания вирусной частицы от клетки. Оболочка нуклеотида содержит протеин с молекулярной массой 24кд (р24). Между наружной оболочкой вириона и нуклеоидом существует каркас, состоящий из матриксного белка 17кд (р17).
В естественных условиях ВИЧ может сохраняться в высушенном биосубстрате в течение нескольких часов в жидкостях, содержащих большое количество вирусных частиц, таких как кровь и эякулят - в течение нескольких дней, а в замороженной сыворотке крови активность вируса сохраняется до нескольких лет.
Нагревание до температуры 56°С в течение 30 мин приводит к снижению инфекционного титра вируса в 100 раз, при 70°- 80°С вирус гибнет через 10 мин; через 1 мин инактивируется 70% этиловым спиртом, 0,5% раствором гипохлорита натрия, 1% глутаральдегидом, 6% перекисью водорода. ВИЧ относительно мало чувствителен к УФ-облучению, ионизирующей радиации.
| env | gp120 | Самый наружный белок обеспечивает связывание с клетками-мишенями. Лиганды - молекула CD4 + ; галактозилцерамиды; рецепторы для цитокинов |
| gp41 | Обеспечивает интернализацию вириона в клетку | |
| gag | р24 | Составляет оболочку ядра вируса (нуклеокапсида) |
| р17 | Составляет матриксное вещество вируса | |
| р9 | Связан с геномной РНК | |
| р7 | То же | |
| pol | р66 | Обратная транскриптаза (синтез ДНК на матрице РНК) |
| р31 | Интеграза (встраивает ДНК вируса в клеточный геном) | |
| р10 | Протеаза (расщепляет большие белковые трансляты на дифинитивные белки вируса) | |
| tat | p14 | Существенен для экспрессии белков оболочки (Env) |
| nef | p27 | Может усиливать и ингибировать репликацию ВИЧ |
| vif | p23 | Необходим для выхода новорожденных вирусов из клетки-мишени (вероятно, участвует в фолдинге белков Env) |
| vpu | p16 | Необязателен для жизненного цикла вируса; усиливает отпочковывание вируса из клетки-мишени |
Гликопротеин gр120 обусловливает присоединение ВИЧ к рецепторам СD4 клеток человека. При попадании ВИЧ в клетку под действием обратной транскриптазы синтезируется ДНК ВИЧ, встраиваемая в ДНК клетки-хозяина, которая в дальнейшем начинает продуцировать вирусные частицы.
Основа естественного иммунитета - это действие неспецифических механизмов, в большинстве своем реагирующих на повреждение тканей воспалительными реакциями. Некоторые клетки (макрофаги - МФ) и гуморальные факторы (комплемент, лизоцим) направлены на уничтожение бактерий. Другие клетки могут секретировать интерферон, действие которого в основном направлено против вирусов.
Адаптивный иммунитет основан на свойствах Т- и В-лимфоцитов избирательно отвечать на чужеродные вещества (антигены) с образованием специфической памяти и продукцией антител.
Попадая в организм человека, ВИЧ поражает различные органы и ткани, но, в первую очередь, клетки, несущие маркер СD4 + . В таблице 3 приведены основные типы клеток, поражаемых ВИЧ. В цитоплазме пораженных клеток освобождается вирусная РНК, и с помощью фермента обратной транскриптазы на основе вирусной РНК синтезируется ДНК - копия, которая встраивается в ДНК клетки хозяина (провирус). При каждом новом делении клетки все ее потомство содержит ретровирусную ДНК. В пораженной клетке начинают создаваться структурные элементы ВИЧ, из которых при помощи другого фермента - протеазы, собираются новые полноценные вирусы, в свою очередь поражающие новые клетки-мишени. С течением времени большинство зараженных клеток погибает.
Таблица 3. Типы клеток, поражаемых ВИЧ
| Тип клеток | Ткани и органы |
| Т-лимфоциты, макрофаги | Кровь |
| Клетки Лангерганса | Кожа |
| Фолликулярные дендритные клетки | Лимфоузлы |
| Альвеолярные макрофаги | Легкие |
| пителиальные клетки | Толстая кишка, почки |
| Клетки шейки матки | Шейка матки |
| Клетки олигодендроглии, астроциты | Мозг |
Уменьшение клеток, несущих рецептор СD4 + , приводит к ослаблению цитотоксической активности CD8+ Т-лимфоцитов, уничтожающих инфицированные вирусом клетки. В результате теряется контроль за проникающими в организм возбудителями бактериальных, вирусных, грибковых, протозойных и других инфекций (оппортунистических), а также за клетками злокачественных опухолей. Одновременно происходит нарушение функции В-лимфоцитов, поликлональная активация которых приводит, с одной стороны, к гипергаммаглобулинемии, а с другой - к ослаблению их способности продуцировать вируснейтрализующие антитела. Повышается количество циркулирующих иммунных комплексов, появляются антитела к лимфоцитам, что еще больше снижает число CD4 + Т-лимфоцитов. Возникают аутоиммунные процессы.
Оппортунистические инфекции, как правило, имеют эндогенное происхождение и возникают за счет активации собственной микрофлоры человека вследствие снижения напряженности иммунитета (например, эндогенная активация микобактерий туберкулеза из очагов Гона).
Цитопатическое действие ВИЧ приводит к поражению клеток крови, нервной, сердечно-сосудистой, костно-мышечной, эндокринной и других систем, что определяет развитие полиорганной недостаточности, характеризующейся разнообразием клинических проявлений и неуклонным прогрессированием ВИЧ-инфекции.
В настоящее время новые диагностические технологии позволяют выявить этиологические и патогенетические причины многих заболеваний и коренным образом повлиять на результаты лечения. Пожалуй, наиболее впечатляющие результаты внедрения этих технологий в клиническую практику достигнуты в области иммунологии и диагностики инфекционных заболеваний.
Для исследования может быть использован различный биологический материал: сыворотка, плазма крови, соскоб, биоптат, плевральная или спинномозговая жидкость (СМЖ). В первую очередь, методы лабораторной диагностики инфекций направлены на выявление таких заболеваний, как вирусный гепатит В, С, D, цитомегаловирусная инфекция, инфекции, передающиеся половым путем (гонорейная, хламидийная, микоплазменная, уреаплазменная), туберкулез, ВИЧ-инфекция и др.
ВИЧ-инфекция – заболевание, вызываемое вирусом иммунодефицита человека (ВИЧ), длительное время персистирующего в лимфоцитах, макрофагах, клетках нервной ткани, в результате чего развивается медленно прогрессирующее поражение иммунной и нервной систем организма, проявляющееся вторичными инфекциями, опухолями, подострым энцефалитом и другими патологическими изменениями.
Возбудители инфекции – вирусы иммунодефицита человека 1-го и 2-го типов (ВИЧ-1, ВИЧ-2) – относятся к семейству ретровирусов, подсемейству медленных вирусов. Вирионы являются сферическими частицами диаметром 100–140 нм. Вирусная частица имеет наружную фосфолипидную оболочку, включающую гликопротеиды (структурные белки) с определенной молекулярной массой, измеряемой в килодальтонах. У ВИЧ-1 – это gpl60, gpl20, gp41. Внутренняя оболочка вируса, покрывающая ядро, также представлена белками с известной молекулярной массой – р17, р24, р55 (ВИЧ-2 содержит gpl40, gpl05, gp36, р16, р25, р55).
В состав генома ВИЧ входит РНК и фермент обратная транскриптаза (ревертаза). Для того чтобы геном ретровируса соединился с геномом клетки хозяина, вначале с помощью ревертазы происходит синтез ДНК на матрице вирусной РНК. Затем ДНК провируса встраивается в геном клетки-хозяина. ВИЧ обладает выраженной антигенной изменчивостью, значительно превышающей таковую у вируса гриппа.
В организме человека основной мишенью ВИЧ являются Т-лимфоциты, несущие на поверхности наибольшее количество СD4-рецепторов. После проникновения ВИЧ в клетку с помощью ревертазы по образцу своей РНК вирус синтезирует ДНК, которая встраивается в генетический аппарат клетки-хозяина (СD4-лимфоциты) и остается там пожизненно в состоянии провируса. Помимо Т-лимфоцитовхелперов поражаются макрофаги, В-лимфоциты, клетки нейроглии, слизистой оболочки кишечника и некоторые другие клетки. Причиной снижения количества Т-лимфоцитов (клетки CD4) является не только прямое цитопатическое действие вируса, но и их слияние с неинфицированными клетками. Наряду с поражением Т-лимфоцитов у больных с ВИЧ-инфекцией отмечается поликлональная активация B-лимфоцитов с увеличением синтеза иммуноглобулинов всех классов, особенно IgG и IgA, и последующим истощением этого отдела иммунной системы. Нарушение регуляции иммунных процессов проявляется также повышением уровня α-интерферона, β2-микроглобулина, снижением уровня IL-2. В результате нарушения функции иммунной системы, особенно при снижении числа Т- лимфоцитов (CD4) до 400 клеток в 1 мкл крови и менее, возникают условия для неконтролируемой репликации ВИЧ со значительным увеличением количества вирионов в различных средах организма. В результате поражения многих звеньев иммунной системы человек, зараженный ВИЧ, становится беззащитным перед возбудителями различных инфекций.
На фоне нарастающей иммунодепрессии развиваются тяжелые прогрессирующие заболевания, которые не встречаются у человека с нормально функционирующей иммунной системой. Это заболевания, которые Всемирная организация здравоохранения (ВОЗ) определила как СПИД-маркерные или СПИД-индикаторные заболевания.
СПИД-индикаторные заболевания
Первая группа – заболевания, присущие только тяжелому иммунодефициту (уровень СD4 74 100 копий/мл почти у всех пациентов развивается клиническая картина СПИДа (Senior D., Holden Е., 1996).
Вероятность развития СПИДа в 10,8 раз выше у лиц с содержанием ВИЧ-1 в крови >10 000 копий/мл, чем у лиц с содержанием ВИЧ-1 в крови 20 000 копий/мл (ПЦР). Оценка результатов антиретровирусной терапии у лиц, инфицированных ВИЧ, проводится по снижению уровня сывороточной РНК ВИЧ.
При эффективном лечении уровень виремии должен снижаться в 10 раз в течение первых 8 недель и быть ниже предела чувствительности метода (ПЦР) (
Иголка в стоге сена
Генетикам давно известны гены устойчивости к некоторым вирусам у мышей, например к вирусу лейкоза. Но существуют ли подобные гены у человека, и если да, то какова их роль в защите против СПИДа?
Стивен О'Брайн и Михаэль Дин со своими коллегами из Национального института рака США много лет вели поиск таких генов у человека.
В начале 80-х годов американские ученые исследовали множество людей, которые по тем или иным причинам могли заразиться вирусом иммунодефицита. Они проанализировали тысячи образцов крови и обнаружили, казалось бы, необъяснимое явление: у 10-25% обследованных вирус вообще не выявляется, а около 1% носителей ВИЧ - относительно здоровы, признаки СПИДа у них либо отсутствуют, либо выражены очень слабо, а иммунная система в полном порядке. Неужели существует какая-то устойчивость к вирусу у некоторых людей? И если да, то с чем она связана?
Опыты на лабораторных мышах, крысах, морских свинках и кроликах показали, что устойчивость к различным вирусным инфекциям часто определяется целым набором генов. Оказалось, что сходный механизм определяет и устойчивость к вирусу иммунодефицита человека.
Известно, что многие гены ответственны за выработку определенных белков. Часто бывает, что один и тот же ген существует в нескольких измененных вариантах. Такие "многоликие" гены называются полиморфными, а их варианты могут отвечать за выработку различных белков, которые по-разному ведут себя в клетке.
Сравнив восприимчивость к вирусам у мышей, несущих множество разнообразных наборов генов, и у мышей с небольшим числом генных вариантов, ученые пришли к выводу, что чем разнороднее генетически были животные, тем реже они заражались вирусом. В таком случае можно предположить, что в генетически разнообразных человеческих популяциях генные варианты, определяющие устойчивость к ВИЧ, должны встречаться достаточно часто. Анализ заболеваемости СПИДом среди американцев различных национальностей выявил еще одну особенность: более устойчивы американцы европейского происхождения, у африканцев и азиатов устойчивость близка к нулю. Чем объяснить такие различия?
Ответ на этот вопрос предложил в середине 80-х годов американский вирусолог Джей Леви из Калифорнийского университета в Сан-Франциско. Леви и его коллеги пытались выяснить, какие именно клетки в организме поражает вирус. Они обнаружили, что после того, как вирус заражает иммунные клетки, они легко узнаются иммунными клетками другого типа, так называемыми Т-киллерами (убийцами). Киллеры разрушают зараженные вирусом клетки, препятствуя дальнейшему размножению вируса. Клетки-убийцы несут на своей поверхности особую молекулу - рецептор CD8. Она, как принимающая антенна, "узнает" сигналы от клеток, зараженных вирусом, и клетки-убийцы уничтожают их. Если из крови удалить все клетки, несущие молекулу CD8, то вскоре в организме обнаруживаются многочисленные вирусные частицы, происходит быстрое размножение вируса и разрушение лимфоцитов. Не в этом ли ключ к разгадке?
В 1995 году группа американских ученых под руководством Р. Галло обнаружила вещества, которые вырабатываются в клетках-киллерах, несущих молекулы CD8, и подавляют размножение ВИЧ. Защитные вещества оказались гормоноподобными молекулами, называемыми хемокинами. Это небольшие белки, которые прикрепляются к молекулам-рецепторам на поверхности иммунных клеток, когда клетки направляются к месту воспаления или заражения. Оставалось найти "ворота", сквозь которые проникают в иммунные клетки вирусные частицы, то есть понять, с какими именно рецепторами взаимодействуют хемокины.
Ахиллесова пята иммунных клеток
Вскоре после открытия хемокинов Эдвард Бергер, биохимик из Национального института аллергических и инфекционных болезней в Бетезде, США, обнаружил в иммунных клетках, в первую очередь поражаемых вирусом (их называют клетки-мишени), сложный по строению белок. Этот белок как бы пронизывает мембраны клеток и содействует "посадке" и слиянию вирусных частиц с оболочкой иммунных клеток. Бергер назвал этот белок "фузин", от английского слова fusion - слияние. Оказалось, что фузин родствен белкам-рецепторам хемокинов. Не служит ли этот белок "входными воротами" иммунных клеток, через которые вирус проникает внутрь? В таком случае взаимодействие с фузином какого-нибудь другого вещества закроет доступ вирусным частицам в клетку: представьте, что в скважину замка вставляется ключ, и вирусная "лазейка" исчезает. Казалось бы, все встало на свои места, и взаимосвязь хемокины - фузин - ВИЧ уже не вызывала сомнений. Но верна ли эта схема для всех типов клеток, зараженных вирусом?
Пока молекулярные биологи распутывали сложный клубок событий, происходящих на поверхности клеток, генетики продолжали поиск генов устойчивости к вирусу иммунодефицита у людей. Американские исследователи из Национального института рака получили культуры клеток крови и различных тканей от сотен пациентов, зараженных ВИЧ. Из этих клеток выделили ДНК для поиска генов устойчивости.
Чтобы понять, насколько сложна эта задача, достаточно вспомнить, что в хромосомах человека содержится около 100 тысяч различных генов. Проверка хотя бы сотой доли этих генов потребовала бы нескольких лет напряженной работы. Круг генов-кандидатов заметно сузился, когда ученые сосредоточили свое внимание на клетках, которые прежде всего поражает вирус, - так называемых клетках-мишенях.
Уравнение со многими неизвестными
Одна из особенностей вируса иммунодефицита заключается в том, что его гены внедряются в наследственное вещество зараженной клетки и "затаиваются" там на время. Пока эта клетка растет и размножается, вирусные гены воспроизводятся вместе с собственными генами клетки. Затем они попадают в дочерние клетки и заражают их.
Из множества людей с высоким риском заражения ВИЧ отобрали зараженных вирусом и тех, кто не стал носителем ВИЧ, несмотря на постоянные контакты с больными. Среди зараженных выделили группы относительно здоровых и людей с быстро развивающимися признаками СПИДа, которые страдали сопутствующими заболеваниями: пневмонией, раком кожи и другими. Ученые изучили разные варианты взаимодействия вируса с организмом человека. Различный исход этого взаимодействия, по-видимому, зависел от набора генов у обследованных людей.
Выяснилось, что люди, устойчивые к СПИДу, имеют мутантные, измененные гены рецептора хемокинов - молекулы, к которой прикрепляется вирус, чтобы проникнуть в иммунную клетку. У них контакт иммунной клетки с вирусом невозможен, поскольку нет "принимающего устройства".
В это же время бельгийские ученые Михаэль Симпсон и Марк Парментье выделили ген другого рецептора. Им оказался белок, который также служит рецептором для связывания ВИЧ на поверхности иммунных клеток. Только взаимодействие этих двух молекул-рецепторов на поверхности иммунной клетки создает "посадочную площадку" для вируса.
Итак, основными "виновниками" заражения клеток вирусом иммунодефицита служат молекулы-рецепторы, названные CCR5 и CD4. Возник вопрос: что происходит с этими рецепторами при устойчивости к ВИЧ?
В июле 1996 года американская исследовательница Мэри Керингтон из Института рака сообщила, что нормальный ген рецептора ССR5 обнаруживается лишь у 1/5 обследованных ею пациентов. Дальнейший поиск вариантов этого гена среди двух тысяч больных дал удивительные результаты. Оказалось, что у 3% людей, не заразившихся вирусом, несмотря на контакты с больными, ген рецептора ССR5 измененный, мутантный. Например, при обследовании двух нью-йоркских гомосексуалистов - здоровых, несмотря на контакты с зараженными, выяснилось, что в их клетках образуется мутантный белок CCR5, не способный взаимодействовать с вирусными частицами. Подобные генетические варианты были найдены лишь у американцев европейского происхождения или у выходцев из западной Азии, у американцев же африканского и восточноазиатского происхождения не нашли "защитных" генов.
Оказалось также, что устойчивость некоторых пациентов к инфекции лишь временная, если они получили "спасительную" мутацию только от одного из своих родителей. Через несколько лет после заражения количество иммунных клеток в крови таких пациентов снижалось в 5 раз, и на этом фоне развивались сопутствующие СПИДу осложнения. Таким образом, неуязвимыми для ВИЧ были только носители сразу двух мутантных генов.
Но у обладателей одного мутантного гена признаки СПИДа все же развивались медленнее, чем у носителей двух нормальных генов, и такие больные лучше поддавались лечению.
Не так давно исследователи обнаружили разновидности чрезвычайно агрессивных вирусов. Людей, зараженных такими вирусами, не спасает даже присутствие двух мутантных генов, обеспечивающих устойчивость к ВИЧ.
Это заставляет продолжать поиск генов устойчивости к ВИЧ. Недавно американские исследователи О'Брайн и М. Дин с коллегами обнаружили ген, который, присутствуя у людей лишь в одной копии, задерживает развитие СПИДа на 2-3 года и более. Значит ли это, что появилось новое оружие в борьбе с вирусом, вызывающим СПИД? Скорее всего, ученые приоткрыли еще одну завесу над загадками ВИЧ, и это поможет медикам в поисках средств лечения "чумы ХХ века". В многочисленных популяциях американцев афро-азиатского происхождения мутантные гены так и не найдены, но тем не менее есть небольшие группы здоровых людей, контактировавших с зараженными. Это говорит о существовании других генов защиты иммунной системы от страшной инфекции. Пока можно лишь предполагать, что в различных популяциях человека сложились свои системы генетической защиты. По-видимому, и для других инфекционных заболеваний, включая вирусный гепатит, также имеются гены устойчивости к вирусам-возбудителям. Теперь уже никто из генетиков не сомневается в существовании таких генов для вируса иммунодефицита. Исследования последних лет дали надежду найти решение такой, казалось бы, неразрешимой проблемы, как борьба со СПИДом. Кто станет победителем в противоборстве ВИЧ - человек, покажет будущее.
КАК ЛЕЧИТЬ СПИД. ПОИСК СТРАТЕГИИ
Результаты исследований последних лет заставили задуматься не только ученых и практических врачей, занимающихся проблемами СПИДа, но и фармацевтов. Раньше основное внимание уделялось комбинированному лечению инфекции, направленному против вируса. Применялись препараты, препятствующие размножению вируса в клетке: невипарин и атевирдин. Это так называемая группа ингибиторов обратной транскриптазы ВИЧ, которые не дают наследственному материалу вируса внедряться в ДНК иммунных клеток. Их сочетают с аналогами нуклеозидов типа зидовудина, диданозина и ставудина, которые облегчают течение болезни. Однако эти средства токсичны и обладают побочными действиями на организм, поэтому их нельзя считать оптимальными. Им на смену все чаще приходят более совершенные средства воздействия на ВИЧ.
В последнее время появилась возможность препятствовать "посадке" вирусных частиц на поверхность клеток. Известно, что этот процесс происходит за счет связывания вирусного белка gр120 с клеточными рецепторами. Искусственное блокирование мест связывания ВИЧ с помощью хемокинов должно защищать клетки от вторжения ВИЧ. Для этого нужно разработать специальные препараты-блокаторы.
Другой путь - получение антител, которые будут связываться с рецепторами ССR5, создающими "посадочную площадку". Такие антитела будут препятствовать взаимодействию этих рецепторов с вирусом, не давая доступа ВИЧ в клетки. Кроме того, можно вводить в организм фрагменты молекул ССR5. В ответ на это иммунная система начнет вырабатывать антитела к данному белку, которые также перекроют доступ к нему вирусных частиц.
Наиболее дорогостоящий способ обезопасить вирусные частицы - ввести в иммунные клетки новые мутантные гены. В результате сборка рецептора для "посадки" вируса на поверхности "оперированных" клеток прекратится, и вирусные частицы не смогут заразить такие клетки. Подобная защищающая терапия, по-видимому, наиболее перспективна при лечении больных СПИДом, хотя и весьма дорого стоит.
При лечении сопровождающих СПИД раковых заболеваний врачи чаще всего прибегают к высоким дозам химических препаратов и к облучению опухолей, что нарушает кроветворение и требует пересадки больным здорового костного мозга. А что, если в качестве донорских кроветворных клеток пересадить больному костный мозг, взятый от людей, генетически устойчивых к инфекции ВИЧ? Можно предположить, что после такой пересадки распространение вируса в организме пациента будет остановлено: ведь донорские клетки устойчивы к инфекции, поскольку не имеют рецепторов, позволяющих вирусу проникнуть через клеточную мембрану. Однако эту привлекательную идею вряд ли удастся воплотить в практику полностью. Дело в том, что иммунологические различия между пациентом и донором, как правило, приводят к отторжению пересаженной ткани, а иногда и к более серьезным последствиям, когда донорские клетки атакуют чужеродные для них клетки реципиента, вызывая их массовую гибель.
Т-киллеры - иммунные клетки, которые уничтожают зараженные вирусом клетки.
Рецепторы клеток - особые молекулы на поверхности, которые служат "опознавательным знаком" для вирусных частиц и других клеток.
Ген рецептора - ген, ответственный за выработку соответствующего белка.
Хемокины - гормоноподобные вещества на поверхности иммунных клеток, которые подавляют размножение вируса в организме.
Культура клеток - клетки, развивающиеся вне организма, в питательной среде пробирки.
Мутантные гены - измененные гены, не способные контролировать выработку нужного белка.
Клетки-мишени - иммунные клетки, которые в первую очередь поражает вирус.
- Сегодня в мире 29 миллионов зараженных вирусом иммунодефицита. 1,5 миллиона человек уже умерли от вызванного этим заражением СПИДа.
- Самый неблагополучный по СПИДу регион - Африка. В Европе лидируют Испания, Италия, Франция, Германия. С 1997 года к этим странам присоединилась Россия. На территории бывшего СССР зараженность ВИЧ распределяется так: 70% - Украина, 18,2% - Россия, 5,4% - Беларусь, 1,9% - Молдова, 1,3% - Казахстан, остальные - менее 0,5%.
- К 1 декабря 1997 года в России официально зарегистрировано около 7000 зараженных вирусом иммунодефицита, в основном при передаче инфекции половым путем.
- В России и странах ближнего зарубежья существует более 80 центров по профилактике и борьбе со СПИДом.
Читайте также:


