Генная инженерия в лечении вич
Ученые из РНИМУ имени Н. И. Пирогова совместно со специалистами из Научного центра им. Кулакова и МГУ создали человеческие эмбрионы с геномом, определяющим устойчивость к заражению вирусом иммунодефицита человека (ВИЧ).

Результатов удалось добиться благодаря редактированию генома эмбрионов на стадии одной клетки (зиготы) при помощи системы CRISPR-Cas9. Редактирование зигот заключалось в вырезании 32 нуклеотидов из последовательности гена CCR5, кодирующего рецептор, за который вирус прикрепляется клеткам крови.
Некоторая часть людей на Земле естественным образом обладает именно таким вариантом гена CCR5? и у них выявлена повышенная устойчивость к заражению ВИЧ. Подобная технология в будущем может помочь защитить от заражения вирусом иммунодефицита детей ВИЧ-инфицированных матерей с плохим ответом на противовирусную терапию.
Об успехах российских ученых в области борьбы с ВИЧ, а также о задачах генной инженерии корреспондент "Правды.Ру" побеседовал с Денисом Ребриковым, доктором биологических наук, профессором РАН, проректором по научной работе РНИМУ им. Н. И. Пирогова, заведующим лабораторией редактирования генома НМИЦ АГП им. В. И. Кулакова.
— Хотелось бы узнать подробности по вопросу создания устойчивых к ВИЧ человеческих эмбрионов?
— Вообще работать с системами редактирования генома эмбрионов человека начали не так давно. Первая попытка была предпринята китайскими исследователями в 2015 году, три года назад. Их работа с очень большим трудом пробивала себе дорогу в качестве публикации, поскольку научные журналы на тот момент плохо понимали, можно ли публиковать такие данные и насколько законодательно разрешено делать такие эксперименты. Изменение генома человека на уровне эмбриона — это новое направление, и оно пока плохо проработано как с точки зрения законодательной, так и на уровне восприятия обществом.
Наше общество очень консервативно. Даже ГМО, используемые в сельском хозяйстве уже более 30 лет, до сих пор вызывают у людей неоднозначное отношение. Уже два поколения выросло на ГМО. Многочисленные исследования доказали, что ГМО безопаснее для человека, чем "классические" сельхозтехнологии. А общество по-прежнему с опаской относится к растениям и животным, созданным с применением методов генной инженерии.
Но это и естественно: люди всегда с большим подозрением относятся к тому, чего они не понимают. Для них это черный ящик, красиво подаваемый в кинотеатрах блокбастерами о сумасшедших ученых, делающих мутантов в своих лабораториях. Поэтому вхождение технологий изменения генома эмбрионов человека в медицинскую практику будет трудным в первую очередь из-за восприятия обществом.
Возвращаясь к истории редактирования генома эмбрионов, следует уточнить, что, по сути, изменение ДНК проводят не на эмбрионе как таковом, а на одной-единственной клетке — зиготе, которая получается в результате оплодотворения: слияния яйцеклетки и сперматозоида. Зигота — это первая клетка, из которой развивается организм человека. Соответственно, самый удобный момент, когда мы можем поменять генетическую программу так, чтобы она была изменена во всем организме, — это стадия зиготы.
Хотя идея изменения генома зиготы лежит на поверхности, ее практическое воплощение до последнего времени было крайне трудоемким из-за недоразвитости технологий. Однако в последние три-четыре года появились высокоэффективные методы направленного изменения генома, основанные на бактериальной системе CRISPR/Cas.
— А какие стоят задачи перед этой генной технологией?
— Если говорить про изменение генома человека на уровне эмбриона, то медицинских задач под эту технологию сегодня не так уж и много. Дело в том, что появления большинства моногенных наследственных заболеваний у ребенка от данной пары родителей можно избежать и без изменения генома — простым отбором здорового эмбриона в рамках процедуры ЭКО.
Одна из потенциально актуальных задач для геномной медицины — создание ВИЧ-резистентных эмбрионов. Но в наших исследованиях выбор именно этой модели был не столько ради решения конкретной медицинской задачи, сколько ради отработки технологии точного внесения изменений в геном человека на уровне одной клетки. Сегодня для нас важнее понимать, что мы это умеем делать, что мы контролируем результат и что технология ведет себя предсказуемо.
При этом выбранная нами модель удобна тем, что мы, по сути, не создаем новый генотип, а лишь меняем один природный вариант на другой. Дело в том, что у некоторых людей (чаще в североевропейской популяции) присутствует вариант гена одного из поверхностных рецепторов клетки — химокинового рецептора 5 (CCR5), который неудобен для прикрепления вируса иммунодефицита к поверхности клетки. Оказалось, что такой "протективный" рецептор защищает клетки человека от проникновения вируса. Человек-носитель такого варианта CCR5 естественным образом защищен от ВИЧ-инфекции.
Геномное редактирование позволяет превратить обычный вариант рецептора в "протективный". Причем поменять код можно прямо на стадии одной клетки для любого эмбриона, даже если его родители не несли "протективного" варианта. То есть родители, у которых не было ВИЧ-резистентности, произведут на свет ребенка с ВИЧ-устойчивостью, потому что мы произведем небольшое изменение ДНК на стадии зиготы.
Повторю, плюс именно этой модели в том, что мы не выдумываем новый вариант гена, мы лишь переводим один-естественный вариант в другой, также присутствующий в человеческой популяции.
Теперь давайте посмотрим, где такую модификацию генома можно было бы применять на практике (в медицине). Известно, что большинство пациентов хорошо поддается лечению от ВИЧ современными препаратами и сегодня при правильной терапии человек с ВИЧ живет столько же, сколько без ВИЧ. Сама по себе ВИЧ-инфекция сегодня не является и противопоказанием для реализации репродуктивной функции: почти все дети у мам на антиретровирусной терапии рождаются без ВИЧ.
Но есть люди, у которых ответ на антиретровирусную терапию гораздо слабее, видимо, в связи с их индивидуальными генетическими особенностями. Если это молодая женщина и ей хочется реализовать репродуктивный потенциал, риск рождения ребенка с ВИЧ для нее будет гораздо выше среднего. Таким женщинам в будущем можно было бы предлагать сделать плод ВИЧ-резистентным, дабы уйти от риска ВИЧ-инфицирования.
Беседовала Лада Коротун
К публикации подготовила Светлана Широкова

Лекарства, полученные с помощью генной инженерии и клеточных технологий, вряд ли в ближайшие годы станут столь массовыми, что обгонят по продажам антибиотики и жаропонижающие. Но эти современные препараты незаменимы в лечении некоторых видов рака, редких наследственных заболеваний, терапии ВИЧ и других вирусных инфекций. А это большой рынок с потенциальным оборотом в десятки миллиардов долларов.
Стволовые клетки и генная инженерия
Генная терапия — общее название для технологий (а также соответствующих лекарств), которые используют изменение генов для достижения нужных медицинских эффектов. Например, в организм пациента могут доставить ген, кодирующий определенный белок. Когда нужная ДНК попадет в клетки, те смогут начать производство данного протеина, что будет иметь лечебное воздействие.
Что касается клеточной терапии, она в большинстве случаев представляет собой лечение стволовыми клетками. Они могут развиться в клетки любого типа, любого органа, если правильно управлять их ростом. И эту науку ученые освоили, но важно было еще и получить достаточный запас стволовых клеток. Проблему решил японский ученый Синья Яманака, который в 2006 году впервые смог получить индуцированные плюрипотентные стволовые клетки, то есть вернуть клетки взрослого человека в то состояние, когда из них может вырасти что угодно. Перед наукой открылись захватывающие перспективы: можно выращивать новые органы, восстанавливать поврежденные участки нервной системы, лечить заболевания крови — все это становится возможным с применением стволовых клеток.
Генный рынок
В 2016 году рынок препаратов для генной терапии оценивался в $584 млн. А к 2023 году, по прогнозам аналитиков, глобальная выручка от продажи таких препаратов превысит $4,4 млрд — это более 30% роста ежегодно.
Среди лидеров рынка как традиционные фармацевтические гиганты (такие, как Novartis и GlaxoSmithKline), так и более специализированные компании (Spark Therapeutics, Bluebird bio, Amgen, Celgene).
Как следует из отчета Allied Market Research, подавляющее большинство препаратов генной терапии производится для больных с онкологическими патологиями. И в ближайшее время — как минимум до 2023 года — эта ниша сохранит свое первенство на рынке. Следом за лекарствами от рака идут средства генной терапии от редких заболеваний, сердечнососудистых болезней, неврологических расстройств, инфекций.
Лидеры рынка следуют за трендами и разрабатывают препараты для онкобольных. Например, в компании Amgen, которая возглавила топ-25 биотехнологических компаний в 2017 году с капитализацией в $129,1 млрд, из 37 препаратов в стадии клинических испытаний 20 относятся к лечению опухолей и заболеваний крови.
А компания Novartis стала первой, кому американское управление по санитарному надзору за качеством пищевых продуктов и медикаментов (Food and Drug Administration, FDA) разрешило запустить массовое производство клеточной терапии рака, основанной на генетической модификации. Это тот самый случай, когда фармкомпания производит лекарство из Т-лимфоцитов, превращая их в средство борьбы с онкологией, а именно с острым лимфобластным лейкозом.
Novartis уже начала получать первые деньги от продажи своего препарата под названием Kymriah. И немалые — каждый курс генной терапии рака стоит порядка $475 000. Вслед за этим FDA одобрило еще одно лекарство для лечения онкологии с подобным механизмом действия — Yescarta от компании Gilead Sciences (капитализация в 2017 году — $103 млрд); оно будет продаваться по цене в $373 000 за курс и помогать больным с неходжкинской лимфомой.
На продажах Kymriah фармгигант Novartis сможет зарабатывать порядка $300 млн в год. А Gilead Science аналитики пророчат выручку от препарата Yescarta в $250 млн за 2018 год.
Novartis хочет расширить спектр применения своего лекарства, чтобы его также можно было назначать пациентам с неходжкинской лимфомой — это позволит компании побороться за рынок, который оценивают примерно в $1 млрд. Но фармгиганту придется конкурировать не только с Gilead Sciences, которые уже предложили свое — и более дешевое — решение, но и с Bluebird Bio и Juno Therapeutics, разрабатывающими аналогичные продукты.
Прибыльность клеточной генной терапии аналитики пока затрудняются оценить. Но по их данным, стоимость производства подобных лекарств от рака должна составлять не менее $200 000 за курс.
По-настоящему революционные открытия, которые происходят на рынке генной терапии и грозят перевернуть фармацевтический рынок (как минимум в области лечения онкологии), привлекают в отрасль инвестиции: за последние пять лет компании-производители получили порядка $600 млн венчурного капитала на свои разработки.
Рыночные перспективы стволовых клеток
По прогнозу аналитиков из Grand View Research, рынок препаратов, основанных на стволовых клетках, к 2025 году достигнет $15,6 млрд. Сегодня самые перспективные сферы применения стволовых клеток — это лечение болезни Паркинсона и болезни Альцгеймера, а также повреждений спинного мозга, сахарного диабета первого типа, заболеваний крови и онкологии.
Но пока что даже топовые компании, занимающиеся стволовыми клетками, не могут похвастаться такими же масштабами, как их коллеги по генной терапии. Например, крупнейшая компания, которая торгуется на бирже NASDAQ — Sangamo Therapeutics, — имеет капитализацию всего в $2,1 млрд.
В данный момент Sangamo Therapeutics разрабатывает два вида терапии на основе собственных — аутологичных — стволовых клеток для лечения заболеваний крови. Если производитель добьется успеха, то с помощью этих препаратов можно будет лечить такие генетические болезни крови, как бета-талассемия и серповидноклеточная анемия.
Что дальше?
По всем оценкам, рынок клеточной и генной терапии в ближайшие годы будет активно развиваться, и средний годовой рост продаж составит не менее 30%. Новые открытия в сфере генной терапии обещают 2200 клинических испытаний, которые проводятся по всему миру: ученые ищут средства от различных видов рака, редких генетических нарушений, болезни Паркинсона, ВИЧ и других болезней.
Впереди планеты всей, как всегда, США — около 55% исследований происходят именно там. Также разработками в сфере генной терапии занимаются в Европе, Канаде и Китае. Один препарат, созданный при участии генной инженерии, запустили и в России — это Неоваскулген, лекарство, призванное помочь при ишемии нижних конечностей.
Что же касается стволовых клеток, рост рынка ожидается в результате появления новых препаратов регенеративной медицины — сейчас многие из них находятся в стадии разработки. Большинство исследований проходят в США, но новые решения в области стволовых клеток также появляются в Сингапуре и Японии.
19 октября 2016
- 6823
- 5,6
- 1
- 8
Система CRSIPR/Cas9 удалит вирусную информацию в геноме человека, зараженного ВИЧ

Генеральным спонсором конкурса, согласно нашему краудфандингу, стал предприниматель Константин Синюшин, за что ему огромный человеческий респект!
CRISPR/Cas9
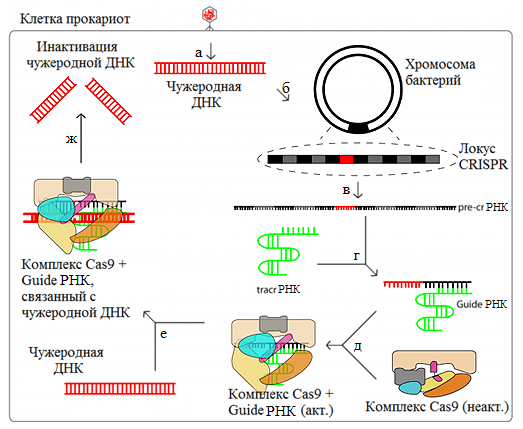
Рисунок 1. Система CRISPR/Cas9 как один из вариантов бактериального иммунитета. а — Внедрение чужеродной ДНК в клетку бактерии. б — Приобретение спейсера. в — Транскрипция CRISPR-локуса. г — Образование guideРНК. д — Образование активного комплекса Cas9 + guideРНК. е — Связывание чужеродной ДНК. ж — Внесение двухцепочечного разрыва в ДНК. Сокращения см. в тексте.
Но затем в 2012 году бактериальную защитную систему взяли на вооружение ученые, ведь если соединить Cas9 с определенной РНК, то можно разрезать необходимый ген. Разрезанный ген запускает в клетке систему репарации, которая в буквальном смысле пытается соединить концы с концами. При этом происходят различные мутации репарируемого гена — в основном удаления, но бывают и разные вставки. Однако если мы предоставим матрицу для репарации, ген может вернуться к правильной форме. Так можно вносить любые изменения в геном. Это означает, что мы в теории можем лечить генетические заболевания, рак и не только. Сегодня мы поговорим о том, как CRISPR/Cas9 поможет решить проблему избавления от вируса иммунодефицита человека (ВИЧ).
ВИЧ — возбудитель синдрома приобретенного иммунодефицита (СПИДа) — относится к роду лентивирусов семейства ретровирусов, чей геном представлен двумя копиями одноцепочечной РНК, на двух концах которой находятся длинные концевые повторы (или по-английски long terminal repeat, LTR) [7]. В самой вирусной частице содержатся еще три фермента: протеаза, обратная транскриптаза и интеграза (рис. 2). Протеаза расщепляет продукты считывания вирусных генов с образованием зрелых белков.
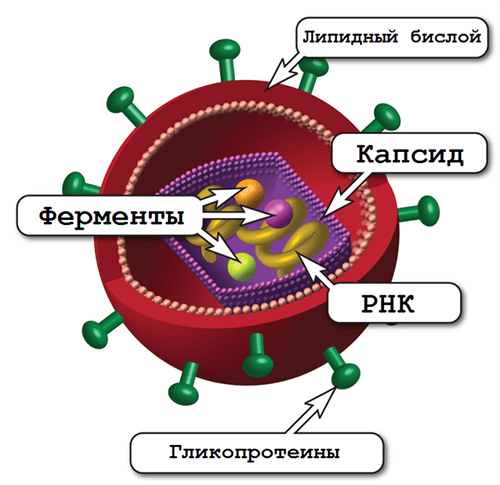
Рисунок 2. Строение вириона ВИЧ. Частица покрыта липидным бислоем, происходящим из клеточной мембраны организма-хозяина, и усеяна молекулами вирусных гликопротеинов.
Жизненный цикл ВИЧ довольно прост (рис. 3). Вначале вирус инфицирует клетку, причем в качестве рецептора служит молекула CD4, а корецепторами становятся рецепторы хемокинов, поэтому поражаются клетки иммунной системы: T-лимфоциты (T-хелперы), моноциты, макрофаги, а также клетки мозга (макрофаги, микроглия, астроциты), клетки лимфоидной ткани желудочно-кишечного тракта и другие. Затем одноцепочечный РНК-геном с помощью обратной транскриптазы превращается в двухцепочечную ДНК, так называемую провирусную ДНК. Наконец интеграза встраивает двухцепочечную провирусную ДНК в геном хозяина. Эта встроенная информация считывается, причем промоторами (то есть местами, привлекающими РНК-полимеразу для транскрипции) служат длинные концевые повторы — LTR. Собираются новые вирусные частицы, поражающие новые клетки. В целом весь этот процесс приводит к частым мутациям вируса, особенно вариабельны поверхностные гликопротеины, в том числе поэтому частицы ВИЧ так неуловимы для нашего иммунитета [8], [9].
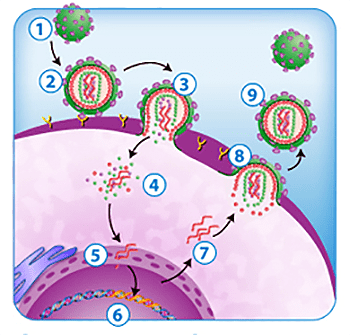
Рисунок 3. Жизненный цикл ВИЧ. 1 — зрелая вирусная частица; 2 — связывание с клеткой благодаря рецепторам; 3 — слияние мембран вируса и клетки; 4 — высвобождение вирусной РНК; 5 — превращение РНК в ДНК (обратная транскрипция); 6 — интеграция в геном клетки; 7 — считывание вирусной информации; 8 — сборка и выход вирусной частицы; 9 — новая вирусная частица.
Терапия ВИЧ

Рисунок 4. Удаление провируса из генома человека приведет к невозможности размножения и распространения вируса.
Современная высокоактивная антиретровирусная терапия основывается на ингибировании обратной транскриптазы, протеазы, интегразы, слияния вируса с клеткой, что значительно осложняет жизнь вируса. Но все же ВИЧ-инфекция в настоящий момент остается неизлечимым заболеванием, так как такая терапия никак не влияет на ДНК вируса у нас в геноме: у пациентов, принимающих антиретровирусную терапию, около 10 6 клеток содержат провирус. Сверх того, у пациентов могут быть серьезные побочные эффекты или устойчивость к антиретровирусной терапии [10].
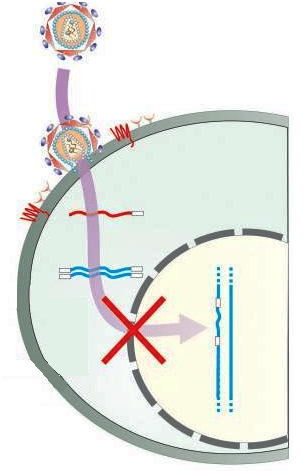
Рисунок 5. Система CRISPR/Cas9, интегрированная в клетки, может препятствовать их заражению вирусом и интеграции вируса в геном.
Предложенная система протестирована японскими учеными в 2013 году на культуре клеток человеческих T-лимфоцитов [8]. В качестве мишени они предложили использовать LTR, а в них — разные участки, необходимые для связывания факторов инициации и элонгации транскрипции. Трехкратное внесение в клетки конструкции CRISPR/Cas9 снижало считывание вирусного генома почти в 3 раза (с 97,8% до 35,5%). Дальнейший анализ показал, что почти все клетки содержали в области провируса различные мутации.
Так как LTR — это концевые повторы, то разрезание с двух концов теоретически может привести к полному вырезанию встроенного в геном вирусного куска. И действительно — почти у трети клеток (31,8%) после трехкратного внесения системы CRISPR/Cas9 этот участок полностью удалялся.
А что насчет мутаций вируса? Ведь если целевой участок изменит свою структуру, система CRISPR/Cas9 не сможет его найти и обезвредить. Понимая это, ученые выбрали именно тот участок LTR, что содержит высококонсервативные последовательности ДНК, практически одинаковые у всех подвидов ВИЧ.
Не все так просто

Рисунок 6. Повышение специфичности разрезания гена с использованием никаз, вносящих одноцепочечные разрывы.
Предложенная система изменения генов не так чудесна, как может показаться на первый взгляд, как бы я ни старалась вас в этом убедить. Есть много подводных камней, которые требуют дальнейшего исследования.
Одной из главных проблем этого метода остается его эффективность. Зачастую работы по прицельному изменению одного участка требуют много времени и средств, но не приводят к 100% результату: не все мишени удается найти и исправить.
Таким образом, стремительно развивающаяся генная терапия с использованием CRISPR/Cas9 — ключ к избавлению от ВИЧ-инфекции и ассоциированных с ней заболеваний и осложнений. Однако не стоит ожидать, что такое лекарство сегодня-завтра появится на прилавках в аптеке, ведь еще о многом стоит подумать, чтобы разработать действительно эффективное и безопасное лечение.
Поделиться сообщением в
Внешние ссылки откроются в отдельном окне
Внешние ссылки откроются в отдельном окне
Запомните аббревиатуру CRISPR уже сегодня, потому что завтра она, вероятнее всего, изменит ваше будущее.
Технология CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats) произносится как "криспер" и представляет собой биологическую систему для изменения ДНК. Технология эта, известная также как генная инженерия, может изменить будущее всей планеты.
Звучит как довольно смелое заявление, но именно такого мнения придерживаются многие ведущие мировые генетики и биохимики.
CRISPR была открыта в 2012 году молекулярным биологом, профессором Дженнифер Дудной. Ее команда ученых в Университете Беркли в Калифорнии изучала, как бактерии защищаются от вирусной инфекции.
Сейчас профессор Дудна и ее коллега Эммануэль Шарпентье входят в число самых влиятельных ученых мира. Природный механизм, который они обнаружили в ходе своих исследований, может быть использован биологами для того, чтобы вносить точечные изменения в любую ДНК.
"С тех пор как мы опубликовали свое исследование четыре года назад, многие мировые лаборатории стали применять эту технологию на животных, растениях, людях, грибках, других бактериях - другими словами, практическими на каждом изучаемом организме", - рассказала профессор в интервью Би-би-си.
Когда бактерию атакует вирус, она производит генетический материал, соответствующий генетической последовательности нападающего.
Этот материал в сочетании с ключевым белком Cas9 может прикрепиться к ДНК вируса, взломать генетический код и нейтрализовать вирус.
Теперь ученые могут применять эту же схему, чтобы вставлять в ДНК новые элементы, удалять или исправлять ее участки.
Этот процесс настолько точный, что ученые могут перебрать миллиарды химических комбинаций, составляющих ДНК клетки, чтобы внести в генетический код какое-то конкретное ключевое изменение.
Важно и то, что это простой и недорогой метод. Поэтому он ускорит все виды исследований - от создания генетически модифицированных моделей человеческих болезней у животных до поиска мутаций ДНК, которые провоцируют возникновение заболеваний или, наоборот, предохраняют от них.
Когда и как мы сможем начать ощущать на себе последствия лечения с применением CRISPR? Учитывая, что этой технологии всего лишь несколько лет, неудивительно, что испытания ее на пациентах еще не начались, однако некоторые эксперименты уже находятся на стадии планирования.
Бостонская биотехническая фирма Editas Medicine планирует запустить клинические испытания первого генномодифицирующего лекарства к 2017 году. Предполагается, что при его помощи можно будет лечить амавроз Лебера (LCA10) - редкое заболевание сетчатки глаза, которое приводит к слепоте, так как в результате мутации генов происходит постепенная утрата расположенных в глазу фоторецепторов.
Цель - лечение рака
В области биотехнологий существует сразу несколько недавно созданных фирм, которые надеются внедрить применение технологии CRISPR в больницах.
Они предполагают, что "крисперы" могут быть использованы для усиления функций Т-клеток организма, что может улучшить способность иммунной системы распознавать раковые клетки и бороться с ними. Еще одна потенциальная область применения технологии - лечение заболеваний крови и иммунной системы.
Лишь одно омрачает будущее CRISPR – борьба за патент на технологию. С одной стороны, на него претендует команда профессора Дудны, с другой – группа ученых из Бостона, штат Массачусетс.
Это вряд ли остановит исследователей в применении "крисперов", но может серьезно повлиять на то, кто получит финансовую выгоду от новой технологии.
Две более ранние технологии генной инженерии уже применяются на практике.
Одна из них – TALENs – в прошлом году была использована в лондонской больнице Грейт-Ормонд-стрит для успешного лечения рака. У пациентки Лайлы Ричардс была агрессивная форма лейкемии, и ей не помогало никакое лечение. На сегодняшний день Ричардс остается первым и единственным человеком, чья жизнь была спасена при помощи редактирования генома.
Первые в мире испытания генной инженерии происходили в Калифорнии с использованием другой технологии - ZFNs.
Тогда иммунные клетки были изъяты из крови около 80 пациентов с ВИЧ. Затем ученые удалили ген под названием CCR5, который ВИЧ-инфекция использует для доступа к клеткам.
Лечение было основано на редкой генной мутации, которая дает людям естественный иммунитет к заболеванию.
Одним из волонтеров в том исследовании был Мэтт Чаппелл, который прожил с вирусом большую часть взрослой жизни и имел возможность своими глазами наблюдать тот ужасающий эффект, который ВИЧ и СПИД оказали на гей-сообщество Сан-Франциско.
С тех пор как ген его иммунных клеток был отредактирован, Чаппелл уже два года не пользуется антиретровирусными препаратами.
Несмотря на то что исследования эти были лишь небольшими и экспериментальными, а следовательно, к их результатам нужно относиться с определенной долей осторожности, тем не менее их результаты выглядят многообещающе.
Генетическое лекарство от ВИЧ было опробовано фирмой Sangamo Biosciences (Ричмонд, штат Калифорния), которая обладает эксклюзивной лицензией на технологию ZFN.
Компания собирается начать испытания на пациентах с гемофилией – серьезным заболеванием, связанным с нарушением свертываемости крови, – а также уже работает над лечением бета-талассемии.
Самый спорный вопрос в редактировании генома – это внесение изменений в зародышевую линию клеток человека, то есть тех генов, которые будут передаваться из поколения в поколение.
Теоретически можно было бы изменять ДНК эмбрионов, которые несут в себе ген болезни Хантингтона или муковисцидоза. Однако в таком случае можно говорить и о проведении других генетических "улучшений", что фактически может привести к "генетическому проектированию" младенцев.
Генная инженерия и эмбрионы
Никто из ученых не предлагает (во всяком случае, пока) "производство" генетически модифицированных младенцев. Однако несколько групп китайских ученых уже провели некоторые базовые исследования в этой области, а Великобритания стала первой страной, которая формально разрешила генную модификацию человеческих эмбрионов – исключительно в научных целях.
Исследования будут проходить в лондонском институте Френсиса Крика, который откроется через несколько месяцев. Там будет находиться крупнейшая биомедицинская лаборатория в Европе и центр генной инженерии.
Команда под руководством Кэти Ниакан, недавно вошедшей в список из 100 самых влиятельных людей мира по версии журнала Time, будет использовать CRISPR для редактирования основных генов эмбриона, чтобы выявить генетические ошибки, приводящие к повторяющимся выкидышам. В рамках исследования эмбрионам дадут развиваться лишь несколько дней.
"Я надеюсь на то, что это позволит нам более точно разобраться в механизмах раннего развития человека. Я думаю, что это также поможет выяснить, как мы можем улучшить технологию экстракорпорального оплодотворения, и понять, какие эмбрионы с большей вероятностью продолжать развиваться и приведут к рождению здоровых детей", – сказала в разговоре с Би-би-си Кэти Ниакан.
Этическая сторона
Однако эти исследования вызывают этические вопросы у Марси Дарновски из Центра генетики и общества в Сан-Франциско.
По ее мнению, генетическая модификация человеческих эмбрионов при недостаточно контроле приведет к тому, что рано или поздно в одной из лабораторий будет создан первый генетически модифицированный младенец.
"Найдутся богатые родители, которые захотят приобрести для своего потомства последний "апгрейд". Вполне возможно, что люди разделятся на тех, кто может позволить себе "улучшить" свое потомство, и тех, кому это не по карману или кто не захочет этого делать. А это приведет к еще большему неравенству, чем то, с которым мы уже имеем дело", - считает Дарновски.
Многие ведущие ученые в этой области обеспокоены тем, что потенциально технология может быть использована в интересах евгеники, для создания генетической дискриминации.
В разговоре с Би-би-си профессору Дудна призналась, что ее мучал кошмарный сон. В нем она заходила в темную комнату, в которой спиной к ней сидел человек.
"Когда он повернулся ко мне лицом, я с ужасом поняла, что это Гитлер и что он вызвал меня, чтобы обсудить новую технологию, в использовании которой он очень заинтересован", - рассказала профессор.
По словам Дудны, несмотря на то что очень важно регулировать использование "крисперов", вместе с тем необходимо и прийти к согласию относительно дальнейших действий.
"Я не хочу давать невыполнимых обещаний, но мне кажется, что это поможет положить конец болезням – и мы должны дать шанс ученым и докторам претворить это в жизнь", - говорит профессор.
СПИД – синдром приобретённого иммунного дефицита – впервые заявил о себе в начале 80-х годов XX века. Страх перед этой болезнью аналогичен страху перед чумой или холерой в Средние века. Приобретённый иммунный дефицит наглядно показывает, насколько может быть коварной и безжалостной ДНК (РНК). В то же время сложно найти какой-либо другой наглядный пример того, какую пользу сулит генная инженерия в борьбе с опасными заболеваниями.

Описание СПИДа
Родиной СПИДа считается Центральная Африка. Оттуда опасная болезнь была занесена в страны Карибского бассейна, а затем на Гаити. Из Гаити она попала на американский континент. В 1984 году французским вирусологам удалось выделить вирус, вызывающий иммунный дефицит. Назвали его ВИЧ (вирус иммунодефицита человека). За это открытие Люк Монтанье и Франсуаза Барре-Синусси получили Нобелевскую премию в области медицины.
Суть ВИЧ заключается в том, что он поражает Т-лимфоциты. Это клетки крови, ответственные за иммунитет. Организм заболевшего человека при этом теряет иммунную реакцию на любую инфекцию. Как результат, больной умирает от воспаления лёгких или ещё чего-нибудь подобного.
Передаётся опасный вирус через кровь, то есть точно так же как, к примеру, сывороточный гепатит. Однако в отличии от гепатита и других известных болезней заболевание СПИДом заканчивается летальным исходом практически всегда, так как разрушается иммунная система.
Следует подчеркнуть, что ко времени появления опасного вируса медицинская наука не имела лекарств, способных лечить вирусные болезни. Лечению поддавались только бактериальные болезни, которые побеждались с помощью антибиотиков.
Для ВИЧ характерны два периода. Первый представляет собой длительный инкубационный. При этом какие-либо внешние признаки заболевания отсутствуют. А во время второго периода человек заболевает распространёнными и опасными инфекционными болезнями. Эти особенности сильно задержали обнаружение коварного вируса. Когда, в конце концов, его установили, уже миллионы людей были заражены.
Борьба со СПИДом
Учёные, вступившие в борьбу с опасной болезнью, вооружились последними достижениями генной инженерии и молекулярной биологии. Смертельный вирус они подвергли всестороннему исследованию. При этом была определена полная последовательность нуклеотидов вирусной РНК. Тут следует сказать, что ВИЧ принадлежит к тому классу вирусов, у которых генетическим материалом служит не ДНК, а РНК.
Специалисты разработали специальный тест, который позволял обнаружить коварный вирус в крови. Благодаря тесту, стали выявлять носителей ВИЧ, а также проверять донорскую кровь.
Может показаться, что те исследования, которые предприняли специалисты по всему миру, должны были быстро привести к созданию вакцины. Однако усилия многих тысяч людей не дали желаемых результатов. А дело тут в том, что подобно вирусу гриппа, ВИЧ чрезвычайно быстро меняется. А поэтому вакцинация против одного штамма не защищает против другого. Поиски вакцины продолжаются по сей день, но надежд на её появление гораздо меньше, чем 15 лет тому назад.
Отсутствие вакцины делает врачей беспомощными в борьбе с любой вирусной болезнью. Поэтому в начале 90-х годов прошлого века больные СПИДом потеряли всякую надежду вылечиться. Страшный диагноз означал смертный приговор, а стиль жизни больных кардинально менялся задолго до появления первых симптомов. Окружающие смотрели на таких людей с ужасом. Их сторонились, увольняли с работы.
Но учёные не сдавались. Они поняли, что традиционными методиками страшную болезнь одолеть нельзя. Начались поиски новых нетрадиционных способов борьбы. Самым же главным являлся поиск ахиллесовой пяты у зловредного вируса. Нужно было выявить это критическое звено и ударить по нему специально разработанными лекарствами.
Собственно говоря, слабое место у вируса было обнаружено очень рано. Он принадлежит к классу ретровирусов. У них генетическим материалом является одноцепочечная РНК. Поэтому ещё в 1987 году стали применять производную дидезокситимидина (АЗТ), который способен ингибировать ревертазу.
У ретровирусов важнейшей стадией является синтез копии ДНК вирусной РНК. Поэтому специалисты полагали, что ингибитор ревертазы уничтожит инфекцию. Частично такие ожидания оправдались. АЗТ стал замедлять протекание болезни, но излечить её не мог.
Вначале у больных количество вирусов уменьшалось, а количество Т-лимфоцитов увеличивалось. Но по прошествию небольшого периода времени всё возвращалось на круги своя. А проблема состояла в изменчивости коварного вируса, поэтому очень быстро появлялись мутанты-вирусы, устойчивые к АЗТ.
Специалисты пошли двумя путями. Стали создавать комбинации ингибиторов ревертазы и искать новые лекарства, способные атаковать ферменты, необходимые ВИЧ для размножения.
Был разработан целый ряд новых ингибиторов, отличных от АЗТ. Эти комбинации стали прописывать больным, но вирус быстро к ним приспосабливался, и успеха не было.
Настоящий прорыв в борьбе с инфекцией наступил в конце 90-х годов прошлого века, когда к комбинациям ингибиторов стали добавлять ингибиторы протеаз.
Детально изучая процесс развития ВИЧ в клетках больного человека, специалисты выявили необычный способ созревания белков оболочки вируса. Они образуют капсулу для генетического материла, а именно РНК. Белки синтезируются в клетке на рибосомах и представляют собой длинные полиаминокислотные молекулы, образующие тандем из нескольких белковых цепей. Эти длинные цепи разрезает специальная вирусная протеаза на отдельные белки.
Если протеаза не работает, то вирусные частицы не созревают. Поэтому протеазу подвергли тщательному изучению и определили с помощью метода рентгеноструктурного анализа её атомную структуру. Затем специалисты разработали специфические ингибиторы протеазы ВИЧ.
В результате этого исследователи получили два типа лекарств, способных ингибировать разные, но одинаково критические для опасного вируса ферменты. По отдельности каждый тип лекарств не предотвращает инфекцию. Но если создать из них коктейль и давать больному в течение долгого времени большие дозы, состоящие из различных пропорций лекарств, то число вирусных частиц резко снижается и достигает уровня, когда их уже невозможно детектировать.
Впервые такие коктейли были применены в Нью-Йорке в 1996 году. Их проверили на сотнях больных, а положительный результат превзошёл все ожидания. Можно сказать, что указанный год стал важной вехой в истории здравоохранения. Человек стал побеждать вирусы не путём стимулирования иммунной системы, а с помощью достижений генной инженерии.
Врачи научились воздействовать на самые чувствительные точки цикла размножения вирусов. Если подвергать эти точки мощной атаке, то размножение вируса останавливается ещё до того, как он успевает выстроить защиту от такой атаки.
В наши дни можно говорить о решении проблемы СПИДа в США. Уже давно опустели специальные приюты, где селили больных, обречённых на смерть. Сама же проблема, связанная со смертельной инфекцией, перешла в плоскость образования, финансовых вливаний и политики. Следует знать, что коктейли против опасной болезни очень дорогие, а курс лечения чрезвычайно длинный.
Больным из бедных африканских стран такое лечение не по карману. Тут также следует учитывать низкий уровень гигиены, что приводит к быстрому распространению болезни. В принципе, смертельная эпидемия распространяется из-за незнания населением элементарных вопросов, касающихся биологии, медицины и гигиены. А вот таблеток, способных излечить от такого невежества, не существует.
Читайте также:


