Внутриутробный сепсис плода причины

Сепсис, представляющий собой полиэтиологическое инфекционное генерализованное заболевание, развивается из местных очагов инфекции и расценивается, как правило, в качестве осложнения таких заболеваний [7, 10]. В этой связи он не учитывается в отчетах Росстата, что не позволяет оценить истинные показатели заболеваемости и смертности в стране и регионах [6].
Вместе с тем, в клинике выделяют ранний и поздний неонатальный сепсис [8, 9, 18]. Ранний (врождённый) неонатальный сепсис развивается при внутриутробном (антенатальном) и интранатальном инфицировании, когда клинические симптомы появляются в первые 3 суток жизни. Для позднего неонатального сепсиса характерно постнатальное инфицирование, при этом клиническая манифестация происходит позднее 4-го дня жизни.
Цель работы: сравнительный анализ перинатальной смертности от сепсиса в федеральных округах Российской Федерации в 2010 и 2014 годах.
Материалы и методы исследования
В основу работы положен анализ статистических форм А-05 Росстата за 2010 г. и 2014 г., относящихся к мертворождению и ранней неонатальной смертности, без учета Крымского федерального округа. Данные формы А-05 Росстата представляют собой перекрестные таблицы, в которых по горизонтали представлена патология плода или новорожденного (первоначальная причина смерти), а по вертикали – заболевания или состояния матери, осложнения со стороны плаценты, пуповины и оболочек, патология беременности и родов, обусловившие (способствовавшие) наступлению смерти новорожденного плода или новорожденного. Значимость различий оценивали при помощи критерия Хи-квадрат Пирсона, в том числе с поправкой Йейтса, и точного критерия Фишера в зависимости от количественных характеристик.
Результаты исследования и их обсуждение
Согласно данным статистических форм А-05 Росстата за 2014 г., в целом по Российской Федерации в перинатальном периоде умерло 16989, включая 11593 мертворожденных и 5396 умерших в первые 168 часов жизни. Соответственно этому значения показателя перинатальной смертности в Российской Федерации в 2014 г составили 8,83 ‰, показателя мертворождаемости – 6,02 ‰ и показателя ранней неонатальной смертности – 2,82 ‰.
Для сравнения в 2010 г. родилось живыми 1788948 детей, в перинатальном периоде погибло 13248, в том числе было 8300 мертворожденных и 4948 умерших в первые 168 часов. В результате показатели перинатальной смертности, мертворождаемости и ранней неонатальной смертности составляли 7,37 ‰, 4,62 ‰ и 2,75 ‰ соответственно [12, 13]. Более высокие значения показателей в 2014 г закономерно обусловлены внедрением новых критериев рождения (с 22 недель гестации).
Согласно данным Росстата по Российской Федерации за 2014 г., врожденный сепсис фигурировал в качестве основного заболевания только в 14 (0,12 %) наблюдениях среди всех случаев мертворождения (табл. 1). Для сравнения, в 2010 г, когда статистическому учету подлежали мертворожденные на сроке беременности 28 недель и более, врожденный сепсис был расценен как основное заболевание в 12 наблюдениях, что составило 0,16 % от общего количества мертворожденных. То есть истинный врожденный сепсис крайне редко является причиной гибели плода. Примечательно, что в Южном и Северо-Кавказском федеральных округах такие наблюдения вообще отсутствовали в 2014 г (табл. 1). При этом снижение нижней границы времени регистрации мертворождений с 28 недель до 22 недель практически не отразилось на частоте врожденного сепсиса у мертворожденных.
Количество мертворожденных и умерших новорожденных от врожденного сепсиса в федеральных округах РФ в 2010 г. и 2014 г. (общее количество и процент от общего количества)
Примечание. Здесь и далее РФ – Российская Федерация, ЦФО – Центральный, СЗФО – Северо-Западный, ЮФО – Южный, СКФО – Северо-Кавказский, ПФО – Приволжский, УФО – Уральский, СФО – Сибирский, ДФО – Дальневосточный федеральные округа.
В случаях ранней неонатальной смерти сепсис новорожденных как основное заболевание диагностировался значительно чаще. Однако следует учитывать, что в статистических формах А-05 Росстата сепсис новорожденных не подразделяется на ранний (врожденный) и поздний, что не позволяет провести соответствующий анализ.
В 2010 г в целом по Российской Федерации неонатальный сепсис явился первоначальной причиной смерти у 104 новорожденных, что составило 2,1 % от всех случаев ранней неонатальной смерти. В 2014 г. неонатальный сепсис в качестве основного заболевания отмечался уже у 219 умерших новорожденных (4,06 %) (табл. 1). Чаще всего в 2010 г. смерть новорожденных от сепсиса наблюдалась в Центральном федеральном округе (в 3,01 %), а в 2014 г. – в Уральском (в 8,72 %) и Южном (в 7,0 %) федеральных округах. Наиболее низкие показатели смертности в 2010 г. были зарегистрированы в Северо-Кавказском федеральном округе (в 0,68 %), а в 2014 г. – в Северо-Западном (в 2,24 %) и Приволжском (в 2,33 %) федеральных округах.
То есть снижение нижней границы срока беременности при регистрации рождения с 28 до 22 недель привело к увеличению как абсолютного количества новорожденных, погибших от неонатальный сепсиса, так и его доли среди всех случаев ранней неонатальной смерти. Подобные изменения согласуются с данными литературы, указывающими на более высокий процент гибели новорожденных, родившихся на более ранних сроках гестации и находящихся в так называемой зоне предела жизнеспособности [1]. При сравнении причин смерти новорожденных с экстремально низкой малой тела в 2012 г. и 2013 г. было установлено увеличение частоты встречаемости сепсиса на 20,64 % [4]. Действительно, более высокие показатели смертности новорожденных в 2014 г. обусловлены, на наш взгляд, незавершенностью процессов формирования иммунного ответа у глубоко недоношенных детей, а также необходимостью длительного применения у них различных видов респираторной поддержки, постановки центральных сосудистых катетеров, осуществления большого числа заборов крови и других инвазивных процедур.
К сожалению, в статистических формах А-05 Росстата отсутствуют также данные об этиологии неонатальный сепсиса, что не позволяет изучить особенности танатогенеза в зависимости от возбудителя. Тем не менее, насчитывается более 40 видов условно-патогенных микроорганизмов, которые рассматриваются в качестве возбудителей сепсиса новорождённых [10]. Основным источником условно-патогенной микрофлоры являются бактерии родовых путей беременной женщины. Установлено, что характер возбудителя заболевания во многом зависит от времени инфицирования плода или новорождённого: антенатальное, интранатальное, постнатальное [17].
Кроме того, в материалах Росстата состояния матери, обусловившие смерть плода или новорожденного, представлены в сгруппированном виде, что не позволяет провести подробный анализ факторов риска и звеньев его патогенеза. Тем не менее, ряд сведений, имеющих значение для развития неонатального сепсиса, может быть получен при анализе статистических форм А-05 Росстата.
Чаще всего среди состояний матери, обусловивших раннюю неонатальную смерть от неонатального сепсиса, фигурировали, по данным Росстата за 2010 г., поражения, которые не связаны с настоящей беременностью (группа I). В целом по России они отмечались в 27,9 % наблюдений (табл. 2). При этом частота таких заболеваний и расстройств была значимо ниже (23,5 %) при анализе всех случаев ранней неонатальной смерти (р 0,05). В этой связи следует отметить, что, по мнению В.В. Васильева с соавт. [3], внутриутробные инфекции у плода не возникают при отсутствии инфекции у матери. Соответственно одним из непременных условий успешной ранней диагностики и этиологической верификации внутриутробных инфекций, включая врожденный сепсис, считается полноценное обследование при планировании беременности и в ходе ее.
Группа II представлена поражениями плода и новорожденного, обусловленными осложнениями беременности у матери. В целом по стране они встречались в 14,4 % наблюдений неонатального сепсиса и в 22,6 % всех случаев ранней неонатальной смерти. Следует добавить, что, согласно данным литературы [5, 14], одной из основных причин инфицирования плаценты и плода считается преждевременный разрыв плодных оболочек (Р01.1 МКБ-10). Дородовое излитие околоплодных вод и длительность безводного промежутка более 10,5 ч расцениваются в качестве критериев положительного интранатального прогноза развития тяжелых форм внутриутробных инфекций [2]. При этом частота инфекционных осложнений повышается с увеличением промежутка времени между разрывом плодного пузыря и окончанием родов. Действительно, в наблюдениях смерти от врожденного сепсиса преждевременный разрыв плодных оболочек отмечался, по данным Росстата, несколько чаще (в 5,8 %) по сравнению с общей частотой ее регистрации в качестве звена танатогенеза при ранней неонатальной смерти (3,3 %, р > 0,05).
В 22,1 % наблюдений смерти новорожденных от неонатального сепсиса в РФ в 2010 г. были выявлены изменения в плацентах, составляющие группу III. Наиболее частой патологией последа являлся хориоамнионит, который фигурировал в свидетельствах о перинатальной смерти в 14,4 % наблюдений ранней неонатальной смерти в результате врожденного сепсиса. При этом частота его выявления у новорожденных, умершими в первые 6 суток жизни, составила лишь 2,1 % (р 0,05). Преждевременное излитие околоплодных вод отмечалось в 7,8 % наблюдений неонатального сепсиса, что также значимо превышало частоту развития данного осложнения среди всех погибших новорожденных (3,4 %, р
Основные факты
- Сепсис развивается, когда ответ организма на инфекцию приводит к повреждению его собственных тканей и органов, и может привести к смерти или серьезному ухудшению состояния.
- Глобальное эпидемиологическое бремя сепсиса не поддается точной оценке. Согласно расчетам, он ежегодно развивается более чем у 30 миллионов человек и, возможно, уносит жизни 6 миллионов человек(1). Проблема сепсиса, по всей вероятности, больше всего распространена в странах с низким и средним уровнем доходов.
- Согласно оценкам, каждый год сепсисом страдает 3 миллиона новорожденных и 1,2 миллиона детей (2). Три из десяти случаев смерти в результате неонатального сепсиса предположительно вызваны лекарственно устойчивыми патогенами.
- Каждая десятая смерть в связи с беременностью и родами происходит по причине материнского сепсиса, при этом 95% случаев смерти от материнского сепсиса происходят в странах с низким и средним уровнем доходов (4). Каждый год в связи с материнскими инфекциями, в частности материнским сепсисом, умирает один миллион новорожденных (5).
- Сепсис может быть клиническим проявлением инфекций, приобретенных как за пределами медицинских учреждений, так и внутри их. Инфицирование в связи с оказанием медицинской помощи является одной из наиболее распространенных, если не самой распространенной разновидностью неблагоприятных событий, происходящих в ходе оказания такой помощи, и ежегодно затрагивает миллионы пациентов по всему миру (6). Поскольку такие инфекции нередко устойчивы к антибиотикам, они могут вызывать быстрое ухудшение клинического состояния.
Общая информация
Сепсис — это опасная для жизни дисфункция внутренних органов, вызванная нарушением регуляции ответа организма на инфекцию (7). Если сепсис не распознать на ранней стадии не обеспечить своевременное лечение, он может вызвать септический шок, полиорганную недостаточность и смерть. Сепсис может быть вызван любым типом инфекционного патогена. Устойчивость к противомикробным препаратам является ведущим фактором, вызывающим отсутствие клинического ответа на лечение и быстрое развитие сепсиса и септического шока. Среди пациентов с сепсисом, вызванным лекарственно-устойчивыми патогенами, наблюдается повышенный риск больничной летальности.
Кто подвергается риску?
Сепсис может развиться у любого человека с инфекцией, однако повышенному риску подвергаются уязвимые группы населения,такие как пожилые люди, беременные женщины, новорожденные, госпитализированные пациенты и лица с ВИЧ/СПИДом, циррозом печени, раком, заболеваниями почек, аутоиммунными заболеваниями и удаленной селезенкой (8) .
Признаки и симптомы
Сепсис является неотложным состоянием. Однако признаки и симптомы сепсиса у пациентов могут быть различными в различные моменты времени, поскольку такое клиническое состояние, как сепсис, может вызываться множеством возбудителей и менять свой характер на различных этапах. К тревожным признакам и симптомам относятся повышение или понижение температуры тела и озноб, изменение психического состояния, затрудненное/учащенное дыхание, учащенное сердцебиение, ослабление пульса/низкое кровяное давление, олигурия, синюшность или мраморность кожи, похолодание конечностей и сильные боли или дискомфорт в теле (9-11) . Возникновение подозрения на сепсис является первым шагом к его раннему распознаванию и диагностике.
Профилактика
Существует два основных пути профилактики сепсиса:
1. предотвращение передачи микроорганизмов и инфицирования;
2. недопущение осложнения инфекции до состояния сепсиса.
Профилактика инфекций среди населения предусматривает соблюдение эффективных правил гигиены, таких как мытье рук и безопасное приготовление пищи, улучшение качества и доступности водоснабжения и средств санитарии, обеспечение доступа к вакцинам, особенно лиц, подверженных высокому риску развития сепсиса, а также надлежащее питание, включая грудное вскармливание новорожденных.
Профилактика внутрибольничных инфекций, как правило, обеспечивается наличием функционирующих программ по профилактике инфекций и инфекционному контролю, а также соответствующих групп персонала, применением эффективных методов соблюдения гигиены, в том числе гигиены рук, наряду с чистотой в помещениях и правильной работой оборудования.
Профилактика развития сепсиса как среди населения, так и в медицинских учреждениях предполагает надлежащее лечение инфекций с применением антибиотиков, в том числе регулярную оценку состояния больных для рационального применения антибиотиков, быстрое обращение за медицинской помощью и раннее обнаружение признаков и симптомов сепсиса.
Эффективность профилактики инфекций однозначно подтверждается научными данными. Например, при строгом соблюдении правил гигиены рук в учреждениях здравоохранения уменьшение числа случаев инфицирования может составить до 50% (12) , а в общественных местах эти меры могут сократить риск возникновения диареи как минимум на 40% (13) . Меры по улучшению водоснабжения, санитарии и гигиены (ВСГ) способны привести к сокращению общего бремени заболеваний во всем мире на 10% 14 . Каждый год вакцинации помогают предотвратить 2–3 миллиона случаев смерти, связанных с инфекциями (15) .
Диагностика и клиническое ведение
Чтобы выявить сепсис на ранних этапах и своевременно организовать его надлежащее клиническое ведение, крайне важно распознать и не игнорировать перечисленные выше признаки и симптомы, а также выявить определенные биомаркеры (в частности прокальцитонин). На этапе после раннего выявления важное значение имеют диагностические процедуры, помогающие выявить возбудитель вызвавшей сепсис инфекции, поскольку от этого зависит выбор целенаправленного противомикробного лечения. Устойчивость к противомикробным препаратам (УПП) может препятствовать клиническому ведению сепсиса, поскольку оно нередко требует подбора антибиотика эмпирическим путем. Поэтому необходимо понимать эпидемиологические параметры распространения УПП в данных условиях. После определения источника инфекции важнейшей задачей является его ликвидация, например, путем дренирования абсцесса.
На раннем этапе ведения сепсиса важное значение также имеет инфузионная терапия для нормализации объема циркулирующей жидкости. Кроме того, для улучшения и поддержания перфузии тканей может потребоваться применение сосудосуживающих препаратов. Дальнейшие мероприятия по правильному ведению сепсиса выбираются исходя из данных повторных обследований и диагностических мероприятий, включая контроль основных показателей жизнедеятельности пациента.
Проблема сепсиса и Цели в области устойчивого развития
Сепсис является крайне актуальной причиной материнской смертности, а также смертности новорожденных и детей в возрасте до пяти лет. По этой причине борьба с сепсисом будет очевидным образом способствовать выполнению задач 3.1 и 3.2 в рамках Целей в области устойчивого развития (ЦУР).
Сепсис является крайне актуальной причиной материнской смертности, а также смертности новорожденных и детей в возрасте до пяти лет. По этой причине борьба с сепсисом будет очевидным образом способствовать выполнению задач 3.1 и 3.2 в рамках Целей в области устойчивого развития (ЦУР).
Показателями выполнения этих двух задач ЦУР являются коэффициенты смертности матерей, новорожденных и детей младше пяти лет. Сепсис занимает важное место среди причин, вызывающих эти предотвратимые виды смертности. Именно он нередко является клиническим состоянием, вызывающим, в конечном счете, смерть пациентов, страдающих ВИЧ, туберкулезом, малярией и другими инфекционными заболеваниями, упомянутыми в задаче 3.3, но при этом он, как правило, не регистрируется в качестве причины смерти таких пациентов и не включается в статистику по показателям выполнения задачи 3.3 ЦУР.
Проблема сепсиса также имеет важное, хотя и более опосредованное значение для других связанных со здоровьем задач в рамках ЦУР 3. Так, профилактика и/или надлежащая диагностика и ведение сепсиса имеют также отношение к надлежащему охвату вакцинами, всеобщему охвату качественными услугами здравоохранения, возможностям для соблюдения Международных медико-санитарных правил, обеспечению готовности и предоставлению услуг водоснабжения и санитарии. Вместе с тем, обеспечение повсеместной профилактики, диагностики и ведения сепсиса остается сложной задачей.
Деятельность ВОЗ
В мае 2017 г. Семидесятая сессия Всемирной ассамблеи здравоохранения на основании доклада Секретариата ВОЗ приняла резолюцию о сепсисе.
Резолюция WHA70.7. Совершенствование профилактики, диагностики и клинического ведения сепсиса
Доклад Секретариата ВОЗ A70/13. Совершенствование профилактики, диагностики и клинического ведения сепсиса
В настоящее время в рамках нескольких программ уровня штаб-квартиры ВОЗ, осуществляемых в сотрудничестве и координации с региональными бюро ВОЗ, изучаются вопросы воздействия сепсиса на общественное здравоохранение, а также предоставляются руководящие указания и поддержка на уровне стран по вопросам профилактики, ранней и правильной диагностики, а также своевременного и эффективного клинического ведения сепсиса в интересах комплексного решения этой проблемы. Глобальная группа по вопросам профилактики инфекций и инфекционного контроля, работающая в штаб-квартире ВОЗ при Департаменте предоставления услуг и обеспечения их безопасности, обеспечивает координацию деятельности по проблеме сепсиса и руководит мероприятиями в области его профилактики.
Библиография
(1) Fleischmann C, Scherag A, Adhikari NK, et al. Assessment of Global Incidence and Mortality of Hospital-treated Sepsis. Current Estimates and Limitations. Am J Respir Crit Care Med 2016; 193(3): 259-72.
(2) Fleischmann-Struzek C, Goldfarb DM, Schlattmann P, Schlapbach LJ, Reinhart K, Kissoon N. The global burden of paediatric and neonatal sepsis: a systematic review. The Lancet Respiratory medicine 2018; 6(3): 223-30.
(3) Laxminarayan R, Matsoso P, Pant S, et al. Access to effective antimicrobials: a worldwide challenge. Lancet 2016; 387(10014): 168-75.
(4) Say L, Chou D, Gemmill A, et al. Global causes of maternal death: a WHO systematic analysis. The Lancet Global health 2014; 2(6): e323-33.
(5) Reproductive, Maternal, Newborn, and Child Health: Disease Control Priorities, Third Edition (Volume 2). In: Black RE, Laxminarayan R, Temmerman M, Walker N, eds. Reproductive, Maternal, Newborn, and Child Health: Disease Control Priorities, Third Edition (Volume 2). Washington (DC): The International Bank for Reconstruction and Development / The World Bank(c) 2016 International Bank for Reconstruction and Development / The World Bank.; 2016.
(6) World Health Organization. WHO Report on the burden of endemic health care-associated infection worldwide. 2017-11-21 15:11:22 2011.
(7) Singer M, Deutschman CS, Seymour CW, et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA 2016; 315(8): 801-10.
(8) Gotts JE, Matthay MA. Sepsis: pathophysiology and clinical management. British Medical Journal 2016.
(9) United States Centers for Disease Control and Prevention. Healthcare Professional (HCP) Resources : Sepsis. 2018-02-01T06:23:15Z.
(12) Luangasanatip N, Hongsuwan M, Limmathurotsakul D, et al. Comparative efficacy of interventions to promote hand hygiene in hospital: systematic review and network meta-analysis. British Medical Journal. 2015;351:h3728.
(14) Pruss-Ustun A, Bartram J, Clasen T, et al. Burden of disease from inadequate water, sanitation and hygiene in low- and middle-income settings: a retrospective analysis of data from 145 countries. Tropical medicine & international health : TM & IH 2014; 19(8): 894-905.
(15) World Health Organization. Fact sheet: Immunization coverage. 2018-04-10 14:55:37.

Рубрика: 11. Прочие отрасли медицины и здравоохранения
Статья просмотрена: 2150 раз
Цель исследования рассмотреть возможные причины и факторы риска возникновения внутриутробной инфекции.
Материал и методы исследования. Проанализировано 100 протоколов патологоанатомических вскрытий из Объединенной детской прозектуры КДКБ.
Актуальность. Внутриутробные инфекции (ВУИ) — группа инфекционно-воспалительных заболеваний плода и детей раннего возраста, которые вызываются различными возбудителями, но характеризуются сходными эпидемиологическими параметрами и нередко имеют однотипные клинические проявления. Врожденные инфекции развиваются в результате внутриутробного (анте- и/или интранатального) инфицирования плода. При этом в подавляющем большинстве случаев источником инфекции для плода является мать. [2] В последние годы наблюдается увеличение частоты внутриутробных инфекций и возрастание их роли в перинатальной смертности. Несмотря на рост рождаемости, показатели детской смертности в период новорожденности остаются высокими. Группу повышенного риска внутриутробного инфицирования плода также составляют беременные с обострениями хронических инфекционных и соматических заболеваний, ОРВИ, инфицирование вирусом корьевой краснухи.Одним из наиболее распространенных путей инфицирования плода является гематогенный путь. Однако проникновение вирусной инфекции может произойти через дыхательные пути, пищеварительный тракт и кожу плода при инфицировании околоплодной жидкости. Факторами риска развития антенатальных инфекций являются: отягощенный акушерский анамнез (выкидыши, мертворождения, невынашивание при предыдущих беременностях, рождение детей с множественными пороками развития или умерших в раннем возрасте); аномалии течения текущей беременности и родов (угроза прерывания беременности, многоводие, приращение, неполная и преждевременная отслойка плаценты); заболевания мочеполовой системы у матери (эрозия шейки матки, эндоцервицит, кольпит, вульвовагинит, киста яичников, внутриматочные сращения, мочевая инфекция в виде уретрита, цистита, пиелонефрита и др.) Внутриутробныемикозымогут возникнуть при заражении плода Candida albicans восходящим путем или в родах в результате аспирации плодом содержимого родовых путей,а также гематогенно. [3]
Результаты исследования. При анализе материала 46 % летальных исходов в результате ВУИ зарегистрировано в первую неделю неонатального периода, причем 42 % детей погибло в первые сутки. Во вторую неделю погибло 14 % новорожденных. Во второй половине неонатального периода (3–4 неделя) погиб 21 ребенок (21 %); с 1 мес. до года жизни — 21 % летальных исходов (рис1).
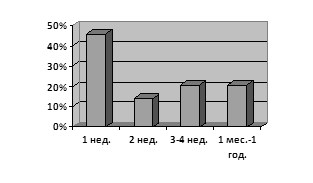
Рис. 1 Возраст умерших детей.
При анализе факторов риска, способствующих развитию внутриутробных инфекций, получены следующие результаты. Угроза прерывания беременности на разных сроках наблюдалась в 9,5 % случаев; маловодие — 2,4 %; длительный безводный период в 9,5 % наблюдений. 47,6 % родов разрешились преждевременно. В течение беременности у 9 % была диагностирована анемия 1–2ст. 22 % женщин перенесли во время беременности поздние гестозы. У повторнородящих гестоз отмечался и во время первой беременности.
При анализе гестационного срока родов установлено, что 67 % новорожденных родились в гестационном периоде менее 30 недель, 31 % родилось досрочно до 30 нед., родилось в срок 3 % детей. (рис2).
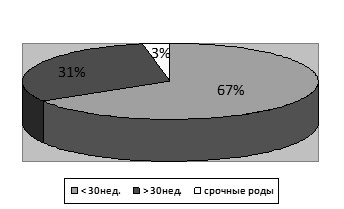
Рис. 2 Гестационный срок родов.
Из посмертных эпикризов выявлено, что 56 % матерей не были обследованы на Тorch — инфекции. ОРВИ во второй половине беременности переболело 14,3 % женщин. Инфицирование женщин ЦМВИ составило около 30 %. Аденовирусная инфекция обнаружена у 1,2 % женщин; ВПГ — 23,8 %; ВГС — 2,4 %; ВГВ — 1,2 %; зафиксирован 1 случай ВИЧ — инфекции. Титры антител к вирусу краснухи были выделены в 23,8 % случаях. 15 % матерей имели в анамнезе хронический пиелонефрит. Сравнительно редкой внутриутробной инфекцией считается токсоплазмоз, но последствия этой инфекции для плода и ребенка более пагубны, чем при других инфекциях. Титры антител к токсоплазме были выделены в 10,7 % случаев.
В последние годы в развитии внутриутробных инфекций важное значение приобретают хламидии. У беременных хламидийная инфекция проявляется в виде хронического продуктивного цервицита, однако риск внутриутробного инфицирования плода достаточно высок. У 7 % женщин в течение беременности был выявлен хламидиоз. У 2 % беременных был обнаружен кандидозный кольпит.
При анализе аутопсий детей установлено, что Enterococcus faecalis выявлены у 21 %; Mycoplasma — 8 %; Candida albicans — 8 %; Pseudomonas aeruginosa — 6 %; Escherichia coli -6 %; Klebsiella oxytoca — 4,8 %; Сandida krusei — 3,6 %; Staphylococcus epidermidis — 3,6 %; Klebsiella pneumoniae — 3,6 %; Аcinetobacter haemolyticus 2,4 %; Klebsiella mobilis — 1,2 % и другие.
Причинами смерти детей были генерализованные внутриутробные инфекции, бактериальный сепсис, пневмония, гепатит, энтероколит.
Заключение. В проведенном исследовании установлено, что 56 % матерей не были обследованы на Тorch — инфекции, что дает основания предполагать о наличии не выявленных очагов инфекций. У обследованных беременных преобладали цитомегаловирусная инфекция (30 %) и ВПГ (23,8 %). Антитела к вирусу краснухи были выделены у 23,8 % беременных. Токсоплазмы обнаружены у 10,7 % матерей. Хронический пиелонефрит выявлен в анамнезе у 14 % женщин. Данные результаты свидетельствуют о недостаточной ранней диагностике и профилактике ВУИ.
1. В. В. Власюк Морфологическая диагностика внутриутробных инфекций. Учебное пособие. СПб, 2010 — С. — 47.
2. А. В. Цинзерлинг, В. А. Цинзерлинг Патологическая анатомия. Учебник для педиатрических факультетов медицинских вузов. СПб 1996 — С. — 334.
3. А. Я. Сенчук, З. М. Дубоссарская. Перинатальные инфекции: практич. пособие. — М.: МИА, 2004 — С. — 448.
4. Дегтярев Д. Н., Дегтярева М. В., Ковтун И. Ю., Шаламова Л. В. Принципы диагностики внутриутробных инфекций у новорождённых и тактика ведения детей группы риска. — М.: Перинатология сегодня, 1997. — Т. 3. — С. 18–24.
Похожие статьи
Осложнения беременности у женщин с высоким риском. Ключевые слова: внутриутробное инфицирование плода, беременные, фетопатия. В 1 группу вошли 62 женщины группы высокого инфекционного риска, родивших детей без признаков ВУИ.
Важнейшим фактором развития внутриутробного инфицирования является период беременности, в котором происходит инфицирование беременной женщины.
ВУИ плода ЦМВ у беременных с первичным инфицированием достигает 30–50 %, при этом только у 5–18 % инфицированных детей
Осложнения беременности у женщин с высоким риском. Важнейшим фактором развития внутриутробного инфицирования является период.
Внутриутробные инфекции (ВУИ) являются одной из ведущих причин перинатальной
Под внутриутробным инфицированием плода и новорожденного понимают патологическое
Если при беременности анализы и клинические признаки доказывают у женщины ТОРЧ комплекс.
Таблица 2. Особенности течения беременности и инфекционных заболеваний у обследуемых женщин в 2 триместре.
Риск инфицированности плода и возможность реализации инфекции в виде болезни у новорожденных обусловлены ВУИ и степенью инфицирования и характером.
Также обследовали на наличие ТОRCH — инфекции влияющей на течение беременности и состояние плода, при выявлении какой-либо одной из них нами
48 % беременных основной группы и 15,56 % женщин контрольной группы перенесли вирусный гепатит.
Внутриутробные инфекции (ВУИ) на современном этапе являются одной из важнейших проблем акушерства и перинатологии.
Изучение перинатальных исходов при родах у женщин с высокой степенью внутриутробного риска инфицирования плода.
Ключевые слова: беременные, высокий риск, инфицирование плода. Внутриутробное инфицирование плода, как заболевание
Нами было принято решение исследовать ФПР у беременных с ЗВУР различной степени в сроки гестации: 16–23 недели, 24–29, 30–36, 37–40.
Основные термины (генерируются автоматически): беременная, вирусный гепатит, беременность, хронический пиелонефрит, родовая
Особенности течения беременности, родов и перинатальные.
Сепсис - это генерализованная форма бактериальной инфекции, протекающая на фоне первичного или приобретенного иммунодефицита.
Этиология. Заболевание обусловлено непрерывным или периодическим поступлением в кровь микроорганизмов и продуктов их жизнедеятельности из очага гнойного воспаления.
Факторами, способствующими развитию сепсиса у новорожденных детей, являются: 1) неблагоприятные состояния, угнетающие иммунитет плода и новорожденного (генитальная и экстрагенитальная патология у матери, невынашивание, асфиксия, острые респираторные инфекции и др.); 2) факторы, приводящие к внутриутробному инфицированию плода (урогенитальная инфекционно-воспалительная патология во время беременности и в родах, раннее отхождение околоплодных вод, длительный безводный период, затяжные роды, инфекционные заболевания и воспалительные осложнения в послеродовом периоде); 3) лечебно-диагностические манипуляции при оказании реанимационной помощи новорожденным (катетеризация центральных сосудов, пупочной вены, мочевого пузыря, интубация, ИВЛ, лаваж трахеобронхиального дерева);
4) наличие различных очагов инфекции у новорожденного. Усугубляют иммунологическую недостаточность гормональная и антибактериальная терапия беременных и новорожденных, ранний перевод на вскармливание молочными смесями.
Патогенез. Различают внутриутробный сепсис (диагноз ставится при наличии гнойно-воспалительных изменений в сосудах и оболочках плаценты) и сепсис новорожденного. Внутриутробное микробное обсеменение плода встречается редко из-за высокой барьерной функции плаценты. В подавляющем большинстве случаев бактериальное инфицирование происходит в родах или после рождения.
В зависимости от входных ворот инфекции различают сепсис пупочный, легочный, кожный, отогенный, кишечный, кате- теризационный, криптогенный (входные ворота не установлены). Распространение инфекций из первичного септического очага (входные ворота инфекций) происходит гематогенным путем. Местный воспалительный процесс активизирует все факторы иммунитета и при достаточной сопротивляемости организма очаг инфекции ограничивается и купируется. При ослаблении защитных факторов способность к очищению лимфы и крови от микроорганизмов снижается и возникает массивная бактериемия и токсемия. Развивается септический процесс. Воздействие микроорганизмов и их токсинов, нарушение нервной регуляции приводят к поражению и дисфункции всех органов и систем.
Различают септицемическую и септикопиемическую формы сепсиса. Септицемическая форма протекает без метастазов и у новорожденных встречается чаще. Септикопиемическая форма заболевания характеризуется образованием метастатических очагов в мозге, костях, легких, почках и др.
Клиническая картина. Проявления сепсиса характеризуются большим разнообразием. Особую важность представляет выявление признаков раннего инфицирования (позднее отпадение пуповинного остатка, замедление эпителизации пупочной ранки, наличие у ребенка омфалита, пиодермии, отита и др.). Характерными начальными клиническими симптомами заболевания являются нарастающие признаки интоксикации. У ребенка снижаются двигательная, рефлекторная и сосательная активность, появляется серый оттенок кожи, метеоризм, срыгивание. Ребенок не прибывает в массе, в последующем масса тела снижается. Гектический характер температуры у новорожденных не является обязательным признаком сепсиса (рис. 35).
Разгар заболевания характеризуется появлением патологических синдромов. Наблюдается прогрессирующее угнетение деятельности ЦНС: развиваются адинамия, гипотония, угасают сосательный и другие рефлексы. Заболевание может сопро-

Рис. 35. Сепсис новорожденного
вождаться длительно сохраняющимися нарушениями функции дыхания (одышка, жесткое дыхание, непостоянные крепи- тирующие хрипы) при отсутствии выраженных рентгенологических изменений в легких. Выявляются признаки недостаточности кровообращения и нарушения микроциркуляции. Кожные покровы бледно-серого цвета с мраморным рисунком, появляется акроцианоз. Тоны сердца глухие, аритмичные, границы сердца расширены, увеличиваются печень и селезенка, отмечаются пастозность и отечность подкожно-жировой клетчатки. Нередко обнаруживаются изменения со стороны почек (олигурия, появление в моче белка, эритроцитов, лейкоцитов). Может развиться желудочно-кишечный синдром: в желудке перед очередным кормлением остается содержимое, появляются упорные срыгивания, метеоризм, диспептические расстройства. Характерными признаками заболевания является длительное и волнообразное течение желтухи, признаки анемии и дистрофии. В тяжелых случаях развивается геморрагический синдром. У больных появляются петехиальная сыпь, мелена, рвота с примесью крови, повышенная кровоточивость слизистых оболочек, пупочной ранки, мест инъекций, что связано с развитием ДВС-синдрома.
Септикопиемия часто протекает с метастазами в головной мозг и развитием гнойного менингита или энцефалита. Нередко присоединяются перитонит, язвенно-некротический энтероколит, пневмония.
Выделяют молниеносное (1-7 дней), острое (4—8 недель) и затяжное (более 8 недель) течение заболевания. Для молниеносного течения характерно развитие септического шока. Он проявляется прогрессирующим угнетением основных жизненных функций организма. Катастрофически нарастает тяжесть состояния больного, наблюдаются резкая бледность кожи, гипотермия, глухость тонов сердца, брадикардия, снижается АД. Появляются признаки отека легких, развиваются почечная недостаточность и геморрагический синдром. Исход обычно летальный.
Лабораторная диагностика. В анализе крови определяются прогрессирующее снижение гемоглобина, тромбоцитов, лимфоцитов, лейкоцитоз или лейкопения, палочкоядерный сдвиг, токсическая зернистость нейтрофилов. Проводится иммунологическое исследование. Для подтверждения диагноза сепсиса необходимо многократно произвести бактериологическое исследование крови, мочи, кала и гноя из пиемических очагов. Большое значение имеет идентичность флоры в посевах крови и отделяемого из гнойного очага.
Лечение. Должно быть направлено на подавление возбудителя, повышение защитных свойств организма и санацию гнойных очагов.
Исключительно важно организовать вскармливание ребенка материнским молоком и обеспечить квалифицированный уход за больным. Антибиотикотерапия проводится длительно в максимальных возрастных дозах с учетом чувствительности возбудителя. Необходимо комбинировать 2-3 антибиотика, один из которых вводится внутривенно. Длительность каждого курса не должна превышать 10-14 дней. Предпочтение отдается пенициллином, цефалоспоринам, аминогликозидам, макролидам новых поколений.
С целью дезинтоксикации проводятся инфузионная терапия, форсированный диурез, назначают питье. Хороший лечебный эффект оказывают гемосорбция, плазмаферез, УФО крови.
Течение и исход сепсиса во многом определяются состоянием иммунной системы. Повышение иммунологической реактивности организма проводится путем создания пассивного иммунитета. Затем, с учетом иммунограммы, вводят иммуномодуляторы. Иммунотерапию направленного действия (в зависимости от этиологического фактора) проводят антистафило- кокковым гамма-глобулином, плазмой с высокой концентрацией специфических антител (антистафилококковой, антисинег- нойной, антипротейной). В качестве стимуляторов иммунной системы применяют тимолин, Т-активин и др. Широко используют средства, повышающие неспецифический иммунитет.
Необходимо проведение базовой терапии ДВС-синдрома. С этой целью применяются гепарин, свежезамороженная плазма, реополиглюкин, трентал, контрикал. Показана витаминотерапия (iвитаминами группы С, В, А, Е). При дисбактериозе назначаются лизоцим, эубиотики, противомикотические средства. Проводятся посиндромная и симптоматическая терапия, местное лечение очагов инфекции, при необходимости - хирургическое вмешательство.
В восстановительный период возрастает роль физических методов лечения: общего УФО, массажа, лечебной гимнастики, прогулок, ванн, проводятся курсы витаминотерапии.
Прогноз. При сепсисе зависит от вирулентности возбудителя, состояния иммунитета и возраста ребенка, своевременности и адекватности лечения. При современных методах диагностики и лечения сепсиса прогноз улучшается, однако остается серьезным, особенно у недоношенных и новорожденных детей.
Читайте также:


