Укажите основные свойства возбудителя чумы
Глава 26. Возбудитель чумы
Бактерии чумы открыты были Иерсеном в Гонконге в 1894 г. и в честь него весь род был назван иерсиниями. Большой вклад в изучение чумы внесли русские ученые Д. К. Заболотный, Н. К. Клодницкий, И. А. Лебединский, Н. Ф. Гамалея и индийские ученые, предложившие для лечения чумы стрептомицин.
К роду иерсиний относятся три вида бактерий:
1. Yersiniae pestis - возбудители чумы.
2. Yersiniae pseudotuberculosis - возбудители псевдотуберкулеза.
3. Yersiniae enterocolitica - возбудители кишечных инфекций.
Все представители этого рода грамотрицательные палочки, имеющие чаще овоидную форму и величину 0,4-0,7 × 1-2 мкм. Спор не образуют. У возбудителей псевдотуберкулеза и иерсиний энтероколитика имеются жгутики. Все иерсиний неприхотливы к питательным средам. Ферментативно они активны: расщепляют ряд углеводов с образованием кислоты.
Морфология. Возбудитель чумы - бвоидная палочка, средний размер 0,3-0,6 × 1-2 мкм. Они очень полиморфны. В мазках с плотной питательной среды палочки бывают удлиненными, нитевидными, описаны также фильтрующиеся формы. Бактерии чумы не имеют спор, жгутиков, образуют нежную капсулу. Грамотрицательны. Ввиду неравномерного распределения цитоплазмы концы палочек окрашиваются интенсивнее. Такая биполярность хорошо видна при окраске их метиленовым синим (рис. 46).
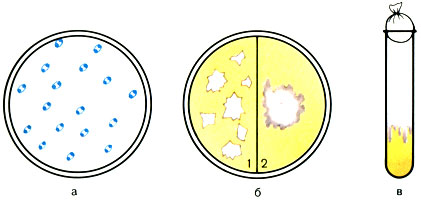
Рис. 46. Морфологические и культуральные свойства возбудителя чумы (Jersinia pestis). а - бактерии чумы (окраска синим Леффлера); б - рост на МПА: 1 - через 24 ч в виде битого стекла; 2 - через 48 ч в виде кружевного платочка; в - рост на МПБ - 'сталактитовый'
Культивирование. Возбудители чумы - факультативные анаэробы. Не прихотливы, растут на обычных питательных средах при температуре 28-30° С, рН среды 7,0-7,2. Рост появляется через 12-14 ч. Для ускорения роста применяют стимуляторы (экстракты некоторых бактерий, например сарцин, свежегемолизированную кровь, сульфит натрия и др.). Элективными средами для выращивания возбудителей чумы являются казеиновые среды и гидролизаты кровяных сгустков. Выросшие колонии через 18-24 ч инкубации имеют вид мелких глыбок с неровными краями, через 48 ч края колоний приобретают фестончатый вид и напоминают "кружевной платочек" (см. рис. 46).
На скошенном агаре культура растет в виде вязкого налета; на НПБ - в виде рыхлых хлопьев, взвешенных в прозрачной жидкости. При более длительном росте с поверхности среды спускаются рыхлые нити: "сталактитовый рост". Бактерии чумы растут в R-форме, которая является вирулентной. Однако они легко диссоциируют под влиянием ряда факторов, например бактериофага и через О-форму переходят в S-авирулентную форму.
Ферментативные свойства. У чумных бактерий выражена сахаролитическая активность - они расщепляют сахарозу, мальтозу, арабинозу, рамнозу, глюкозу (не всегда) и маннит с образованием кислоты. Различают два варианта бактерий чумы - разлагающие и не разлагающие глицерин. Протеолитические свойства выражены слабо: они не разжижают желатин, не свертывают молоко, образуют сероводород.
Бактерии чумы продуцируют фибринолизин, гемолизин, гиалуронидазу, коагулазу.
Токсинообразование. Токсин чумной палочки представляет собой особый белок, сочетающий свойства экзо- и эндотоксина, он состоит из двух белковых фракций (А и В), различающихся по аминокислотному составу и антигенным свойствам. Он очень токсичен для человека. Чумный токсин называют мышиный яд, так как мыши высоко чувствительны к его действию.
Антигенная структура бактерий чумы сложна. Микробы чумы содержат около десяти различных антигенов: фракции F, V, W и др. Фракция F - основной компонент, связанный с капсулой; V и W компоненты препятствуют фагоцитированию клетки. У бактерий чумы имеются общие антигены с возбудителем псевдотуберкулеза, эшерихиями, шигеллами и эритроцитами человека О-группы.
Устойчивость к факторам окружающей среды. Высокие температуры (100° С) губят чумные бактерии мгновенно, 80° С - через 5 мин. Низкие температуры чумные бактерии переносят хорошо: при 0° С сохраняются 6 мес, в замороженных трупах - год и больше. Прямые солнечные лучи убивают их через 2-3 ч. Чумные бактерии очень чувствительны к высыханию. В пищевых продуктах они сохраняются от 2 до 6 мес. В блохах - до года.
Обычные концентрации дезинфицирующих растворов убивают их через 5-10 мин. Особенно они чувствительны к сулеме и карболовой кислоте.
Восприимчивость животных. Основными носителями чумы являются грызуны: сурки, суслики, тарабаганы; они обусловливают природную очаговость чумы. Очень чувствительны к чуме серые и черные крысы, мыши; восприимчивы также верблюды, лисицы, кошки. К экспериментальному заражению чувствительны мыши, крысы, морские свинки и др.
Источники заражения. Больные животные, в основном грызуны. Эпидемии у людей часто предшествуют эпизоотии у грызунов.
Пути передачи и переносчики. 1. Основной путь передачи - трансмиссивный. Переносчики - блохи (грызуны → блохи → человек).
2. Воздушно-капельный путь (заражение человека от человека при легочной форме чумы).
3. Пищевой - при употреблении в пищу плохо проваренного зараженного мяса (этот путь бывает редко).
Патогенез и формы заболевания. Входными воротами являются кожа и слизистые оболочки дыхательных путей и пищеварительного тракта. Возбудители чумы обладают большой инвазивной способностью. На месте проникновения возбудителя образуются папулы, переходящие в пустулу с кровянисто-гнойным содержимым. В патологический процесс вовлекаются регионарные лимфатические узлы, через которые микробы проникают в кровь, вызывая бактерифмию. С кровью они попадают во внутренние органы.
В зависимости от места локализации у человека могут возникнуть разные формы заболевания: кожная, кожно-бубонная, кишечная, легочная, первично-септическая; каждая форма может закончиться сепсисом (вторичная септицемия). Наиболее часто возникает бубонная форма. Бубон болезнен. При попадании большой дозы возбудителя и малой разистентности организма может возникнуть первично-септическая форма. Заболевание начинается остро и протекает с явлениями интоксикации - высокой температурой, головной болью и т. д.
Иммунитет. Напряженный и продолжительный (в прошлые века в период больших эпидемий переболевших использовали для ухода за больными). Иммунитет обусловливается системой макрофагов. Большое значение имеет фагоцитарный фактор.
Профилактика. Общие мероприятия заключаются в ранней диагностике, изоляции больных. Установление карантина для людей, находившихся в контакте с больными. Проведение в очагах дезинсекции и дератизации. Защита медицинского персонала, находящегося в очагах, проводится введением стрептомицина и противочумной вакцины. Выполнение международных конвенций по профилактике чумы (дератизация и дезинфекция кораблей в портах). Охрана государственных границ.
Специфическая профилактика. В СССР применяют живую вакцину EV. Этот штамм был получен из вирулентной культуры путем последовательных пересевов возбудителя на питательные среды в течение 5 лет. Штамм потерял вирулентность, сохранив при этом иммуногенные свойства. Иммунитет длится около года. Вакцинируют только людей, которым угрожает опасность заражения.
Лечение. Стрептомицин, тетрациклин, специфический фаг и противочумный иммуноглобулин.
Большой вклад в изучение профилактики и лечения чумы внесли советские ученые М. П. Покровская и Н. Н. Жуков-Вережников.
1. К какой группе инфекций относится чума?
2. Как растет возбудитель чумы на плотных и жидких питательных средах? Какая форма является вирулентной - R или S?
3. Какой токсин образует возбудитель чумы и какие Вы знаете ферменты патогенности?
4. Кто является источником и переносчиком чумы?
5. Какие формы заболевания вызывает палочка чумы?
Цель исследования: выявление возбудителя чумы.
1. Отделяемое язвы или пунктат из карбункула - кожная форма.
2. Содержимое бубона - бубонная форма.
3. Мокрота - легочная форма.
4. Испражнения - кишечная форма.
5. Кровь - при всех формах.
6. На вскрытии берут кусочки органов трупа, кровь, костный мозг.
7. Блохи - содержимое кишечника.
8. Крысы, мыши и другие погибшие грызуны (и болеющие) - вскрывают, исследуют органы и кровь.

Способы сбора материала
4. Люминесцентно-серологический метод (см. главу 2).
Методы серодиагностики не нашли широкого применения.

Первый день исследования
Посев. Незагрязненный посторонней флорой материал засевают на плотные и жидкие питательные среды (МПА и МПБ) с прибавлением к ним стимуляторов: кровь, сульфит натрия и др. Стимуляция роста необходима, так как посевная доза может быть недостаточной. Материал, содержащий постороннюю флору (мокрота, содержимое открытых язв), засевают на среду Туманского или среду Коробковой. Эти среды содержат генциановый фиолетовый (1:50000), подавляющий рост посторонней флоры. Посевы инкубируют в термостате при 28° С.
Биологическая проба. Биопробу ставят на морских свинках и белых мышах. Метод введения исследуемого материала зависит от характера материала. Мокроту, гной из открытого абсцесса вводят путем втирания в кожу брюшной стенки (предварительно кожу эпилируют, обрабатывают стерильным изотоническим раствором натрия хлорида и скарифицируют). На скарифицированный участок наносят исследуемый материал, втирая его плоской частью скальпеля, под прикрытием специальной воронки или стеклянной крышки от чашки Петри. Незагрязненный материал (кровь, содержимое закрытого бубона) вводят животным подкожно или внутрибрюшинно. В зависимости от метода введения животное погибает на 3-9-й день.
Посевы вынимают из термостата. Изучают рост на плотной и жидкой питательной среде.
Из бульонной культуры при типичном росте делают мазки, окрашивают по Граму и метиленовым синим. Микроскопируют. Из плотной питательной среды при наличии типичных колоний выделяют чистую культуру и помещают в термостат. На 2-3 подозрительные в отношении возбудителя чумы колонии наносят чумный бактериофаг. Инкубируют в термостате. Через 10-12 ч колонии изменяются - лизируются. Лизис колоний под действием чумного бактериофага имеет диагностическое значение.
Вынимают из термостата пробирки с культурой на скошенном агаре. На поверхности агара чумная палочка образует вязкий серовато-белый налет. Выделенную культуру проверяют микроскопически. При наличии типичных палочек проверяют сахаролитические свойства посевом на сахара: глюкозу, мальтозу, сахарозу, рамнозу, маннит. Ставят пробу с бактериофагом.
Производят учет результатов: 1. Ферментативные свойства (табл. 42).
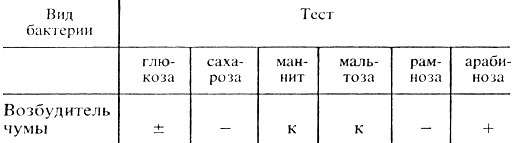
Таблица 42. Ферментативные свойства возбудителей чумы
Примечание. к - кислота; - отсутствие расщепления; ± не всегда расщепляет; + расщепление.
Проба с бактериофагом - лизис колоний.
Ускоренный метод пробы с бактериофагом. Исследуемый материал наносят на 3 чашки со средой Туманского.
1-я чашка - засевают вместе с чумным бактериофагом.
2-я чашка - засевают равномерным распределением материала по поверхности среды (шпателем), после чего делают дорожку из чумного бактериофага.
3-я чашка (контрольная) - засевают только исследуемым материалом. Посевы инкубируют при 28° С. Через 12-14 ч чашки вынимают из термостата.
При наличии в исследуемом материале возбудителя чумы отмечают:
в 1-й чашке - негативные колонии (лизис колоний чумы), во 2-й чашке - стерильную дорожку, в 3-й чашке - типичные колонии чумных бактерий.
Проводят дифференциацию чумных бактерий от бактерий псевдотуберкулеза (табл. 43).
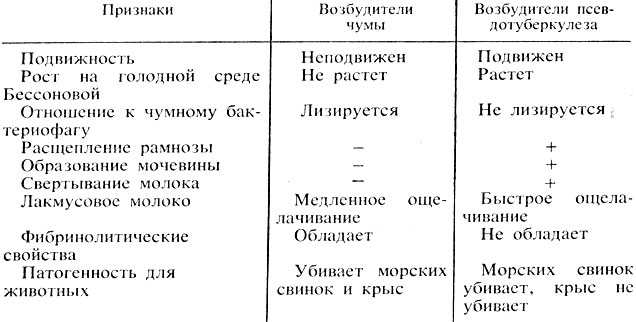
Таблица 43. Дифференциация возбудителей чумы и бактерий псевдотуберкулеза
Продолжают наблюдение за животными, зараженными в первый день исследования. Павших или убитых животных вскрывают. Изучают изменения в органах. Обычно у животных, павших от чумы, увеличены регионарные узлы, в органах - геморрагические и некротические участки. Печень и селезенка увеличены. При вскрытии из органов и крови делают мазки-отпечатки на специальные среды. Дальнейшее исследование ведут описанным выше способом.
1. Какой режим работы необходимо соблюдать при работе с возбудителями чумы?
2. Какие методы являются ведущими? В каких случаях следует прибавить в среду генциановый фиолетовый?
3. На каких животных ставят биопробу? Какие изменения обнаруживают у павших животных?
4. Как дифференцируют возбудителей чумы от бактерий псевдотуберкулеза?
Таксономия: Y.pestis вызывает чуму; отдел Gracilicutes, семейство Enterobacteriaceae, род Yersinia. Возбудитель – Yersinia pestis.
Морфологические свойства: грамотрицательные палочки, овоидной формы, окрашиваются биполярно. Подвижны, имеют капсулу, спор не образуют.
Культуральные свойства.Факультативные анаэробы. Температурный оптимум +25С. Хорошо культивируются на простых питательных средах. Ферментируют большинство углеводов без образования газа. Психофилы - способны менять свой метаболизм в зависимости от температуры и размножаться при низких температурах. Вирулентные штаммы образуют шероховатые (R) колонии, переходные (RS) и сероватые слизистые гладкие авирулентные(S) формы.
Образуют 2 типа колоний - молодые и зрелые. Молодые с неровными краями. Зрелые колонии крупные, с бурым зернистым центром и неровными краями. На скошенном агаре черед двое суток при +28 С образуют серовато - белый налет, врастающий в среду, на бульоне - нежную поверхностную пленку и хлопковидный осадок.
Биохимические свойства: фенментативная активнсть высокая: ферментация до кислоты ксилозу, синтез плазмокоагулазы, фибринолизина, гемолизина, лецитиназу, сероводород. Рамнозу, мочевину не ферментирует.
Антигенная структура.Группа белково - полисахаридных и липополисахаридных антигенов: термостабильный соматический О-антиген и термолабильный капсульный V,W антигены. С W-антигеном связывают вирулентность бактерий. Продуцирует факторы патогенности: фибринолизин, плазмокоагулазу, эндотоксин, экзотоксин, капсулу, V,W антигены.
Резистентность: чувствителен к антибиотикам (особенно стрептомицин), нестоек к окружающей среде при высокой температуре.
Патогенные свойства.Обладает патогенным потенциалом, подавляет функции фагоцитарной системы, подавляет окислительный взрыв в фагоцитах и беспрепятственно в них размножается. Факторы патогенности контролируются плазмидами трех классов. В патогенезе выделяют три основных стадии - лимфогенного заноса, бактеремии, генерализованной септицемии. Имеют адгезины и инвазины, низкомолекулярные протеины (ингибируют бактерицидные факторы), энтеротоксин. Часть факторов контролируется плазмидами вирулентности.
Клинические особенности: Инкубационный период – несколько часов до 8 сут. Различают локальные – кожно-бубонная, бубонная; внешне-диссеминированные – первично-легочная, вторично-легочная и кишечная; генерализованная – первично-септическая, вторично-септическая формы чумы. Региональная лимфоаденопатия, энтероколиты, реактивные артриты, спондилит, лихорадка.
Эпидемиология: Чума - классический природноочаговый зооноз диких животных. Основные носители в природе - сурки, суслики, в городских условиях - крысы. В передаче возбудителя - блохи животных, способные заражать человека.
Иммунитет: клеточно-гуморальный, ограничен по длительности и напряженности.
Бактериоскопическое исследование. Из исследуемого материала готовят мазки, окрашивают по Граму и водным раствором метиленового синего. Бактерии чумы представляют собой грамотрицательные палочки овоидной формы.
Бактериологическое исследование. Исследуемый материал засевают на чашки с питательным агаром. Посевы инкубируют при 25С. Первичное изучение посевов производят через 10ч. К этому сроку появляются колонии, которые образованы вирулентными R-формами. Мало- и авирулентные бактерии формируют S-формы колоний. Идентификацию чистой культуры проводят по морфологии бактериальных клеток, характеру роста, антигенным и биохимическим свойствам, чувствительности к специфическому фагу и биопробе.
На бульоне бактерии образуют пленку; ферментируют многие сахара до кислоты, индола не образуют, желатин не разжижают. Содержат групповой термостабильный соматический антиген и специфический термолабильный капсульный антиген.
Биопроба. Проводится для выделения чистой культуры из материала, загрязненного посторонней микрофлорой. Наиболее чувствительными лабораторными животными являются морские свинки, которым материал вводят подкожно. Внутрибрюшинно материал вводят в том случае, если он не загрязнен другими бактериями. После гибели животных отмечают патологические изменения органов и проводят бактериологическое исследование
Экспресс-методы лабораторной диагностики:
1.Иммунофлюоресцентный метод позволяет обнаружить присутствие возбудителя как в патологическом материале, так и в объектах окружающей среды (вода, воздух), а также в пищевых продуктах и эктопаразитах. С этой целью используют люминесцентную видоспецифическую противочумную сыворотку, люминесцентные противокапсульную и противосоматическую сыворотку.
2.РПГА - для обнаружения антигенов бактерий в материале с помощью стандартной противочумной сыворотки, антитела которой нагружены на эритроциты.
Лечение: антибиотики –стрептомицин, препараты тетрациклинового ряда.
Профилактика: специфическая профилактика - живая ослабленная чумная вакцина EV. Имеется сухая таблетированная вакцина для перорального применения. Для оценки иммунитета к чуме (естественного постинфекционного и вакцинального) может применяться внутрикожная аллергическая проба с пестином.
Возбудитель чумы. Характеристика, свойства
Таксономия: Y.pestis вызывает чуму; отдел Gracilicutes, семейство Enterobacteriaceae, род Yersinia. Возбудитель – Yersinia pestis.
Чума относится к природно-очаговым заболеваниям, в качестве источника инфекции выступают различные виды грызунов, обитающих в степных и полупустынных зонах (суслики, сурки, в том числе тарбаганы, песчанки). У этих грызунов развивается общая септическая инфекция с достаточно высокой летальностью. Кроме того, в естественных условиях могут быть поражены черная и серая (в меньшей степени) крысы. Среди чувствительных к возбудителю чумы грызунов есть такие, которые впадают в спячку (суслики, сурки). У этих животных, если они заражаются перед стадией спячки, наступает своеобразная консервация инфекционного процесса, обеспечивающая сохранение практически неразмножающегося возбудителя. Но после пробуждения животного инфекционный процесс активизируется, возбудитель оказывается в крови, что обеспечивает дальнейшее распространение Y. pestis. Такому развитию эпизоотического процесса способствует появление весной молодняка, обладающего особенно высокой восприимчивостью, поскольку иммунитет у народившихся особей отсутствует.
Однако грызуны не в состоянии обеспечить длительное сохранение возбудителя чумы в природных очагах: часть животных выздоравливает и освобождается от возбудителя, другая часть погибает от инфекции, которая продолжается примерно 5
10 дней. Эпизоотия ведет к разрежению популяции и, соответственно, к сокращению или прекращению циркуляции Y. pestis.
Черная и серая крысы относятся к синантропным животным. Их заражение чумой происходит в результате заноса возбудителя из природного очага (т. е. они формируют вторичные, но весьма опасные для людей очаги, поскольку живут в населенных пунктах в жилище людей). В средние века крупные эпидемии чумы происходили после развития эпизоотии среди крыс. В настоящее время значение крыс в распространении чумы существенно снизилось.
Морфологические свойства: возбудитель — Yersinia pestis, относится к роду иерсиниа, семейству энтеробактерий. Представляет собой неподвижную, закругленную на конце овоидную палочку размерами 1,5-2 х 0,5-0,7 мкм. Описан полиморфизм возбудителей чумы с появлением удлиненных зернистых, нитевидных и фильтрующихся форм.
Возбудитель чумы не образует спор, имеет капсулу, грамотрицателен, легко окрашивается анилиновыми красителями (более интенсивно на концах — биполярное окрашивание). В мазках из бульона бактерии чумы располагаются цепочками различной длины обычно с хорошо выраженной биполярностью. На агаре с 3% поваренной соли можно обнаружить причудливые формы.
Микроб чумы при культивировании на искусственных питательных средах в условиях повышенной температуры (37 °С) образует капсулы. Капсула лучше образуется на влажных и слегка кислых питательных средах. Жгутики отсутствуют.
Устойчивость возбудителя чумы вне организма к воздействию факторов среды неравнозначна. Понижение температуры увеличивает сроки выживания бактерий, на пищевых продуктах и предметах обихода они сохраняются до 3 мес, в гное бубонов — 40 дней, в крови и мокроте — 1 мес и более. При температуре 55 °С они погибают через 10—15 мин, при 100 °С — спустя несколько секунд. Обычные дезинфекционные средства в рабочих концентрациях (сулема 1 : 1000, 3—5%-ный раствор лизола, 3%-ный раствор карболовой кислоты, 10%-ный раствор известкового молока), антибиотики (стрептомицин, тетрациклин, левомицетин) оказывают губительное действие на палочку чумы. Бактерии чумы образуют эндо- и экзотоксин, содержат до 20 антигенов.
Факультативные анаэробы. Температурный оптимум +25С. Хорошо культивируются на простых питательных средах. Ферментируют большинство углеводов без образования газа. Психофилы - способны менять свой метаболизм в зависимости от температуры и размножаться при низких температурах. Вирулентные штаммы образуют шероховатые (R) колонии, переходные (RS) и сероватые слизистые гладкие авирулентные (S) формы.
Для стимуляции роста микроба чумы целесообразно прибавлять в питательную среду сульфит натрия, гемолизиро-ванную кровь, которые синтезируют дыхательные ферменты. На агаровых пластинах рост микроба чумы уже через 24 ч заметен в виде нежного сероватого налета.
Колонии на агаре соответствуют R-форме (вирулентные); начало развития колонии обнаруживается в виде появления очень маленьких рыхлых глыбок и затем плоских слоистых образований с неровными краями, напоминающих кружевной платочек серовато-белого с голубоватым оттенком цвета. Колониям присущ полиморфизм.
На бульоне культура растет в виде хлопьев, взвешенных, в совершенно прозрачной жидкости с рыхлым осадком на дне. Возбудители чумы восстанавливают нитриты в нитраты, ферментируют с образованием пленки глюкозу, левулезу, мальтозу, галактозу, арабинозу, ксилозу и маннит, продуцируют дегидра-зы и уреазы. Желатин не разжижают, индол и сероводород не образуют.
Два типа колоний - молодые и зрелые. Молодые с неровными краями. Зрелые колонии крупные, с бурым зернистым центром и неровными краями. На скошенном агаре черед двое суток при +28 С образуют серовато - белый налет, врастающий в среду, на бульоне - нежную поверхностную пленку и хлопковидный осадок.
Биохимические свойства: ферментативная активность высокая: ферментация до кислоты ксилозы, синтез плазмокоагулазы, фибринолизина, гемолизина, лецитиназы, сероводород. Рамнозу, мочевину не ферментирует.
Группа белково-полисахаридных и липополисахаридных антигенов: термостабильный соматический О-антиген и термолабильный капсульный V, W антигены. С W-антигеном связывают вирулентность бактерий. Продуцирует факторы патогенности: фибринолизин, плазмокоагулазу, эндотоксин, экзотоксин, капсулу, V, W антигены.
Резистентность: чувствителен к антибиотикам (особенно стрептомицин), нестоек к окружающей среде при высокой температуре.
Патогенные свойства: Обладает патогенным потенциалом, подавляет функции фагоцитарной системы, подавляет окислительный взрыв в фагоцитах и беспрепятственно в них размножается. Факторы патогенности контролируются плазмидами трех классов. В патогенезе выделяют три основных стадии - лимфогенного заноса, бактериемии, генерализованной септицемии. Имеют адгезины и инвазины, низкомолекулярные протеины (ингибируют бактерицидные факторы), энтеротоксин. Часть факторов контролируется плазмидами вирулентности.
Клинические особенности: Инкубационный период – несколько часов до 8 сут. Различают локальные – кожно-бубонная, бубонная; внешне-диссеминированные – первично-легочная, вторично-легочная и кишечная; генерализованная – первично-септическая, вторично-септическая формы чумы. Региональная лимфоаденопатия, энтероколиты, реактивные артриты, спондилит, лихорадка.
Эпидемиология: Чума - классический природноочаговый зооноз диких животных. Основные носители в природе - сурки, суслики, в городских условиях - крысы. В передаче возбудителя - блохи животных, способные заражать человека.
Иммунитет: клеточно-гуморальный, ограничен по длительности и напряженности.
Бактериоскопическое исследование. Из исследуемого материала готовят мазки, окрашивают по Граму и водным раствором метиленового синего. Бактерии чумы представляют собой грамотрицательные палочки овоидной формы Бактериологическое исследование. Исследуемый материал засевают на чашки с питательным агаром. Посевы инкубируют при 25С. Первичное изучение посевов производят через 10 ч. К этому сроку появляются колонии, которые образованы вирулентными R-формами. Мало- и авирулентные бактерии формируют S-формы колоний. Идентификацию чистой культуры проводят по морфологии бактериальных клеток, характеру роста, антигенным и биохимическим свойствам, чувствительности к специфическому фагу и биопробе.
На бульоне бактерии образуют пленку; ферментируют многие сахара до кислоты, индола не образуют, желатин не разжижают. Содержат групповой термостабильный соматический антиген и специфический термолабильный капсульный антиген.
Биопроба. Проводится для выделения чистой культуры из материала, загрязненного посторонней микрофлорой. Наиболее чувствительными лабораторными животными являются морские свинки, которым материал вводят подкожно. Внутрибрюшинно материал вводят в том случае, если он не загрязнен другими бактериями. После гибели животных отмечают патологические изменения органов и проводят бактериологическое исследование
Экспресс-методы лабораторной диагностики:
1. Иммунофлюоресцентный метод позволяет обнаружить присутствие возбудителя как в патологическом материале, так и в объектах окружающей среды (вода, воздух), а также в пищевых продуктах и эктопаразитах. С этой целью используют люминесцентную видоспецифическую противочумную сыворотку, люминесцентные противокапсульную и противосоматическую сыворотку.
2. РПГА - для обнаружения антигенов бактерий в материале с помощью стандартной противочумной сыворотки, антитела которой нагружены на эритроциты.
Лечение: антибиотики – стрептомицин, препараты тетрациклинового ряда.
Профилактика: специфическая профилактика - живая ослабленная чумная вакцина EV. Имеется сухая таблетированная вакцина для перорального применения. Для оценки иммунитета к чуме (естественного постинфекционного и вакцинального) может применяться внутрикожная аллергическая проба с пестином.
2 род, не восстанавливает нитраты в нитриты, не расщепляет мочевину, реакция Фогес-Проскауэра - отрицательная. Антигенная структура ОСА (основной соматический антиген), токсичен для человека и животных (белых крыс и мышей). О-антиген F1 антиген (фракция-1) - основной компонент поверхностной структуры клетки, защищает бактерии от фагоцитоза и обусловливает иммуногенные свойства возбудителя. VW это фактически 2 антигена, они всегда встречаются вместе у вирулентных штаммов: V-антиген - белок, W-фракция- липопротеин, обладающий антифагоцитарным действием и способствующий внутриклеточному размножению микробов. Т-антиген (мышиный токсин) - блокирует функции митохондрий клеток печени и селезенки. При введении лабораторным животным вызывает у них шок и быструю гибель. Возбудитель чумы выделяет бактериоцины (пестицины), обладающие иммуногенным действием. Факторы патогенности. Большинство из перечисленных выше антигенов являются одновременно и факторами патогенности. Ферменты: лецитиназа, гиалуронидаза, фибринолизин, плазмокоагулаза. Структурные компоненты клетки: капсула, пили-1, обеспечивающие адгезию на клетках различных органов и тканей. Гены, детерминирующие синтез большинства факторов патогенности, локализованы в плазмидах. Резистентность Палочка обладает значительной устойчивостью во внешней среде. Она хорошо сохраняется в экскрементах больных и на объектах внешней среды. В гнойном содержимом бубонов выживает дней, в трупах животных (верблюдов, грызунов) до 60 дней; в мокроте больных - до 10 суток; на одежде и белье несколько недель; в трупах погибших больных - неопределенно длительное время, особенно при низких температурах. В организме блох живут до 346 дней; на овощах и фруктах 6-11 суток. Высокочувствительны чумные палочки к УФЛ, высушиванию, повышенной температуре. При нагревании до 60 0 С возбудители погибают за 1 час, при кипячении за несколько минут. Чувствительны также к действию дезинфектантов: 3-5% растворы карболовой кислоты и лизола инактивируют их за 5-10 мин. 2
3 Эпидемиология. Основной резервуар и источник инфекции дикие грызуны (почти 300 видов), которые распространены повсеместно. Источниками инфекции в природе являются сурки, суслики, песчанки, полевки; в городах очаги чумы серые крысы, живущие в канализационных трубах; черные крысы, обитающие на морских судах. Сохранение чумной инфекции происходит, главным образом, благодаря передаче возбудителя от больных животных здоровым. Механизм передачи инфекции чаще всего трансмиссивный. Переносчиками являются, в основном, взрослые особи крысиных блох, пожизненно сохраняющих возбудителя. Человек заражается не столько при укусе блохи, сколько после втирания в кожу ее фекалий или срыгиваемых рвотных масс. (Бактерии, размножающиеся в кишечнике блохи, выделяют коагулазу, образующую пробку в глотке и препятствующую поступлению пищи в ее организм; попытка голодной блохи насасывания крови сопровождается срыгиванием зараженных масс в месте укуса). Алиментарный путь заражения реализуется при приеме пищи, инфицированной возбудителем (например, мяса больных животных, не подвергавшегося достаточной тепловой обработке). Контактный путь заражения возможен, когда возбудитель проникает через поврежденные кожу или слизистые при разделке туш зараженных животных (зайцев, лис, сайгаков). Воздушно-капельный путь заражения реализуется при легочной форме чумы, когда возбудитель в больших количествах попадает в воздух с мокротой больного, выделяемой при кашле. Чума трансмиссивный антропозооноз, способный вызывать как спорадические случаи заболевания, так и вспышки, эпидемии. Патогенез Патогенез чумы включает 3 стадии. 1. Внедрение возбудителя в организм происходит в месте укуса блохи. Он быстро попадает в лимфоузлы, где кратковременно задерживается. В лимфоузлах образуются чумные бубоны с развитием воспалительных, геморрагических и некротических явлений. 2. Распространение в кровоток (бактериемия) происходит довольно быстро. При этом развивается сильнейшая интоксикация с проявлениями геморрагий. Бактерии активно поглощаются фагоцитами, но фагоцитоз незавершенный, поэтому он способствует дальнейшему распространению возбудителя. 3. После преодоления ретикуло-гистиоцитарного барьера происходит диссеминация возбудителя по различным органам и системам. Микроциркуляторные нарушения вызывают изменения в сердечной мышце, сосудах и в надпочечниках, что обусловливает острую сердечно-сосудистую недостаточность. При аэрогенном пути заражения поражаются альвеолы. В них развивается воспалительный процесс. Последующая бактериемия сопровождается 3
4 интенсивным токсикозом и развитием септико-геморрагических проявлений в различных органах и тканях. Различают кожную, бубонную, легочную, кишечную, септическую формы. Иммунитет Формирующийся постинфекционный иммунитет в основном гуморальный, напряженный, длительный (пожизненный). Профилактика. При неспецифической профилактике решающую роль играют мероприятия, исключающие завоз инфекции из других стран и предупреждающие возникновение заболевания на территории природных очагов. Существуют международные медико-санитарные правила по контролю за распространением инфекции. В очагах следят за составом и численностью грызунов, исследуют их экзопаразитов на инфицированность чумной палочкой. При выявлении эпизоотий проводится дератизация, дезинфекция. Для специфической профилактики используются живая аттенуированная вакцина из штамма EV, а также химическая вакцина. Вакцинация по эпидпоказаниям, однократная, ревакцинация через год. Длительность поствакцинального иммунитета 1 год Особенности микробиологической диагностики. Диагностика чумы осуществляется специализированными лабораториями. Материалом для исследования являются: отделяемое бубонов, язв, мокрота, слизъ из зева, кровь, испражнения, секционный материал. Применяются методы исследования: бактериоскопический (окраска мазков из исследуемого материала по Граму и метиленовым синим, РИФ); бактериологический (посев на МПА с генцианвиолетом и сульфитом натрия для выделения чистой культуры возбудителя и его последующей идентификации); биологический метод. Для серодиагностики используется РНГ, РИФ. Экспресс -диагностика осуществляется с использованием РИФ и ИФА. Генетическая диагностика методом ПЦР. BRUCELLA SPP. Бруцеллез зоонозное инфекционно-аллергическое заболевание, склонное к хронизации и протекающее с преимущественным поражением опорно-двигательного аппарата, сердечно-сосудистой, нервной и половой систем. Морфология. Возбудители представляют собой мелкие кокковидные палочки размерами 0,6-1,5 х О,5 0,7 мкм, грамотрицательные, неподвижные, спор не образуют. Свежевыделенные штаммы могут образовывать нежную капсулу. Бруцеллы отличаются выраженным полимофизмом; в мазках бактерии располагаются беспорядочно. 4
5 Культуральные свойства. Бруцеллы строгие аэробы. Они требовательны к питательным средам, для их роста необходимы тиамин, ниацин, биотин. Они хорошо растут на печеночном, сывороточном или кровяном агаре (с добавлением 0,5% эритроцитов барана). На плотных питательных средах бруцеллы образуют выпуклые гладкие мутноватые колонии с перламутровым оттенком (Sформы). При длительном выращивании колонии приобретают желтозеленый оттенок. Возможна диссоциация в R-формы. В жидких средах наблюдается рост в виде диффузного помутнения. Оптимальные условия культивирования: температура С, рн среды 6,6-7,4. Биохимическая активность Выражена слабо: бруцеллы ферментируют глюкозу и арабинозу до кислоты, разлагают белки с образованием сероводорода, восстанавливают нитриты, индол не образуют. Разделение на виды основано на биохимических различиях, в частности, на способности расти на средах с фуксином и тионином. Виды бруцелл B. melitensis (3 биовара) B. abortus (8. биоваров) В.suis (4 биовара) Видовые различия бруцелл Рост на средах с красителями Образование фуксином тионином сероводорода 1:5000 1:2500 Потребность в СО Антигенная структура. Различают родовой и поверхностный антигены. М-антиген доминирует у В.melitensis ; A-антиген преобладает у В. abortus и В suis; R-антиген свойственен шероховатым формам. Третий, поверхностный антиген L, термолабильный, имеет сходство с Viантигеном сальмонелл. Факторы патогенности. Ферменты: гиалуронидаза и нейраминидаза. Адгезивные свойства связаны с пилями-1 и белками наружной мембраны. Бруцеллы могут образовывать капсулу. Резистентность Возбудители довольно устойчивы во внешней среде: при температуре С они могут сохраняться в воде и влажной почве до 5 месяцев, в мо- 5
6 локе 9 месяцев, в сыре до 1 года. Они устойчивы к низким температурам, и в замороженном мясе выживают до 5 месяцев. Хуже они переносят высокую температуру: при 70 0 С погибают в течение 10 минут, при кипячении мгновенно. Чувствительны к 3 % раствору хлорной извести. 1% хлорамину, 0,5% лизолу, 2% формалину, которые губят их за 5 минут. Эпидемиология. Основной источник и резервуар инфекции - больные домашние животные: овцы, козы, свиньи, крупный рогатый скот. В редких случаях источником инфекции могут быть лошади, верблюды и некоторые другие животные, которые выделяют возбудителя с молоком, мочой, калом, околоплодной жидкостью. У человека наиболее часто заболевание вызывается В.melitensis, которые обусловливают наиболее тяжелые формы заболевания. Реже человек заражается В.abortus от крупного рогатого скота, однако клинически выраженные инфекции при этом регистрируются редко. Наиболее опасными в смысле заражения являются периоды отелов скота, так как в околоплодной жидкости содержится большое количество возбудителей. Больной человек не опасен для окружающих. Механизмы заражения - разнообразны; наиболее частый фекальнонооральный. Большую опасность представляют сырое молоко и молочные продукты, не подвергающиеся в процессе приготовления тепловой обработке (брынза, сыр). Мясо представляет меньшую опасность только в случаях его недостаточной тепловой обработки. Контактно-бытовой путь заражения возможен при попадании возбудителя на поврежденные кожные или слизистые покровы при уходе за больными животными; при оказании им родовспомогательной помощи или при разделке туш больных животных. Воздушно-капельный путь заражения описан при вдыхании воздушнопылевой смеси, содержащей инфицированные частицы шерсти, навоза, земли во время уборки помещения. Для бруцеллеза свойственен выраженный профессиональный характер заболевания. Иммунитет Постинфекционный иммунитет формируется нестойкий, гуморальный и клеточный, нестерильный. При этом образуются неполные антитела. Возможны повторные заболевания. Профилактика Неспецифическаяие мероприятия заключаются в соблюдении правил личной гигиены и режима обработки сельскохозяйственной продукции; в осуществлении профилактики заболеваемости среди животных. Специфическая профилактика. В эндемичных очагах инфекции проводят вакцинацию живой вакциной, получаемой из аттенуированного штамма В. аbortus. Вакцинация накожная, однократная. При отрицательной кожной пробе и отсутствии выработки антител проводится ревакцинация. 6
7 Лечение Терапия основана на применении антибиотиков широкого спектра действия. Препараты выбора: тетрациклины, аминогликозиды (стрептомицин); в тяжелых случаях рифампицин. Для лечения хронических форм заболевания применяется убитая бруцеллезная вакцина. Микробиологическая диагностика. При бактериологическом методе исследуемым материалом является: кровь, пунктат костного мозга, моча. Посев производится в 2 флакона, в одном из них создается повышенная концентрация углекислого газа. При появлении видимого роста делают пересев на плотную питательную среду для выделения чистой культуры и последующей идентификации бактерий в РА с видовыми сыворотками. С целью идентификации выделенных возбудителей используется комплекс признаков, отличающих виды друг от друга: потребность в углекислом газе при культивировании; способность расти на питательных средах с красителями (основной фуксин, тионин); образование сероводорода; способность синтезировать уреазу; чувствительность к бактериофагам. FRANCISЕLLA TULARENSIS Туляремия- острое природно-очаговое заболевание, характеризующееся поражением лимфоузлов, легких, кожных покровов, кишечника. Морфология Мелкие палочки размерами 0,2 х 0,7 мкм., неподвижные, обладают полиморфизмом, грамотрицательные, спор не образуют, некоторые имеют капсулу. В мазках из культур преобладают кокковые формы. Окрашиваются слабо, интенсивнее окрашиваются по полюсам. Культуральные свойства. Факультативные анаэробы, требовательны к питательным средам. На обычных средах не растут. Культивируются на средах с добавлением яичного желтка (среда Мак-Коя). На них вырастают крупные нежные молочно-белые колонии.. Хороший рост появляется также на средах с мозговой или печеночной тканью. В первых генерациях микробы роста не дают. Рост на питательных средах -замедленный, максимальных размеров колонии достигают на 3-5 дни культивирования. В жидких питательных средах рост поверхностный в виде пленки. Оптимальные условия культивирования рн 6,8 7; температура 37 0 С. Биохимические свойства Они слабо выражены. Бактерии ферментируют глюкозу, мальтозу и некоторые другие сахара до кислоты. Некоторые штаммы ферментируют глицерин, и это используется для их дифференциации. Образуют аммиак, серо- 7
8 водород, индола не образуют. Биохимическая активность нестандартна. С учетом ферментативной активности (по отношению к глицерину) и распространенности в природе выделяют 3 географические расы (подвиды) возбудителя: а) голарктическая не ферментирует глицерин, умеренно патогенна для домашних крыс и человека, распространенна в Европе и Азии; б) среднеазиатская ферментирует глицерин, умеренно патогенна для человека, встречается на территории нашей страны; в) неарктическая ферментирует глицерин, высоко патогенна для человека, распространена в Северной Америке. Антигенная структураа. Бактерии имеют: О-антиген, связанный с клеточной стенкой; Vi антиген, которым обладают только бактерии в S-форме; с этим антигеном связана вирулентность и иммуногенность возбудителя. Возбудитель туляремии в S-форме (вирулентный) имеет 2 антигена: О- и Vi- капсульный. Факторы патогенности. О-антиген (эндотоксин), Vi-антиген, а также ферменты (гиалуронидаза, нейраминидаза), пили-1, белки наружной мембраны (адгезины), капсула. Резистентность. Возбудитель хорошо сохраняется во внешней среде без снижения вирулентных свойств, особенно при низких температурах. Так в воде при +4 0 С он сохраняет жизнеспособность до 1 месяца; на зерне до 6 месяцев; при С 20 дней; в шкурах животных, погибших от туляремии, - до 1 месяца. Отмечается хорошая чувствительность возбудителя к высоким температурам и к дезинфицирующим веществам. При 60 0 С гибель микробов наступает через 20 минут; при кипячении за 1-2 минуты. 5% раствор формалина убивает возбудителя за 2-5 минут, 70% этиловый спирт - за несколько минут. Эпидемиология. Туляремия - природно-очаговая зоонозная инфекция. Резервуар и источник инфекции многочисленные виды диких грызунов, зайцевидные, птицы, собаки, парнокопытные и другие животные (всего- 82 вида). Основная роль в поддержании инфекции в природе принадлежит грызунам (полевкам, крысам, ондатрам и другие). Механизм заражения чаще всего трансмиссивный: передается животным и птицам кровососущими насекомыми. Специфические переносчики иксодовые клещи. Человек заражается от больных животных: при прямом контакте, например, при снятии шкур, сборе павших грызунов; алиментарным путем через инфицированную воду или продукты; респираторным путем при вдыхании содержащей возбудителей пыли от зерна. соломы, овощей. 8
9 Иммунитет Формирующийся постинфекционный иммунитет - гуморальный и клеточный, стойкий, пожизненный. Развивается гиперчувствительность замедленного типа. Профилактика Неспецифическая профилактика заключается в проведении мероприятий по обеззараживанию источников инфекции; нейтрализации путей ее передачи; по устранению условий заражения людей, включая санпросветработу, защиту от кровососущих насекомых, дезинфекцию в очаге поражения. Специфическая профилактика применение живой аттенуированной туляремийной вакцины по эпидпоказаниям. Вакцина применяется накожно. Микробиологическая диагностика. Материал для исследования: пунктат из бубонов, отделяемое конъюнктивы, мокрота, слизь из зева, кровь, испражнения, ткани погибших грызунов. Бактериологические исследования проводятся только в лабораториях, оборудованных для работы с особо опасными инфекциями. Как правило, выделить возбудителя из патологического материала невозможно, поэтому проводится биологическая проба на животных (морских свинках), которых заражают исследуемым материалом. Затем делают посев крови и тканей животных для выделения чистой культуры и ее идентификации. Для окончательной идентификации заражают чистой культурой белых мышей. Для экспресс-диагностики возбудитель идентифицируют в РИФ. Серодиагностика проводится в РА с туляремийным диагностикумом. Положительным считается результат при получении титров 1:100 и более. Для ранней диагностики применяется кожная проба с тулярином. (Проба остается положительной у лиц, переболевших туляремией). 9
Читайте также:


