Туляремия материал для микробиологических исследований








ТУЛЯРЕМИЯ. ВОЗБУДИТЕЛЬ ЗАБОЛЕВАНИЯ И ЛАБОРАТОРНАЯ ДИАГНОСТИКА
Цель данной статьи: охарактеризовать данное заболевание, возбудителя; изучить способы идентификации туляремии и методы борьбы людей с ней
Историческая справка, распространение, степень опасности и ущерб.Впервые заболевание было обнаружено в 1908 г. в графстве Туляре (Калифорния, США) у грызунов. Мак-Коу и Чепин (1911) первыми выделили культуру возбудителя болезни. Затем в том же штате США болезнь обнаружили у людей и овец (1921). Э. Френсис предложил назвать ее туляремией. Туляремия регистрируется в Северной Америке, Японии, разных странах Европы, Азии и Африки. Болезнь распространена преимущественно в ландшафтах умеренного климатического пояса Северного полушария. В нашей стране ее впервые зарегистрировали в 1921 г. Экономический, ущерб, причиняемый туляремией животноводству, в целом незначительный, так как у сельскохозяйственных животных клинически выраженная болезнь встречается редко. Однако больших затрат требует проведение противотуляремийных мероприятий [1].
Одной из характерных эпидемиологических особенностей туляремии является почти 100% восприимчивость к ней людей. Для человека прогноз при современных методах лечения благоприятный. Летальность колеблется в пределах 0,5% и наблюдается в основном при легочной и абдоминальной формах туляремии .
В настоящее время установлено свыше 60 видов животных — источников болезни. Основным источником инфекции в природных условиях являются грызуны [5].
Заражение сельскохозяйственных и домашних животных при включении их в эпизоотический процесс, протекающий среди диких животных, происходит в основном алиментарным, аэрогенным и трансмиссивным путями. Бактерии могут проникать в организм даже через неповрежденные кожные покровы, конъюнктиву и слизистые оболочки органов дыхания. Возможна внутриутробная передача возбудителя. Собаки заражаются обычно при поедании инфицированных тушек зайцев и кроликов (объектов охоты), а кошки, как и свиньи, — при поедании трупов крыс и мышей.
Из-за преимущественно латентного (бессимптомного) проявления болезни, незначительного обсеменения органов, отсутствия активного бактериовыделения сельскохозяйственные животные не участвуют в кругообращении возбудителя болезни, следовательно, нет их взаимного перезаражения внутри стада [1].
Клинические проявления. Сельскохозяйственные животные, как было сказано ранее, малочувствительные к возбудителю туляремии, за исключением ягнят и поросят. Спорадичные случаи болезни описаны у овец, свиней, коней, коров, а также у собак, кошек, кур и диких птиц.
Источником возбудителя болезни для домашних животных являются больные, переболевшие и погибшие грызуны, которые контаминируют франциселами пастбища, водопои, фураж.
Туляремийная инфекция протекает с чрезвычайно разнообразными признаками. Инкубационный период при туляремии длится от 4 до 12 сут., и в зависимости от вида животных болезнь может протекать остро или стерто.
У ягнят, при остром течении болезни отмечается повышение температуры до 41 °С, вялость, учащенное дыхание, шаткая походка. Спустя 2—3 дня температура тела снижается до нормы с последующим вторичным подъемом. У больных появляются признаки конъюнктивита и ринита; подчелюстные и предлопаточные лимфоузлы увеличены, плотные, болезненные (рисунок 2). В связи с резким снижением содержания гемоглобина развивается анемия, а в дальнейшем — паралич задних конечностей. Смерть наступает через 8—15 дней. При стертом течении болезни, которое бывает у взрослых овец, наблюдается незначительное угнетение и повышение температуры тела на 0,5°С. Через 2—3 дня эти признаки исчезают и животные выздоравливают.
У поросят туляремия проявляется повышением температуры тела до 42 °С, угнетением, кашлем и обильным потоотделением, вследствие чего кожа становится грязной и покрывается корками. Большинство больных погибает.
Рисунок 1 – Клинические признаки туляремии (слева направоо): воспаление подчелюстного лимфоузла у барана, аденит и поражение кожи у человека
Крупный рогатый скот, буйволы, лошади, собаки и птицы болеют латентно, со стертыми признаками. У беременных животных возможны аборты.
У кошек клинические симптомы следующие: депрессия; анорексия и лихорадка; лимфаденопатия, спленомегалия, гепатомегалия; изъязвление языка и полости рта; абсцессы; желтуха. Отмечена передача инфекции от кошек человеку. Клинические симптомы у человека и кошек похожи (рисунок 1) [2, 5].
Характеристика возбудителя
Систематика по Берджи:: отдел Gracilicutes
вид Francisella tularensis.
Морфология.. В окрашенных мазках возбудитель туляремии имеет кокковидную или палочковидную форму, размер 0,3…0, 7х0,2…0,4 мкм, кроме того, встречаются более мелкие клетки: от 0,15 мкм и меньше, способные проходить через бактериальные фильтры. Кокковидные формы чаще находят в культурах, палочковидные – в организме животных. Для бактерии характерен полиморфизм:могут попадаться шаровидные и нитевидные формы (рисунок 2).
Рисунок 2 – Возбудитель туляремии под микроскопом
Микроб неподвижен, спор не образует, имеет небольшую капсулу.
Устойчивость. Возбудитель туляремии характеризуется высокой устойчивостью в окружающей среде, особенно при низких температурах и высокой влажности (сохраняется в мороженом мясе до 3 месяцев, длительно сохраняется в молоке, сливках при низких температурах), менее резистентен к высыханию. Малоустойчив к высоким температурам (при 60 °C погибает через 5-10 минут, при 100° С — в течение 1-2 минут), солнечному свету, УФ-лучам, дезинфицирующим средствам (растворы лизола, хлорамина, хлорной извести убивают его за 3-5 минут) [2].
Лабораторная диагностика заболевания
Особенности взятия и пересылки патологического материала. В лабораторию при жизни животного посылают пунктат из увеличенных (мягких) лимфоузлов, абортированный плод (или органы плода), мочу, фекалии; после гибели животного - печень, почку, селезенку, увеличенные лимфоузлы от крупных животных. Трупы грызунов и других мелких животных направляют целиком. При необходимости патматериал консервируют в растворе глицерина. Следует учитывать, что обнаружить возбудитель туляремии в препаратах-отпечатках возможно лишь при обильном обсеменении исследуемого материала [4].
Бактериологическая диагностика. Бактерии легко воспринимают краску Гимзы (окрашиваются в розово-голубой цвет, рисунок 6). Хорошо окрашиваются всеми анилиновыми красками, но менее интенсивно, чем другие микробы. Грамотрицательны.
Окраска по Романовскому-Гимзе: бактерии окрашиваются в фиолетово-красный цвет, цитоплазма — в голубой, ядра — в красный (рисунок 3) [2].
Рисунок 3 - F. tularensis в отпечатке из селезенки
(окраска по Романовскому-Гимзе)
Культуральные свойства. F. tularensis является аэробом, на простых питательных средах не растет. Для получения чистой культуры исследуемый материал вводят в организм чувствительного животного, а потом делают посев на питательные среды, так как при первичном посеве на питательных средах возбудитель туляремии не растет.
Культивируют на питательных средах, содержащих цистеин, яичный желток, либо на кровяном агаре с цистеином и глюкозой. Наилучший рост наблюдается при температуре 37°С и рН 6,7—7,2.
Включение в питательную среду полимиксина В или пенициллина подавляет рост других микроорганизмов.
На обогащенных агаровых средах колонии F.tularensis мелкие, в виде капелек беловатого цвета с голубоватым отливом, круглые, с ровным краем, выпуклые и блестящие (рисунок 4).
На жидких средах размножаются хуже и только у поверхности среды, что связано, по-видимому, с аэрофильностью бактерий [4].
Рисунок 4 - Колонии возбудителя туляремии на глюкозо-кровяном агаре
Биохимические и токсигенные свойства возбудителя. Бактерия туляремии не обладает выраженной биохимической активностью. Способность сбраживать углеводы и спирты ограничена и может быть достоверно выявлена лишь на специальных плотных средах с пониженным содержанием белка и с определенным рН. Микроб ферментирует с образованием кислоты без газа глюкозу, мальтозу; образует сероводород и аммиак, редуцирует тионин, метиленовый голубой, малахитовый зеленый. Индол не образует.
Болезнетворное действие микробов связано с эндотоксином [2].
Антигенное строение возбудителя. Антигенная структура изучена недостаточно. Имеет общие антигены с бруцеллами, поэтому культуры могут агглютинироваться бруцеллезными сыворотками в низких титрах [4].
Серологическая диагностика. Серологические методы. Наличие AT к F. tularensis в сыворотке больного определяют в реакции агглютинации с туляремийным диагностикумом; положительной считают видимую глазом реакцию при разведении сыворотки 1:100 и больше.
Для быстрого обнаружения возбудителя в органах и тканях исследуемого животного применяют РСК или РП. Для диагностики туляремии у человека в настоящее время широко используют ПЦР.
Для ранней диагностики эффективна аллергическая кожная проба. В качестве АГ используют тулярин — взвесь бактерий, убитых нагреванием до 70°С.
Ускоренный метод серологической диагностики туляремии. Для этой цели применяют кровяно-капельную реакцию на стекле. В качестве антигена используют обычный туляремийный диагностикум. В положительных случаях при наличии у больного титра сыворотки 1 : 100 и выше агглютинация на стекле наступает немедленно после смешения крови с антигеном.
Для диагностики туляремии у больного вполне достаточно применение двух реакций: кожной пробы и РА.
Биопроба. Биологический метод является самым чувствительным способом обнаружения туляремийных бактерий в любом исследуемом материале. Исследуемый материал вводят подопытным животным (морская свинка, белая мышь) подкожно или внутрибрюшно. Зараженные животные погибают от туляремии в течении 4-14 дней [3].
Особенности специфической профилактики, лечение и иммунитет
Для человека используют живую туляремийную вакцину (Эльберта-Гайского) (рисунок 9). Ревакцинация проводится по показаниям через 5 лет .
Предложенная для иммунизации людей против туляремии живая вакцина при введении животным оказалась слабоиммуногенной, поэтому вакцинацию животных не проводят [4].
Для лечения туляремии у человека используют антибиотики. Бактерии туляремии устойчивы к пенициллину и его аналогам.
У переболевших людей стойкий пожизненный иммунитет [1,2].
Заключение
Туляремийная инфекция протекает с чрезвычайно разнообразными признаками. Клинические проявления этой инфекции зависят от вирулентности возбудителя и путей заражения и вида животного. Летальность у людей не превышает 0,5 % и отмечается лишь при генерализованной, легочной и абдоминальной формах туляремии.
Существует множество методов лабораторной диагностики этого заболевания: бактериологическая диагностика (бактерии легко воспринимают краску Гимзы, грамотрицательны), культивируют на обогащенных питательных средах, активно используют серологические методы и заражение лабораторных животных.
В настоящее время для специфической профилактики и лечения используют:
Для профилактики туляремии у человека используют живую туляремийную вакцину (Эльберта-Гайского) (ревакцинация проводится по показаниям через 5 лет) (вакцинацию животных не проводят).
Биопрепаратов для специфической терапии нет, для лечения туляремии у человека используют антибиотики.
I. Бактериологический метод:
Материал для исследования:содержимое бубона, отделяемое кожной язвы, конъюнктивы, зева, кровь, мокрота, ткани и органы трупа человека, грызунов, животных, объекты внешней среды.
1 день: Обработка Мазки-отпечатки Заражение
иммунолюминесцентной Окраска по Граму морской свинки
сывороткой (РИФ, РНИФ)
3-5 дни: Патанатомическое мазки-отпечатки Посев на среду Посев на МПА
исследование органов Окраска по Граму Мак-Коя (нет роста).
6-7 дни: Мазок Реакция агглютинации Изучение биохимической
Окраска с туляремийной активности проводят редко
по Граму диагностической (среды Гисса непригодны.
сывороткой Используют монометрический
Бактерии туляремии расщепляют до кислоты гл, мл
II. Биологический метод:
подкожное или внутрибрюшинное заражение мышей, морских свинок:
- патанатомическое исследование (увеличение миндалин, органов РЭС и т.д.);
- мазки – отпечатки, микроскопия;
- посев на питательные среды.
III. Серологический метод:
чаще используют для ретроспективной диагностики реакции:
- агглютинации (диагностический титр у детей 1:100),
- гемагглютинации (титры 1:1280 – 1:1560),
- кровяно-капельную реакцию Минкевича,
IV. Аллергологический метод:
0,1 мл тулярина вводится строго внутрикожно.
Для контроля – 0,1 мл 0,9% физиологического раствора.
Учет результатов через 24-48 часов.
Лабораторная диагностика чумы
1. Материал для исследования
Содержимое бубонов, язв,кровь, СМЖ, мокрота, испражнения, трупный материал(грызунов, людей), блохи.
2. Методы исследования
1. Микроскопический (окраска по Граму, РИФ).
2. Микробиологический с выделением культуры и её идентификацией.
3. Биологический с заражением чувствительных животных (мыши, крысы).
4. Иммунологический: РА, РНГА, РИФ, ИФА.
5. Аллергологический метод применяется invivo,invitro
а) Используется при ДСЛ в виде внутрикожной пробы с аллергеном, полученным из псевдотуберкулезного микроба. Это специфический аутолизат или препарат из его клеточной стенки. Положительная реакция начинает проявляться с 4-7 дня болезни и сохраняется до 5 месяцев. Это реакция in vivo на больных.
б) Аллергеном – псевдотуберкулином пользуются так же для реакции повреждаемости нейтрофилов больного invitro.
Схема бактериологического выделения возбудителя чумы


I этап. Бактериоскопия Отделяемое язвы, бубона,
(грамотрицательные мокрота, кровь, кал, грызуны,
коккобациллы и палочки) насекомые, трупы



Биопроба

Иммунофлюоресценция (втирание)

РИФ (АТ) МПБ 




II этапБактериоскопия Среда Туманского-






Биопроба










По Граму Подвижность Бактериоскопия РНГА


III этапБактериоскопия ИФА










РИФ Иммуно-



флюоросценция






РА РНГА





а)Чувствительность к б)Определение
в) Биохимическая активность (углеводов)
+ Глюкоза + Левулеза ± Сорбит
+ Мальтоза - Сахароза ± Декстрин
+ Галактоза - Рафиноза ± Лактоза
+ Маннит - Инулин ± Глицерин
+ Маноза - Дульцит ± Рамноза
IV этап. Анализ полученных результатов и заключение.
Примечание: В связи с высокой энергией роста Y. pestis все этапы могут пройти в течение суток. Поэтому учет результатов следует проводить многократно, каждые 4-8 часов. Заключение дается на основе совокупности всех признаков.
Питательные среды для иерсиний
Среда Клиглера содержит три сахара: глюкозу, сахарозу, лактозу, МПА, индикатор-феноловый красный.
Среда Эндо – МПА, глюкоза, лактоза, индикатор – фуксин.
Среда Левина – МПА, лактоза, индикатор – эозин с метиленовым синим.
Среда Серова Г.Д. – глюкоза, мочевина, желчь, конго красный, генциановый фиолетовый, МПА, молибденовокислый аммоний.
Среда обогащения – фосфатно-буферный раствор.
Реакция Фогес-Проскауэра – В среду Кларка засевают культуру, затем добавляют креатинин / альфа-нафтол с КОН/ В положительном случае бульон окрашивается в розовый цвет.
Среда Кларка – МПБ, 1% глюкозы, К2НРО4.
Среда Бессоновой жидкая голодная с рамнозой.
Среда Бессоновой плотная – 3% голоднокислый агар.
Среда Туманского-Коробковой с рамнозой.
Схема бактериологического выделения возбудителей иерсиниозов



I этап Испражнения, кровь, 





рвотные массы, желчь,
По Граму Подвижность дуоденальное содержимое, моча, секционный материал.


Среда обогащения



Резервуаром возбудителя туляремии (Francisella tularensis) являются грызуны, человек заражается от них всеми известными способами (при прямом и непрямом контакте, алиментарным, аэрогенным, трансмиссивным путем). По клиническим проявлениям тулерямия напоминает чуму, однако летальность при этой инфекции не высока (1-2%). Выделяют язвенно-железистую (бубонную), глазо-бубонную, ангинозно-буббонную, кишечную и легочную формы туляремии.
Методы микробиологической диагностики туляремии отражены в схеме 5. Для лабораторной диагностики туляремии широко используются иммунологические методы (серологическая диагностика, аллергические пробы), осуществляемые в обычных клинических условиях. Биопробы с выделением чистой культуры возбудителя проводятся в специализированных лабораториях особо-опасных инфекций.
Серологический метод.В сыворотке крови больных специфические антитела появляются с 10-12 дня болезни. В диагностических целях используют развернутую РА (диагностический титр 1:100 и выше), РНГА (диагностический титр 1:1280 и выше), ИФА.
Аллергическая проба.Выпускается 2 вида аллергена– туляринадля постановки соответственно накожной и внутрикожной аллергической пробы – раннего (положительная реакция ГЗТ с 5 дня болезни) и специфического метода диагностики туляремии. Наличие инфильтрата и гиперемии диаметром 1 см и более через 24-48 часов после введения тулярина расценивается как положительная реакция.
Биологический и бактериологический методы. Выделить культуры возбудителя от больного путем непосредственного посева материала на питательные среды не удается. Для выделения чистой культуры возбудителя туляремии применяется биопроба. С этой целью исследуемый материал (см. схему 5) вводят мышам или морским свинкам подкожно, накожно, внутрибрюшинно и/или через рот. Если экспериментальные животные в течение 7-15 дней не погибают, их умерщвляют и трупы подвергают бактериоскопическому и бактериологическому исследованию. Для этого готовят мазки-отпечатки из внутренних органов и окрашивают их по Романовскому-Гимзе. Возбудитель туляремии - мелкие (0,2-0,7 мкм) кокковидные и палочковидные бактерии, располагающиеся в мазках-отпечатках из органов внутриклеточно и в виде скоплений с образованием нежной капсулы (рис. 8). Применяют также методы экспресс- диагностики (обнаружение возбудителя в материале с помощью ИФМ и ИФА). Параллельно с микроскопическим исследованием кровь, костный мозг, участки внутренних органов и лимфатических узлов трупа животного засевают на одну из плотных питательных сред (желточная среда, среда МакКоя, глюкозо-цистиновый агар с кроличьей кровью и антибиотиками), которую культивируют при 37 0 С. Рост туляремийного микроба в виде нежных мелких колоний (рис. 10) появляется на 3-5-20 день, иногда позже. Возбудитель туляремии хорошо размножается также в желточном мешке 12-дневного куриного эмбриона.
Выделенную чистую культуру идентифицируют по морфологическим, антигенным (РА с туляремийной агглютинирующей сывороткой) и биологическим свойствам, определяют ее чувствительность к антибиотикам. В биохимическом отношении возбудитель туляремии мало активен (ферментация глюкозы, продукция сероводорода).
Схема 5. Микробиологическая диагностика туляремии
|
|
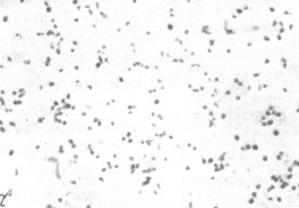
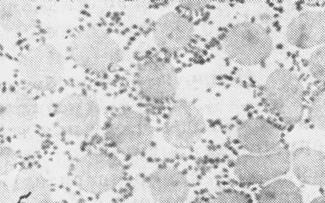
а б
Рис. 9. Возбудитель туляремии(Francisella tularensis) в мазках из чистой культуры (а) и в мазках-отпечатках органов белой мыши (б), погибшей в результате биопробы. х630.
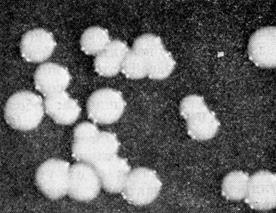
Рис. 10. Колонии возбудителя туляремии на глюкозо-цистеиновом агаре. х56
Генодиагностика.Для обнаружения ДНК возбудителя туляремии разработана ПЦР.
Читайте также:


