Стрептококки в кале норма
Обзор
Анализ на стрептококк (быстрый стрептококковый тест или экспресс-тест на стрептококк) - это тест, который позволяет определить, есть ли у вас в горле бактерия, которая называется "стрептококк группы А". Эта бактерия вызывает инфекцию, которая называется стрептококковый фарингит (ангина).
Использование
Стрептококковая инфекция встречается достаточно часто, особенно у детей в возрасте от 3 до 15 лет. Инфекция передается через контакт с инфицированной слизью или слюной.
Обычно врач назначает экспресс-тест на стрептококк, если у вас есть боли в горле и лихорадка. Другими признаками стрептококковой инфекции могут быть:
- затрудненное глотание;
- отсутствие аппетита;
- озноб;
- недостаток сил;
- болезненность или увеличение лимфатических узлов.
В некоторых случаях у людей, болеющих стрептококковой инфекцией, появляется розовая сыпь на коже, которая по ощущениям похожа на наждачную бумагу. Так как у взрослых стрептококковая инфекция встречается реже, врач не будет назначать быстрый стрептококковый тест, если у вас есть сочетание таких тяжелых или повторяющихся симптомов, как боли в горле, лихорадка, увеличение лимфатических узлов в горле.
Процедуры
Процедура быстрого стрептококкового теста проста, и он может проводиться в большинстве кабинетов врачей и медицинских клиник. Вам не нужно готовиться заранее. Перед тестом врач посмотрит в ваш рот и убедится в наличии красноты, отечности или других признаков инфекции. Врач попросит вас открыть рот и при помощи деревянного шпателя отодвинет язык вниз.
После этого врач возьмет ватный тампон и проведет им по задней стенке глотки (горла) для получения образца для анализа. Чтобы получить более точные результаты, он может сделать это дважды. Мазок будет протестирован при помощи специальных реактивов, которые позволяют подтвердить наличие стрептококка группы А.
Тест не болезненный, но может вызывать некоторый дискомфорт. Взятие мазка может вызвать рвотный рефлекс. Если быстрый стрептококковый тест требуется вашему ребенку, лучше взять его на руки или усадить к себе на колени, потому что, возможно, потребуется держать ребенка во время процедуры.
Результаты
Для получения результатов экспресс-теста требуется 15 минут. Если тест положительный, у вас в горле есть стрептококк группы А, который может быть причиной инфекции. Если он отрицательный, в вашем горле нет бактерий.
Быстрый стрептококковый тест является достаточно надежным. Тем не менее антибиотики и антисептики, которыми вы полощете рот, могут повлиять на результаты теста. Если вы принимаете антибиотики, не забудьте сообщить об этом своему врачу. Если вы знаете, что скоро вам будут делать тест, не используйте жидкость для полоскания рта, так как это может привести к ложному отрицательному результату.
В некоторых случаях, если у вас есть симптомы стрептококковой инфекции, но результат теста отрицательный, врач может назначить посев из горла. Посев из горла похож на экспресс-тест, но обработка образца более сложная. Кроме того, он более дорогой и требует больше времени для получения результатов, так как для роста бактерий необходимо определенное время. Посев из горла может подтвердить наличие стрептококка группы А.
Важно также отметить, что стрептококковый экспресс-тест позволяет обнаружить только один тип бактерий - стрептококк группы А. Это означает, что, если тест отрицательный, у вас может быть инфекция, вызванная другим типом бактерий или вирусов.
Реабилитация
Тест простой, быстрый и не имеет никаких побочных эффектов или рисков. Если результат теста на стрептококк положительный, врач, скорее всего, назначит антибиотики и порекомендует вам пить теплую жидкость и полоскать горло соленой водой.
Если результат теста на стрептококк отрицательный, но горло все равно болит, врач может проанализировать другие возможные причины, включая инфекции, вызванные другими бактериями или вирусами.
Если стрептококковую инфекцию не лечить, она может привести к более серьезным заболеваниям, таким как стрептококковая пневмония, ушные инфекции, менингит, воспаление почек и ревматизм. Если у вас появляются симптомы стрептококковой инфекции, своевременно обращайтесь к врачу.
, MD, FACP, Charles E. Schmidt College of Medicine, Florida Atlantic University;
, MD, Wellington Regional Medical Center, West Palm Beach
Last full review/revision September 2017 by Larry M. Bush, MD, FACP; Maria T. Perez, MD









Классификация стрептококков
Три различных типа стрептококков дифференцируют по характерным зонам гемолиза при выращивании на агаре овечьей крови:
Бета-гемолитические стрептококки образуют зоны прозрачного гемолиза вокруг каждой колонии.
Альфа-гемолитические стрептококки (обычно называемые стрептококки viridans) окружены зоной зеленоватой окраски, образующейся в результате частичного гемолиза.
Гамма-гемолитические стрептококки не являются гемолитическими.
Следующая классификация, базирующаяся на особенностях углеводов клеточной стенки, подразделяет стрептококки на группы согласно Лэнсфилду от А до H и от K до T ( Классификация стрептококков). Стрептококки группы вириданс формируют отдельную группу, которая трудно поддается классификации. В классификации Лэнсфилда энтерококки были первоначально включены в группу стрептококков D. Позже энтерококки были классифицированы как отдельный род.
Группа по Лэнсфилду
Streptococcus pyogenesStreptococcus pyogenes
Фарингит, тонзиллит, инфекции ран и кожи, септицемия, скарлатина, пневмония, ревматическая лихорадка, гломерулонефрит
Пенициллин, эритромицин, клиндамицин
Незамедлительный хирургический контроль
Бета-лактамы (обычно широкий спектр, если этиология не выявлена; если выявлены бета-гемолитические стрептококки группы А, можно назначить пенициллин или цефазолин) плюс клиндамицин
Сепсис, послеродовой или неонатальный сепсис, менингит, инфекции кожи, эндокардит, септический артрит, ИМП
Пенициллин или ампициллин, цефалоспорин, ванкомицин
Фарингит, пневмония, целлюлит, пиодермия, рожистое воспаление, импетиго, инфекции раны, послеродовой сепсис, неонатальный сепсис, эндокардит, септический артрит
Пенициллин, ванкомицин, цефалоспорины, макролиды (разной восприимчивости)
Энтерококковый: Enterococcus faecalis, E. faecium
Неэнтерококковый: S. bovis, S. equinus
Альфа или гамма
Эндокардит, инфекция мочевых путей, интраабдоминальная инфекция, целлюлит, инфекция раны, а также сопутствующая бактеремия
Пенициллин, ампициллин, ванкомицин (плюс аминогликозид при тяжёлой инфекции)
Ванкомицин-резистентные энтерококки: стрептограмины (хинупристин/дальфопристин), оксазолидононы (линезолид), липопептиды
S. gallolyticus (ранее S. bovis биотип I)
Кишечные аденомы или карциномы, эндокардиты
S. mutans, S. sanguis, S. salivarius, S. mitior, S. anginosus (ранее S milleri), S. constellatus, S. intermedius
Альфа или гамма
Эндокардит, бактериемия, менингит, локализованная инфекция, абсцессы (особенно S. anginosus)
Пенициллин, ампициллин, ванкомицин (плюс аминогликозид при тяжёлой инфекции), другие антибиотики, основываясь на in vitro чувствительности
Менингит, иногда синдром токсического шока
Целлюлит, инвазивные инфекции, обусловленные рыбой
*Нет соответствия специфической подгруппе.
GABHS = бета-гемолитические стрептококки группы А.
Факторы вирулентности
Многие стрептококки вырабатывают факторы вирулентности, включая стрептолизины, ДНКазы и гиалуронидазу, которые способствуют разрушению ткани и распространению инфекции. Отдельные штаммы продуцируют экзотоксины, которые активируют определенные Т-клетки, вызывая высвобождение цитокинов, включая фактор некроза опухоли-альфа, интерлeйкины и другие иммуномодуляторы. Эти цитокины активизируют комплемент, коагуляцию и фибринолитические системы, что ведет к шоку, полиорганной недостаточности и смерти.
Болезни, вызываемые стрептококками
Наиболее значимым патогеном из группы стрептококков является S. pyogenes, который является бета-гемолитическим и по классификации Лэнсфилда относящийся к группе А, поэтому его относят к бета-гемолитическим стрептококкам группы А (БГСА).
Самыми распространенными острыми заболеваниями, вызванными GABHS, являются:
Кроме того, отдаленные негнойные осложнения (ревматизм, острый гломерулонефрит) наблюдаются спустя ≥ 2 недели после инфекции.
Заболевания, вызываемые другими штаммами стрептококков, менее распространены и обычно включают инфекцию мягких тканей или эндокардит ( Классификация стрептококков). Некоторые инфекции, вызываемые не β-гемолитическими стрептококками группы А, развиваются у определенных групп населения (например, стрептококки группы B вызывают заболевания у новорожденных и рожениц).
Бета-гемолитический стрептококк группы А может распространяться через поражённые ткани и вдоль лимфатических каналов (вызывая лимфангиты) к региональным лимфоузлам (вызывая лимфадениты). БГСА могут также вызывать местные гнойные осложнения, такие как перитонзиллярный абсцесс, средний отит, синусит и бактериемию. Нагноение зависит от тяжести инфекции и восприимчивости ткани.
Другие тяжелые инфекции БГСГА включают септицемию, послеродовый сепсис, эндокардит, пневмонию и эмпиему.
Стрептококковый фарингит обычно вызывается β-гемолитическими стрептококками группы А. Приблизительно у 20% пациентов наблюдается острый тонзиллит, лихорадка, покраснение ротоглотки и гнойный налет на миндалинах. У остальных – менее выраженные симптомы, первичный осмотр может выявить картину, похожую на вирусный фарингит. Шейные и подчелюстные узлы увеличены и болезненны. Стрептококковый фарингит может осложниться перитонзиллярным абсцессом. Кашель, ларингит и заложенность носа нехарактерны для стрептококковой фарингеальной инфекции; наличие таких симптомов предполагает другую причину (обычно вирусную или аллергическую).

Состояние бессимптомного носительства может наблюдаться примерно в 20% случаев.
Скарлатина в настоящее время - редкое заболевание, однако вспышки скарлатины все еще возникают. Передача усиливается в условиях тесного контакта между детьми (например, в школах или детских садах).
Скарлатина - преимущественно детская болезнь, как правило, поражает глотку; реже встречается поражение стрептококковой инфекцией других областей (например кожи). Скарлатина вызывается стрептококками группы А, которые продуцируют эритрогенный токсин, приводящий к диффузному покраснению кожи с розовато-красным оттенком, бледнеющим при надавливании.
Сыпь лучше всего видна на животе или боковой части грудной клетки в виде темно-красных полос в кожных складках (линии Пастиа), на фоне бледного носогубного треугольника. Сыпь состоит из характерных, многочисленных, небольших (1–2 мм) папулезных высыпаний, придающих коже вид наждачной бумаги. Когда лихорадка купируется, обычно начинается отшелушивание верхнего слоя кожи. Обычно, сыпь длится 2–5 дней.

Малиново-красный язык (воспалённые сосочки, проявляющиеся сквозь ярко-красную оболочку) также типичен, эти симптомы необходимо дифференцировать от изменений языка, характерных при синдроме токсического шока и болезни Кавасаки.

Другие симптомы похожи на стрептококковый фарингит, а течение и контроль скарлатины – те же, как и при других инфекциях группы А.
Кожные инфекции включают:
Импетиго – это поверхностная инфекция кожи, протекающая с образованием корок и пузырей.

Рожистое воспаление (рожа) – это вариант поверхностной флегмоны с поражением лимфатических сосудов дермы. У пациентов имеются блестящие, красные, выпуклые, уплотненные очаги поражения с четкими краями. Чаще всего поражение вызвано БГСА, но иногда и другими стрептококками и нестрептококковыми возбудителями.

Флегмона затрагивает глубокие слои кожи и может быстро распространяется из-за многочисленных литических ферментов и токсинов, продуцируемых преимущественно стрептококками группы А.

На фотографии продемонстрировано локальное покраснение и отек, которые обычно сопровождаются местным повышением температуры и болезненностью при надавливании, характеризующие очаговый целлюлит.
Некротизирующий фасциит, вызванный S. pyogenes, является тяжелой кожной (иногда и мышечной) инфекцией, которая распространяется по фасциальным каналам. Инокуляция возбудителя происходит в коже или кишечнике.

Некротирующий фасциит распространен среди наркоманов, злоупотребляющих внутривенными препаратами.
Прежде известный как стрептококковая гангрена, этот синдром может также быть полимикробным, с участием аэробной и анаэробной микрофлоры, включая Clostridium perfringens. Полимикробная этиология заболевания вероятна, когда источником инфекции является кишечник (например, после операции на кишечнике, перфорации кишечника, дивертикулита или аппендицита).
Некротический фасциит начинается остро с повышения температуры тела и резкой локализованной боли, несоразмерной наблюдаемой физической картине, боль быстро прогрессирует и часто бывает первым, а иногда и единственным, проявлением болезни. Может присутствовать диффузная или локальная эритема. Тромбоз микроциркуляторного русла вызывает ишемический некроз, что приводит к быстрому распространению и непропорционально тяжелой интоксикации. У 20–40% пациентов поражены соседние мышцы. Шок и дисфункция почек распространены. Характерна высокая летальность даже при адекватном лечении.
Стрептококковый синдром токсического шока, подобный СТШ, вызванному S. aureus, может развиваться в результате инфекции токсин-продуцирующими штаммами GABHS и иногда другими стрептококками. У здоровых детей и взрослых стрептококки этой группы вызывают обычно инфекции мягких тканей и кожи.
Механизм, при котором определенные штаммы β-гемолитических стрептококков группы А вызывают поздние осложнения, неясен, может проявиться как аутоиммунное заболевание.
Ревматическая лихорадка – это воспалительное заболевание, встречающееся приблизительно у 3% пациентов через несколько недель после недолеченного фаринита, вызванного GABHS. Она стала гораздо менее распространенной в развитых странах, но все еще обычна в развивающихся странах. Диагноз первого эпизода основан на сочетании симптомов артрита, кардита, хореита, специфических кожных проявлений и результатов лабораторных анализов (критерии Джонса— Измененные критерии Джонса и первый эпизод острой ревматической лихорадки (ОРЛ)*).
Одна из самых основных причин необходимости лечения фарингита, вызванного БГСА (стрептококкового воспаления горла), состоит в том, чтобы предотвратить ревматическую лихорадку.
Постстрептококковый острый гломерулонефрит – острый нефритический синдром, развивающийся как осложнение фарингита или инфекции кожи, вызванной ограниченными нефрогенными штаммами GABHS (например, М-протеин серотипов 12 и 49). После инфекции горла или кожи, вызванной одним из этих штаммов, приблизительно 10–15% пациентов заболевают острым гломерулонефритом. Состояние чаще распространено среди детей и развивается спустя 1–3 нед. после инфекции. Почти все дети и несколько меньшее число взрослых выздоравливают без хронического почечного нарушения. Лечение данной инфекции антибиотиками имеет небольшое влияние на последующее развитие гломерулонефрита.
Синдром PANDAS (детское аутоиммунное нейропсихическое нарушение, связанное со стрептококками группы А), относится к под-множеству обсессивных нарушений или тиковых расстройств у детей, которые, как считается, также связаны с инфекцией β-гемолитических стрептококков группы А.
Определенные формы псориаза (например, каплевидный) могут также быть связаны с бета-гемолитическими стрептококковыми инфекциями.
Диагностика
Иногда экспресс-диагностика на антиген или титры антител
Стрептококки быстро идентифицируются посевом в питательной среде с бараньей кровью.
Существуют тесты для быстрого выявления антигена, которые могут обнаружить β-гемолитические стрептококки группы А непосредственно по мазку из ротоглотки (например, для диагностики на месте). Многие анализы основаны на иммуноферментном анализе, но в последнее время стали применяться анализы с использованием оптического иммунологического исследования. Эти быстрые тесты имеют высокую специфичность ( > 95%), но варьируют в значительной степени по чувствительности (от 55 до 80–90% у более современных оптических иммунологических анализов). Таким образом, положительные результаты могут установить диагноз, но отрицательные результаты, по крайней мере у детей, должны быть подтверждены культуральным исследованием. Поскольку стрептококковый фарингит менее распространен среди взрослых и они вряд ли будут иметь постстрептококковые осложнения, многие врачи не подтверждают у взрослых отрицательный результат при культивировании, если только не рассматривается вопрос использования макролидов; в таких случаях следует проводить тестирование на чувствительность к макролидам.
Обнаружение антистрептококковых антител в сыворотке крови в период выздоровления дает лишь косвенные доказательства инфекции. Анализ на противострептококковые антитела не являются целесообразным при диагностике острой БГСА-инфекции, поскольку антитела впервые вырабатываются через несколько недель после начала болезни, а повышение одного титра антител, скорее всего, отражает длительную предшествующую инфекцию. Обнаружение антител является основным при диагностике постстрептококковых заболеваний, таких как ревматизм и гломерулонефрит.
Титры антистрептолизина O (АСЛ-О) и антидезоксирибонуклеазы В (анти-ДНКазы B) начинают расти примерно через 1 неделю после заражения БГСА и достигают максимума через 1-2 месяца после заражения. Оба титра могут оставаться повышенными в течение нескольких месяцев, даже после неосложненных инфекций. Титры измеряются в острой фазе и в фазе выздоровления, спустя 2-4 недели. Результат считают положительным при увеличении титра в 2 и больше раза. Повышение одного титра выше верхнего предела нормы, указывает на предшествующую стрептококковую инфекцию или высокую стрептококковую эндемичность в социальной среде. Титр АСO повышается только в 75–80% инфекций. Для окончательного подтверждения диагноза в трудных случаях может также использоваться любой из других анализов (антигиалуронидаза, антиникотинамид аденин динуклеотидаза, антистрептокиназа).
Пенициллин, который назначают в течение первых 5 дней при симптоматическом стрептококковом фарингите, может задержать появление и уменьшить интенсивность иммуного ответа на антистрептолизин.
Пациенты со стрептококковой пиодермией обычно не дают выраженного иммунного ответа на антистрептолизин, но могут дать реакцию на другие антигены (т.е. анти-ДНКаза, антигиалуронидаза).
Что понимают под дисбактериозом? Какие методы диагностики являются современными и достоверными? Какие лекарственные препараты применяются при дисбактериозе? Вкишечнике человека находится свыше 500 различных видов микробов, общее количество которых
Вкишечнике человека находится свыше 500 различных видов микробов, общее количество которых достигает 10 14 , что на порядок выше общей численности клеточного состава человеческого организма. Количество микроорганизмов увеличивается в дистальном направлении, и в толстой кишке в 1 г кала содержится 10 11 бактерий, что составляет 30% сухого остатка кишечного содержимого.
В тощей кишке здоровых людей находится до 10 5 бактерий в 1 мл кишечного содержимого. Основную массу этих бактерий составляют стрептококки, стафилококки, молочнокислые палочки, другие грамположительные аэробные бактерии и грибы. В дистальном отделе подвздошной кишки количество микробов увеличивается до 10 7 –10 8 , в первую очередь за счет энтерококков, кишечной палочки, бактероидов и анаэробных бактерий. Недавно нами было установлено, что концентрация пристеночной микрофлоры тощей кишки на 6 порядков выше, чем в ее полости, и составляет 10 11 кл/мл. Около 50% биомассы пристеночной микрофлоры составляют актиномицеты, примерно 25% — аэробные кокки (стафилококки, стрептококки, энтерококки и коринеформные бактерии), от 20 до 30% приходится на бифидобактерии и лактобациллы.
Количество анаэробов (пептострептококки, бактероиды, клостридии, пропионобактерии) составляет около 10% в тонкой и до 20% в толстой кишке. На долю энтеробактерий приходится 1% от суммарной микрофлоры слизистой оболочки.
До 90-95% микробов в толстой кишке составляют анаэробы (бифидобактерии и бактероиды), и только 5-10% всех бактерий приходится на строгую аэробную и факультативную флору (молочнокислые и кишечные палочки, энтерококки, стафилококки, грибы, протей).
Кишечные палочки, энтерококки, бифидобактерии и ацидофильные палочки обладают выраженными антагонистическими свойствами. В условиях нормально функционирующего кишечника они способны подавлять рост несвойственных нормальной микрофлоре микроорганизмов.
Площадь внутренней поверхности кишечника составляет около 200 м 2 . Она надежно защищена от проникновения пищевых антигенов, микробов и вирусов. Важную роль в организации этой защиты играет иммунная система организма. Около 85% лимфатической ткани человека сосредоточено в стенке кишечника, где продуцируется секреторный IgA. Кишечная микрофлора стимулирует иммунную защиту. Кишечные антигены и токсины кишечных микробов значительно увеличивают секрецию IgA в просвет кишки.
Расщепление непереваренных пищевых веществ в толстой кишке осуществляется ферментами бактерий, при этом образуются разнообразные амины, фенолы, органические кислоты и другие соединения. Токсические продукты микробного метаболизма (кадаверин, гистамин и другие амины) выводятся с мочой и в норме не оказывают влияния на организм. При утилизации микробами неперевариваемых углеводов (клетчатки) образуются короткоцепочечные жирные кислоты. Они обеспечивают клетки кишки энергоносителями и, следовательно, улучшают трофику слизистой оболочки. При дефиците клетчатки может нарушаться проницаемость кишечного барьера вследствие дефицита короткоцепочечных жирных кислот. В результате кишечные микробы могут проникать в кровь.
Под влиянием микробных ферментов в дистальных отделах подвздошной кишки происходит деконъюгация желчных кислот и преобразование первичных желчных кислот во вторичные. В физиологических условиях от 80 до 95% желчных кислот реабсорбируется, остальные выделяются с фекалиями в виде бактериальных метаболитов. Последние способствуют нормальному формированию каловых масс: тормозят всасывание воды и тем самым препятствуют излишней дегидратации кала.
В понятие дисбактериоза кишечника входит избыточное микробное обсеменение тонкой кишки и изменение микробного состава толстой кишки. Нарушение микробиоценоза происходит в той или иной степени у большинства больных с патологией кишечника и других органов пищеварения. Следовательно, дисбактериоз является бактериологическим понятием. Он может рассматриваться как одно из проявлений или осложнение заболевания, но не самостоятельная нозологическая форма.
Крайней степенью дисбактериоза кишечника является появление бактерий желудочно-кишечного тракта в крови (бактериемия) или даже развитие сепсиса.
Состав микрофлоры кишечника нарушается при болезнях кишечника и других органов пищеварения, лечении антибиотиками и иммунодепрессантами, воздействиях вредных факторов внешней среды.
Клинические проявления дисбактериоза зависят от локализации дисбиотических изменений.
При дисбактериозе тонкой кишки численность одних микробов в слизистой оболочке тонкой кишки увеличена, а других уменьшена. Отмечается увеличение Eubacterium (в 30 раз), α-стрептококков (в 25 раз), энтерококков (в 10 раз), кандид (в 15 раз), появление бактерий рода Acinetobacter и вирусов герпеса. Уменьшается от 2 до 30 раз количество большинства анаэробов, актиномицетов, клебсиелл и других микроорганизмов, являющихся естественными обитателями кишечника.
Причиной дисбактериоза могут быть: а) избыточное поступление микроорганизмов в тонкую кишку при ахилии и нарушении функции илеоцекального клапана; б) благоприятные условия для развития патологических микроорганизмов в случаях нарушения кишечного пищеварения и всасывания, развития иммунодефицита и нарушений проходимости кишечника.
Повышенная пролиферация микробов в тонкой кишке приводит к преждевременной деконъюгации желчных кислот и потере их с калом. Избыток желчных кислот усиливает моторику толстой кишки и вызывает диарею и стеаторею, а дефицит желчных кислот приводит к нарушению всасывания жирорастворимых витаминов и развитию желчнокаменной болезни.
Бактериальные токсины и метаболиты, например фенолы и биогенные амины, могут связывать витамин В12.
Некоторые микроорганизмы обладают цитотоксическим действием и повреждают эпителий тонкой кишки. Это ведет к уменьшению высоты ворсинок и углублению крипт. При электронной микроскопии выявляется дегенерация микроворсинок, митохондрий и эндоплазматической сети.
Состав микрофлоры толстой кишки может меняться под влиянием различных факторов и неблагоприятных воздействий, ослабляющих защитные механизмы организма (экстремальные климатогеографические условия, загрязнение биосферы промышленными отходами и различными химическими веществами, инфекционные заболевания, болезни органов пищеварения, неполноценное питание, ионизирующая радиация).
В развитии дисбактериоза толстой кишки большую роль играют ятрогенные факторы: применение антибиотиков и сульфаниламидов, иммунодепрессантов, стероидных гормонов, рентгенотерапия, хирургические вмешательства. Антибактериальные препараты значительно подавляют не только патогенную микробную флору, но и рост нормальной микрофлоры в толстой кишке. В результате размножаются микробы, попавшие извне, или эндогенные виды, устойчивые к лекарственным препаратам (стафилококки, протей, дрожжевые грибы, энтерококки, синегнойная палочка).
Клинические проявления чрезмерного роста микроорганизмов в тонкой кишке могут полностью отсутствовать, выступать в качестве одного из патогенетических факторов хронической рецидивирующей диареи, а при некоторых болезнях, например, дивертикулезе тонкой кишки, частичной кишечной непроходимости или после хирургических операций на желудке и кишечнике, приводить к тяжелой диарее, стеаторее и В 12 -дефицитной анемии.
Особенностей клинического течения заболевания у больных с различными вариантами дисбактериоза толстой кишки, по данным бактериологических анализов кала, в большинстве случаев установить не удается. Можно отметить, что больные хроническими заболеваниями кишечника чаще инфицируются острыми кишечными инфекциями по сравнению со здоровыми. Вероятно, это связано со снижением у них антагонистических свойств нормальной микрофлоры кишечника и, прежде всего, частым отсутствием бифидобактерий.
Особенно большую опасность представляет псевдомембранозный колит, развивающийся у некоторых больных, длительно лечившихся антибиотиками широкого спектра действия. Этот тяжелый вариант дисбактериоза вызывается токсинами, выделяемыми синегнойной палочкой Clostridium difficile, которая размножается в кишечнике при угнетении нормальной микробной флоры.
Очень редко наблюдается молниеносное течение псевдомембранозного колита, напоминающее холеру. Обезвоживание развивается в течение нескольких часов и заканчивается летальным исходом.
Таким образом, оценка клинической значимости дисбиотических изменений должна основываться прежде всего на клинических проявлениях, а не только на результатах исследования микрофлоры кала.
Диагностика дисбактериоза представляет собой сложную и трудоемкую задачу. Для диагностики дисбактериоза тонкой кишки применяют посев сока тонкой кишки, полученного с помощью стерильного зонда. Дисбактериоз толстой кишки выявляют с помощью бактериологических исследований кала.
Микробная флора образует большое количество газов, в том числе водорода. Это явление используют для диагностики дисбактериоза. Концентрация водорода в выдыхаемом воздухе натощак находится в прямой зависимости от выраженности бактериального обсеменения тонкой кишки. У больных с заболеваниями кишечника, протекающими с хронической рецидивирующей диареей и бактериальным обсеменением тонкой кишки, концентрация водорода в выдыхаемом воздухе значительно превышает 15 ppm.
Для диагностики дисбактериоза применяют также нагрузку лактулозой. В норме лактулоза не расщепляется в тонкой кишке и метаболизируется микробной флорой толстой кишки. В результате количество водорода в выдыхаемом воздухе повышается (рис. 1).
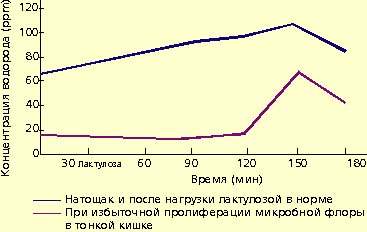 |
| Рисунок 1. Концентрация водорода в выдыхаемом воздухе |
Наиболее частыми бактериологическими признаками дисбактериоза толстой кишки являются отсутствие основных бактериальных симбионтов — бифидобактерий и уменьшение количества молочнокислых палочек. Увеличивается количество кишечных палочек, энтерококков, клостридий, стафилококков, дрожжеподобных грибов и протея. У отдельных бактериальных симбионтов появляются патологические формы. К ним относятся гемолизирующая флора, кишечные палочки со слабо выраженными ферментативными свойствами, энтеропатогенные кишечные палочки и т. д.
Углубленное изучение микробиоценоза показало, что традиционные методы не позволяют получить истинную информацию о состоянии микрофлоры кишечника. Из 500 известных видов микробов в целях диагностики обычно изучаются лишь 10-20 микроорганизмов. Важно, в каком отделе — в тощей, подвздошной или толстой кишках — исследуется микробный состав. Поэтому перспективы разработки клинических проблем дисбактериоза в настоящее время связывают с применением химических методов дифференциации микроорганизмов, позволяющих получить универсальную информацию о состоянии микробиоценоза. Наиболее широко для этих целей используются газовая хроматография (ГХ) и газовая хроматография в сочетании с масс-спектрометрией (ГХ-МС). Этот метод позволяет получить уникальную информацию о составе мономерных химических компонентов микробной клетки и метаболитов. Маркеры такого рода могут быть определены и использованы для детектирования микроорганизмов. Главным преимуществом и принципиальным отличием этого метода от бактериологических является возможность количественного определения более 170 таксонов клинически значимых микроорганизмов в различных средах организма. При этом результаты исследования могут быть получены в течение нескольких часов.
Проведенные нами исследования микробиоценоза в крови и биоптатов слизистой оболочки тонкой и толстой кишок у больных с синдромом раздраженного кишечника позволили обнаружить отклонения от нормы до 30-кратного увеличения или уменьшения многих компонентов. Существует возможность оценки изменений микрофлоры кишечника на основании данных анализа крови методом ГХ-МС-микробных маркеров.
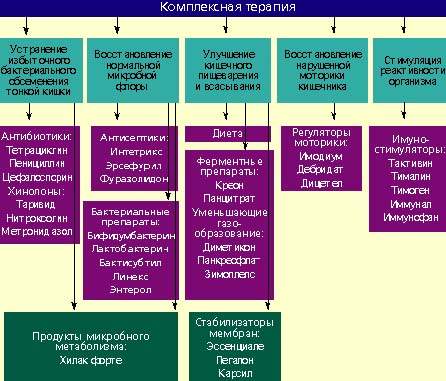 |
Лечение дисбактериоза должно быть комплексным (схема) и включать в себя следующие мероприятия:
- устранение избыточного бактериального обсеменения тонкой кишки;
- восстановление нормальной микробной флоры толстой кишки;
- улучшение кишечного пищеварения и всасывания;
- восстановление нарушенной моторики кишечника;
- стимулирование реактивности организма.
Антибактериальные препараты необходимы в первую очередь для подавления избыточного роста микробной флоры в тонкой кишке. Наиболее широко применяются антибиотики из группы тетрациклинов, пенициллинов, цефалоспорины, хинолоны (таривид, нитроксолин) и метронидазол.
Однако антибиотики широкого спектра действия в значительной степени нарушают эубиоз в толстой кишке. Поэтому они должны применяться только при заболеваниях, сопровождающихся нарушениями всасывания и моторики кишечника, при которых, как правило, отмечается выраженный рост микробной флоры в просвете тонкой кишки.
Антибиотики назначают внутрь в обычных дозах в течение 7–10 дней.
При заболеваниях, сопровождающихся дисбактериозом толстой кишки, лечение лучше проводить препаратами, которые оказывают минимальное влияние на симбионтную микробную флору и подавляют рост протея, стафилококков, дрожжевых грибов и других агрессивных штаммов микробов. К ним относятся антисептики: интетрикс, эрсефурил, нитроксолин, фуразолидон и др.
При тяжелых формах стафилококкового дисбактериоза применяют антибиотики: таривид, палин, метронидазол (трихопол), а также бисептол-480, невиграмон.
Антибактериальные препараты назначают в течение 10–14 дней. В случае появления в кале или кишечном соке грибов показано применение нистатина или леворина.
У всех больных с диареей, ассоциированной с антибиотиками, протекающей с интоксикацией и лейкоцитозом, возникновение острой диареи следует связывать с Cl. difficile.
В этом случае срочно делают посев кала на Cl. difficile и назначают ванкомицин по 125 мг внутрь 4 раза в сутки; при необходимости доза может быть увеличена до 500 мг 4 раза в день. Лечение продолжают в течение 7-10 суток. Эффективен также метронидазол в дозе 500 мг внутрь 2 раза в сутки, бацитрацин по 25 000 МЕ внутрь 4 раза в сутки. Бацитрацин почти не всасывается, в связи с чем в толстой кишке можно создать более высокую концентрацию препарата. При обезвоживании применяют адекватную инфузионную терапию для коррекции водно-электролитного баланса. Для связывания токсина Cl. difficile используют холестирамин (квестран).
Живые культуры нормальной микробной флоры выживают в кишечнике человека от 1 до 10% от общей дозы и способны в какой-то мере выполнять физиологическую функцию нормальной микробной флоры. Бактериальные препараты можно назначать без предварительной антибактериальной терапии или после нее. Применяют бифидумбактерин, бификол, лактобактерин, бактисубтил, линекс, энтерол и др. Курс лечения длится 1-2 месяца.
Возможен еще один способ устранения дисбактериоза — воздействие на патогенную микробную флору продуктами метаболизма нормальных микроорганизмов. К таким препаратам относится хилак форте. Он создан 50 лет назад и до настоящего времени применяется для лечения больных с патологией кишечника. Хилак форте представляет собой стерильный концентрат продуктов обмена веществ нормальной микрофлоры кишечника: молочной кислоты, лактозы, аминокислот и жирных кислот. Эти вещества способствуют восстановлению в кишечнике биологической среды, необходимой для существования нормальной микрофлоры, и подавляют рост патогенных бактерий. Возможно, продукты метаболизма улучшают трофику и функцию эпителиоцитов и колоноцитов. 1 мл препарата соответствует биосинтетическим активным веществам 100 млрд. нормальных микроорганизмов. Хилак форте назначают по 40–60 капель 3 раза в день на срок до 4 недель в сочетании с препаратами антибактериального действия или после их применения.
Совсем недавно появились сообщения о возможности лечения острой диареи, ассоциированной с антибактериальной терапией и Cl. difficile, большими дозами пре- и пробиотиков.
У больных с нарушением полостного пищеварения применяют креон, панцитрат и другие панкреатические ферменты. С целью улучшения функции всасывания назначают эссенциале, легалон или карсил, т. к. они стабилизируют мембраны кишечного эпителия. Пропульсивную функцию кишечника улучшают имодиум (лоперамид) и тримебутин (дебридат).
Для повышения реактивности организма ослабленным больным целесообразно применять тактивин, тималин, тимоген, иммунал, иммунофан и другие иммуностимулирующие средства. Курс лечения должен составлять в среднем 4 недели. Одновременно назначаются витамины.
Первичная профилактика дисбактериоза представляет очень сложную задачу. Ее решение связано с общими профилактическими проблемами: улучшением экологии, рациональным питанием, улучшением благосостояния и прочими многочисленными факторами внешней и внутренней среды.
Вторичная профилактика предполагает рациональное применение антибиотиков и других медикаментов, нарушающих эубиоз, своевременное и оптимальное лечение болезней органов пищеварения, сопровождающихся нарушением микробиоценоза.
Читайте также:


