Стрептококк на клапанах сердца
Тябут Тамара Дмитриевна, профессор кафедры кардиологии и ревматологии Бел МАПО, доктор медицинских наук
Год здоровья. Прочитай и передай другому
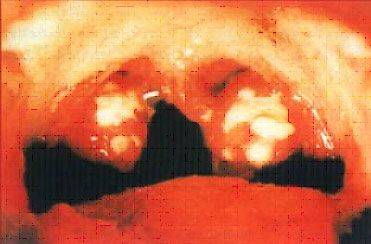
Тонзиллит, вызванный бета-гемолитическим стрептококком.
При наличии хронического тонзиллита в лакунах скапливается большое количество гноя, состоящего из погибших микробов, белых кровяных телец - лейкоцитов, других клеток (гнойно-казеозные пробки). В гнойном содержимом лакун размножаются болезнетворные микробы. Продукты жизнедеятельности микробов из миндалин попадают в кровь и приводят к развитию тонзиллогенной интоксикация, проявляющейся утомляемостью, болями в мышцах и суставах, головными болями, снижением настроения, субфебрилитетом. Миндалины превращаются в хранилище инфекционных агентов, откуда они могут распространяться по организму и быть причиной воспалительных процессов. Частые болезни еще более ослабляют иммунитет, что приводит к дальнейшему развитию тонзиллита. Так формируется порочный круг заболевания.
Хронический тонзиллит опасен осложнениями, связанными с распространением инфекции по организму. К ним относятся паратонзиллярные абсцессы, ·поражение сердца (тонзилогенная миокардиодистрофия, острая ревматическая лихорадка), сосудов, почек.
Тонзиллогенная миокардиодистрофия относится к часто развивающимся, но гораздо реже диагностируемым поражениям сердечной мышцы при хроническим тонзиллите. Она вызывается токсинами бактерий, находящихся в миндалинах, и продуктами местного воспаления и распада тканей.
Клинические признаки тонзиллогенной дистрофии миокарда обусловлены нарушением деятельности вегетативной нервной системы (вегетативной дисфункцией) и нарушением различных видов обмена в сердечной мышце (электролитного, белкового), следствием которых является нарушение образования энергии в сердечной мышце. На ранних этапах развития тонзилогенная миокардиодистрофия проявляется высокой частотой сердечных сокращений - тахикардией, перебоями в работе сердца - экстрасистолией, одышкой при интенсивных физических нагрузках, нарушением общего самочувствия больных. При поздней диагностике появляются признаки сердечной недостаточности, уменьшается объем нагрузки, вызывающей одышку, появляются более тяжелые нарушения ритма и проводимости. При своевременной диагностике и лечении внесердечного фактора - хронического тонзиллита, вызвавшего перечисленные изменения в сердечной мышце, они обратимы и постепенно структура и функции сердечной мышцы
восстанавливаются.
Наибольшую опасность для прогноза и качества жизни пациентов представляет поражение сердца при острой ревматической лихорадке.
Острая ревматическая лихорадка (ОРЛ) - постинфекционное осложнение тонзиллита (ангины) или фарингита, вызванных бета - гемолитическим стрептококком группы А, в виде системного воспалительного заболевания соединительной ткани с преимущественной локализацией патологического процесса в сердечно-сосудистой системе (кардит), суставах (мигрирующий полиартрит), мозге (хорея) и коже (кольцевидная эритема, ревматические узелки), развивающегося у предрасположенных лиц, главным образом молодого возраста (7-15 лет). В Российской Федерации и в РБ заболеваемость ревматической лихорадкой составляет от 0,2 до 0,6 случаев на 1000 детского населения. Первичная заболеваемость ОРЛ в России в начале ХХI века составила 0,027 случая на 1000 населения. Частота впервые выявленной хронической ревматической болезни сердца (ХРБС), которая включает пороки сердца и специфические изменения клапанов (краевой фиброз), выявляемые при ультразвуковом исследовании сердца - 0,097случаев на 1000 населения, в том числе ревматических пороков сердца - 0,076 случаев на 1000 взрослого населения. Имеющиеся статистические различия между частотой первичной заболеваемости острой ревматической лихорадкой и хронической ревматической болезнью сердца свидетельствует о наличии большого количества не диагностированных острых форм болезни.
Временной интервал между перенесенным острым стрептококковым тонзиллитом, фарингитом, обострением хронического тонзиллита и возникновением проявлений острой ревматической лихорадки составляет 3-4 недели. При острой ревматической лихорадке могут поражаться все структуры сердца - эндокард, миокард, перикард. Поражение миокарда (мышцы сердца) встречается всегда. Проявлениями поражения сердца могут быть сердцебиение, одышка, связанная с физической нагрузкой или в покое, боли в области сердца ноющего характера, которые в отличие о стенокардии не имеют четкой связи с физической нагрузкой и могут сохраняться длительный период времени, сердцебиение, перебои в работе сердца, приступообразные нарушения ритма - мерцательная аритмия, трепетание предсердий. Обычно поражение сердца сочетается с суставным синдромом по типу артралгий - болей в крупных суставах (коленных, плечевых, голеностопных, локтевых) или артрита (воспаления) этих же суставов. Для воспаления суставов характерны боль, изменения формы сустава, вызванные отеком, покраснение кожи в области пораженного сустава, местное повышение температуры и нарушение функции сустава в виде ограничения объема движений. Мелкие суставы поражаются гораздо реже. Воспалительный процесс в суставах носит мигрирующий характер и быстро проходит на фоне правильного лечения. Поражение сердца и суставов обычно сопровождается повышением температуры тела, слабостью потливостью, нарушением трудоспособности. У части пациентов встречаются поражения нервной системы, кожные сыпи по типу кольцевидной эритемы и подкожные ревматические узелки.
Для постановки диагноза острой ревматической лихорадки существуют диагностические критерии, которые включают клинические, лабораторные и инструментальные данные, а также информацию о перенесенной инфекции, вызванной бета-гемолитическим стрептококком группы А, его ревматогенными штаммами. Своевременно поставленный диагноз позволяет добиться выздоровления больного при проведении терапии антибиотиками, глюкокортикоидными гормонами, нестероидным противовоспалительными препаратами. Однако, при поздно начатом лечении, несоблюдении пациентами двигательного режима, наличии генетической предрасположенности, не санированной очаговой инфекции (декомпенсированный тонзиллит, кариес) исходом острой ревматической лихорадки может быть хроническая ревматическая болезнь сердца с пороком сердца или без него. Порок сердца возникает как исход воспалительного поражения клапанов сердца. Наличие порока сердца ревматической этиологии требует отнесения пациента к группе высокого риска развития инфекционного эндокардита, наиболее тяжелой формы поражения сердца, связанного с инфекционными агентами.
Острая ревматическая лихорадка относится к заболевания, при которых профилактика имеет важное значение для снижения как первичной заболеваемости, так и повторных эпизодов болезни (повторная острая ревматическая лихорадка).
Первичная профилактика имеет своей целью снижение первичной заболеваемости и включает комплекс медико-санитарных и гигиенических мероприятий, а так же адекватное лечение инфекций, вызванных бета-гемолитическим стрептококком группы А. Первое направление включает мероприятия по закаливанию, знакомство с гигиеническими навыками, санацию хронических очагов инфекции, в первую очередь - хронического тонзиллита и кариеса. Миндалины тщательно санируют повторными полосканиями и промываниями растворами антибактериальных средств, вакуум-аспирацией патологического содержимого лакун. Если это не дает желаемого результата обсуждается вопрос хирургического лечения - удаления миндалин. В каждом конкретном случае выбор тактики лечения определяет врач отоларинголог и терапевт, кардиолог или ревматолог.
Адекватное лечение ангины и фарингита направлено на подавление роста и размножения стрептококка в организме при развитии стрептококкового фарингита, ангины, тонзиллита. Основу лечения составляет антибиотикотерапия в сочетании с противовоспалительными средствами, которые должны проводиться не менее 10 дней с обязательным контролем общего анализа крови, мочи, а по показаниям биохимического анализа крови при возникновении признаков болезни, при окончании лечения и через месяц от появления первых признаков болезни. Лабораторное исследование, проведенное в эти сроки, позволяет правильно поставить диагноз, определить эффективность лечения, и что самое главное, не пропустить начало развития осложнения в виде острой ревматической лихорадки.
Вторичная профилактика имеет своей целью предупреждение развития повторной острой ревматической лихорадки и прогрессирования заболевания у лиц, перенесших ОРЛ. Она проводится у пациентов, не имеющих аллергии к препаратам пенициллинового ряда. Лекарственным средством, используемым для профилактики у взрослых является бензатинбензилпенициллин (экстенциллин, ретарпен) в дозе 2 400 000 ЕД 1 раз в 3 недели внутримышечно. Профилактические режимы зависят от возраста пациента и исхода острой ревматической лихорадки. В соответствии с рекомендациями Ассоциации ревматологов России вторичная профилактика включает следующие режимы:
Наиболее тяжелым и прогностически неблагоприятным заболеванием сердца, связанным с инфекцией считается инфекционный эндокардит - заболевание, характеризующееся развитием воспалительного процесса на клапанном или пристеночном эндокарде, включающее поражение крупных внутригрудных сосудов, отходящих от сердца, возникающее вследствие воздействия микробной инфекции. Наиболее часто это различные бактерии- стрептококки, стафилококки, энтерококки, кишечная палочка, синегнойная палочка и многие другие. Описано 119 различных возбудителей, приводящих к развитию заболевания.
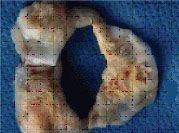
Аортальный клапан
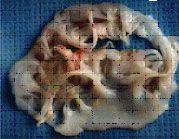
Митральный клапан
Так выглядят клапаны сердца при развитии инфекционного эндокардита.
Наложения из микробов, клеток крови нарушают их функцию,
разрушают клапан и зачастую требуют экстренного хирургического лечения.
Распространенность инфекционного эндокардита в начале 21 века составляла 2- 4 случая на 100 000 населения в год. Отмечается повсеместный рост заболеваемости, наиболее выраженный в старших возрастных группах и составляющий 14, 5 случая на 100 000 населения в возрасте 70-80 лет. Диагностика заболевания сложна. При первом обращении к врачу диагноз ставится только у 19 - 34,2% больных. Средний срок от первичного обращения до постановки диагноза составляет не менее 1,5 - 2 месяцев.
Выделяют группу больных с высоким риском развития инфекционного эндокардита, в которую входят:
- пациенты с ранее перенесенным инфекционным эндокардитом,
- пациенты с протезированными клапанами сердца,
- пациенты с синими врожденными пороками,
- пациенты после хирургических операций на аорте, легочных сосудах
- пациенты с приобретенными пороками сердца, в первую очередь ревматической этиологии (ХРБС).
Кроме этого выделена группа умеренного (промежуточного) риска, объединяющая пациентов со следующими заболеваниями:
- Пролапс митрального клапана, обусловленный миксоматозной дегенерацией или другими причинами с регургитацией 2-3 степени или пролапсы нескольких клапанов
- Нецианотичные врожденные пороки сердца (исключая вторичный ДМПП)
- Бикуспидальный (двухстворчатый)аортальный клапан
- Гипертрофическая кардиомиопатия (идиопатический гипертрофический субаортальный стеноз).
Установлено, что для развития инфекционного эндокардита необходимо попадание возбудителя в кровь. Наиболее частой причиной этого могут быть стоматологические манипуляции, сопровождающиеся повреждением десны и кровоточивостью. При наличии кариеса или заболеваний десен, бактериемия (наличие возбудителя в крови) может возникать достаточно часто.
, MD, North Shore Hospital, Auckland
Last full review/revision September 2017 by Guy P. Armstrong, MD







Эндокардит обычно означает инфекцию эндокарда (то есть инфекционный эндокардит). Термин эндокардит также может включать неинфекционный эндокардит, при котором стерильные тромбоциты и фибриновые тромбы фиксируются на клапанах сердца и прилегающем эндокарде. Неинфекционный эндокардит иногда может приводить к инфекционному эндокардиту. Оба могут привести к эмболизации и нарушению функции сердца.
Диагноз инфекционного эндокардита обычно устанавливается с учетом совокупности всех клинических данных, а не результата одного исследования.
Инфекционный эндокардит может возникнуть в любом возрасте. Мужчины заболевают в два раза чаще, чем женщины. Лица, употребляющие внутривенные наркотики, пациенты с ослабленным иммунитетом и пациенты с искусственными клапанами сердца и другими внутрисердечными устройствами имеют наибольший риск.
Этиология
Здоровое сердце относительно устойчиво к инфекции. Бактерии и грибы не легко адгезируются к поверхности эндокарда, и постоянный ток крови помогает предотвратить их оседание на эндокард. Таким образом, для развития эндокардита требуются, как правило, 2 условия:
Предшествующая аномалия эндокарда
Присутствие микроорганизмов в кровотоке (бактериемия)
Реже, массивная бактериемия или особо вирулентные микроорганизмы поражают нормальные клапаны.
Эндокардит часто поражает клапаны сердца. Основными предрасполагающими факторами ИЭ являются врожденные пороки сердца, ревматическое поражение клапанов, бикуспидальный или кальцинированный аортальный клапан, пролапс митрального клапана, гипертрофическая кардиомиопатия и предшествующий эндокардит. Протезирование клапанов и других внутрисердечных устройств представляет особый риск. Иногда пристеночные тромбы, дефекты межжелудочковой перегородки и область открытого аортального протока подвергаются инфицированию. Ядром инфекции является стерильная фибринозно-тромбоцитарная вегетация, формирующаяся при высвобождении поврежденными эндотелиальными клетками тканевых факторов.
Инфекционный эндокардит чаще всего поражает левые отделы сердца (например, митральный или аортальный клапаны). Примерно в 10–20% случаев поражаются правые отделы (трикуспидальный или пульмональный клапаны). Внутривенные наркоманы имеют более высокий риск развития правостороннего эндокардита (около 30–70%).
Микроорганизмы, поражающие эндокард, могут попадать из отдаленных очагов инфекции (например, кожный абсцесс, воспаленные или инфицированные десны, инфекция мочевыводящих путей) или через очевидные входные ворота, такие как центральный венозный катетер или места инъекций препаратов. Практически любой чужеродный имплантированный материал (например, желудочковый или перитонеальный шунт, протез) подвергается риску бактериальной колонизации, тем самым становясь источником бактериемии и, следовательно, эндокардита. Эндокардит может быть результатом асимптомной бактериемии, которая, как правило, возникает во время инвазивных стоматологических, медицинских или хирургических вмешательств. Даже чистка зубов и жевание могут приводить к бактериемии (обычно зеленящим стрептококком) у пациентов с гингивитом.
Возбудители различаются в зависимости от места инфекции, источника бактериемии и факторов риска пациента (например, внутривенные наркоманы), но в 80–90% случаев стрептококки и Staphylococcus aureus являются причиной ИЭ. Энтерококки, грам-отрицательные бациллы, микроорганизмы группы HACEK (Haemophilus, гемофильные бактерии, Actinobacillus actinomycetemcomitans, Cardiobacterium hominis, Eikenella corrodens и Kingella kingae) и грибки являются причиной большинства других случаев.
Болезнь протекает в трех стадиях:
Бактериемия: микроорганизмы присутствуют в крови
Адгезия: микроорганизм присоединяется к аномальному или поврежденному эндотелию с помощью поверхностных адгезинов
Колонизация: пролиферация организма вместе с развитием воспаления, что приводит к образованию зрелых вегетаций
Многие из возбудителей образовывают полисахаридные биопленки, которые защищают их от иммунной защиты хозяина и препятствуют проникновению антибиотиков
Патофизиология
Эндокардит имеет локальные и системные осложнения.
Местные последствия инфекционного эндокардита включают:
Абсцессы миокарда с деструкцией тканей, а иногда и с нарушением проводимости (чаще при нижне-перегородочных абсцессах).
Внезапная, тяжелая клапанная регургитация может привести к сердечной недостаточности и смерти (чаще из-за поражения митрального или аортального клапана).
Аортит в связи с распространением инфекции из прилегающих структур.
Для больных с протезированными клапанами характерно развитие абсцессов клапанного кольца, обструктивных вегетаций, абсцессов миокарда и грибковых аневризм, что проявляется клапанной обструкцией, дисфункцией клапана и нарушением проводимости.
Системные осложнения в первую очередь обусловлены
Эмболизация инфицированным материалом из сердечного клапана
Иммуно-опосредованные явления (в основном при хронической инфекции)
Поражение правых камер сердца характеризуется развитием септических эмболий легочной артерии, которые могут привести к инфаркту легкого, пневмонии или эмпиеме. Поражение левых камер сердца может приводить к эмболиям любых органов, особенно часто почек, селезенки и центральной нервной системы. Микотические аневризмы могут формироваться в любых крупных сосудах. Часто развиваются эмболии кожи и сетчатки. Вследствие отложения иммунных комплексов развивается диффузный гломерулонефрит.
Классификация
Инфекционный эндокардит может иметь вялотекущее, подострое течение или более острое, молниеносное течение с высокой опасностью развития быстрой декомпенсации.
Подострый бактериальный эндокардит (ПБЭ), несмотря на агрессивность, обычно развивается незаметно и прогрессирует медленно (т.е от нескольких недель до месяцев). Источник инфекции или входные ворота часто не выявляются. Возбудителями ПСЭ чаще всего являются стрептококки (особенно зеленящий, микроаэрофильный, анаэробный, стрептококки группы D и энтерококки), реже причиной могут быть золотистый и эпидермальный стафилококки - S. aureus, Staphylococcus epidermidis, стрептококки Gemella morbillorum, Abiotrophia defectiva (ранее, Streptococcus defectivus), Granulicatella и требовательный к питательным средам Haemophilus. Стрептококковый подострый эндокардит часто развивается на пораженных клапанах после асимптомной бактериемии, вследствие инфекций периодонта, гастроинтестинальных и урогенитальных инфекций.
Острый бактериальный эндокардит (ОБЭ) обычно развивается внезапно и прогрессирует быстро (т.е. в течение дней). Источник инфекции или входные ворота часто легко выявляются. Когда инфекция высоко вирулентна или бактериальное воздействие массивно, острый бактериальных эндокардит может поражать нормальные клапаны сердца. Он обычно вызван золотистым стрептококком S. aureus, гемолитическим стрептококком группы А, пневмококком или гонококком.
Эндокардит протезированного клапана (ЭПК) развивается у 2–3% пациентов в течение первого года после протезирования клапана и в 0,5% в последующие годы. Чаще развивается после замены аортального клапана, нежели митрального и в одинаковой степени поражает как механические, так и биологические протезы. Раннее начало инфекции ( 2 мес. после хирургического лечения) вызвано главным образом инфицированием в ходе операции бактериями, резистентными к противомикробным препаратам (S. epidermidis, дифтероиды, колиформные бациллы, Candida, Aspergillus). Позднее начало инфекции происходит в основном в результате контаминации низко-вирулентными организмами во время оперативного вмешательства или при транзиторных бессимптомных бактериемиях, чаще всего благодаря попаданию стрептококка; S. epidermidis; дифтероидов; и требовательной к средам грамотрицательной палочки Haemophilus, Actinobacillus actinomycetemcomitans, и Cardiobacterium hominis.
Клинические проявления
Клиническая картина зависит от классификации, но она неспецифична.
Первоначально симптомы подострого бактериального эндокардита смазанные: субфебрильная лихорадка ( 39 ° С), ночные поты, утомляемость, недомогание и потеря веса. Возможны озноб и артралгии. Симптомы клапанной недостаточности могут быть первым признаком, ведущим к постановке диагноза. Первоначально менее чем ( ≤ ) у 15% пациентов наблюдается лихорадка или шумы в сердце, но со временем оба эти симптома развиваются практически у всех больных. Объективное исследование может выявлять бледность, лихорадку, изменение ранее существовавшего шума или появление шума новой регугитации и тахикардию.

Этот пациент с инфекционным эндокардитом имеет множественные узелки Ослера (болезненные, эритематозные узелки на пальцах ног).
У данного пациента с инфекционным эндокардитом на ладонях видны множественные язвочки Джейнвея (безболезненные эритематозные папулы). На пальцах пациента также наблюдаются своеобразные узлы Ослера (болезненные, эритематозные узелки на пальцах).
На изображении слева показан узелок Ослера (мягкий эритематозный узелок) на большом пальце. На изображении справа показаны язвочки Джейнвея (безболезненные эритематозные пятна на ладони).
Точечные кровоизлияния представляют собой небольшие линейные кровоизлияния под ногтевыми пластинами.

На данной фотографии показаны конъюнктивальные петехии у пациента с инфекционным перикардитом.
На данной фотографии показано конъюктивальное кровоизлияние у пациента с инфекционным перикардитом.
На изображении слева показаны множественные пятна Рота или ретинальные кровоизлияния. Изображение справа – увеличенный снимок пятен Рота с бледной зоной в центре.
Клиническая картина острого бактериального эндокардита и эндокардита искусственного клапана подобна картине подострого бактериального эндокардита, но течение более быстрое. Лихорадка почти всегда выявляется в начале заболевания, у пациентов имеются симптомы интоксикации; иногда развивается септический шок. Сердечные шумы выявляются первоначально примерно у 50–80% пациентов и со временем у > 90%. Редко развивается гнойный менингит.
Септическая эмболия легочной артерии может вызывать кашель, плевральные боли в грудной клетке и иногда кровохарканье. Характерно наличие шума трикуспидальной регургитации.
Диагностика
Эхокардиография, иногда – другие методы получения изображения
Так как клиническая картина неспецифична, вариабельна и может развиться незаметно, диагностика требует высокой настороженности. Эндокардит следует подозревать у пациентов с лихорадкой без явных причин инфекции, особенно если есть шум в сердце. Настороженность в плане ИЭ должна быть очень велика в том случае, если имеются положительные результаты посева крови у пациентов с патологией клапанов сердца, у пациентов, которым недавно выполнялись инвазивные процедуры или у внутривенных наркоманов. Пациенты с доказанной бактериемией должны быть тщательно и многократно обследованы на предмет новых клапанных шумов и признаков эмболии.
Кроме позитивных посевов крови, других специфических лабораторных изменений нет. Установленные инфекционные поражения эндокарда часто приводят к нормохромной нормоцитарной анемии, лейкоцитозу, повышению СОЭ, увеличению уровня иммуноглобулинов, появлению циркулирующих иммунных комплексов и положительному ревматоидному фактору, но эти изменения не помогают в постановке диагноза. В общем анализе мочи часто выявляется микрогематурия, иногда эритроцитарные цилиндры, пиурия или бактериурия.
Идентификация возбудителя и определение его чувствительности к антибиотикам жизненно необходимы для определения тактики лечения.
Если заподозрен эндокардит, должно быть выполнено 3 забора крови на посев (20 мл каждый) в течение 24 ч (если клиническая картина представлена острым бактериальным эндокардитом, то 2 забора крови с интервалом между 1-м и 2-м в 1 час). Каждый новый забор крови должен быть произведен путем отдельной венепункции (т.е. не из ранее установленных внутрисосудистых катетеров). Забор крови не должен производиться во время наличия у пациента лихорадки или озноба, поскольку у большинства пациентов бактериемия носит постоянный характер. При эндокардите и в отсутствие предшествовавшей антибиотикотерапии все 3 посева образцов крови положительны, поскольку бактериемия продолжается; по крайней мере, 1 посев крови положительный в 99% случаев. Необходимо избегать преждевременного использования эмпирической антибактериальной терапии у пациентов с приобретенными или врожденными пороками во избежание эндокардитов с негативными посевами крови. Если ранее проводили антибактериальную терапию, следует также получить результаты гемокультуры, однако они могут быть отрицательными.
Посевы крови требуют 3–4-недельной инкубации для определенных микроорганизмов; однако некоторые запатентованные автоматически мониторирующие культуральные системы могут идентифицировать позитивные культуры в течение недели. Другие микроорганизмы (например, Aspergillus sp) могут не выявляться при посевах крови. Некоторые микроорганизмы (например, Coxiella burnetii, Bartonella sp, Chlamydia psittaci, Brucella sp) требуют серологической диагностики; другие микроорганизмы (например, Legionella pneumophila) требуют специальную культуральную среду или ПЦР (например, Tropheryma whippelii). Негативные результаты посевов крови могут быть следствием первичной антибактериальной терапии, инфицированности микроорганизмами, которые не растут на стандартных питательных средах, или указывать на другой диагноз (например, неинфекционный эндокардит, миксома предсердия с эмболиями, васкулит).
На начальном этапе необходимо выполнение эхокардиаграфии, обычно трансторакальной (ТТЭ), а не трансэзофагеальной (ТЭЭ). ТЭЭ является более чувствительной (т.е. способна выявлять вегетации маленького размера, невидимые при ТТЭ),
Чреспищеводную эхокардиографию следует проводить при таких случаях:
Пациенты имеют искусственный клапан
Трансторакальная эхокардиография не является диагностической
Диагноз инфекционного эндокардита был установлен клинически (проводится для выявления перфораций, абсцессов и свищей)
Иногда используется КТ, если при ЧПЭ не возможно точно определить околоклапанные абсцессы, а также для обнаружения микотических аневризм. ПЭТ является новым инструментом для диагностики эндокардита, который возникает в простетических и внутрисердечных устройствах. В настоящее время патологии, выявленные при КТ и ПЭТ включены в Европейские рекомендации в качестве основных критериев.
Инфекционный эндокардит достоверно диагностируется, когда микроорганизмы выявляются гистологически (или культурально) в эндокардиальных вегетациях, полученных в ходе операции на сердце, эмболэктомии или аутопсии. Так как вегетации обычно недоступны для исследования, существуют разнообразные клинические критерии для установления диагноза. К ним относятся пересмотренные критерии Дюка (с чувствительностью и специфичностью > 90%— Диагностические требования к диагнозу инфекционного эндокардита в соответствии с пересмотренными критериями Дюка а также Пересмотренные клинические критерии Дюка для диагностики инфекционного эндокардита) и модифицированные критерии Европейского общества кардиологии (ESC) 2015 года (1).
Критерии ESC аналогичны модифицированным критериям Дюка, но в качестве основных критериев включают результаты расширенной визуализации как указано далее:
Вегетации, абсцесс, псевдоаневризма, внутрисердечная фистула, клапанная перфорация или аневризма или новое частичное раскрывание створок искуссвенного клапана, которые выявлены при эхокардиографии
Аномальная активность вокруг искусственного клапана (имплантированного > 3 мес раньше), обнаруженная при ПЭТ/КТ или ОФЭКТ/КТ с лейкоцитами, меченными радиоактивными изотопами
Околоклапанные поражения, выявленные при КТ сердца
Критерии ESC также отличаются от малых модифицированных критериев Дюка, детализируя, что только лишь выявление бессимптомных сосудистых явлений при визуализации является достаточным.
Полный текст:
Цель исследования – описать редкий случай инфекционного эндокардита (ИЭ) с изолированной локализацией на клапане легочной артерии (ЛА).
Материалы и методы. Мы наблюдали первичный ИЭ с изолированной локализацией на клапане ЛА у 27-летней больной без факторов риска ИЭ правых отделов сердца.
Результаты. Заболевание было вызвано Streptococcus gordonii и протекало остро с типичными проявлениями ИЭ правых отделов сердца: лихорадкой выше 38 °С, ознобами, клинической картиной двусторонней септической эмбологенной абсцедирующей пневмонии, а также вторичной анемией, вторичной тромбоцитопенией и гломерулонефритом. При эхокардиографическом исследовании были выявлены крупные вегетации на клапане ЛА, пролабирующие в правый желудочек и ЛА.
Заключение. ИЭ с локализацией на клапане ЛА следует предполагать у лихорадящих пациентов с клинической картиной септической эмбологенной пневмонии при отсутствии других эмбологенных ситуаций.
1. Park L. P., Chu V. H., Peterson G. et al. Validated Risk Score for Predicting 6-Month Mortality in Infective Endocarditis J Am Heart Assoc 2016;5(4):e003016. DOI: 10.1161/JAHA.115.003016.
2. Тюрин В. П. Инфекционные эндокардиты. Под ред. акад. РАМН Ю. Л. Шевченко. М.: ГЭОТАР-Медиа, 2012.
3. Cresti A., Baratta P., De Sensi F. et al. Frequency and Clinical Significance of Right Atrial Embryonic Remnants Involvement in Infective Endocarditis. J Heart Valve Dis 2017;26(6):700–7.
4. Чипигина Н. С., Шостак Н. А., Виноградова Т. Л., Малышева А. М. Инфекционный эндокардит у инъекционных наркоманов. Вестник РГМУ 2009;(7):97–101.
5. Lee M. R., Сhang S. A., Choi S. H. et al. Clinical Features of Right-Sided Infective Endocarditis Occurring in Non-Drug Users. J Korean Med Sci 2014;29(6):776–81. DOI: 10.3346/jkms.2014.29.6.776.
6. Mathura K. C., Thapa N., Rauniyar A. et al. Injection drug use and tricuspid valve endocarditis. Kathmandu Univ Med J(KUMJ) 2005;3(1):84–6.
7. Moss R., Munt B. Injection drug use and right sided endocarditis. Heart 2003; 89(5):577–81.
8. Buber J., Bergersen L., Lock J. E. et al. Bloodstream infections occurring in patients with percutaneously implanted bioprosthetic pulmonary valve: a singlecenter experience. Circ Cardiovasc Interv 2013;6(3):301–10. DOI: 10.1161/CIRCINTERVENTIONS.112.000348.
9. Asgeirsson H., Thalme A., Weiland O. Low mortality but increasing incidence of Staphylococcus aureus endocarditis in people who inject drugs Experience from a Swedish referral hospital Medicine(Baltimore). 2016;95(49):e5617. DOI: 10.1097/MD.0000000000005617.
10. Frontera J. A., Gradon J. D. Right-side endocarditis in injection drug users: review of proposed mechanisms of pathogenesis. Clin Infect Dis 2000;30(2):374–9. DOI: 10.1086/313664.
11. Revilla A., Lopez J., Villacorta E. et al. Isolated right-sided valvular endocarditis in non-intravenous drug users. Rev Esp Cardiol 2008;61(12):1253–9.
12. Alves M., Faria R., Messias A., Meneses-Oliveira C. Eustachian Valve Endocarditis: Echocardiographic Diagnosis ina Critical Care Patient. Case Rep Crit Care 2018;2018:5193976. DOI: 10.1155/2018/5193976.
13. English N., Weston P. Multivalvular infective endocarditis in pregnancy presenting with septic pulmonary emboli BMJ Case Rep 2015; PII: bcr2014209131. DOI: 10.1136/bcr-2014-209131.
14. Chowdhury M. A., Moukarbel G. V. Isolated pulmonary valve endocarditis. Cardiology 2016;133(2):79–82. DOI: 10.1159/000440857.
15. Nakamura K., Satomi G., Sakai T. et al. Clinical and echocardiographic features of pulmonary valve endocarditis. Circulation 1983;67(1):198–204.
16. Vaideeswar P., Jawale R. M., Tullu M. Isolated infective endocarditis of the pulmonary valve: an autopsy analysis of nine cases. Cardiovasc Pathol 2009;18(4):231–5. DOI: 10.1016/j.carpath.2008.06.011.
17. Miranda W. R., Connolly H. M., DeSimone D.C. et al. Infective Endocarditis Involving the Pulmonary Valve. Am J Cardiol 2015;116(12):1928–31. DOI: 10.1016/j.amjcard.2015.09.038.
18. Hamza N., Ortiz J., Bonomo R. A. Isolated pulmonic valve infective endocarditis: a persistent challenge. Infection 2004;32(3):170–5.
19. Akram M., Khan I. A. Isolated pulmonic valve endocarditis caused by group B streprococcus(Streptococcus agalactiae) – a case report and literature review. Angiology 2001;52(3):211–5. DOI: 10.1177/000331970105200309.
20. Samaroo-Campbell J., Hashmi A., Thawani R. et al. Isolated Pulmonic Valve Endocarditis. Am J Case Rep 2019;20: 151–3. DOI: 10.12659/AJCR.913041.
21. Laursen M. L., Gill S., Moller J. E., Guastavsen. Healthcare-associated infective endocarditis of the pulmonary valve. BMJ Case Rep 2015;2015. PII: bcr2014207577. DOI: 10.1136/bcr-2014-207577.
22. Schroeder R. A. Pulmonic valve endocarditis in a normal heart. J Am Soc Echocardiogr 2005;18(2):197–8. DOI: 10.1016/j.echo.2004.08.006.
23. Gersony W. M., Hayes C. J., Driscoll D. J. et al. Bacterial endocarditis in patients with aortic stenosis, pulmonary stenosis, or ventricular septal defect. Circulation 1993;87(2 Suppl): 121–6.
24. Hatemi A. C., Gursoy M., Tongut A. et al. Pulmonary stenosis as a predisposing factor for infective endocarditis in a patient with Noonan syndrome. Tex Heart Inst J 2010;37(1):99–101.
25. Inchaustegui C. A., Wang K. Y., Teniola O., De Rosen V. L. Large septic pulmonary embolus complicating streptococcus mutans pulmonaryvalve endocarditis. J Radiol Case Rep 2018;12(2):18–27. DOI: 10.3941/jrcr.v12i2.3240.
26. Goswami U., Brenes J. A., Punjabi G. V. et al. Associations and outcomes of septic pulmonary embolism. Open Respir Med J 2014;8:28–33. DOI: 10.2174/1874306401408010028.
27. Vrettos A., Mota P., Nash J. et al Pneumococcal pulmonary valve endocarditis. Echo Res Pract 2017. PII: ERP-17–0026. DOI: 10.1530/ERP-17–0026.
28. Swaminath D., Yaqub Y., Narayanan R. et al. Isolated Pulmonary Valve Endocarditis Complicated With Septic Emboli to the Lung Causing Pneumothorax, Pneumonia, and Sepsis in an Intravenous Drug Abuser. J Investig Med High Impact Case Rep 2013;1(4). DOI: 10.1177/2324709613514566.
29. Goud A., Abdelqader A., Dahagam C., Padmanabhan S. Isolated pulmonic valve endocarditis presenting as neck pain. J Community Hosp Intern Med Perspect 2015;5(6):29647. DOI: 10.3402/jchimp.v5.29647.eCollection 2015.
30. Passen E., Feng Z. Cardiopulmonary manifestations of isolated pulmonary valve infective endocarditis demonstrated with cardiac CT. J Cardiovasc Comput Tomogr 2015;9(5):399–405. DOI: 10.1016/j.jcct.2015.03.013.
31. Edmond J. J., Eykyn S. J., Smith L. D. Community acquired staphylococcal pulmonary valve endocarditis in non-drug users: Case report and review of the literature. Heart 2001;86(6):E17.
32. Li D., Zhu Z, Zheng X. et al. Gemella morbillorum endocarditis of pulmonary valve: a case report. J Cardiothorac Surg 2017;12(1):16. DOI: 10.1186/s13019-017-0579-3.
33. Habib G., Lancellotti P., Antunes M. J. et al. 2015 ESC Guidelines for the management of infective endocarditis: The Task Force for the Management of Infective Endocarditis of the European Society of Cardiology (ESC). Endorsed by: European Association for Cardio-Thoracic Surgery (EACTS), the European Association of Nuclear Medicine (EANM). Eur Heart J 2015;36(44):3075–128. DOI: 10.1093/eurheartj/ehv319.
34. Joskowiak D., Kappert U., Matschke K., Tugtekin S. M. Ruptured pulmonary artery caused by isolated pulmonary valve endocarditis: case report. Clin Res Cardiol 2010;99(7):471–3.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Читайте также:


