Семейство род и вид дифтерии
 |
| Corynebacterium diphtheriae |
 |
| Дифтерийный токсин. Выделены цветом: фрагменты A (сверху) и B (снизу) |
 |
| Характерный для дифтерии отёк шеи |
Дифтерия может быть причиной таких заболеваний желудочно-кишечного тракта, как острый гастрит, эзофагит и других.
Наиболее опасными осложнениями дифтерии являются отёк сердечной мышцы, сердечная недостаточность, истинный круп, кома, параличи, следствием чего возможен летальный исход.
Согласно официальным данным, число зарегистрированных случаев заболеваний дифтерией в Российской Федерации, начиная с 2009 следующее:
В 2009 году: всего в России — 14 случаев дифтерии, в том числе 3 в Москве; дети до 17 лет включительно: всего 2, из них 1 в Москве.
В 2010 году: всего в России — 9 случаев, из них дети до 17 лет включительно — 3. В Москве случаев дифтерии в 2010 году не было.
За 2011 год зарегистрировано 7 случаев дифтерии — по 1 случаю в Удмуртской Республике, Пермском крае, Ивановской, Калужской, Московской, Оренбургской и Иркутской областях.
В 2012 году эпидемическая ситуация по дифтерии в Российской Федерации оставалась стабильной. В 5 регионах России зарегистрированы единичные случаи заболевания дифтерией и носительства возбудителя этой инфекции: 5 больных и 11 носителей токсигенных Corynebacterium diphtheria. Показатели составили 0,0035 и 0,008 на 100 тыс. населения соответственно. Среди заболевших один ребёнок (12 лет) и 4 взрослых (19, 24, 59 и 66 лет), трое из них относятся к группам профессионального риска. Все, за исключением заболевшей 66 лет, привиты против дифтерии. С момента последней ревакцинации прошло от 3 до 7 лет. У всех привитых диагностированы локализованные формы дифтерии, у непривитой — токсическая. Соотношение больных и бактерионосителей возбудителя дифтерии, как и в 2011 году составило 1:2. Из 11 выявленных носителей – 4 дети. Все носители, за исключением 2-х взрослых, привиты против дифтерии.
В 2013 году зарегистрировано 2 случая дифтерии, один у взрослого старше 17 лет, второй у подростка старше 14 лет. В 2014 году — 2 случая, оба у взрослых. В 2015 году — 2 случая дифтерии, в том числе 1 у ребёнка младше 15 лет. В 2016 году — также 2 случая, оба у граждан старше 17 лет. В первой половине 2017 года случаев заболеваний дифтерией в РФ не зарегистрировано.
Антибактериальные средства (из имеющих описание в данном справочнике), активные в отношении Corynebacterium diphtheriae: джозамицин, кларитромицин, ванкомицин, линкомицин, моксифлоксацин. Corynebacterium diphtheriae резистентны к ципрофлоксацину.
Несмотря на активность ряда антибиотиков в отношении Corynebacterium diphtheriae, они не очень эффективны при лечении дифтерии и если и применяются, то в качестве вспомогательных средств, при этом в качестве основного рекомендуется применять антитоксическую противодифтерийную сыворотку, подавляющую дифтерийный токсин.
Презентация на тему: " Дифтерия Род Corynebacterium Вид Corynebacterium diphtheriae." — Транскрипт:
1 Дифтерия Род Corynebacterium Вид Corynebacterium diphtheriae
2 Морфология C.diphtheriae окраска по Леффлеру -Грамположительные палочки с утолщениями на концах, - располагаются в виде V - неподвижны - многослойная клеточная стенка содержит миколовую кислоту, корд-фактор - при окраске по Леффлеру и Нейссеру выявляются включения волютина на полюсах клетки C.diphtheriae окраска по Нейссеру C.diphtheriae окраска по Граму
3 Культуральные свойства Факультативные анаэробы Растут на средах с кровью и сывороткой, на кровяном теллуритовом агаре образуют колонии двух типов По характеру колоний, биохимическим свойствам и способности продуцировать гемолизин выделяют три биовара: gravis, mitis, intermedius
4 Антигены С. diphtheriae содержат в микрокапсуле К-антиген, позволяющий дифференцировать их на серовары и группоспецифический полисахаридный антиген клеточной стенки
5 Факторы патогенности Пили и микрокапсула обеспечивают адгезию к эпителиоцитам миндалин, реже гортани, трахеи, полости носа, конъюнктивы глаза, вульвы; колонизация эпителиоцитов сопровождается развитием воспалительного процесса; Гиалуронидаза, нейраминидаза,гемолизин – факторы инвазии; микрокапсула – антифагоцитарный фактор; Корд-фактор – нарушает дыхание в митохондриях и обладает антфагоцитарной активностью; Дифтерийный гистотоксин – главный фактор патогенности
9 После адгезии на клетках слизистой начинается колонизация Под действием гиалуронидазы, нейраминидазы осуществляется разрушение межклеточного вещества, В результате действия гемолизина, корд-фактора и гистотоксина возникают некроз поверхностного эпителия, в результате развития воспалительного процесса повышается проницаемость сосудов, замедляется кровоток, сосуды становятся ломкими. Жидкая часть крови выходит в окружающие ткани. Фибриноген, содержащийся в плазме,при контакте с тромбопластином некротизированного эпителия переходит в фибрин, который выпадает в виде фибринозной пленки. В области многослойного плоского эпителия, развивается дифтеритическое воспаление, при котором фибринозный выпот, пронизывая всю слизистую оболочку, плотно спаян с подлежащей тканью. На слизистых оболочках с однослойным эпителием (гортань, трахея, бронхи) развивается крупозное воспаление, при котором пленка легко отделяется. Возбудитель остается в месте входных ворот, а в кровь поступает токсин - токсинемия Наиболее чувствительными к действию токсина являются миокард, капилляры и нервные клетки. В кардиомиоцитах развиваются явления миокардиодистрофии с последующим их некрозом, миолизом и развитием инфекционно-токсического миокардита. Поражение капилляров при дифтерии сопровождается инфекционно-токсическим шоком. Повреждение нервных клеток сопровождается дистрофическими изменениями швановских клеток и демиэлинизацией нервных волокон. Наряду с отмеченным, общее действие дифтерийного токсина проявляется явлениями общей интоксикации. Таким образом,дифтерийный гистотоксин оказывает местное и общее воздействие на организм
10 Клинические проявления А. Дифтерия зева Б. Дифтерия кожи
11 Эпидемиология Источник – больной или бактерионоситель Путь передачи – воздушно-капельный, входные ворота – носоглотка; Существенно меньшее значение играют больные дифтерией глаз, кожи, раны и других локализаций, способные распространять инфекцию контактным путем (через руки, предметы быта, игрушки); Дифтерийные бактерии значительно устойчивы во внешней среде. В дифтерийной пленке, в капельках слюны, на ручках дверей, детских игрушках сохраняются до 15 дней. В пыли, на полу, на предметах в окружении больного дифтерийная палочка сохраняет жизнеспособность до дней В воде и молоке выживают в течение 6-20 дней. Хорошо переносят высушивание.В воде Неблагоприятно на них действуют прямые солнечные лучи, высокая температура. При кипячении погибают в течение 1 мин, очень чувствительна ко всем дезинфицирующим средствам Коринебактерии дифтерии чувствительны к действию многих антибиотиков: пенициллина, эритромицина, тетрациклина, рифампицина. Однако в носоглотке больных и носителей, несмотря на лечение антибиотиками, бактерии дифтерии могут сохраняться длительное время.эритромициналечение антибиотиками
12 Иммунитет Иммунитет после перенесенного заболевания нестойкий, возможно повторное заболевание; Основная роль в профилактике дифтерии принадлежит формированию активного искусственного антитоксического иммунитета в результате плановой вакцинации
13 Действующее начало всех вакцин – дифтерийный анатоксин (дифтерийный гистотоксин, утративший токсичность,но сохранивший антигенные свойства в результате обработки формалином при 37-40С в течение 3 недель: АД – адсорбированный дифтерийный анатоксин АДС – адсорбированный дифтерийно-столбнячный анатоксин АДС-М анатоксин -вакцина для профилактики дифтерии и столбняка с уменьшенным содержанием антигенов АД-М анатоксин вакцина для профилактики дифтерии с уменьшенным содержанием антигенов Имовакс Д.Т. Адюльт вакцина для профилактики дифтерии и столбняка, аналог АДС-М (Aventis Pasteur, Франция) ДТ Вакс вакцина для профилактики дифтерии и столбняка, аналог АДС (Aventis Pasteur, Франция) Специфическая п рофилактика
14 ТетрАкт-ХИБ Адсорбированная вакцина против дифтерии, столбняка, коклюша и гемофильной инфекции типа b (Франция) Тританрикс вакцина для профилактики коклюша, дифтерии, столбняка и гепатита В ( СмитКляйн Бичем, Бельгия) Тетракок 05 вакцина для профилактики коклюша, дифтерии, столбняка и полиомиелита (Aventis Pasteur, Франция) Инфанрикс бесклеточная вакцина для профилактики коклюша, дифтерии и столбняка (Бельгия) Пентаксим Вакцина для профилактики дифтерии и столбняка адсорбированная, коклюша ацеллюлярная, полиомиелита инактивированная, инфекции, вызываемой Haemophilus influenzae тип b конъюгированная. АКДС – адсорбированная коклюшно-дифтерийно-столбнячная вакцина
15 Лечение 1.Нейтрализация токсина путем введения противодифтерийной сыворотки антитоксической (донорской или лошадиной) 2.Антибиотикотерапия: пенициллины, цефалоспорины, хинолоны и др.
16 Лечение 1.Нейтрализация токсина путем введения противодифтерийной сыворотки антитоксической (донорской или лошадиной) 2.Антибиотикотерапия: пенициллины, цефалоспорины, хинолоны и др.
17 Лабораторная диагностика дифтерии Клинический материал: мазок из зева, слизь из носоглотки и др. Методы: 1.Бактериоскопический (окраска мазка поЛеффлеру и Нейссеру – предварительный) 2.Бактериологический (культуральный) - основной 3.Серологический ( ИФА, латексагглютинация, реакция нейтрализации антител,РНГА ) для обнаружения антител и/или токсина в сывороткекрови 4.Проба Шика – реакция нейтрализации токсина in vivo
18 Бактериологический метод 1 этап: посев клинического материала на кровяной теллуритовый агар (среда Клауберга). 2 этап: Макроскопическое изучение колоний, мазок по Леффлеру или Неййсеру; отсев типичной колонии на среды Ру или Леффоера 3 этап: Идентификация по совокупности свойств: культуральных, морфологических, тинкториальных, биохимических, обязательно определение токсигенности методом Оухтерлони; чувствительности к антибиотикам.
19 Двойная диффузия в геле по Оухтерлони ( может проводиться без выделения чистой культуры)
20 Проба Шика проводится для оценки состояния антитоксического иммунитета; внутрикожно вводят минимальное количество токсина: При наличии антител против дифтерийного токсина видимых изменений не будет При отсутствии антитоксического имммунитета наблюдается воспалительная реакция
C. diphtheriae - палочковидные бактерии; вызывают дифтерию (греч. diphtheria - кожа, пленка) - острую инфекцию, характеризующуюся фибринозным воспалением в зеве, гортани, реже в других органах, и явлениями интоксикации.
Морфологические и культуральные свойства.
Corinebacterium diphteriae – тонкие, слегка изогнутые или прямые грамположительные палочки, расположенные под углом друг к другу в виде римских пятерок. Они утолщены на концах за счет наличия зерен валютина на одном или обоих полюсах клетки. Зерна валютина состоят из полифосфатов, они воспринимают анилиновые красители более интенсивно, чем цитоплазма клетки и легко выявляются при окраске по Нейссеру в виде гранул сине-черного цвета, тогда как тела бактерий – окрашивается в желто-зеленый. При окраске по Граму зерна валютина не выявляются.
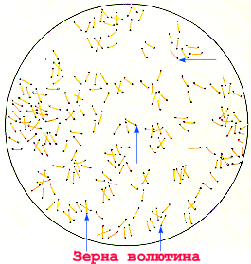
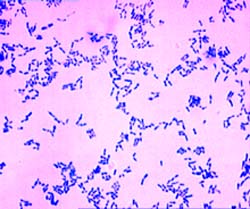
Рисунок мазка из чистой культуры. Окраска по Нейссеру Мазок из чистой культуры.
Окраска щелочной синькой Леффлера
Дифтерийная палочка не обладает кислотоустойчивостью, неподвижна, спор не образует, имеет микрокапсулу с входящим в ее состав корд-фактором. В состав клеточной стенки входят галактоза, манноза, арабиноза, а также большое количество липидов, в том числе некислотоустойчивые миколовые кислоты.
Возбудитель дифтерии – факультативный анаэроб, гетеротроф, растет при 37 о С на сложных питательных средах: свернутая кровяная сыворотка, кровяной теллуритовый агар.
На элективных средах через 8-14 часов образует точечные, выпуклые желтовато-кремовые колонии с гладкой или слегка зернистой поверхностью. Колонии не сливаются и имеют вид шагреневой кожи.
На теллуритовых средах возбудитель дифтерии через 24-48 час образует черные или черно-серые колонии в результате восстановления теллурита до металлического теллура.
Возбудитель дифтерии обладает высокой ферментативной активностью. Дифференциально-диагностическими признаками C. diphteriae являются:
отсутствие способности ферментировать сахарозу и разлагать мочевину,
способность продуцировать фермент цистиназу.
Возбудитель дифтерии не однороден по культуральным и биохимическим свойствам. В соответствии с рекомендациями Европейского регионального бюро ВОЗ вид C. diphteriae подразделяют на 4 биовара: gravis, mitis, intermedius, belfanti.
На теллуритовой среде биовар gravis образует сухие, матовые, крупные, плоские, серовато-черные колонии, приподнятые в центре. Периферия колонии светлая с радиальной исчерченностью и неровным краем. Такие колонии напоминают цветок маргаритку. Биовар mitis образует мелкие, гладкие, блестящие, черные, выпуклые колонии с ровным краем, окруженные зоной гемолиза. Биовары intermedius и belfanti фактически относятся к биовару mitis, так как не разлагают крахмал, а этот признак у C. diphteriae является наиболее стабильным.
Антигенная структура. C. diphteriae имеют О-антиген (липидные и полисахаридные фракции, расположенные в глубине клеточной стенки) и К-антиген (поверхностный термолабильный белок). О-антиген является межвидовым. На основании К-антигена различают около 58 сероваров.
Факторы патогенности. Основными факторами патогенности C. diphteriae являются поверхностные структуры, ферменты и токсины.
Поверхностные структуры (пили, компоненты микрокапсулы: корд-фактор, К-антиген, миколовые кислоты) имеют белковую и липидную природу, способствуют адгезии микробов в месте входных ворот, препятствуют фагоцитозу бактерий, оказывают токсическое воздействие на клетки макроорганизма, разрушают митохондрии.
Ферменты патогенности: нейраминидаза, гиалуронидаза, гемолизин, дермонекротоксин. Нейраминидаза отщепляет N-ацетилнейраминовую кислоту от гликопротеидов слизи и поверхности клеток, лиаза расщепляет ее на пируват и N-ацетилманнозамин, а пируват стимулирует рост бактерий. В результате действия гиалуронидазы повышается проницаемость кровеносных сосудов и выход плазмы за их пределы, что ведет к отеку окружающих тканей. Дермонекротоксин вызывает некроз клеток в месте локализации возбудителя. Вышедший за пределы сосудов фибриноген плазмы контактирует с тромбокиназой некротизированных клеток организма и превращается в фибрин, что и является сущностью дифтерийного воспаления. Внутри дифтерийной пленки C. diphteriae находят защиту от эффекторов иммунной системы и антибиотиков, размножаясь, они образуют в большом количестве основной фактор патогенности - дифтерийный гистотоксин.
Дифтерийный гистотоксин оказывает блокирующее действие на синтез белка в органах, наиболее интенсивно снабженных кровью: сердечно-сосудистая система, миокард, нервная система, почки и надпочечники.
Эпидемиология. В естественных условиях дифтерией болеет только человек, не обладающий устойчивостью к возбудителю и антитоксическим иммунитетом. Заболевание распространено повсеместно. Наибольшее количество больных наблюдается во второй половине сентября, октябре и ноябре. Наиболее восприимчивы дети дошкольного и младшего школьного возраста. Среди взрослых к группе повышенного риска относятся работники общественного питания и торговли, школ, детских дошкольных и медицинских учреждений.
C. diphteriae обладает устойчивостью к факторам окружающей среды: в капельках слюны, прилипших к посуде или игрушкам, на ручках дверей они могут сохраняться до 15 дней, на предметах окружающей среды – 5,5 мес., могут размножаться в молоке. При кипячении C. diphteriae погибают в течение 1 мин, в 10% растворе перекиси водорода – через 3 мин, в 5% растворе карболовой кислоты и 50-60% спирте – через 1 мин.
Дифтерийный гистотоксин очень неустойчив и быстро разрушается при действии света, нагревании, окислении.
Источником инфекции являются:
1.носители токсигенных штаммов - особенно опасны те носители, у которых нет клинических проявлений заболевания, так как они обладают антитоксическим иммунитетом.
2.больные: Среди больных наибольшее значение имеют лица с локализацией процесса в верхних дыхательных путях. Больной эпидемиологически опасен в течение всего периода болезни, даже в период выздоровления он выделяет токсигенные штаммы в окружающую среду.
Основным механизмом заражения является аэрозольный. Пути передачи:
ведущая роль принадлежит воздушно-капельному,
иногда могут осуществляться воздушно-пылевой, контактно-бытовой, а также алиментарный (через молоко) пути передачи.
Входными воротами инфекции служат слизистые оболочки ротоглотки (небные миндалины и окружающие их ткани), носа, гортани, трахеи, а также слизистые оболочки глаз и половых органов, поврежденные кожные покровы, раневая или ожоговая поверхность, незажившая пупочная ранка.
Наиболее часто встречается дифтерия зева (90-95%). Инкубационный период длится от 2 до 10 дней. По патогенезу дифтерия относится к токсинемическим инфекциям, когда микроб остается в месте входных ворот инфекции, а все клинические проявления связаны с действием экзотоксина.
Начальным этапом инфекционного процесса является адгезия микроба в месте входных ворот. Размножаясь там, микроб выделяет гистотоксин, который оказывает местное действие на клетки тканей, а также поступает в кровь, что ведет к возникновению токсинемии.
В области входных ворот развивается воспалительная реакция, которая сопровождается некрозом эпителиальных клеток и отеком, образуется налет белого цвета с сероватым или желтоватым оттенком, содержащим большое количество микробов, продуцирующих токсин.
Характерным признаком дифтерии является фибринозная пленка:
Если слизистая оболочка образована однослойным эпителием (гортань, трахея, бронхи), возникает крупозное воспаление, здесь пленка располагается поверхностно и легко отделяется от подлежащих тканей.
Если слизистая оболочка образована многослойным эпителием (ротоглотка, надгортанник, голосовые связки), возникает дифтерическое воспаление, когда все клетки прочно связаны между собой и с подлежащей соединительнотканной основой. Фибринозная пленка в этом случае плотно спаяна с подлежащими тканями и не снимается тампоном. При попытке сделать это слизистая оболочка кровоточит.
Иммунитет. После перенесенного заболевания формируется стойкий и напряженный гуморальный антитоксический иммунитет. Продолжительность поствакцинального иммунитета – 3-5 лет.
Материалом для исследования является фибринозная пленка, слизь из зева или носа.
Сбор материала необходимо проводить в течение 3-4 ч (не позднее 12 ч) с момента обращения больного. Для взятия материала используют сухие ватные тампоны, если посев будет произведен в течение 2-3 ч, при транспортировке материала тампоны смачивают 5% раствором глицерина.
Основным методом диагностики является бактериологический. Бактериологическая лаборатория через 48 ч должна дать ответ о наличии или отсутствии C. diphteriae в анализах.
Материал засевают на питательную среду. Отбирают подозрительные колонии и выделенную культуру идентифицируют:
По наличию цистиназы (проба Пизу): в столбик питательного агара с цистином уколом засевают исследуемую культуру. Посевы инкубируют при 37 о С 24 ч. C. diphteriae вызывает почернение среды по ходу укола в результате образования сульфида свинца.
По наличию уреазы (проба Закса): готовят спиртовый раствор мочевины и раствор индикатора – фенолового красного, которые перед употреблением смешивают в соотношении 1:9 и разливают в агглютинационные пробирки. Исследуемые бактерии вносят петлей и растирают по стенке прибирки. В положительном случае через 20-30 мин инкубации при 37 о С среда приобретает красный цвет в результате расщепления мочевины уреазой.
Для определения токсигенности возбудителя дифтерии может быть использована биопроба. Морской свинке внутрикожно или подкожно вводят испытуемую культуру. Токсигенные культуры убивают животных в течение 3-5 суток, при вскрытии обнаруживаются гиперемированные надпочечники, а при внутрикожном заражении – некроз кожи.
Для бактериоскопического исследования (как самостоятельный диагностический метод применяется редко ввиду полиморфизма возбудителя, но может быть проведен по просьбе врача) из материала готовят мазки на нескольких стеклах, один мазок окрашивают по Граму, другой по Нейссеру, третий – обрабатывают флюорохромом – корифосфином для люминесцентной микроскопии.
О наличии антитоксического иммунитета судят по реакции Шика – реакции нейтрализации токсина антитоксином. В кожу предплечья вводят 1/40 DLM дифтерийного токсина. Покраснение и припухлость в месте введения свидетельствует об отсутствии антитоксинов в крови. Отрицательная реакция Шика говорит о наличии антитоксинов.
Для ускоренного обнаружения дифтерийного токсина, как в бактериальных культурах, так и в сыворотке крови, применяют: РНГА с антительным эритроцитарным диагностикумом, РИА и ИФА. Из молекулярно-генетических методов исследования применяют ПЦР.
Препараты для специфического лечения дифтерии.
В целях нейтрализации дифтерийного гистотоксина применяют специфическую противодифтерийную лошадиную очищенную концентрированную сыворотку, которую получают путем гипериммунизации лошадей дифтерийным антитоксином.
Специфическое лечение противодифтерийной сывороткой начинают немедленно при клиническом подозрении на дифтерию. Необходимо выбрать оптимальный режим введения сыворотки, так как антитоксин может нейтрализовать только не связанный с тканями токсин. Для профилактики развития анафилактического шока сыворотку вводят дробно по А.М. Безредке. Введение сыворотки позднее 3-го дня болезни нецелесообразно.
Разработан противодифтерийный иммуноглобулин человека для внутривенного введения. Его применение дает меньше побочных реакций.
Для подавления размножения C. diphteriae в месте входных ворот обязательно назначают антибиотики. Препаратами выбора являются пенициллин или эритромицин, либо другие β-лактамы и макролиды.
Препараты для специфической профилактики дифтерии.
Для создания искусственного активного антитоксического иммунитета применяют дифтерийный анатоксин. Очищенный и концентрированный препарат входит в состав ассоциированных вакцин:
1. адсорбированной коклюшно-дифтерийно-столбнячной вакцины (АКДС-вакцина),
2. адсорбированного дифтерийно-столбнячного анатоксина (АДС-анатоксин),
3. адсорбированного дифтерийно-столбнячного анатоксина с уменьшенным содержанием антигенов (АДС-М),
4. адсорбированного дифтерийного анатоксина с уменьшенным содержанием антигена (АД-М).
Базисный иммунитет создается у детей согласно календарю прививок. Только 95% охват населения прививками гарантирует эффективность вакцинации.
Род Corynebacterium семейства Corynebacteriaceae относится к порядку Actinomycetales и типу Actinobacteria.
В род коринебактерий входят десятки патогенных и непатогенных бактерий, часть из которых играет роль в патологии человека, животных или растений.
Ведущим патогенным микроорганизмом для человека является C. diphtheriае – возбудитель дифтерии.
Кроме C. diphtheriае в редких случаях дифтерию могут вызывать C. ulcerans и С. pseudotuberculosis, так как они способны приобретать гены, кодирующие дифтерийный экзотоксин.
Другие коринебактерии иногда могут становиться возбудителями оппортунистических инфекций. Например, C. riegelii вызывает инфекции мочевыводящих путей; C. minutissimum связана с кожным заболеванием эритразмой, а в отдельных случаях может быть причиной септицемий, абсцесса мозга, остеомиелитов, фарингитов.
Возбудители дифтерии были открыты Т. Клебсом в 1883 г., выделены в чистой культуре Ф. Леффлером в 1884 г. Позднее Э. Беринг и Э. Ру получили противодифтерийную сыворотку, а Г. Рамон – дифтерийный анатоксин.
У бактерий выражен полиморфизм, чаще они имеют вид тонких палочек, расположенных под углом в виде римских цифр Х или V, на концах расположены зерна волютина, состоящие из полифосфатов.
При окраске по Нейссеру зерна волютина имеют сине-фиолетовый цвет, а цитоплазма бактерий – желтый. При окраске корифосфином в люминесцентном микроскопе зерна волютина дают красное свечение на фоне желто-зеленого тела клетки.
Спор и жгутиков у коринебактерий нет, иногда образуют капсулу. Грамположительны.
Для культивирования широко применяют среду Леффлера (1 часть бульона с глюкозой и 3 части лошадиной сыворотки).
Селективными средами являются среда Тинсдаля (цистин-теллурит-сывороточный агар), на которой коринебактерии растут в виде коричневатых колоний; среда Клауберга (МПА, гемолизированная кровь, теллурит калия, глицерин), на ней образуются серые колонии, т.к. теллурит калия восстанавливается в металлический теллур.
На жидких средах коринебактерии дифтерии могут давать равномерное помутнение или поверхностную пленку, которая растет, крошится и хлопьями оседает на дно пробирки.
Факультативные анаэробы, метаболизм окислительно-ферментативный.
Разлагают глюкозу, мальтозу, галактозу, крахмал до кислоты, не разлагают лактозу, сахарозу, маннит.
Выделяют фермент цистиназу, который выявляют на среде Пизу (МПА, цистин, уксуснокислый свинец, гипосульфит натрия). Посев на эту среду производят уколом. Если есть фермент цистиназа, то среда по ходу укола чернеет, так как образуется сернистый свинец.
Не образуют фермента пиразинамидазы. Данный тест, а также продукция цистиназы отличает возбудителей дифтерии от других коринебактерий.
Не выделяют уреазу, следовательно, не разлагают мочевину; не разжижают желатин, не образуют индол.
Восстанавливают нитраты в нитриты, кроме C. diphtheriае, биовар belfanti.
Возбудитель дифтерии продуцирует каталазу, гиалуронидазу, нейрамидазу, ДНКазу.
В 1931 г. Андерсен подразделил возбудителей дифтерии на 3 биовара: gravis – R-тип, mitis – S-тип и intermedius – R-S-тип. Он полагал, что I тип выделяется при тяжелых формах, II – при легких, а III занимает промежуточное положение. В основу дифференциации биоваров положены биохимические и культуральные свойства.
В настоящее время доказано, что биовары имеют эпидемиологическое значение. При массовых вспышках чаще выделяются R-типы, при спорадических – S-типы.
Дифференциальные признаки различных биоваров возбудителя, включая биовар belfanti, а также свойства C. ulcerans и С. pseudotuberculosis и некоторых других представлены в таблице.
Имеют 2 основных антигена: К-АГ – типоспецифический, термолабильный белковой природы; О-АГ – группоспецифический, термостабильный, липополисахарид. В реакции агглютинации выделяют 57 серотипов, чаще встречаются 11 серотипов.
Фимбрии и поверхностные структуры клеточной стенки обеспечивают адгезию и колонизацию клеток к эпителию слизистой оболочки.
Главным фактором вирулентности, вызывающим заболевание, является дифтерийный экзотоксин.
Продукция экзотоксина обусловлена наличием в геноме возбудителя tox-гена умеренного бактериофага, полученного в результате трансдукции. Данный ген кодирует синтез токсина.
Не инфицированная специфическим фагом дифтерийная палочка не способна к токсинообразованию.
Экзотоксин состоит из двух фракций (А и В), соединенных дисульфидной связью.
Фракция А обладает токсическими свойствами, вызывая некроз клеток.
Она проявляет ферментативную АДФ-рибозилазную активность, вызывая рибозилирование фактора элонгации-2 или EF-2. В норме данный фактор выполняет элонгацию (наращивание) полипептидных цепей на рибосомах.
В результате блокируется белковый синтез в любых клетках, в том числе в миокарде и клетках нервной системы. Это приводит к демиелинизации нервных волокон, развиваются параличи и парезы, токсин повреждает эндотелий сосудов, вызывает усиленную экссудацию.
Фракция В (транспортный полипептид) обеспечивает доставку фракции А в клетки. Он связывается на мембранах клеток со специфическим рецептором HB-EGF – белком из семейства эпидермального фактора роста.
Токсин попадает в клетки посредством эндоцитоза. Субъединица В образует пору в мембране эндосомы, через которую в цитоплазму выходит субъединица А и останавливает белковый синтез в клетке.
Часть возбудителей способна продуцировать гемолизин.
Корд-фактор (бактериальный гликолипид) нарушает процессы фосфорилирования, в результате чего угнетается тканевое дыхание в клетках.
Специфические бактериоцины или корицины обеспечивают микробный антагонизм. Гены, кодирующие синтез корицинов, контролируются плазмидами.
Возбудители устойчивы к низким температурам, однако чувствительны к нагреванию. Сохраняют чувствительность к дезинфицирующим растворам, (перекиси водорода, хлорсодержащим соединениям, карболовой кислоте).
При кипячении дифтерийные бактерии погибают в течение 1 минуты, в 10% растворе перекиси водорода – через 3 минуты.
В дифтерийной пленке они могут сохраняться до 15 дней, в воде и молоке – 20 дней. В составе дифтерийной пленки бактерии не погибают в течение часа даже при 98 о С.
Патогенез и характеристика заболевания
Дифтерия – острое инфекционное заболевание, вызываемое токсигенными коринебактериями. Характеризуется образованием фибринозных пленок у входных ворот и интоксикацией, приводящей к токсическим поражениям сердечно-сосудистой, нервной и других систем и органов.
Источники инфекции: больной человек и бактерионоситель.
Пути передачи: воздушно-капельный, контактно-бытовой (например, через мягкие игрушки у детей), реже алиментарный (через молоко).
Инкубационный период болезни составляет в среднем от 2 до 10 дней.
Входные ворота – слизистые оболочки носоглотки, реже конъюнктива глаза, раневая поверхность, слизистые половых органов.
У входных ворот за счет выделения токсина и его цитопатического действия повреждаются эндотелиоциты, увеличивается проницаемость сосудистой стенки, усиливается экссудация.
Содержащийся в плазме фибриноген превращается в фибрин под действием тромбопластина из пораженных клеток. Развивается активное фибринозное (или дифтеритическое) воспаление, образуется плотно спаянный с подлежащими тканями налет, возникает регионарный лимфаденит.
Некроз может захватывать все слои слизистой оболочки, на ней появляются язвы.
Болезнь сопровождается выраженной интоксикацией, токсин распространяется лимфогенным и гематогенным путем, поражаются паренхиматозные органы, сердечно-сосудистая и центральная нервная системы. Увеличивается проницаемость сосудов, появляются местные отеки. При дифтерии зева может возникнуть отек слизистых гортани и голосовых связок, что приводит к асфиксии (удушью) и гибели больных без оказания срочной помощи.
Различают несколько клинических форм заболевания.
Для локализованной формы характерен ограниченный очаг поражения, фибринозный налет на относительно бледных миндалинах, зеве, температура – 37,2-37,5 0 С, интоксикация слабо выражена.
Среди локализованных форм наиболее часто встречается дифтерия зева, носа, гортани, гораздо реже – глаз, кожи.
При генерализованная форме налеты выходят за пределы очага поражения, в процесс вовлекаются другие ткани и органы, температура 38-39 0 С, интоксикация, головная боль, лимфоузлы болезненны, увеличены.
При токсической форме начало бурное, температура 39-40 0 С, интоксикация резко выражена, толстые, бугристые, гнойные налеты, плохо снимаются, миндалины кровоточат при снятии налетов, отек тканей, регионарные лимфоузлы болезненны и увеличены. Поражаются сердечно-сосудистая, нервная системы, паренхиматозные органы.
При гипертоксической форме симптомы развиваются еще более бурно, поражаются миокард, почки, надпочечники, ЦНС, выражена интоксикация.
Для токсических форм характерна высокая летальность, летальность в целом по заболеванию составляет 3-6%.
Иммунитет при заболевании антитоксический (антитела класса IgG), в меньшей степени антимикробный. Естественный пассивный иммунитет от матери сохраняется 3-5 месяцев. После перенесенного заболевания или вакцинации развивается стойкий иммунитет. Он считается достаточным при титре антител 1:40 в РПГА или 0,03 МЕ/мл в реакции флоккуляции.
При титре антител ниже порогового уровня необходимо проводить вакцинацию дифтерийным анатоксином или комплексным препаратом АДС.
Так как развитие болезни определяется действием экзотоксина, то основным методом лабораторной диагностики дифтерии является выделение чистой культуры возбудителя с доказательством ее токсигенности.
В качестве материала для исследования берут материал тампоном из носа и зева, дифтерийные пленки, а также при подозрении на дифтерию – из всех ран и кожных поражений.
Бактериоскопический метод. В мазке из слизи зева и фибринозного налета при окраске по Нейссеру выявляют типичную морфологию возбудителя и явление метахромазии. Можно окрашивать препарат корифосфином и изучать препарат в люминесцентном микроскопе (оранжево-красное свечение).
В остром периоде заболевания за счет антагонистических свойств возбудителя коринебактерии видны прямо в мазке при микроскопии практически в чистой культуре.
Бактериологический метод – засевают материал на кровяной агар и селективные среды (Клауберга, Тинсдаля). На одну половину чашек от больного засевают материал из ротоглотки, на другую – из носа.
Идентифицируют возбудителя по культуральным, морфологическим, биохимическим свойствам (см. Таблицу).
Определяют токсигенность выделенной культуры методом иммунопреципитации (реакция Элека). Для этого на чашку с сывороточным агаром накладывают фильтровальную бумагу, смоченную антитоксической противодифтерийной сывороткой, а вокруг на расстоянии 1,5 см сеют выделенные и идентифицированные дифтерийные культуры. Если культура выделяет экзотоксин, то он диффундирует в среду, и на месте встречи с антителами видны линии преципитации. Реакцию учитывают через 24 и 48 часов после посева.
При идентификации культуры бактериологическом методом необходима дифференциация возбудителя дифтерии от других коринебактерий, которые могут быть частью нормальной микрофлоры.
C. pseudodiphtericum может располагаться параллельными рядами или беспорядочно с одним зерном волютина. Не разлагает углеводы, восстанавливает нитраты в нитриты, разлагает мочевину, не имеет цистиназы, не выделяет экзотоксин.
C. xerosis располагаются параллельными рядами, не имеют зерен волютина, разлагают глюкозу и сахарозу, мальтозу, восстанавливают нитраты, не разлагают крахмал и мочевину.
Для установления источника инфекции необходимо проверить эпидмаркеры: фаговары (их 22), бактериоциновары (5), серовары, биовары, антибиотикограмму.
Биохимические свойства микробов рода Corynebacterium
C. diphtheriае gravis
C. diphtheriае intermedius
С целью ускоренного определения токсина в материале применяют ИФА или РПГА, для обнаружения tox-генов ставят ПЦР. Используют также заражение куриных эмбрионов, наблюдают их гибель при наличии токсина. При заражении культур клеток Vero дифтерийный токсин дает ЦПД (цитопатическое действие). В реакции нейтрализации идентифицируют вид токсина.
Серологический метод используют при стертых формах для ретроспективной диагностики или для выявления неиммунной прослойки населения. С этой целью ставят РПГА, ИФА и реакцию нейтрализации токсина в культуре клеток Vero.
Основным лечебным мероприятием является как можно более раннее введение антитоксической противодифтерийной сыворотки, полученной при иммунизации лошадей. С учетом гетерологичного происхождения сыворотку вводят по методу Безредко (дробно, постепенно увеличивая дозу и контролируя появление анфилактических реакций или признаков сывороточной болезни).
Доза сыворотки зависит от локализации процесса. В случае токсических форм заболевания количество вводимой сыворотки достигает 40-100 тыс МЕ. При необходимости ее можно вводить повторно.
Параллельно применяют антибиотики (пенициллин, цефалоспорины, эритромицин или другие препараты). Антибиотикотерапия не влияет прямо на течение заболевания, однако препараты подавляют размножение возбудителя, что снижает концентрацию токсина. Также они угнетают рост сопутствующей микрофлоры.
Дифтерия относится к управляемым инфекциям. Это заболевание полностью контролируется вакцинацией высокоэффективным дифтерийным анатоксином. Заболеваемость в популяции определяется уровнем коллективного иммунитета населения, который должен превышать 95%.
В СССР отмечались лишь единичные спорадические случаи дифтерии в связи с проведением активной иммунизации всего населения. В начале 90-х годов на территории СНГ мероприятия по плановой вакцинации против дифтерии выполнялись нерегулярно при низкой приверженности населения мерам иммунопрофилактики. В итоге заболеваемость резко возросла, в 1994 г. на территории СНГ было зарегистрировано около 50 тыс случаев дифтерии, которые привели к 1750 летальным исходам. После восстановления программ плановой иммунопрофилактики заболеваемость дифтерией значительно снизилась. Сейчас в Республике Беларусь отмечаются только единичные случаи заболевания.
Для специфической профилактики применяют дифтерийный анатоксин в составе вакцины АКДС или АДС.
Активную иммунизацию начинают с 3-х-месячного возраста введением вакцины АКДС (содержит анатоксин столбняка, дифтерии и убитые коклюшные бактерии) или АДС (не содержит коклюшного компонента) трехкратно с интервалом в 45 дней, затем проводят ревакцинацию в 1,5 года, 6 лет, 11 и 16 лет и далее через каждые 10 лет проводят ревакцинацию.
Неспецифическая профилактика включает изоляцию и лечение больных, санацию носителей антибиотиками, меры по дезинфекции в очаге.
Читайте также:


