От синегнойной палочки и стрептококка лечение
P.аeruginosa (синегнойная палочка) - один из основных возбудителей гнойно-воспалительных процессов, особенно в условиях стационара. Первое описание раневой инфекции, вызванной синегнойной палочкой, принадлежит Люке (1862), отметившему характерное сине-зелёное окрашивание перевязочного материала. Первая вспышка госпитальной инфекции, вызванной P.аeruginosa, зарегистрирована в 1897 г.
Эпидемиология
P.аeruginosa распространена повсеместно, существенное значение в циркуляции возбудителя имеет вода, в которой он может выживать до года (при 37°С), в том числе во многих растворах, применяемых в медицине (например, жидкость для хранения контактных линз). Иногда входит в состав нормальной микрофлоры (кожа паха, подмышечной области, ушей, носа, глотки, ЖКТ). P.аeruginosa вызывает до 15-20% всех внутрибольничных инфекций.
Свойства возбудителя
Грамотрицательные палочки, подвижны, имеют 1-2 полярных жгутика, в мазке располагаются одиночно, попарно, короткими цепочками, синтезируют крахмалоподобное вещество типа внеклеточной слизи, более вирулентные штаммы синтезируют повышенное его количество. Хорошо растет на простых питательных средах, имеет ограниченную потребность в питательных веществах. Растет в широком диапазоне температур (4-42°С). Выраженный хемоорганотроф, строгий аэроб, протеолитическая активность сильно выражена, сахаролитическая низкая. Продуцирует бактериоцины - пиоцины (белки, оказывают бактерицидный эффект на микроорганизмы аналогичного или генетически близкого вида). Характерным является пигментообразование. Наиболее часто встречаются: пиоцианин (окрашивает среду, отделяемое ран в сине-зелёный цвет), флюоресцин (флюоресцирует при УФ-облучении). Некоторые штаммы могут синтезировать и другие пигменты. Высоковирулентные штаммы синтезируют пиоцианин, обладающий свойствами бактериоцина, в больших количествах. При выделении культур могут наблюдаться атипичные непигментированные штаммы.
Патогенное действие обусловлено образованием экзотоксинов и высвобождением эндотоксинов при гибели клеток. Вырабатывает следующие экзотоксины: экзотоксин А - вызывает нарушение организации матрицы белкового синтеза, экзоэнзим S - вызывает глубокие патологические процессы в лёгких, цитотоксин - вызывает нейтропению и цитолиз других клеток, гемолизины, фосфолипазы. Среди продуктов жизнедеятельности значение имеют энтеротоксический фактор (возможно ответственный за развитие диарейного синдрома), фактор проницаемости, нейраминидаза (нарушает метаболизм нейраминовой кислоты), протеолитические ферменты (протеазы, коллагеназа).
Имеет соматический О и жгутиковый Н антигены, у мукоидных штаммов можно обнаружить капсульный К антиген.
Патогенез поражений
Несмотря на наличие большого количества факторов вирулентности, инфекции редко наблюдаются у лиц с нормальной резистентностью и неповреждёнными анатомическими барьерами. Большинство штаммов обладает поверхностными ворсинками, обеспечивающими адгезию к эпителию. Взаимодействие с клетками реализуется через рецепторы, определенную роль играет вырабатываемая слизь. Прикрепление стимулирует дефицит фибронектина, наблюдаемый при муковисцидозе и других хронических заболеваниях лёгких. Типичный внеклеточный паразит, размножение прямо обусловлено способностью противостоять действию факторов резистентности [1]. Основную роль в патогенезе поражений играют токсины возбудителя.
Клинические проявления
Не характерна высокая инвазивность, течение инфекций тяжёлое, выраженный фатальный характер носят септицемии. По данным многоцентрового исследования грамотрицательных возбудителей нозокомиальных инфекций в ОРИТ в России, на долю P.aeruginosa приходилось 18% всех выделенных штаммов (второе место после кишечной палочки) [2]. Является одним из основных возбудителей нозокомиальных пневмоний, поражений мочеполовой системы у урологических больных, вызывает 20-25% гнойных хирургических инфекций и первичных граммотрицательных бактериемий. Часто встречается у больных с ожогами, заболеваниями мочевого пузыря. Факторы инфицирования: нарушение правил стерилизации, хранения и применения сосудистых и мочевых катетеров, игл для поясничной пункции, а также различных растворов, применяемых в медицине [1].
Лабораторная диагностика
Заподозрить синегнойную инфекцию позволяет характерное окрашивание ран, перевязочного материала в сине-зелёный цвет. Для выделения идентификации возбудителя используют культуральный метод. Забор материала следует производить до начала антибактериальной терапии. Растет на простых питательных средах, в частности используют агар Мюллер-Хинтон. При росте на плотных средах дает характерный феномен радужного лизиса, развивающийся спонтанно, при образовании пигмента окрашивает некоторые среды в зелёный цвет. Используется метод пиоцианинотипирования, основанный на том, что штаммы резистентны к своему пиоцианину и обладают различной чувствительностью к пиоцианинам других штаммов. На жидких средах дают рост в виде поверхностной пленки, со временем образуется помутнение, распространяющееся сверху вниз.
Лечение
Инфекции, вызванные синегнойной палочкой, плохо поддаются терапии в связи с множественной её резистентностью, передаваемой R-плазмидами. Механизмы резистентности: блокада транспорта препарата к внутриклеточной мишени (анатомические особенности поверхностных структур) и инактивация ферментами (бета-лактамазы инактивируют пенициллины и цефалоспорины, ацетилтрансфераза и нуклеотидаза инактивируют аминoгликозиды). В многоцентровом исследовании NPRS-3, синегнойная палочка отличалась очень высоким уровнем резистентности к гентамицину (61,3%), а также к пиперациллину, пиперациллину/тазобактаму, ципрофлоксацину. Наиболее активными в отношении P.aeruginosa являлись амикацин (резистентность 6,7%) и цефтазидим (резистентность 11,2%), меропенем (резистентность 3%) [3].
Антибактериальная терапия нозокомиальных инфекций установленной этиологии
| Микроорганизм | Препараты выбора | Альтернативные препараты | |
| монотерапия | комбинации | ||
| P.aeruginosa | Цефтазидим
Ципрофлоксацин | Цефтазидим + аминогликозиды
Ципрофлоксацин + аминогликозиды | Антисинегнойные пенициллины (за исключением ОРИТ), азтреонам или карбапенемы + аминогликозиды |
Комментарии: Частота цефтазидиморезистентных штаммов в среднем по ОРИТ в России составила 11%; отмечен рост имипенемо- и ципрофлоксацинорезистентных штаммов (соответственно, 19% и 30%)
Профилактика
Возбудитель устойчив к действию антисептиков и дезинфектантов, может сохраняться в растворах фурацилина, способен нейтрализовывать некоторые дезинфектанты, чувствителен к высушиванию, хлорсодержащим веществам, высоким температурам и давлению. Создана вакцина Aerugen, предназначенная для профилактики инфекций, вызываемых Pseudomonas aeruginosa, разработанная фирмами Berna Biotech и Orphan Europe для применения у пациентов с муковисцидозом. Ожидается, что новая вакцина поступит на рынок в 2005 году, и её мировые продажи достигнут 18-30 млн. долларов США. Основным в профилактике внутрибольничных инфекций остается соблюдение правил асептики и антисептики.
Материалы по теме
- Сравнительная активность антисинегнойных антибиотиков в отношении нозокомиальных штаммов Pseudomonas aeruginosa, выделенных в отделениях реанимации и интенсивной терапии России
Л.С. Страчунский, Г.К. Решедько, О.У. Стецюк, А.С. Андреева, А.Г. Щебников, исследовательская группа РОСНЕТ.
Журнал КМАХ, 2003; 5:35-46. [Статья в формате PDF] (317 кб) - Практическое руководство по антиинфекционной химиотерапии
под редакцией Л.С. Страчунского, Ю.Б. Белоусова, С.Н. Козлова- Группа монобактамов
- Группа аминогликозидов
- Группа хинолонов/фторхинолонов
- Группа пенициллинов
- Группа цефалоспоринов
Инфекции, вызываемые P.aeruginosa
Профилактикa
Вопросы и ответы
- Известно, что аминогликозиды не создают высоких концентраций в ткани лёгких; насколько обоснованно их применение при госпитальной пневмонии вызванной P.aeruginosa?
Учитывая невысокое проникновение аминогликозидов в ткани, фармакодинамической предпосылкой их высокой клинической эффективности является создание концентрации в крови и /или очаге инфекции в 10 и более раз превышающих МПК возбудителей (Сmax/МПК > 10). Кроме того, при нозокомиальной пневмонии, вызванной P.aeruginosa, аминогликозиды обоснованно назначать только в комбинации с бета-лактамными антибиотиками, обладающими антисинегнойной активностью (цефоперазон, цефтазидим и т.д.) так как в некоторых случаях это повышает активность препаратов и уменьшает частоту появления резистентных штамов P.aeruginosa.
- Kamnev Y.V., Firsov A.A., Dombrovsky V.S. e.a. Clinical trial of amikacin once-daily: focus on penetration into bronchial secretions. European Bulletin of Drug Research. 1993; 2:35-9.
- Craig W. Pharmacocinetic/pharmacodinamic parameters: rational for antibacterial dosing of mice and man. J Antimicrob Chemother. 1996; 37: 645-63.
Литература, использованная при подготовке выпуска:
- Медицинская микробиология под ред. Покровского, М.: Гэотармед,1999 г.
- Нозокомиальные инфекции. Практическое руководство по антиинфекционной химиотерапии под редакцией Л.С. Страчунского, Ю.Б. Белоусова, С.Н. Козлова
- Состояние резистентности к антиинфекционным химиопрепаратам в России. Практическое руководство по антиинфекционной химиотерапии под редакцией Л.С. Страчунского, Ю.Б. Белоусова, С.Н. Козлова
Pseudomonas aeruginosa, синегнойная палочка, пиоцин, Aerugen, нозокомиальные инфекции
Как наилучшим образом использовать антибиотики для устранения легочной инфекции, вызванной микробом под названием Pseudomonas aeruginosa (синегнойная палочка), у людей, страдающих муковисцидозом?
Муковисцидоз - это наследственное заболевание, при котором воздушные пути часто бывают заблокированы слизью. Муковисцидоз ассоциирован с инфекциями органов грудной клетки, которые могут привести к прогрессирующей дыхательной недостаточности и смерти. Бактерия, которая называется синегнойной палочкой - Pseudomonas aeruginosa - является частой причиной такой инфекции, и она с трудом поддаёся лечению при развитии инфекционного процесса.
Мы хотели сравнить различные комбинации ингаляционных, пероральных и внутривенных антибиотиков для устранения синегнойной палочки - Pseudomonas aeruginosa - у людей с муковисцидозом, чтобы выяснить, какой метод лечения лучше всего работает и является более экономически эффективным.
Доказательства актуальны на 10 октября 2016 года.
Мы включили семь испытаний с участием 744 человек с муковисцидозом обоих полов, любого возраста как с легкой, так и с более тяжелой формой поражения легких. Испытания продолжались от 28 дней до 27 месяцев. Мы не могли объединить многие результаты, поскольку в испытаниях использовали различные методы лечения. В двух исследованиях сравнивали тобрамицин с плацебо (лечение пустшкой). В трех исследованиях использовали комбинацию перорального ципрофлоксацина и ингаляционного (вдыхаемого) колистина в экспериментальной группе, но использовали разные препараты сравнения: в одном испытании сравнивали эту комбинацию с отсутствием лечения, в другом - с вдыхаемым тобрамицином и в третьем испытании сравнивали комбинацию с пероральным ципрофлоксацином и вдыхаемым тобрамицином. В другом испытании изучили ингаляционный тобрамицин и сравнили лечение длительностью 28 дней с лечением, продолжавшимся 56 дней. В последнем испытании сравнили регулярные циклы ингаляционного (вдыхаемого) тобрамицина (плюс пероральный ципрофлоксацин или плацебо) с лечением ингаляционным тобрамицином (плюс пероральный ципрофлоксацин или плацебо), используемым на основе результатов культур, выращиваемых в лаборатории.
По результатам двух небольших испытаний (38 добровольцев) лечение ранней инфекции в течение 2 месяцев ингаляционными антибиотиками имело превосходство над отсутствием лечения и устранило Pseudomonas aeruginosa у большинства пациентов. В одном из этих испытаний сообщалось о результатах, полученных в течение более длительного периода, и было предположено, что эффект от лечения может длиться до 12 месяцев. Еще одно небольшое исследование (26 человек), которое длилось два года, показало, что лечение ранней инфекции комбинацией ингаляционных и пероральных антибиотиков лучше, чем отсутствие лечения для устранения Pseudomonas aeruginosa. В испытании, в котором сравнили лечение в течение 28 дней распыленным через небулайзер раствором тобрамицина для ингаляции (88 человек) с лечением в течение 56 дней, было показано, что оба режима лечения были одинаково переносимы и успешны в отношении устранения синегнойной палочки - Pseudomonas aeruginosa. Четыре прямых сравнения пероральных или ингаляционных антибиотиков (или их комбинаций), в одном из которых сообщалось о 223 лицах, не нашли разницы между различными комбинациями антибиотиков. В недавнем испытании с участием 306 детей (в возрасте до 12 лет) сравнили регулярные циклы ингаляционного тобрамицина (либо с пероральным ципрофлоксацином, либо с плацебо) с лечением только тогда, когда было показано, что ребенок был инфицирован синегнойной палочкой. В этом испытании было показано, что, когда детям давали регулярные циклы ингаляционного тобрамицина (либо с пероральным ципрофлоксацином, либо с плацебо), у меньшего числа детей обнаруживался рост Pseudomonas aeruginosa (синегнойной палочки) из мокроты. В этом испытании сделали поправку на возраст и не показали никакой разницы по числу эпизодов роста Pseudomonas aeruginosa из образцов между группами, и не было разницы в продолжительности времени, до момента, когда у детей были следующие эпизоды инфекции органов грудной клетки.
Некоторые из исследований были проведены до 20 лет назад, и их результаты могут быть не применимы сегодня. Некоторые испытания были небольшими. Все испытания имели довольно короткий период наблюдения. Таким образом, мы не смогли показать, приводит ли лечение людей с муковисцидозом к улучшению их самочувствия или продлению их жизни. С учетом видов лечения, используемых в большинстве испытаний, добровольцам было легко угадать, какое лечение они получали, что могло повлиять на некоторые результаты. Два исследования были поддержаны представителями фармацевтической индустрии. Дальнейшие исследования по-прежнему необходимы, чтобы увидеть, улучшает ли самочувствие и качество жизни у людей с муковисцидозом полное устранение бактерий, и чтобы установить, какие комбинации антибиотиков обеспечивают лучший способ устранения синегнойной палочки - Pseudomonas aeruginosa.
В целом качество доказательств было от умеренного до очень низкого, а это означает, что дальнейшие исследования могут изменить оценку размера эффекта лечения. Будущие, более крупные испытания (с большей мощностью) могут показать, что одно лечения является более эффективным в эрадикации (уничтожении) синегнойной палочки - Pseudomonas aeruginosa, чем другое.
Первые клинические эксперименты с бактериофагами начались сто лет назад, и казалось, что этот новый метод терапии обречен на успех: с научной точки зрения он выглядел безупречным, и результаты применения выглядели многообещающими.
Почему же в последующие десятилетия интерес к терапевтическому применению бактериофагов в мире упал? Почему он возник вновь, и почему эта замечательная идея до сих пор не реализована в полной мере? И практические врачи, и их пациенты сегодня должны четко представлять не только суть, но и все сильные и слабые стороны этого перспективного вида терапии
Бактериофаги – это не обычные лекарства. Они не являются простыми химическими веществами, как антибиотики и большинство других препаратов, но их вряд ли можно считать и полноценными живыми организмами, так как они, как и все остальные вирусы, могут размножаться только в клетке-хозяине. По сути, это нанороботы с генетической программой, способные проникнуть внутрь бактериальной клетки и там размножиться, разрушив ее.
Поэтому к бактериофагам не всегда применимы стандартные для фармакологии нормы и подходы. И хотя фаговые препараты сегодня производятся и используются в медицине, наши знания о многообразии этих вирусов, механизмах их взаимодействия с бактериями и конкуренции с себе подобными пока недостаточны, чтобы в полной мере использовать их мощный терапевтический потенциал.
Безопасно и эффективно
Фаготерапия родилась едва ли не сразу после открытия самих бактериофагов, однако широкие испытания этих противобактериальных средств начали проводиться в СССР только в конце 1930-х гг. В результате была доказана эффективность препаратов бактериофагов как профилактического средства при борьбе с эпидемиями дизентерии и холеры, а использование их при лечении ран и гнойно-воспалительных процессов показало их потенциал как альтернативы антибиотикам.
Однако результаты исследований тех времен были зачастую противоречивы: иногда фаги сразу подавляли развитие инфекционных процессов, но иногда оказывались бесполезными. Специалисты сразу поняли, в чем причина: лечение было успешным лишь тогда, когда использовались фаги, способные инфицировать именно тот бактериальный штамм, который и вызвал заболевание. Поэтому при возникновении эпидемии требовалось выделить инфекционный агент, проверить на нем имеющиеся фаговые препараты и запустить в производство в качестве препарата наиболее эффективный бактериофаг.
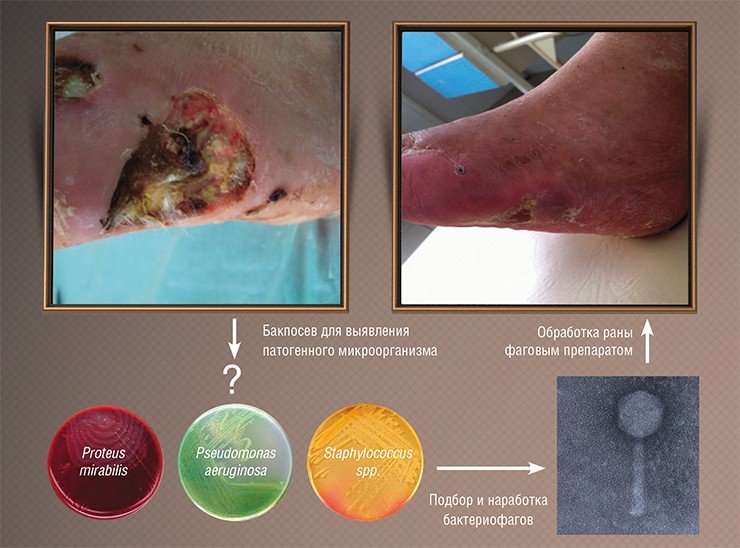
К сожалению, результаты подобных исследований, проводившихся в СССР, не были должным образом документированы и описаны в научной литературе, к тому же они проводились по схемам, не соответствующим принятым на сегодня протоколам клинических испытаний. Тем не менее главные результаты этой работы были бесспорны: фаги доказали свою безопасность и высокую эффективность в реальных условиях и с тех пор используются в нашей стране в клинической практике наряду с обычными лекарственными средствами.

С появлением антибиотиков интерес к фагам на Западе был утрачен, но после появления антибиотикоустойчивых штаммов бактерий в разных странах начали разрабатывать фаговые препараты и проводить испытания, которые, по сути, повторяли исследования, уже проведенные в СССР. Результаты этих работ вновь подтвердили безопасность препаратов бактериофагов, что, в частности, отметило и Управление по контролю за качеством пищевых продуктов и лекарственных препаратов США (FDA).
В Великобритании успешно проведены эксперименты по лечению бактериофагами хронического отита, вызванного нечувствительной к антибиотикам синегнойной палочкой Pseudomonas aeruginosa, а в рамках проекта Phagoburn семь медицинских центров Франции, Бельгии и Швейцарии проводят клинические испытания коктейля фагов для предотвращения инфекций при ожогах. Об испытаниях собственных оригинальных коктейлей фагов для лечения широкого спектра заболеваний сообщает и ряд американских фирм (Intralytix, Enbiotix, AmpliPhi). Правда ни одно из этих масштабных клинических испытаний пока не доведено до конца.
В России препараты бактериофагов можно приобрести в обычной аптеке. Но при этом нужно понимать, что в отличие от других лекарств с точной химической формулой и концентрацией действующих компонентов препарат бактериофага представляет собой нестандартный раствор, содержащий живые вирусные частицы. Даже препарат с одним и тем же названием, но произведенный на разных предприятиях или в разное время, может содержать отличающиеся комбинации и (или) пропорции фагов.
Поэтому покупать препарат бактериофага, чтобы лечиться самостоятельно, не стоит. Назначить лечение и выбрать лекарство должен специалист. Спектр заболеваний, которые можно лечить бактериофагами широк: трофические язвы, ожоговые и раневые инфекции, инфекции органов дыхания, мочеполовой системы и желудочно-кишечного тракта, остеомиелит и т. п. Возбудителями болезней во всех этих случаях служат такие печально известные бактерии, как золотистый стафилококк, включая лекарственно устойчивые штаммы, синегнойная палочка, патогенные формы кишечной палочки, сальмонеллы, протеи, стрептококки и др. В принципе в природе можно найти бактериофаг против любой бактерии, включая возбудителей чумы и сибирской язвы. Можно применять бактериофаги и для профилактики бактериальных инфекционных болезней, например, они были успешно использованы в детских садах и школах для предотвращения эпидемии дизентерии.

Основная же и главная причина неудач – неумелый подбор фагов для лечения конкретных пациентов. Каждый конкретный фаг эффективен против одного или максимум нескольких штаммов бактерий, а у разных пациентов схожая по внешнему проявлению инфекция, например, ангина может быть вызвана разными штаммами стрептококка. Чтобы вылечить больного, необходимо выделить культуру патогена и протестировать ее на чувствительность к конкретным фагам. То есть терапия бактериофагами должна проводиться с использованием принципов персонализированной медицины, к чему современная медицина практически не готова.

На пути к персонализированной Фаготерапии
Опыт СССР, Грузии и Польши показал, что для успешного применения бактериофагов нужны не только клиника, но и производственно-лабораторный участок, располагающий коллекцией фагов и специалистами, способными идентифицировать бактерии, подбирать и выделять бактериофаги для конкретного пациента.
Но в таком случае имеет ли смысл масштабное производство фаговых препаратов? Ответ – да, потому что проблема узкой специфичности фагов частично решается производством фаговых коктейлей из нескольких (иногда десятков) разных фагов, поражающих разные штаммы целевого возбудителя. Ведь подобрать для больного нужный фаговый коктейль быстрее и проще, чем тестировать отдельные фаги из большой коллекции.
И все же не надо думать, что бактериофаги полностью заменят антибиотики – эти препараты дополняют друг друга, и применяться они должны в разных ситуациях. Когда больной находится в тяжелом состоянии, и есть уверенность, что причиной служит бактериальная инфекция, времени на эксперименты и подбор препаратов нет. Единственно правильное решение в этой ситуации – антибиотик широкого спектра действия.
Но в ситуации хронической инфекции или инфекции, вызванной бактериями со множественной устойчивостью к антибиотикам, предпочтение следует отдавать бактериофагу. В случае таких затяжных болезней, как отит, у врача есть время, чтобы использовать фаговый коктейль или специально подобрать фаг. Или же, когда после операции больной поражается антибиотикоустойчивым бактериальным штаммом, и его состояние быстро ухудшается, фаготерапия может стать единственным спасением.
Богатый опыт применения бактериофагов в клинической практике, накопленный за последние сто лет, свидетельствует о перспективности фаговых медицинских технологий. Дальнейшая работа специалистов из множества компаний, работающих сегодня в этой области, и применение методов синтетической биологии обязательно приведут к созданию препаратов с несравненно большей эффективностью по сравнению с современными фаговыми коктейлями.
Тем не менее, биотехнологи, также как ученые и медики, надеются, что безвредные и эффективные препараты все же займут свое законное место в арсенале терапии инфекционных заболеваний.
Алешкин А. В. Бактериофаги в инфекционной патологии: прошлое, настоящее и будущее // Лекции по исследованию и применению бактериофагов. 2016. Ульяновск. С. 11—51.
Козлова Ю. Н., Репин В.Е., Анищенко В.В., Власов В.В. и др. Штамм бактериофага Pseudomonas aeruginosa, используемый в качестве основы для приготовления асептического средства против синегнойной палочки. // Патент РФ №2455355. 2012.
Козлова Ю. Н., Морозова В. В., Тикунова Н. В. и др. Штамм бактериофага Staphylococcus aureus SA20, обеспечивающий разрушение биопленок, образуемых бактериями рода Staphylococcus // Патент РФ № 2565824. 2015.
Морозова В. В., Козлова Ю. Н., Тикунова Н. В. и др. Штамм бактериофага Citrobacter freundii CF17, способный лизировать патогенные штаммы Citrobacter freundii // Патент РФ № 2565559. 2015.
Тикунова Н. В., Морозова В. В. Фаговый дисплей на основе нитчатых бактериофагов: применение для отбора рекомбинантных антител // Аcta Naturae. 2009. № 3. С. 6—15.
Тикунова Н. В. и Власов В. В. Бактериофаги – враги наших врагов // Наука из первых рук. 2013. № 2(50). С. 58—69.
Покровская М. П. Каганова Л. С., Морозенко М. А. и др. Лечение ран бактериофагом. М.: НАРКОМЗДРАВ СССР, МЕДГИЗ. 1941. 57 с
Górski A. et al. Phages targeting infected tissues: novel approach to phage therapy. // Future Microbiol. 2015. V. 10. P. 199—204.
Międzybrodzki R. et al. Clinical aspects of phage therapy // Adv. Virus. Res. 2012. V. 83. P. 73—121.
В публикации использованы иллюстрации из книги Лечение ран бактериофагом. М.: НАРКОМЗДРАВ СССР, МЕДГИЗ. 1941. 57 с.
Предисловие
Антипрививочное движение недалеких и ограниченных людей с явными психопатами и мошенниками во главе и преступно доступное и широкое применение антибиотиков привели к тому, что мы остались практически беззащитны! Да, мы уже почти победили врага, зажали его в угол, кого-то вообще извели… И расслабились!
Глава 1
Кто в чьем мире живет?
«И назвал Бог сушу землёю, а собрание вод назвал морями. И увидел Бог, что [это] хорошо.
Бактерии проникли в организм самых первых людей. Хорошо, не Адам и Ева, но кто-то же был первым? Если это та самая пресловутая обезьяна, которая вдруг стала мыслить и пошла разжигать костер, – там и подавно микроорганизмы уже исчислялись миллиардами! Дальше вообще не очень понятно… Могли ведь сразу убить! До всякого там иммунитета – его надо было еще развить!
То, что я сейчас говорю, скорее гипотеза, не надо относиться к ней слишком серьезно. И все-таки меня поразило недавнее исследование, доказавшее, что токсоплазма может менять поведение людей!
Токсоплазма, попадая в организм человека, остается там навсегда. Исследование показало, что носители токсоплазмы и люди, свободные от нее, ведут себя по-разному. Дальше. Важнейшее и абсолютно незаменимое звено в цикле развития токсоплазмы – это кошки. Посмотрите, как мы их любим! Лелеем, холим! Пророк Мухаммед, чтобы не потревожить кошку, спавшую на широком рукаве его шелкового халата, вставая, просто этот рукав отрезал! В древней Грузии за убийство кошки полагалась смертная казнь!
Подумайте о трех фактах:
1. Доказано, что токсоплазма может менять поведение человека.
2. Токсоплазме необходимы кошки.
3. Большинство из нас обожает кошек.
Вывод, основанный на этих фактах, таков: токсоплазма, поселившись у нас в организме, подспудно генерирует у нас любовь к кошкам и заставляет проявлять заботу о них, превращая нас в своеобразных пастухов, необходимых их организмам!
Хотите опровергнуть? Для этого надо сравнить анализы крови на носительство токсоплазмоза у тех, кто обожает кошек, и тех, их не любит! Конечно, это до некоторой степени фантазии!
Теперь совесть может быть чиста: это не мы тянем очередную конфету в рот, не по своей воле наворачиваем зараз пачку пельменей, а потом еще и идем ночью к холодильнику – это всё живущие в нас бактерии дергают за веревочки, а без них бы мы, конечно, питались одними фруктами и цветочной пыльцой!
Микробы могут изменять поведение и привычки человека. Так считают американские врачи.
Шутки шутками, но работы по исследованию возможности влияния бактерий на поведение человека продолжаются, и, боюсь, дождемся-таки данных о связи хламидийной инфекции или уреаплазмы с нашими предпочтениями в выборе половых партнеров! Хотя в 2012 году ВОЗ признала любовь заболеванием (да-да, код в Международной классификации болезней: F63.9), теперь не хватало еще, чтобы инфекционным!
Давайте знакомиться с микромиром, где мы то ли гости, то ли домашний скот, то ли жертвы…
Общая масса бактерий на Земле – около 500 млрд тонн. Они необходимы для нашего существования.
Давайте познакомимся поименно с теми бактериями, которые у нас на слуху как основные виновники многих серьезных болезней.
Пневмококк. Частый возбудитель пневмонии, потому так и назван! Но он вполне может поспорить за лидерство за место, уже занятое другой бактерией под названием менингококк, которая является наиболее частой причиной менингитов у детей (тот менингококк на втором месте!). Вообще, эта бактерия поражает наиболее часто детей до двух лет (отит!) и пожилых людей (65+). Отсюда очевидна необходимость прививок не только детям, но и людям в возрасте. Иначе по мере снижения естественного иммунитета у пожилых пневмококк рождает таких монстров! Это сепсис, воспаление клапанов сердца, суставов, костей, нервной системы…
Также очень подвержены поражающему действию пневмококка алкоголики и люди с удаленной селезенкой, как уже было сказано. Около 30 % всех пневмококков устойчивы к антибиотикам пенициллинового ряда. Вся надежда на прививки, благо вакцина есть!
Вакцинация от менингококка входит в список обязательных прививок (для безответственных родителей справка: смертность от менингита у детей – 30 %).
Заметки на полях
Как-то ко мне пришел главный врач соседней больницы и попросил совета по поводу своего родственника, стоит ли ему исправлять давнее искривление носовой перегородки? Храп, затруднение носового дыхания, конечно, делать надо! В остальном – здоров как бык, молодой, 45 лет. Положил я его к себе – мы славимся своим ЛОР-отделением – короткая операция и все хорошо. Хорошо первые 2 дня. А потом – в точности, как я только что описал: температура, сыпь, падение давления и шок! Больной в реанимации, приходят родственники, тот же соседский главврач, и я должен смотреть им в глаза и лепетать про 1–3 случая на 100 000 операций… Слава Богу, вытащили мы его с того света! А я сам по сей день так и продолжаю ходить с искривленной носовой перегородкой, все понимаю, но… Вместе с тем золотистый стафилококк часто живет на нашей коже и слизистых, не вызывая никаких симптомов до поры до времени. У кого-то он потом провоцирует гнойничковые инфекции кожи, у кого-то рвоту и понос, у кого-то инфекционное поражение костей или даже сердца! Вакцины нет, мойте чаще руки и соблюдайте правила личной гигиены!
Стрептококк. Обычно мы знаем только это название, хотя их много разновидностей (тот же пневмококк относится к стрептококкам). То, что так часто вызывает ангины и может дать осложнения на сердце и почки, – стрептококк группы А. Он виноват еще и в ревматизме, скарлатине и в том же синдроме токсического шока (на пару с золотистым стафилококком). Стрептококковый фарингит (ангина) характеризуется наличием трех компонентов: температура за 38, увеличенные болезненные лимфоузлы на передней поверхности шеи и отечные миндалины. Если есть все три признака – шанс стрептококковой инфекции 50 %! Наши действия: подтвердить мазком и назначить антибиотики на 10 дней как профилактику осложнений!
Группа Б не менее злая: поражает новорожденных (основная причина воспаления легких и менингитов у детей до трех месяцев, это потом пневмококк выходит на лидирующие позиции) и стариков. А также алкоголиков, диабетиков, беременных. Вакцины нет.
То же относится и к гемофильной палочке. Живет она у детей в слизистых дыхательных путях (к 18 месяцам жизни носители бактерии – больше 1/3 детей), передается воздушно-капельным путем. После введения в 1985 году вакцины число заболеваний, вызванных гемофильной палочкой, резко снизилось, смертность при них была 15 %… По официальным данным, в России от прививок отказываются 5 % родителей, в действительности, видимо больше, судя по вспышке потенциально контролируемых инфекций. Обидно смотреть!
Женщины должны с осторожностью пользоваться тампонами. Зафиксированы многие случаи, когда последствием был синдром токсического шока.
Синегнойная палочка. Один из самых неприятных микроорганизмов, основной источник головной боли врачей и исследователей. Очень распространен, особенно в воде, иногда даже в дистиллированной! Добро бы просто в воде… Синегнойная палочка живет в аппаратах искусственного дыхания и больничных раковинах, поражая и так тяжелобольных людей! Она – вторая причина пневмоний, полученных внутри больницы, причастна к инфекции мочевыводящих путей, к инфицированию послеоперационных ран. Смертельно опасна для больных со СПИДом, с обширными ожогами, муковисциозом, диабетом, низким уровнем лейкоцитов. Для борьбы с этой бактерией разработаны специальные антибиотики – надо их знать и не применять неправильно! Вакцины нет.
Сальмонеллы. Они бывают разные, самая известная – та, что вызывает тиф: сальмонелла тифа группы Д. Приходит к нам с едой (молоком), водой. Во время мировой и гражданской войн эпидемии брюшного тифа выкашивали людей целыми ротами и опустошали фронты! Люди также могут быть и носителями. Где бы вы думали, мы ее носим до поры до времени? В содержимом желчного пузыря! Вакцина есть, не такая уж и эффективная: защищает процентов на 70–80…
Есть и нетифоидные сальмонеллы – частая причина пищевых токсикоинфекций, отравлений. Источник – замороженные продукты, особенно куры, молоко, яйца. Также возможно распространение через экзотических животных: игуан, черепах и проч. Лечение антибиотиками обычно не ускоряет выздоровление, а лишь переводит больных в разряд носителей, поэтому лечат время, терпение и большое количество жидкости!
Легионелла. По меркам микробиологии совсем недавно открытая бактерия – в 1976 году. Обитает в воде, передается воздушно-капельным путем. Те несчастные ветераны Американского легиона, у которых эта бактерия была впервые выделена, заразились через кондиционер. Действительно, кондиционеры, системы охлаждения и отопления, душ – лучшая среда для бактерии, у которой комфортная температура для размножения 40–60 гр. Вызывает воспаление легких, сопровождаемое и другими симптомами: поносом, спутанностью сознания, при низком уровне натрия. Рентгенограмма таких больных всегда выглядит значительно хуже, чем можно предположить, выслушивая больного фонендоскопом! Ключ к диагнозу: вовлечение в процесс различных органов и систем. Вакцины нет.
Листерия. Вот про эту бактерию мы практически не слышали. Вместе с тем про нее надо знать хотя бы беременным женщинам. Да, беременность – это не болезнь, но состояние, при котором происходит снижение защитных сил организма (они же теперь прикрывают двоих, а то и троих-четверых). Листерия – такая бактерия, которая с сильным организмом может и не справиться (максимум, что грозит, это понос), а вот на слабых набрасывается! Она еще и бич алкоголиков, больных СПИДом и новорожденных: частая причина менингитов у этих категорий! Так вот беременные особенно чувствительны к инфекциям мочевыводящих путей. Поэтому к ним такое повышенное в этом плане внимание: если в обычной ситуации наличие бактерий в моче не требует лечения, то у беременных тут необходимо назначение антибиотиков и в первую очередь тех, что действуют на листерию! Здесь, кстати, тонкость: то, чем обычно лечат мочевую инфекцию, на листерии не действует! Поэтому беременным надо давать эффективный в этой ситуации и безопасный для будущей мамы ампициллин. Вообще, беременным надо помнить несколько простых правил предохранения от листерии. Надо исключить следующие продукты:
3. Мясную кулинарию.
5. Копченые морепродукты.
Как видим, у листерии губа не дура, знает, где селиться! Вакцины нет.
Хелиобактр пилори. По частоте инфицирования человека занимает первое место! Врачи открыли ее еще 100 лет назад, но осознание ее роли в провоцировании стольких проблем у человека пришло только в 80-х годах XX века, когда была обнаружена связь между этим микроорганизмом и язвой желудка. Врачи за это исследование получили Нобелевскую премию, а мы уже 4-й десяток лет никак не привыкнем, что язва желудка – инфекционная болезнь! И эрозивный гастрит, и лимфома желудка, и еще некоторые малоприятные состояния! И как только эта бактерия только выживает в очень кислом содержимом желудка?
До 50 % населения Земли заражено этой бактерией. С возрастом эта цифра приближается к 80 %. Передается от человека к человеку (мы – основной ее резервуар), носителями могут быть и кошки, и овцы, иногда может передаваться с водой… Вакцины нет, одна надежда пока на внучку Аполлона – Гигиену! Нас еще в институте учили: Гигиена – дочка Эскулапа и внучка Аполлона! Когда на экзамене по гигиене в свое время получил одну из немногих троек, это запомнил на всю жизнь!
Заметки на полях
Ученые проследили последовательность генных изменений этой бактерии и пришли к заключению, что ей уже как минимум 58 000 лет, примерно тогда же человечество стало расселяться из своей колыбели – Африки. Теперь врачи (и я в том числе) активно стараемся ее искоренить: вот искореним – и не будет у нас язв, эрозий и изжоги… Но ведь получается, что без этой бактерии люди никогда и не жили! Нарушить экосистему легко, но истребишь вредных насекомых – и начинают от голода вымирать птицы и далее по цепочке… Может, отчасти и поэтому сегодня рекомендации такие: изничтожать хелиобактер пилори, только если есть симптомы – диспепсия, изжога, боль. Если бессимптомное носительство, то и не трогать!
Спирохеты бывают не только бледные. Ниже будет сказано про болезнь Лайма или боррелиоз, которую распространяют клещи. Там возбудитель тоже спирохета, только другая ее разновидность. Коварная болезнь, поражающая не только кожу, но и сердце, суставы, нервную систему. Может давать ложноположительный тест на сифилис (тот, что остается положительным навсегда).
Есть еще и лептоспироз. Эта спирохета передается с водой и через зараженных животных, очень распространена в странах третьего мира, поражает печень, мозг, легкие… От спирохет вакцин нет.
Читайте также:




