Кровь на иерсиниоз и псевдотуберкулез инвитро

Диагностика иерсиниоза и псевдотуберкулеза методом РПГА

Анализ выявляет наличие антител к патогену кишечного иерсинеоза и псевдотуберкулеза и является маркером острой или перенесенной ранее инфекции.
Методика РПГА (реакция пассивной гемагглютинации) проводится следующим образом - на лабораторный планшет вносят тестируемые образцы - исследуемая сыворотка в первой пробе разводится в 10 раз, последующие образцы разводят с двукратным отличием (1:10, 1:20 и так далее). К каждой пробе добавляют иерсиниозный диагностикум (стандартные эритроциты, связанные с антигенами возбудителей инфекции). При наличии в пробах антител происходит их соединение с патогеном, которое проявляется осаждением гемагглютининов. То же самое проделывают и с псевдотуберкулезным диагностикумом. Позитивная реакция оценивается по разведению пробы, в которой произошла агглютинация.
| Сроки выполнения | до 7-10 дней |
| Синонимы (rus) | Реакция пассивной агглютинации с грамотрицательными палочками иерсиниями |
| Cинонимы (eng) | Indirect hemagglutination test from Yersinia pseudotuberculosis, Yersinia enterocoliticа |
| Методы исследования | Полуколичественная реакция непрямой гемагглютинации |
| Подготовка к проведению анализа | Анализ проводится утром, натощак. С последнего приема пищи должно пройти не менее 8 часов. |
| Исключить прием алкоголя не менее чем за 24 часа до взятия биоматериала. | |
| Не рекомендуется сдавать кровь на серологию после флюорографии, рентгена, физиотерапевтических процедур. | |
| Биоматериал и способы его взятия | Кровь, взятие производят в лечебном учреждении из вены. |

Бациллы представляют опасность для человека и животных, они обладают высокой устойчивостью к окружающим условиям, накапливаются и размножаются в почве, воде. В человеческий организм бактерии проникают при уходе за инфицированным животным и употреблении сырой воды, немытых овощей и фруктов, плохо приготовленной рыбы и мяса, некипяченого молока.
Клинические проявления кишечного иерсиниоза и псевдотуберкулеза очень похожи:
- диарея;
- лихорадка;
- спастические боли в животе;
- рвота;
- увеличение лимфоузлов;
- катаральные симптомы.
Отличительным признаком псевдотуберкулеза является появление скарлатиноподобных высыпаний в естественных складках (на шее, в подмышках, паху, вдоль торса), отек стоп ног и кистей рук. Именно поэтому заболевание могут называть скарлатиноподобной лихорадкой. Сходство клинико-этиологических характеристик, механизма зарождения и развития болезни позволяет рассматривать кишечный иерсиниоз и псевдотуберкулез как близкие друг другу кишечные инфекции, различить возбудителей инфекционного процесса можно лишь при помощи лабораторных анализов.
Отрицательный результат свидетельствует об отсутствии заражения иерсиниями.
Условно-диагностическим титром считают итог 1:160 и выше - положительный результат, подтверждающий текущее заболевание.
Рекомендуют двукратное проведение анализа - при появлении первых клинических признаков и через неделю. Окончательный диагноз инфекционного процесса устанавливает квалифицированный специалист.
Комплексное исследование для выявления возбудителя иерсиниоза (Yersinia enterocolitica) и псевдотуберкулеза (Yersinia pseudotuberculosis), включающее серологические тесты и полимеразную цепную реакцию (ПЦР).
Анализы на иерсиниоз и псевдотуберкулез.
Laboratory Diagnostics of Yersiniosis, Enteropathogenic Yersiniae Lab Panel.
Какой биоматериал можно использовать для исследования?
Венозную кровь, кал.
Как правильно подготовиться к исследованию?
- Исследование рекомендуется проводить до начала приема антибиотиков и других антибактериальных химиотерапевтических препаратов.
- Исключить прием слабительных препаратов, введение ректальных свечей, масел, ограничить (по согласованию с врачом) прием медикаментов, влияющих на перистальтику кишечника (белладонна, пилокарпин и др.), и препаратов, влияющих на окраску кала (железо, висмут, сернокислый барий), в течение 72 часов до сбора кала.
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Иерсинии - это грамотрицательные, факультативно-анаэробные палочки, относящиеся к семейству Enterobacteriaceae. Известно 11 видов иерсиний, три из которых являются возбудителями заболеваний человека: Yersinia pestis – это возбудитель чумы, Yersinia enterocolitica (Y. enterocolitica) и Yersinia pseudotuberculosis (Y. pseudotuberculosis) – кишечные патогены. Хотя Y. enterocolitica и Y. pseudotuberculosis относятся к разным видам, они имеют много общего, особенно в плане клинической картины и диагностики.
Основной "резервуар" иерсиний - дикие и домашние животные (свиньи, грызуны, овцы, козы, коровы, собаки, кошки и птицы). Считается, что человек не участвует в естественном жизненном цикле этих патогенов ни в качестве промежуточного, ни окончательного хозяина и его заражение, таким образом, носит случайный характер. Как правило, заражение кишечными иерсиниями происходит фекально-оральным путем при употреблении контаминированных продуктов питания (молочные продукты, сырое или плохо приготовленное мясо, особенно свинина). Как Y. enterocolitica, так и Y. pseudotuberculosis сохраняют жизнеспособность в условиях пониженных температур. Случаи передачи инфекции от человека к человеку или при переливании инфицированной крови описаны, но очень редки.
Следует отметить, что не все кишечные иерсинии являются патогенами. Так, к развитию заболевания у человека приводят серотипы Y. enterocolitica O:3, O:8, O:9 и O:5,27 и Y. pseudotuberculosis O:1 и O:2. Только указанные серотипы являются истинно энетропатогенными иерсиниями.
Особенностью энтеропатогенных иерсиний является их тропность к лимфатичекой ткани. Проникая через слизистую оболочку кишечника, эти микроорганизмы попадают в мезентериальные лимфатические узлы. Развивающийся воспалительный ответ сопровождается болью в области живота и диареей, а также мезентериальным лимфаденитом. У иммунокомпетентных лиц заражение энтеропатогенными иерсиниями чаще ограничивается гастроэнтеритом и регионарным лимфаденитом. Если возбудителем заболевания является Y. enterocolitica, говорят об иерсиниозе, если Y. pseudotuberculosis – о псевдотуберкулезе. Иерсиниоз встречается чаще, чем псевдотуберкулез. Как при иерсиниозе, так и при псевдотуберкулезе могут наблюдаться иммунопатологические феномены в виде реактивного артрита и узловатой эритемы. У лиц с иммунодефицитом, а также маленьких детей могут наблюдаться тяжелые формы иерсиниоза и псевдотуберкулеза с диссеминацией бактерий и сепсисом.
Диагностика иерсиниоза и псевдотуберкулеза достаточно сложна. Хотя бактериологический посев кала (крови или других биологических материалов) считается "золотым стандартом" диагностики, он трудноосуществим. Это связано с тем, что энтеропатогенные иерсинии сложно отличить от других кишечных микроорганизмов, которые в норме преобладают в кишечной флоре. После выявлении роста иерсиний проводят дополнительные биохимические тесты, устанавливающие их энтеропатогенность. Кроме того, метод бактериологического посева характеризуется достаточно низкой чувствительностью (для получения результата необходимо 10 3 -10 6 КОЕ в грамме образца биоматериала). Учитывая эти особенности, диагностика иерсиниоза и псевдотуберкулеза носит комплексный характер и включает следующие дополнительные тесты:
- Полимеразная цепная реакция (ПЦР) – один из методов молекулярной диагностики, в ходе которого определяется генетический материал (ДНК) микроорганизма в образце биоматериала (в кале). Основными преимуществами ПЦР являются быстрота получения результата, высокая чувствительность и специфичность. В данное комплексное исследование входит анализ ПЦР на Y. pseudotuberculosis.
- Серологические тесты. Антитела к энтеропатогенным иерсиниям обычно могут быть определены в первые 2-4 недели болезни (IgM-антитела). Следует отметить, что из-за определенного антигенного сходства Yersinia с бактериями других родов (Salmonella, Morganella, Brucella) серологические тесты могут давать ложноположительные результаты. Еще одним недостатком серологических тестов является то, что антитела к иерсиниям (IgG-антитела) сохраняются в течение нескольких лет после инфицирования, что может препятствовать интерпретации результата. Следует помнить, что результат серологических тестов зависит от иммунного статуса организма.
Точность ПЦР и серологических тестов в меньшей степени, чем бактериологического метода, подвержена влиянию антибактериальных препаратов. Однако максимально точный результат теста будет получен при анализе биоматериала, полученного до начала лечения.
Гастроэнтерит, возникающий при инфицировании энтеропатогенными иерсиниями, сложно отличить от сальмонеллеза, кампилобактериоза и других кишечных инфекций. По этой причине часто требуются дополнительные лабораторные анализы.
Для чего используется исследование?
- Для диагностики иерсиниоза и псевдотуберкулеза.
Когда назначается исследование?
- При подозрении на иерсиниоз или псевдотуберкулез: лихорадка, тошнота, боли в животе (боль может локализоваться в правой паховой области), диарея, а также узловатая эритема или реактивный артрит;
- в некоторых случаях при подозрении на острый аппендицит.
Что означают результаты?
Для каждого показателя, входящего в состав комплекса:

За прошедшие 10‒15 лет применение высоких технологий позволило получить новые результаты, которые определили особое место иерсиниозов в современном мире. На настоящий момент в исследования по проблеме иерсиниозов вовлечен весь мир – это страны Северной (США, Канада) и Южной (Колумбия, Бразилия) Америки, Великобритания и Ирландия, страны Центральной Европы (Франция, Германия, Бельгия, Испания, Польша, Болгария), Скандинавии (Финляндия, Норвегия, Швеция) и Африки (Мадагаскар), а также Россия, Китай, Южная Корея, Япония, Израиль.
Псевдотуберкулез у человека до середины 1950-х годов встречался как редкое спорадическое заболевание, протекающее в виде острого аппендицита и мезентериального лимфаденита, и был известен лишь в Европейских странах, Северной и Южной Америке, Японии, Индии [21, 26].
Не будет преувеличением сказать, что именно Россия обратила внимание всего мира на проблему эпидемического псевдотуберкулеза, и в целом иерсиниозов, с тех пор как с 1959 года впервые стало известно о вспышках во Владивостоке своеобразной инфекционной болезни, с охватом до нескольких сотен человек, первоначально получившее название дальневосточная скарлатиноподобная лихорадка (ДСЛ) [5]. В период 1960-1990-х годов под руководством академика РАМН Георгия Павловича Сомова в НИИЭМ СО РАМН, при сотрудничестве с военными и практическими врачами, ВГМИ (ныне – ТГМУ), было проведено комплексное изучение этиологии, эпидемиологии, патоморфологии, клиники и иммунологии, лечения и профилактики этой новой болезни. В 1989 году, за проведение этих крупномасштабных исследований, группа специалистов во главе с Г.П. Сомовым была удостоена Государственной премии СССР. А спустя 20 лет было доказано, что клинико-эпидемическое проявление псевдотуберкулеза (ДСЛ) связано с конкретной клональной линией Y. рseudotuberculosis, распространенной в РФ и характеризующейся определенным плазмидным профилем (pVM82, pYV 48 MDa), сиквенстипом (2ST) и аллелем гена yadA (1й аллель) [7].
Повсеместный интерес к проблеме иерсиниозов имеет отражение в регулярно проводимых с 1967 года Международных симпозиумах – International Symposium on Yersinia (Франция, Швеция, Канада, Австралия, Япония, Италия, Нидерланды, Финляндия, США, Бразилия, Китай). Последний 11-й Международный симпозиум в Китае в 2013 году показал, что высокий интерес к иерсиниозам обусловлен тем, что до сих пор в значительной мере не раскрыты побудительные мотивы к эволюции возбудителей внутри рода Yersinia, транс- и межконтинентальной трансмиссии иерсиний, в первую очередь Yersinia pestis, с возникновением эпидемий и пандемий, а также механизмы возможной реверсии и поддержания высокой патогенности нечумных иерсиний.
Прежде всего, важность и значимость углубленного изучения иерсиниозов обусловлены их принадлежностью к эмерджентным инфекциям, одновременно с особо опасной чумной инфекцией. Непредсказуемость и опасность их возникновения требуют перманентного контроля и глубокого всестороннего изучения. Недавно показано [11], что возбудитель чумы, Y. pestis, эволюционировал из возбудителя псевдотуберкулеза, Y. pseudotuberculosis, и оба патогена генетически почти идентичны. Причем, переход Y. pseudotuberculosis в Y. pestis сопровождался утратой многих и приобретением нескольких генов, ассоциированных с патогенностью возбудителей. В этой связи не следует забывать о том, что у Y. pseudotuberculosis сохранилась способность изредка вызывать у человека геморрагическую пневмонию, напоминающую легочную чуму.
Об опасности эмерджентных инфекций свидетельствует история Черной Смерти, вызванной Y. pestis. В средние века чума путешествовала по суше из Азии и прибыла через морскую торговую сеть в Европу (1347 год), уничтожив 30-50 % ее населения. Позднее вспышки чумы продолжали появляться в Европе в течение четырех веков, с последующей реинтродукцией заболевания из Азии в Европу, происходившей без существования локального природного резервуара [37]. Имеются сведения о том, что первые пандемические волны чумы начались в Китае и Центральной Азии еще более 2 600 лет тому назад и с помощью караванов, шедших по Великому шелковому пути, болезнь проникла в Европу, а затем и в Африку. Причем выявлены специфические мутации Y. pestis в зависимости от географического региона.
В начале XXI века вновь началась регистрироваться эмерджентная заболеваемость Yersinia-caused инфекциями. Так, на Мадагаскаре зимой 2011 года описано две вспышки чумной пневмонии с летальностью, достигшей 75 % [33]. Эти вспышки подтвердили высокую контагиозность легочной чумы и необходимость быстрой идентификации первых случаев заболеваний для немедленного применения мер защиты и предупреждения быстрого распространения заболевания.
Вторым уязвимым место в проблеме иерсиниозов является то, что их возбудители признаны потенциальными агентами биотерроризма. Пристальное внимание исследователей к проблеме иерсиниозов с начала XXI века в большой мере связано с возросшей угрозой биотерроризма во всем мире, а также с потенциальной способностью гетерогенных популяций патогенных иерсиний к реверсии вирулентных свойств, ассоциированной с изменениями на геномном уровне в определенных условиях внешней среды. Эти изменения могут быть причиной полиморфизма клинико-морфологических проявлений иерсиниозов, что требует целенаправленного исследования на основе современных методических подходов. В конечном итоге, углубленное понимание биологии и патологии инфекционных процессов в контексте их связи с молекулярно-генетической характеристикой патогенов создаст новые возможности для борьбе с иерсиниозами в целом.
Биохимические маркеры Yersinia pseudotuberculosis complex (YPC)
Примечаниея. 1) – Sprague et al., 2008; 2) – Laukkanen-Ninios et al., 2011; 3) – Savinа et al., 2014; 4) – Fukushima et al., 2001.
Используя секвенирование целого генома всех видов Yersinia, S. Reuter et al. [35] очертили комплект гена (или дополнение гена) рода в целом и определили закономерности эволюции вирулентности иерсиний. Несколько различных экологических специализаций, вероятно, дают расщепление остро патогенных штаммов Yersinia от непатогенных линий из окружающей среды. Вопреки гипотезе, что все патогенные виды Yersinia имеют общего патогенного предка, показано, что они развивались независимо друг от друга, но с последующими параллельными путями эволюции в приобретении одних и тех же детерминант вирулентности. Эти геномные вариации привели к параллельному появлению родственных возбудителей, где отображается их все более специфический образ жизни, со спектром потенциала вирулентности.
Ферментативная активность микроорганизмов является достаточно стабильной, поэтому исследование биохимических свойств Yersinia может служить надежным инструментом для таксономической характеристики новых видов. По ферментативной активности, все виды, входящие в Yersinia pseudotuberculosis complex, проявили высокую биохимическую однородность [36, 39]. Однако были выявлены биохимические маркеры, по которым можно провести дифференциальную диагностику между Y. pseudotuberculosis, Y. similis и Korean group по активности ферментов пиразинамидаза, D-мелибиоза, β-галактозидаза, D-раффиноза, D-таггатоза (таблица). При этом активность указанных видов Yersinia по основным ферментам, входящим в дифференциально-диагностический спектр оказалась полностью идентичной. Таким образом, все исследованные виды иерсиний, входящих в Yersinia pseudotuberculosis complex, по биохимическим маркерам представляются в качестве трех отдельных видов.
Нестабильность фенотипических свойств затрудняет интерпретацию получаемых результатов по дифференциации микроорганизмов. Это вызывает необходимость разработки приемов молекулярной диагностики, основанной на анализе структуры генома, отличающегося большей консервативностью по сравнению с фенотипическими свойствами. С. Savina et al. [36>, на основании секвенирования и анализа единичных вариабельных нуклеотидов 417 изолятов из 29 стран, показали генетическое сходство и разнообразие видов, входящих в Yersinia pseudotuberculosis complex (рисунок). Установлено, что все секвенированные штаммы Y. pseudotuberculosis, Y. similis и Korean group представляют собой три однородных кластера с минимальной вариабельностью нуклеотидов (0,04–1,4 %), что подтверждает обособленность этих видов иерсиний. В то же время эти виды оказались генетически близкими друг другу: количество вариабельных нуклеотидов варьировало от 0,8–1,8 % (пара Y. pseudotuberculosis и Korean group) до 4,2–4,5 % (пара similis и Korean group).
Весьма важный аспект проблемы иерсиниозов касается нового фактора патогенности, идентифицированного у штаммов Y. pseudotuberculosis I серотипа, ответственного за уникальный клинический синдром, описанный на Дальнем Востоке как скарлатиноподобная лихорадка (Far East scarlet-like fever, FESLF) [27]. Это ранее неизвестный белок вирулентности Y. pseudotuberculosis (TcpYI), который имеет значительную гомологию последовательности с членами семейства Toll / IL-1 рецептора (TIR). Бактериальный TIR домен содержит белки (Tcps), действующие на иммунную систему по TIR-TIR взаимодействиям, и подрывает защитные реакции организма с помощью многогранных механизмов. Белок TcpYI увеличивает внутриклеточное выживание штаммов in vitro и в селезенки мышей на модели перитонита, участвует в торможении фагоцитоза, даже штаммов Y. pseudotuberculosis группы FESLF, где плазмида вирулентности pYV отсутствует. Таким образом, подтверждена гипотеза, что белок TcpYI самостоятельно способствует патогенности Yersinia и играет решающую роль в качестве потенциального фактора вирулентности Y. pseudotuberculosis, который особенно связан с штаммами дальневосточной скарлатиноподобной лихорадки I серотипа, имеющими измененный ген кластера вирулентности [16, 32].
В настоящее время возбудитель псевдотуберкулеза привлекает внимание исследователей всего мира в качестве модели для раскрытия молекулярных механизмов взаимодействия патогенных Yersiniae в системе микроорганизм-хозяин, где первостепенное значение придается клеткам врожденного иммунитета. Патогенные для человека виды Yersinia преимущественно инактивируют клетки врожденного иммунитета, что является важным шагом, с помощью которого эти бактерии избегают элиминации и вызывают заболевание [41]. Установлено, что в ответ на заражение иерсиниями, фундаментальную роль в первичной иммунной защите играют нейтрофилы, которые используют несколько механизмов для ликвидации бактерий, таких как фагоцитоз, оксидативный стресс и дегрануляция, а также образование нейтрофильных внеклеточных ловушек (NET) – особого типа повреждения клеток, наряду в некрозом и апоптозом, а также пироптозом.
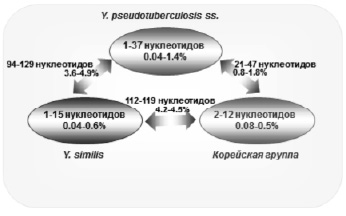
Кластеры генетического разнообразия Yersinia pseudotuberculosis complex (пояснение в тексте)
Многочисленные исследования, проведенные в конце ХХ в., коренным образом изменили представление о факторах патогенности бактерий рода Yersinia. Иерсинии имеют способность преодолевать механизмы врожденного иммунитета, обладая большим набором факторов патогенности, часть из которых кодируется хромосомными генами, а часть – генами плазмид (внехромосомных генетических элементов) [5, 9, 18, 31].
Детально охарактеризованы факторы патогенности, детерминированные хромосомными генами [8]. Это: 1) инвазин, м.м. 103 кДа (обеспечивает температура-зависимое проникновение в клетки хозяина); 2) белок Ail 17 кДа (действует как вторичный фактор адгезии и инвазии уже после адаптации клеток бактерий к температуре тела хозяина); 3) антиген рН6 (экспрессируется максимально при температуре 37 °С и низком значении рН; белок 21 кДа – экспрессирует образование фимбрий).
Доказано, что вирулентность бактерий рода Yersinia ассоциируется с наличием плазмиды pYV молекулярной массой 42–48 МDa. Плазмида pYV кодирует комплекс белков, объединенных в единую систему и предназначенных для нейтрализации иммунокомпетентных клеток хозяина [10, 28]. Она состоит из эффекторых белков (Yops) и системы секреции III типа (T3SS), позволяющей бактериям вводить синтезируемые ими эффекторные белки в цитоплазму клетки-мишени без проникновения в нее. T3SS является общей для всех патогенных Yersiniae и играет существенную роль в возникновении инфекции [13, 20].
На настоящий момент особый интерес представляет плазмида Y. pseudotuberculosis с мол. массой 82 MDa (рVM82), которая обнаруживается только у штаммов Y. pseudotuberculosis I серовара – наиболее частого этиологического агента ДСЛ [19]. Способность Y. pseudotuberculosis вызывать эпидемические вспышки инфекции у людей связывают с одновременным наличием у микроба плазмид pYV и pVM82 [5]. Сообщается о способности штаммов Y. pseudotuberculosis, несущих плазмиду pVM 82, оказывать иммуносупрессивное действие и индуцировать апоптоз [2, 3, 4, 27]. Однако до сих пор остается недостаточно выяснен спектр эффектов плазмиды pVM 82 в проявлениях вирулентности Y. pseudotuberculosis и особенностях инфекционного процесса. В этой связи, в модельных экспериментах первостепенное значение имеет использование штаммов Y. pseudotuberculosis, выделенных от больных ДСЛ, уникальность которых признается исследователями всего мира.
Нами [2, 6, 30] установлены различия реакции клеток врожденного иммунитета при инфицировании разными плазмидными вариантами Y. pseudotuberculosis. Так, более выраженное апоптоз-индуцирующее действие вызывает слабовирулентный pVM82 вариант, по сравнению с высоковирулентным pYV48:pVM82 вариантом, который преимущественно вызывает некроз фагоцитов.
Актуальной проблемой микробиологии является поиск новых, более быстрых и точных методов идентификации штаммов возбудителей инфекций. Большой прорыв в идентификации микроорганизмов позволил осуществить принципиально новый метод – матрично-ассоциированная лазерная десорбция/ионизация (МАЛДИ) в комплексе с времяпролетной масс-спектрометрией (МALDI-ToF) [15, 23]. Этот метод дает возможность проводить анализ сложных биоорганических молекул, получать молекулярные профили нуклеиновых кислот и белков. В дальнейшем, полученные белковые профили анализируются, определяются родо- и видоспецифические протеиновые биомаркеры, которые используются для таксономической характеристики возбудителей и диагностики инфекций. Недавно проведенный углубленный протеомный анализ бактерий рода Yersinia [22] продемонстрировал наличие родоспецифических и видоспецифических биомаркеров. В 2014 году опубликованы результаты успешной апробации метода в Иркутском НИПЧИ с целью кластеризации возбудителей иерсиниозов [1].
Важное значение имеет профилактика иерсиниозов, в первую очередь, особо опасной чумной инфекции. Привлекают внимание исследования последних лет, касающиеся разработки современных эффективных вакцин против чумы на основе модифицированных штаммом Y. pseudotuberculosis. Живая чумная вакцина (live pestis vaccine, LPV) Y. pestis EV NIEG широко используется для профилактики у человека более 70 лет. Однако антительный ответ к этой вакцине был изучен главным образом к капсулярному антигену F1 и LPS.
Французскими учеными [14] выбрана вакцинная стратегия, основанная на живом, аттенуированном штамме Y. pseudotuberculosis, генетически почти идентичном виде Y. pestis, но менее патогенном и генетически более стабильном. Сконструирован штамм, названный V674TnF1, который является сильно аттенуированным ((LD50 ≥ 1010 CFU, оральный путь) и обеспечивает 100 % защиту против бубонной чумы после однократного подкожного введения 107 CFU V674pF1, даже когда была использована высокая доза заражения Y. pestis (105 CFU = 104 x LD50).
W. Sun et al. [40] получили аттенуированный штамм Y. pseudotuberculosis, синтезирующий гибридные белки, состоящие из YopE, сшитых с LcrV (V-антиген, супрессирующий воспалительный ответ в ранней стадии инфекции) или LcrV221 и доставляемые через систему секреции III типа (T3SS). Эти белки могут быть транслоцированы в цитоплазму культуральных клеток HeLa. Мыши, орально иммунизированные аттенуированным штаммом Y. pseudotuberculosis, синтезирующим YopE – LcrV, продуцировали высокий уровень секреторного IgA и также были значительно защищены к интраназальному заражению примерно 104 CFU вирулентной Y. pestis (примерно 100 LD50).
Резюмируя вышесказанное, можно заключить, что на настоящий момент по проблеме иерсиниозов перспективными для российских ученых следует считать:
1. Поиск и изучение новых факторов патогенности, детерминируемых плазмидой pVM82 у дальневосточных штаммов Yersinia pseudotuberculosis I серотипа, что будет способствовать углубленному пониманию сложности и многообразия взаимодействия этого патогена и макроорганизма, а также идентификации ранее неизвестных механизмов развития эпидемического псевдотуберкулеза.
2. Cравнительная характеристика инфекционных процессов, вызываемых разными плазмидными вариантами Yersinia pseudotuberculosis, в контексте раскрытия закономерностей защитных механизмов системы врожденного иммунитета и иммунопатологии эпидемического псевдотуберкулеза.
Симптомы аллергии – это последствие иммунной реакции при контакте организма с каким-либо веществом, к которому имеется индивидуальная гиперчувствительность. В случае, если аллерген попадает на кожу, в желудочно-кишечный тракт (ЖКТ), на слизистые бронхов, носоглотки или глаз, начинается усиленная выработка иммуноглобулинов E. Именно это становится началом цепочки, которая приводит к воспалению.
Чтобы выявить вещества, на которые у пациента аллергия, рекомендуется сдать анализы на аллергены. Они проводятся в лабораторных условиях и позволяют выделить вещество, которое вызывает в организме конкретно эту иммунную реакцию. При контакте с аллергеном в крови вырабатываются антитела. Именно их наличие позволяет выявить наличие/отсутствие реакции на определенный продукт.
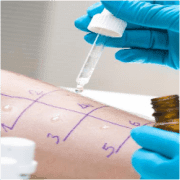
Методы выявления чувствительности к аллергенам
Одним из основных этапов диагностического поиска является применение инструментальных методов и установление как механизма развития заболевания, так и истинных триггеров (аллергенов). К данным методам относятся широко распространенные in vivo- (например, кожные скарификационные пробы) и in vitro (например, определение концентрации аллергенспецифических IgE) тесты.
Кожные пробы рассчитаны на определение индивидуального спектра аллергенов. Наличие реакции определяется местными проявлениями на участке проведения тестирования - появление красноты, папулы, зуда, размеры гиперемии.
В ходе процедуры ведется контроль, который позволяет исключить ложные трактовки результатов.
Существует 3 способа проведения кожных проб:
- эпикутанный ("эпи" - "на") - аллерген наносят на поверхность кожи (например, открытые или закрытые патч-тесты с целью обнаружения гиперчувствительности замедленного типа при контактных дерматитах);
- перкутанный ("пер" - "через") - чрескожный, когда аллерген вводят через поверхность кожи (например, скарификационным методом, уколом (прик-тесты) или прокалыванием кожи с помощью игл);
- интракутанный ("интра" - "в") - внутрикожный, когда аллерген вводят в верхний слой кожи.
В аллергологической практике наибольшее распространение получил метод прик-теста как наиболее безопасный, простой и дешевый способ диагностики аллергии, с которого обычно начинают обследование пациента Источник:
Балаболкин И.И. Кожные пробы: показания и противопоказания / И.И. Балаболкин,
Д.Ш. Мачарадзе // Вопросы современной педиатрии. - 2013. - № 12(3). - С. 31-37. .
Анализ крови на аллергены позволяет идентифицировать вещество, которое вызывает в организме реакцию иммунитета. В ходе анализа кровь смешивают с определенными аллергенами (пищевыми, контактными и ингаляционными) и проверяют, на какие вещества она вырабатывает специфические антитела.
Плесневые грибы
Диагностические исследования аллергии на плесневые грибы назначаются при ухудшении состояния здоровья в следующих условиях:
- во влажных и сырых помещениях;
- при употреблении продуктов, содержащих аллергены грибов;
- в помещениях, оснащенных кондиционерами;
- при осенних или ранневесенних работах в саду и пр.
РНГА с эритроцитарным диагностикумом
Исследования основаны на взаимодействии эритроцитов с антигенами и эритроцитов пациента. Данный метод помогает диагностировать наличие следующих заболеваний.
- брюшной тиф;
- псевдотуберкулез;
- иерсиниоз;
- шигеллез;
- сальмонеллез.
Анализ на бытовые аллергены:
- волос человека;
- клещ домашней пыли;
- дафния;
- пыль;
- перо;
- шерсть;
- и др. бытовые аллергены.
Анализ на пыльцевые аллергены:
- бухарник шерстистый;
- амброзия полыннолистная;
- береза;
- дуб;
- крапива;
- клен;
- и пр. пыльцевые аллергены.
Аллергологические исследования
- анализ на пищевую аллергию;
- респираторная панель;
- анализ на пищевую непереносимость;
- педиатрическая панель
- пищевая панель.
Анализ на наличие аллергии к лекарственным препаратам
- парацетамол;
- аскорбиновая кислота;
- ампициллин;
- диклофенак;
- тетракаин;
- артикаин;
- амоксициллин;
- лидокаин и пр.
Анализ на наличие аллергии к металлам, полимерам, волокнам
- Платина, золото, никель, акрил, латекс, полиамидное волокно, вата, ацетатное волокно и пр.

Подготовка к сдаче анализов
Чтобы исследование крови на аллергены было максимально точным и информативным, необходимо соблюдать ряд несложных требований.
- За 3–5 дней до сдачи крови пациенту следует исключить из своего рациона все продукты, обладающие высокой аллергенностью, а именно:
- морепродукты;
- орехи;
- шоколад и любые напитки/продукты, содержащие его;
- натуральный мед;
- яйца;
- напитки и продукты, в состав которых входят ароматизаторы, синтетические подсластители, красители;
- цитрусовые;
- сыры и молоко;
- несезонные фрукты и овощи.
- Желательно прекратить контакт с домашними животными за 3–5 дней до сдачи крови.
- За несколько суток до сдачи крови полностью отказаться от приема любых лекарств (только с согласия лечащего врача).
- За 2–3 дня до проведения анализов рекомендуется избегать тяжелых эмоциональных и физических нагрузок.
- Непосредственно перед утренней сдачей крови не есть и не пить.
- За 1–2 часа до процедуры не курить.
Не рекомендуется сдавать анализы на аллергены в период обострения различных заболеваний. Это может снизить точность результатов диагностики.
Узнать о том, как сдавать анализы на аллергены, Вы можете у специалистов нашей клиники. Они подробно проконсультируют Вас, рассчитают цены и запишут на процедуру.
Читайте также:
- Коклюш лечение аскорбиновой кислоты
- Коклюш на українській мові
- Вакцина от чумы и оспы
- Чума болезнь у людей от чего наступает смерть при
- Введение сыворотки для лечения дифтерии какой иммунитет
 Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Copyright © Иммунитет и инфекции

