Дифференциация возбудителей чумы и псевдотуберкулеза







Владельцы патента RU 2566559:
Способ дифференциации возбудителей чумы и псевдотуберкулеза по N-ацетил-β-D-глюкозаминидазной активности предусматривает получение суспензии агаровой культуры исследуемых бактерий в концентрации (1-5)×10 9 м.к., подготовку синтетического субстрата, в качестве которого используют 4-метилумбеллиферил-N-ацетил-β-D-глюкозаминид в количестве 50 мкМ. Субстрат растворяют в 2 мл диметилформамида. Из полученного раствора берут 0,6 мл и добавляют 9,4 мл 0,1 М фосфатного буфера pH 7,4. Смешивают 20 мкл подготовленного субстрата с каплей 0,05 мл суспензии агаровой культуры бактерий в физрастворе, помещенной в чашку Петри. Полученную смесь инкубируют 10-20 мин при 37°C, после чего реакцию останавливают добавлением 5 мкл 10 н. раствора щелочи. Осуществляют дифференцирование в УФ-лучах трансиллюминатора при 366 нм. Яркая флюоресценция голубого цвета свидетельствует о положительном результате реакции и подтверждает, что исследуемый штамм гидролизует подготовленный субстрат и принадлежит к Yersinia pseudotuberculosis. Отсутствие свечения подтверждает принадлежность штамма к Yersinia pestis. Изобретение обеспечивает экспресс-диагностику и дифференциацию указанных бактерий, а именно в течение 10-20 мин. 3 табл., 3 пр.
Предлагаемое изобретение относится к медицинской микробиологии и может быть использовано при экспресс-диагностике для всех видов штаммов, принадлежащих к видам Yersinia pestis и Yersinia pseudotuberculosis, их дифференциации друг от друга.
В настоящее время в лабораторной диагностике существует проблема при дифференциации двух близкородственных и высокогомологичных (степень гомологии на уровне ДНК составляет более 90%) видов Yersinia чумного и псевдотуберкулезного микробов. Это обстоятельство существенно при мониторинге природных очагов чумы, реально действующих на территории стран СНГ.
Штаммы псевдотуберкулезного микроба имеют широкое географическое распространение, они патогенны для большого круга теплокровных животных и часто выделяются от грызунов, обитающих на территориях природных очагов чумы. И хотя эти микроорганизмы вызывают разные по клинике и тяжести заболевания, многие фенотипические свойства у них близки с микробом чумы, что затрудняет их дифференциацию.
Известно, что в деградации широко распространенного в природе хитина, который является полимером N-ацетил-β-D-глюкозамина, соединенного β-1,4-гликозидной связью, принимают участие несколько хитиназ, включая экзохитиназу (N ацетил - β-D-глюкозаминидазу, которая отщепляет от хитинсодержащих субстратов легко утилизируемые микробной клеткой крайние остатки N-ацетилглюкозамина (см. 1,2).
Известно о повреждении у возбудителя чумы в результате делеции гена chiC (хитиназы, эндо-β-N-ацетилглюкозаминидазы), а также β-гексозаминидазы (nghA, YPO2632) в результате сдвига рамки считывания, что выражается в способности микроба блокировать/колонизировать преджелудок блохи благодаря образованию аггрегатов из возбудителя и внеклеточного матрикса, тем самым обеспечивая его передачу чувствительному хозяину в результате укуса и последующего срыгивания излишками крови (см.3).
Псевдотуберкулезный микроб, обладающий активностью ферментов экзохитиназы (YTB3365) и β-гексозаминидазы (YTB1123), такой возможности лишен, так как из-за разрушения биопленки этими ферментами у блохи не происходит формирования блока преджелудка. Использовать выявленную особенность для дифференциации этих близких в генетическом, но далеких в экологическом отношении возбудителей по их N-ацетил-β-D-глюкозаминидазной активности не предлагалось.
Известны способы идентификации и дифференциальной диагностики, которые предполагают использование различных вариантов полимеразной цепной реакции (ПЦР) для обнаружения специфических фрагментов генов cafl (плазмида pFra), pla (плазмида pPst) и lcrV (плазмида pCad) чумного микроба, серологических методов (МФА, ИФА, РНат, РНаг) на продукцию видоспецифического капсульного антигена Ф1 и других антигенов или фенотипических признаков (ферментация углеводов, тест на уреазу, ауксотрофность, отношение к фагам и др.) (см.4).
Однако проведение ПЦР требует соответствующего оборудования, специалистов, что отражается на стоимости лабораторных исследований и длительности их проведения (не меньше 2 суток).
Однако известная тест-система требует много времени (4-5 часов) и затрат на дорогостоящее оборудование, реактивы, сертифицированной лаборатории и специалистов, что усложняет способ дифференциации.
Технической задачей предлагаемого изобретения является разработка нового способа, позволяющего в ускоренном режиме и наглядном воспроизведении осуществлять дифференциацию культур генетически родственных Yersinia pestis и Yersinia pseudotuberculosis в условиях in vitro.
Поставленная задача достигается тем, что способ дифференциации возбудителей чумы и псевдотуберкулеза по N-ацетил-β-D-глюкозаминидазной активности включает следующие стадии:
а) получение суспензии агаровой культуры исследуемых бактерий в концентрации (1-5)×10 9 м.к.;
б) подготовку синтетического субстрата, для этого в его качестве берут субстрат 4-метилумбеллиферил-N-ацетил-β-D-глюкозаминид в количестве 50 мкМ, который растворяют в 2 мл диметилформамида,
затем из полученного раствора берут 0,6 мл и добавляют к нему 9,4 мл 0,1 М фосфатного буфера pH 7,4;
в) смешивание приготовленного субстрата в количестве 20 мкл с каплей 0,05 мл суспензии агаровой культуры бактерий в физиологическом растворе, помещенной в чашку Петри;
г) инкубирование полученной смеси при 37°С в течение 10-20 мин, после этого реакцию останавливают добавлением 5 мкл 10 н. раствора щелочи;
д) дифференцирование в УФ-лучах трансиллюминатора при 366 нм, при этом яркая флюоресценция голубого цвета свидетельствует о положительном результате реакции, которая проявляет N-ацетил-β-D-глюкозаминидазную активность и подтверждает, что исследуемый штамм гидролизует подготовленный субстрат, поэтому его идентифицируют как штамм Yersinia pseudotuberculosis, а отсутствие свечения подтверждает его принадлежность к штаммам Yersinia pestis.
Способ осуществляется следующим образом.
Для проведения дифференциации исследуемые культуры in vitro проходят соответствующие стадии.
Первоначально на чашки агара Хоттингера с pH 7,2 петлей высевают в отдельности исследуемые штаммы возбудителей чумы и псевдотуберкулеза для получения суспензии агаровых культур бактерий в концентрации (1-5)×10 9 м.к. Затем проводят инкубирование в течение 24-48 часов при 28°C.
После этого готовят синтетический субстрат 4-метилумбеллиферил-N-ацетил-β-D-глюкозаминид (4-MUF. GlcNAc, Sigma). Субстрат в количестве 50 мкМ растворяют в 2 мл диметилформамида. Из полученного раствора берут 0,6 мл и добавляют к нему 9,4 мл 0,1 М фосфатного буфера с pH 7,4.
Затем приготовленный субстрат в количестве 20 мкл смешивают с каплей 0,05 мл суспензии агаровой культуры бактерий в физиологическом растворе, помещенной в чашку Петри.
После этого проводят инкубирование в течение 10-20 мин при 37°С, затем реакцию останавливают добавлением 5 мкл 10 н. раствора любой щелочи.
Дифференциацию полученных проб осуществляют путем просмотра проб в УФ-лучах трансиллюминатора при 366 нм.
Таким образом, исследуемый штамм гидролизует субстрат 4-метилумбеллиферил-N-ацетил-β-D-глюкозаминид, проявляя при этом N-ацетил-β-D-глюкозаминидазную активность, поэтому его идентифицируют как штамм Yersinia pseudotuberculosis. Если свечения нет, то подтверждают факт отсутствия гидролиза и соответственно отсутствие N-ацетил-β-D-глюкозаминидазной активности, в результате чего делают вывод, что штамм является Yersinia pestis.
Вывод: N-ацетил-β-D-глюкозаминидазную активность штаммов Yersinia pestis и Yersinia pseudotuberculosis рассматривают как дифференциальный признак.
В качестве исследуемых штаммов использовали 14 культур Y. pseudotubeculosis разных серотипов и из разных источников выделения. Все они обладали N-ацетилглюкозаминидазной активностью (см. таблица 1). Стадии проведения способа описаны выше. В качестве субстрата использовали 4-метилумбеллиферил-N-ацетил-β-D-глюкозаминид (4-MUF. GlcNAc, Sigma) в количестве 20 мкл.
Учет результатов приведен в таблице 1, из которой видно, что N-ацетил-β-D-глюкозаминидазная активность обнаруживается у всех взятых в
исследование культур. Следовательно, они относятся к виду Yersinia pseudotuberculosis.
Для изучения были взяты 22 музейных штаммов (коллекция Ростовского-на-Дону противочумного института) другого представителя рода Yersinia - Y. enterocolitica, которые также эффективно расщепляли предложенный субстрат (см. таблица 2). Технология проведения способа такая же, как в примере 1. Все штаммы обладали N-ацетилглюкозаминидазной активностью. В качестве субстрата использовали 4-метилумбеллиферил-N-ацетил-β-D-глюкозаминид в количестве 20 мкл.
Из таблицы 2 видно, что N-ацетил-β-D-глюкозаминидазная активность обнаруживается у всех взятых в исследование культур. Таким образом, можно дифференцировать исследуемые штаммы как не Yersinia pestis.
Исследовали коллекцию из 50 штаммов чумного микроба основного и неосновных подвидов, хранившихся в лиофилизированном состоянии в музее живых культур РПЧИ. Штаммы были выделены в разных природных очагах чумы бывшего СССР и мира, в разные годы и от разных носителей. Технологические стадии проведения способа такие же, как в примере 1,2.
В результате ни один из штаммов не обладал способностью гидролизовать синтетический субстрат 4-метилумбеллиферил-N-ацетил-β-D-глюкозаминид (4-MUF. GlcNAc, Sigma) в количестве 20 мкл (см. таблица 3). Из таблиц 1,2 видно, что у всех проверенных штаммов возбудителя псевдотуберкулеза и Y. enterocolitica, независимо от серотипа, места, времени и источника выделения, N-ацетил-β-D-глюкозаминидазная активность обнаруживается, тогда как 50 штаммов чумного микроба из разных природных очагов были лишены способности расщеплять синтетический субстрат.
Вывод: провести дифференциацию по исследуемому признаку возможно.
Использование предлагаемого изобретения позволяет проводить в ускоренном режиме, а именно в течение 10-20 мин, и наглядном воспроизведении дифференциацию Yersinia pestis от Yersinia pseudotuberculosis в условиях in vitro, что позволяет этот способ использовать как экспрессную диагностику при эпидемической ситуации и мониторинге больших территорий, так как дает экономию во времени, играющую большое значение для принятия экстренных санитарно-эпидемических решений.
1. Enzyme nomenclature -1984, р. 313.
2. Номенклатура ферментов. Москва. 1979, с.148.
3. Erickson D.L., Jarrett C.O., Callison J.A., Fischer E.R., Hinnebusch B.J. Loss of a biofilm-inhibiting glycosyl hydrolase during the emergence of Yersinia pestis. J. Bacteriol., 2008, v. 190, N 24, p. 8163-8170.
4. Brubaker R.R. The recent emergence of plague: a process of felonious evolution. Microbial Evolution, 2004, v. 47, p. 293-299.






Способ дифференциации возбудителей чумы и псевдотуберкулеза по N-ацетил-β-D-глюкозаминидазной активности, включающий следующие стадии:
а) получение суспензии агаровой культуры исследуемых бактерий в концентрации (1-5)×10 9 м.к.;
б) подготовку синтетического субстрата; для этого в его качестве берут субстрат 4-метилумбеллиферил-N-ацетил-β-D-глюкозаминид в количестве 50 мкМ, который растворяют в 2 мл диметилформамида, затем из полученного раствора берут 0,6 мл и добавляют к нему 9,4 мл 0,1 М фосфатного буфера pH 7,4;
в) смешивание приготовленного субстрата в количестве 20 мкл с каплей 0,05 мл суспензии агаровой культуры бактерий в физиологическом растворе, помещенной в чашку Петри;
г) инкубирование полученной смеси при 37°C в течение 10-20 мин, после этого реакцию останавливают добавлением 5 мкл 10 н. раствора щелочи;
д) дифференцирование в УФ-лучах трансиллюминатора при 366 нм, при этом яркая флюоресценция голубого цвета свидетельствует о положительном результате реакции, которая проявляет N-ацетил-β-D-глюкозаминидазную активность и подтверждает, что исследуемый штамм гидролизует подготовленный субстрат, поэтому его идентифицируют как штамм Yersinia pseudotuberculosis, а отсутствие свечения подтверждает его принадлежность к штаммам Yersinia pestis.
Материал для исследования берется различный, но при всех клинических формах обязательно исследуются фекалии.
Бактериологический метод. Первичный посев исследуемого материала производят в консервант – фосфатный буфер или жидкую среду накопления, Серова. В глицериновом консерванте иерсинии гибнут. Посевы выдерживают в холодильнике до 30 суток, делая каждые 3-4 дня высевы на плотные среды, например Эндо, Серова. Выращивание производят при комнатной температуре. Подозрительные колонии пересевают на скошенный агар или на среду Эндо в сектора. Выделенную культуру идентифицируют по комплексу морфологических, культуральных, биохимических, серологических свойств, фаголизабельности. Обязательно дифференцируют от возбудителя чумы (Y.pestis) и от возбудителя кишечного иерсиниоза (см. табл. 10).
Биобактериологический метод. Для накопления иерсиний материалом заражают белых мышей или морских свинок с последующим выделением и идентификацией культуры.
Серологический метод. Применяется на 7-14 дни болезни. Ставится реакция агглютинации (титр 1:200) или в более ранние сроки – РПГА (титр 1:100) с набором эритроцитарных диагностикумов, несущих антигены разных типов иерсиний. Реакция ставится в динамике заболевания, регистрируется нарастание титра антител.
Дополнительно можно ставить экспресс-методы – РПГА для обнаружения возбудителя в материале или МИФ с этой же целью.
Дифференциация возбудителей псевдотуберкулеза
от возбудителей чумы
Рост на голодной среде
Мелкие, полиморфные, по цвету и величине
Подвижность при 18-22 0 С
Иммунитет после перенесенного заболевания нестойкий, возможны повторные случаи.
Профилактика неспецифическая, предупреждение загрязнения грызунами овощей и других продуктов.
Лечение – назначение антибиотиков с учетом чувствительности возбудителя.
Иерсиниоз, вызываемый Y.enterocolitica, представляет собой инфекционное заболевание из группы антропозоонозов с поражением желудочно-кишечного тракта, явлениями интоксикации и бактериемии, сходное с псевдотуберкулезом. В настоящее время рост заболеваемости кишечным иерсиниозом отмечается повсеместно.
Морфология. Сходная морфология с возбудителями чумы и псевдотуберкулеза. В отличие от Y.pseudotuberculosis подвижность у Y.enterocolitica сохраняется и при температуре 37 0 С.
Культуральные свойства такие же как и у Y.pseudotuberculosis.
Биохимические свойства хорошо выражены. Ферментируют до кислоты глюкозу, мальтозу, маннит, сахарозу, арабинозу, мочевину; не расщепляют лактозу, рамнозу, дульцит, декстрин, обладают каталазной активностью. По расщеплению трегалозы, салицина, эскулина и других углеводов описано 5 биоваров. Y.enterocolitica так же, как и возбудители псевдотуберкулеза, не обладают плазмокоагулирующей и фибринолитической и протеолитической активностью. Вызывают гемолиз эритроцитов человека и животных.
Антигенная структура: у Y.enterocolitica выявлены О- и Н- антигены. По О-антигену разделены на 30 сероваров. Кроме того, обнаружены антигены, родственные с другими иерсиниями, сальмонеллами, эшерихиями, протеем, холерным вибрионом, бруцеллами.
Токсинообразование. Возбудители кишечного иерсинеоза высвобождают при разрушении эндотоксин, связанный с ЛПС клеточной стенки и действующий энтеротропно. Они способны к внутриклеточному паразитированию.
Факторами патогенности являются адгезины к клеткам эпителия тонкого кишечника, инвазины, помогающие взаимодействию с эпителиальными клетками кишечника, термостабильный энтеротоксин, который стимулирует синтез гианилатциклазы.
Источник инфекции. В природе иерсинии выделяются от зайцев, среди которых эта инфекция очень распространена, от грызунов, гусей, диких уток, бобров, енотов, пресноводных рыб; от домашних животных – коров, овец, свиней, лошадей, собак, кошек. Есть наблюдения, что источником заболевания может быть и человек. Известны внутрисемейные вспышки кишечного иерсиниоза, вспышки в детских коллективах, больницах, когда прямой контакт с животными исключен.
Способы заражения: алиментарный, контактно-бытовой, особенно если источник инфекции человек. Восприимчивы к заболеванию люди от 4 месяцев до 80 лет. Заболевание регистрируется в течение всего года, но чаще осенью. Заражение происходит при употреблении овощных, мясных и других продуктов, особенно без термической обработки, контаминированных иерсиниями. Немаловажное значение имеет способность иерсиний сохраняться и размножаться при низких температурах.
Патогенез. Попав через рот и преодолев зищитный барьер желудка иерсинии, обладая адгезинами и пилями, внедряются в слизистую оболочку и лимфоидные образования терминального отдела тонкого кишечника, размножаются в пейеровых бляшках и мигрируют в брыжеечные лимфатические узлы. Из лимфы микроорганизмы проникают в кровь. Генерализация процесса сопровождается токсинемией и паренхиматозной диффузией, поражением суставов, что связано со способностью компонентов клеточной стенки взаимодействовать с молекулами II класса HLA, образуется суперантиген, который вызывает поликлональную активацию Т-клеток.
Клиническая картина разнообразная, в подавляющем большинстве случаев отмечается диарея, гепатолиенальный синдром. Преобладание той или иной симптоматики связывают с возрастом больного. Решающее значение придается лабораторным исследованиям. Постановка микробиологического диагноза проводится точно так же, как при псевдотуберкулезе. Материал для исследования берется различный, но обязательно исследованию подлежат фекалии. Выделенную культуру дифференцируют от возбудителя псевдотуберкулеза по следующим свойствам (см. табл. 11).
Профилактика – неспецифическая, предупреждение инфицирования из перечисленных выше источников.
Глава 26. Возбудитель чумы
Бактерии чумы открыты были Иерсеном в Гонконге в 1894 г. и в честь него весь род был назван иерсиниями. Большой вклад в изучение чумы внесли русские ученые Д. К. Заболотный, Н. К. Клодницкий, И. А. Лебединский, Н. Ф. Гамалея и индийские ученые, предложившие для лечения чумы стрептомицин.
К роду иерсиний относятся три вида бактерий:
1. Yersiniae pestis - возбудители чумы.
2. Yersiniae pseudotuberculosis - возбудители псевдотуберкулеза.
3. Yersiniae enterocolitica - возбудители кишечных инфекций.
Все представители этого рода грамотрицательные палочки, имеющие чаще овоидную форму и величину 0,4-0,7 × 1-2 мкм. Спор не образуют. У возбудителей псевдотуберкулеза и иерсиний энтероколитика имеются жгутики. Все иерсиний неприхотливы к питательным средам. Ферментативно они активны: расщепляют ряд углеводов с образованием кислоты.
Морфология. Возбудитель чумы - бвоидная палочка, средний размер 0,3-0,6 × 1-2 мкм. Они очень полиморфны. В мазках с плотной питательной среды палочки бывают удлиненными, нитевидными, описаны также фильтрующиеся формы. Бактерии чумы не имеют спор, жгутиков, образуют нежную капсулу. Грамотрицательны. Ввиду неравномерного распределения цитоплазмы концы палочек окрашиваются интенсивнее. Такая биполярность хорошо видна при окраске их метиленовым синим (рис. 46).
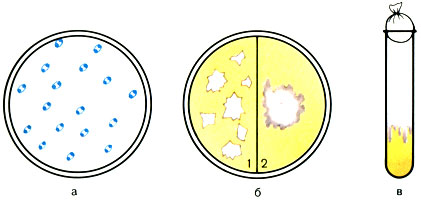
Рис. 46. Морфологические и культуральные свойства возбудителя чумы (Jersinia pestis). а - бактерии чумы (окраска синим Леффлера); б - рост на МПА: 1 - через 24 ч в виде битого стекла; 2 - через 48 ч в виде кружевного платочка; в - рост на МПБ - 'сталактитовый'
Культивирование. Возбудители чумы - факультативные анаэробы. Не прихотливы, растут на обычных питательных средах при температуре 28-30° С, рН среды 7,0-7,2. Рост появляется через 12-14 ч. Для ускорения роста применяют стимуляторы (экстракты некоторых бактерий, например сарцин, свежегемолизированную кровь, сульфит натрия и др.). Элективными средами для выращивания возбудителей чумы являются казеиновые среды и гидролизаты кровяных сгустков. Выросшие колонии через 18-24 ч инкубации имеют вид мелких глыбок с неровными краями, через 48 ч края колоний приобретают фестончатый вид и напоминают "кружевной платочек" (см. рис. 46).
На скошенном агаре культура растет в виде вязкого налета; на НПБ - в виде рыхлых хлопьев, взвешенных в прозрачной жидкости. При более длительном росте с поверхности среды спускаются рыхлые нити: "сталактитовый рост". Бактерии чумы растут в R-форме, которая является вирулентной. Однако они легко диссоциируют под влиянием ряда факторов, например бактериофага и через О-форму переходят в S-авирулентную форму.
Ферментативные свойства. У чумных бактерий выражена сахаролитическая активность - они расщепляют сахарозу, мальтозу, арабинозу, рамнозу, глюкозу (не всегда) и маннит с образованием кислоты. Различают два варианта бактерий чумы - разлагающие и не разлагающие глицерин. Протеолитические свойства выражены слабо: они не разжижают желатин, не свертывают молоко, образуют сероводород.
Бактерии чумы продуцируют фибринолизин, гемолизин, гиалуронидазу, коагулазу.
Токсинообразование. Токсин чумной палочки представляет собой особый белок, сочетающий свойства экзо- и эндотоксина, он состоит из двух белковых фракций (А и В), различающихся по аминокислотному составу и антигенным свойствам. Он очень токсичен для человека. Чумный токсин называют мышиный яд, так как мыши высоко чувствительны к его действию.
Антигенная структура бактерий чумы сложна. Микробы чумы содержат около десяти различных антигенов: фракции F, V, W и др. Фракция F - основной компонент, связанный с капсулой; V и W компоненты препятствуют фагоцитированию клетки. У бактерий чумы имеются общие антигены с возбудителем псевдотуберкулеза, эшерихиями, шигеллами и эритроцитами человека О-группы.
Устойчивость к факторам окружающей среды. Высокие температуры (100° С) губят чумные бактерии мгновенно, 80° С - через 5 мин. Низкие температуры чумные бактерии переносят хорошо: при 0° С сохраняются 6 мес, в замороженных трупах - год и больше. Прямые солнечные лучи убивают их через 2-3 ч. Чумные бактерии очень чувствительны к высыханию. В пищевых продуктах они сохраняются от 2 до 6 мес. В блохах - до года.
Обычные концентрации дезинфицирующих растворов убивают их через 5-10 мин. Особенно они чувствительны к сулеме и карболовой кислоте.
Восприимчивость животных. Основными носителями чумы являются грызуны: сурки, суслики, тарабаганы; они обусловливают природную очаговость чумы. Очень чувствительны к чуме серые и черные крысы, мыши; восприимчивы также верблюды, лисицы, кошки. К экспериментальному заражению чувствительны мыши, крысы, морские свинки и др.
Источники заражения. Больные животные, в основном грызуны. Эпидемии у людей часто предшествуют эпизоотии у грызунов.
Пути передачи и переносчики. 1. Основной путь передачи - трансмиссивный. Переносчики - блохи (грызуны → блохи → человек).
2. Воздушно-капельный путь (заражение человека от человека при легочной форме чумы).
3. Пищевой - при употреблении в пищу плохо проваренного зараженного мяса (этот путь бывает редко).
Патогенез и формы заболевания. Входными воротами являются кожа и слизистые оболочки дыхательных путей и пищеварительного тракта. Возбудители чумы обладают большой инвазивной способностью. На месте проникновения возбудителя образуются папулы, переходящие в пустулу с кровянисто-гнойным содержимым. В патологический процесс вовлекаются регионарные лимфатические узлы, через которые микробы проникают в кровь, вызывая бактерифмию. С кровью они попадают во внутренние органы.
В зависимости от места локализации у человека могут возникнуть разные формы заболевания: кожная, кожно-бубонная, кишечная, легочная, первично-септическая; каждая форма может закончиться сепсисом (вторичная септицемия). Наиболее часто возникает бубонная форма. Бубон болезнен. При попадании большой дозы возбудителя и малой разистентности организма может возникнуть первично-септическая форма. Заболевание начинается остро и протекает с явлениями интоксикации - высокой температурой, головной болью и т. д.
Иммунитет. Напряженный и продолжительный (в прошлые века в период больших эпидемий переболевших использовали для ухода за больными). Иммунитет обусловливается системой макрофагов. Большое значение имеет фагоцитарный фактор.
Профилактика. Общие мероприятия заключаются в ранней диагностике, изоляции больных. Установление карантина для людей, находившихся в контакте с больными. Проведение в очагах дезинсекции и дератизации. Защита медицинского персонала, находящегося в очагах, проводится введением стрептомицина и противочумной вакцины. Выполнение международных конвенций по профилактике чумы (дератизация и дезинфекция кораблей в портах). Охрана государственных границ.
Специфическая профилактика. В СССР применяют живую вакцину EV. Этот штамм был получен из вирулентной культуры путем последовательных пересевов возбудителя на питательные среды в течение 5 лет. Штамм потерял вирулентность, сохранив при этом иммуногенные свойства. Иммунитет длится около года. Вакцинируют только людей, которым угрожает опасность заражения.
Лечение. Стрептомицин, тетрациклин, специфический фаг и противочумный иммуноглобулин.
Большой вклад в изучение профилактики и лечения чумы внесли советские ученые М. П. Покровская и Н. Н. Жуков-Вережников.
1. К какой группе инфекций относится чума?
2. Как растет возбудитель чумы на плотных и жидких питательных средах? Какая форма является вирулентной - R или S?
3. Какой токсин образует возбудитель чумы и какие Вы знаете ферменты патогенности?
4. Кто является источником и переносчиком чумы?
5. Какие формы заболевания вызывает палочка чумы?
Цель исследования: выявление возбудителя чумы.
1. Отделяемое язвы или пунктат из карбункула - кожная форма.
2. Содержимое бубона - бубонная форма.
3. Мокрота - легочная форма.
4. Испражнения - кишечная форма.
5. Кровь - при всех формах.
6. На вскрытии берут кусочки органов трупа, кровь, костный мозг.
7. Блохи - содержимое кишечника.
8. Крысы, мыши и другие погибшие грызуны (и болеющие) - вскрывают, исследуют органы и кровь.

Способы сбора материала
4. Люминесцентно-серологический метод (см. главу 2).
Методы серодиагностики не нашли широкого применения.

Первый день исследования
Посев. Незагрязненный посторонней флорой материал засевают на плотные и жидкие питательные среды (МПА и МПБ) с прибавлением к ним стимуляторов: кровь, сульфит натрия и др. Стимуляция роста необходима, так как посевная доза может быть недостаточной. Материал, содержащий постороннюю флору (мокрота, содержимое открытых язв), засевают на среду Туманского или среду Коробковой. Эти среды содержат генциановый фиолетовый (1:50000), подавляющий рост посторонней флоры. Посевы инкубируют в термостате при 28° С.
Биологическая проба. Биопробу ставят на морских свинках и белых мышах. Метод введения исследуемого материала зависит от характера материала. Мокроту, гной из открытого абсцесса вводят путем втирания в кожу брюшной стенки (предварительно кожу эпилируют, обрабатывают стерильным изотоническим раствором натрия хлорида и скарифицируют). На скарифицированный участок наносят исследуемый материал, втирая его плоской частью скальпеля, под прикрытием специальной воронки или стеклянной крышки от чашки Петри. Незагрязненный материал (кровь, содержимое закрытого бубона) вводят животным подкожно или внутрибрюшинно. В зависимости от метода введения животное погибает на 3-9-й день.
Посевы вынимают из термостата. Изучают рост на плотной и жидкой питательной среде.
Из бульонной культуры при типичном росте делают мазки, окрашивают по Граму и метиленовым синим. Микроскопируют. Из плотной питательной среды при наличии типичных колоний выделяют чистую культуру и помещают в термостат. На 2-3 подозрительные в отношении возбудителя чумы колонии наносят чумный бактериофаг. Инкубируют в термостате. Через 10-12 ч колонии изменяются - лизируются. Лизис колоний под действием чумного бактериофага имеет диагностическое значение.
Вынимают из термостата пробирки с культурой на скошенном агаре. На поверхности агара чумная палочка образует вязкий серовато-белый налет. Выделенную культуру проверяют микроскопически. При наличии типичных палочек проверяют сахаролитические свойства посевом на сахара: глюкозу, мальтозу, сахарозу, рамнозу, маннит. Ставят пробу с бактериофагом.
Производят учет результатов: 1. Ферментативные свойства (табл. 42).
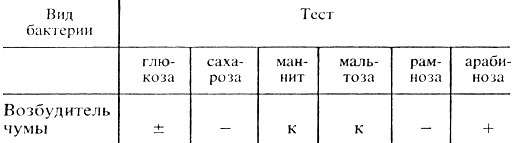
Таблица 42. Ферментативные свойства возбудителей чумы
Примечание. к - кислота; - отсутствие расщепления; ± не всегда расщепляет; + расщепление.
Проба с бактериофагом - лизис колоний.
Ускоренный метод пробы с бактериофагом. Исследуемый материал наносят на 3 чашки со средой Туманского.
1-я чашка - засевают вместе с чумным бактериофагом.
2-я чашка - засевают равномерным распределением материала по поверхности среды (шпателем), после чего делают дорожку из чумного бактериофага.
3-я чашка (контрольная) - засевают только исследуемым материалом. Посевы инкубируют при 28° С. Через 12-14 ч чашки вынимают из термостата.
При наличии в исследуемом материале возбудителя чумы отмечают:
в 1-й чашке - негативные колонии (лизис колоний чумы), во 2-й чашке - стерильную дорожку, в 3-й чашке - типичные колонии чумных бактерий.
Проводят дифференциацию чумных бактерий от бактерий псевдотуберкулеза (табл. 43).
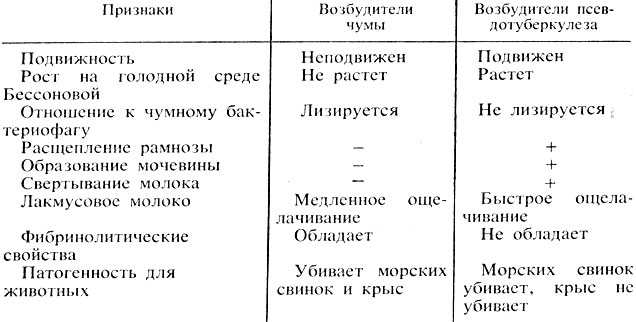
Таблица 43. Дифференциация возбудителей чумы и бактерий псевдотуберкулеза
Продолжают наблюдение за животными, зараженными в первый день исследования. Павших или убитых животных вскрывают. Изучают изменения в органах. Обычно у животных, павших от чумы, увеличены регионарные узлы, в органах - геморрагические и некротические участки. Печень и селезенка увеличены. При вскрытии из органов и крови делают мазки-отпечатки на специальные среды. Дальнейшее исследование ведут описанным выше способом.
1. Какой режим работы необходимо соблюдать при работе с возбудителями чумы?
2. Какие методы являются ведущими? В каких случаях следует прибавить в среду генциановый фиолетовый?
3. На каких животных ставят биопробу? Какие изменения обнаруживают у павших животных?
4. Как дифференцируют возбудителей чумы от бактерий псевдотуберкулеза?
Читайте также:


