Что такое чума по микробиологии
Глава 26. Возбудитель чумы
Бактерии чумы открыты были Иерсеном в Гонконге в 1894 г. и в честь него весь род был назван иерсиниями. Большой вклад в изучение чумы внесли русские ученые Д. К. Заболотный, Н. К. Клодницкий, И. А. Лебединский, Н. Ф. Гамалея и индийские ученые, предложившие для лечения чумы стрептомицин.
К роду иерсиний относятся три вида бактерий:
1. Yersiniae pestis - возбудители чумы.
2. Yersiniae pseudotuberculosis - возбудители псевдотуберкулеза.
3. Yersiniae enterocolitica - возбудители кишечных инфекций.
Все представители этого рода грамотрицательные палочки, имеющие чаще овоидную форму и величину 0,4-0,7 × 1-2 мкм. Спор не образуют. У возбудителей псевдотуберкулеза и иерсиний энтероколитика имеются жгутики. Все иерсиний неприхотливы к питательным средам. Ферментативно они активны: расщепляют ряд углеводов с образованием кислоты.
Морфология. Возбудитель чумы - бвоидная палочка, средний размер 0,3-0,6 × 1-2 мкм. Они очень полиморфны. В мазках с плотной питательной среды палочки бывают удлиненными, нитевидными, описаны также фильтрующиеся формы. Бактерии чумы не имеют спор, жгутиков, образуют нежную капсулу. Грамотрицательны. Ввиду неравномерного распределения цитоплазмы концы палочек окрашиваются интенсивнее. Такая биполярность хорошо видна при окраске их метиленовым синим (рис. 46).
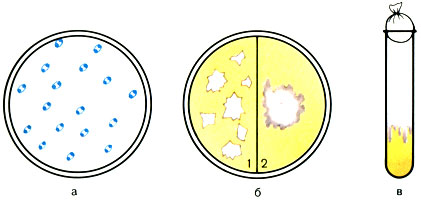
Рис. 46. Морфологические и культуральные свойства возбудителя чумы (Jersinia pestis). а - бактерии чумы (окраска синим Леффлера); б - рост на МПА: 1 - через 24 ч в виде битого стекла; 2 - через 48 ч в виде кружевного платочка; в - рост на МПБ - 'сталактитовый'
Культивирование. Возбудители чумы - факультативные анаэробы. Не прихотливы, растут на обычных питательных средах при температуре 28-30° С, рН среды 7,0-7,2. Рост появляется через 12-14 ч. Для ускорения роста применяют стимуляторы (экстракты некоторых бактерий, например сарцин, свежегемолизированную кровь, сульфит натрия и др.). Элективными средами для выращивания возбудителей чумы являются казеиновые среды и гидролизаты кровяных сгустков. Выросшие колонии через 18-24 ч инкубации имеют вид мелких глыбок с неровными краями, через 48 ч края колоний приобретают фестончатый вид и напоминают "кружевной платочек" (см. рис. 46).
На скошенном агаре культура растет в виде вязкого налета; на НПБ - в виде рыхлых хлопьев, взвешенных в прозрачной жидкости. При более длительном росте с поверхности среды спускаются рыхлые нити: "сталактитовый рост". Бактерии чумы растут в R-форме, которая является вирулентной. Однако они легко диссоциируют под влиянием ряда факторов, например бактериофага и через О-форму переходят в S-авирулентную форму.
Ферментативные свойства. У чумных бактерий выражена сахаролитическая активность - они расщепляют сахарозу, мальтозу, арабинозу, рамнозу, глюкозу (не всегда) и маннит с образованием кислоты. Различают два варианта бактерий чумы - разлагающие и не разлагающие глицерин. Протеолитические свойства выражены слабо: они не разжижают желатин, не свертывают молоко, образуют сероводород.
Бактерии чумы продуцируют фибринолизин, гемолизин, гиалуронидазу, коагулазу.
Токсинообразование. Токсин чумной палочки представляет собой особый белок, сочетающий свойства экзо- и эндотоксина, он состоит из двух белковых фракций (А и В), различающихся по аминокислотному составу и антигенным свойствам. Он очень токсичен для человека. Чумный токсин называют мышиный яд, так как мыши высоко чувствительны к его действию.
Антигенная структура бактерий чумы сложна. Микробы чумы содержат около десяти различных антигенов: фракции F, V, W и др. Фракция F - основной компонент, связанный с капсулой; V и W компоненты препятствуют фагоцитированию клетки. У бактерий чумы имеются общие антигены с возбудителем псевдотуберкулеза, эшерихиями, шигеллами и эритроцитами человека О-группы.
Устойчивость к факторам окружающей среды. Высокие температуры (100° С) губят чумные бактерии мгновенно, 80° С - через 5 мин. Низкие температуры чумные бактерии переносят хорошо: при 0° С сохраняются 6 мес, в замороженных трупах - год и больше. Прямые солнечные лучи убивают их через 2-3 ч. Чумные бактерии очень чувствительны к высыханию. В пищевых продуктах они сохраняются от 2 до 6 мес. В блохах - до года.
Обычные концентрации дезинфицирующих растворов убивают их через 5-10 мин. Особенно они чувствительны к сулеме и карболовой кислоте.
Восприимчивость животных. Основными носителями чумы являются грызуны: сурки, суслики, тарабаганы; они обусловливают природную очаговость чумы. Очень чувствительны к чуме серые и черные крысы, мыши; восприимчивы также верблюды, лисицы, кошки. К экспериментальному заражению чувствительны мыши, крысы, морские свинки и др.
Источники заражения. Больные животные, в основном грызуны. Эпидемии у людей часто предшествуют эпизоотии у грызунов.
Пути передачи и переносчики. 1. Основной путь передачи - трансмиссивный. Переносчики - блохи (грызуны → блохи → человек).
2. Воздушно-капельный путь (заражение человека от человека при легочной форме чумы).
3. Пищевой - при употреблении в пищу плохо проваренного зараженного мяса (этот путь бывает редко).
Патогенез и формы заболевания. Входными воротами являются кожа и слизистые оболочки дыхательных путей и пищеварительного тракта. Возбудители чумы обладают большой инвазивной способностью. На месте проникновения возбудителя образуются папулы, переходящие в пустулу с кровянисто-гнойным содержимым. В патологический процесс вовлекаются регионарные лимфатические узлы, через которые микробы проникают в кровь, вызывая бактерифмию. С кровью они попадают во внутренние органы.
В зависимости от места локализации у человека могут возникнуть разные формы заболевания: кожная, кожно-бубонная, кишечная, легочная, первично-септическая; каждая форма может закончиться сепсисом (вторичная септицемия). Наиболее часто возникает бубонная форма. Бубон болезнен. При попадании большой дозы возбудителя и малой разистентности организма может возникнуть первично-септическая форма. Заболевание начинается остро и протекает с явлениями интоксикации - высокой температурой, головной болью и т. д.
Иммунитет. Напряженный и продолжительный (в прошлые века в период больших эпидемий переболевших использовали для ухода за больными). Иммунитет обусловливается системой макрофагов. Большое значение имеет фагоцитарный фактор.
Профилактика. Общие мероприятия заключаются в ранней диагностике, изоляции больных. Установление карантина для людей, находившихся в контакте с больными. Проведение в очагах дезинсекции и дератизации. Защита медицинского персонала, находящегося в очагах, проводится введением стрептомицина и противочумной вакцины. Выполнение международных конвенций по профилактике чумы (дератизация и дезинфекция кораблей в портах). Охрана государственных границ.
Специфическая профилактика. В СССР применяют живую вакцину EV. Этот штамм был получен из вирулентной культуры путем последовательных пересевов возбудителя на питательные среды в течение 5 лет. Штамм потерял вирулентность, сохранив при этом иммуногенные свойства. Иммунитет длится около года. Вакцинируют только людей, которым угрожает опасность заражения.
Лечение. Стрептомицин, тетрациклин, специфический фаг и противочумный иммуноглобулин.
Большой вклад в изучение профилактики и лечения чумы внесли советские ученые М. П. Покровская и Н. Н. Жуков-Вережников.
1. К какой группе инфекций относится чума?
2. Как растет возбудитель чумы на плотных и жидких питательных средах? Какая форма является вирулентной - R или S?
3. Какой токсин образует возбудитель чумы и какие Вы знаете ферменты патогенности?
4. Кто является источником и переносчиком чумы?
5. Какие формы заболевания вызывает палочка чумы?
Цель исследования: выявление возбудителя чумы.
1. Отделяемое язвы или пунктат из карбункула - кожная форма.
2. Содержимое бубона - бубонная форма.
3. Мокрота - легочная форма.
4. Испражнения - кишечная форма.
5. Кровь - при всех формах.
6. На вскрытии берут кусочки органов трупа, кровь, костный мозг.
7. Блохи - содержимое кишечника.
8. Крысы, мыши и другие погибшие грызуны (и болеющие) - вскрывают, исследуют органы и кровь.

Способы сбора материала
4. Люминесцентно-серологический метод (см. главу 2).
Методы серодиагностики не нашли широкого применения.

Первый день исследования
Посев. Незагрязненный посторонней флорой материал засевают на плотные и жидкие питательные среды (МПА и МПБ) с прибавлением к ним стимуляторов: кровь, сульфит натрия и др. Стимуляция роста необходима, так как посевная доза может быть недостаточной. Материал, содержащий постороннюю флору (мокрота, содержимое открытых язв), засевают на среду Туманского или среду Коробковой. Эти среды содержат генциановый фиолетовый (1:50000), подавляющий рост посторонней флоры. Посевы инкубируют в термостате при 28° С.
Биологическая проба. Биопробу ставят на морских свинках и белых мышах. Метод введения исследуемого материала зависит от характера материала. Мокроту, гной из открытого абсцесса вводят путем втирания в кожу брюшной стенки (предварительно кожу эпилируют, обрабатывают стерильным изотоническим раствором натрия хлорида и скарифицируют). На скарифицированный участок наносят исследуемый материал, втирая его плоской частью скальпеля, под прикрытием специальной воронки или стеклянной крышки от чашки Петри. Незагрязненный материал (кровь, содержимое закрытого бубона) вводят животным подкожно или внутрибрюшинно. В зависимости от метода введения животное погибает на 3-9-й день.
Посевы вынимают из термостата. Изучают рост на плотной и жидкой питательной среде.
Из бульонной культуры при типичном росте делают мазки, окрашивают по Граму и метиленовым синим. Микроскопируют. Из плотной питательной среды при наличии типичных колоний выделяют чистую культуру и помещают в термостат. На 2-3 подозрительные в отношении возбудителя чумы колонии наносят чумный бактериофаг. Инкубируют в термостате. Через 10-12 ч колонии изменяются - лизируются. Лизис колоний под действием чумного бактериофага имеет диагностическое значение.
Вынимают из термостата пробирки с культурой на скошенном агаре. На поверхности агара чумная палочка образует вязкий серовато-белый налет. Выделенную культуру проверяют микроскопически. При наличии типичных палочек проверяют сахаролитические свойства посевом на сахара: глюкозу, мальтозу, сахарозу, рамнозу, маннит. Ставят пробу с бактериофагом.
Производят учет результатов: 1. Ферментативные свойства (табл. 42).
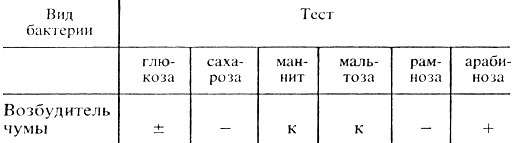
Таблица 42. Ферментативные свойства возбудителей чумы
Примечание. к - кислота; - отсутствие расщепления; ± не всегда расщепляет; + расщепление.
Проба с бактериофагом - лизис колоний.
Ускоренный метод пробы с бактериофагом. Исследуемый материал наносят на 3 чашки со средой Туманского.
1-я чашка - засевают вместе с чумным бактериофагом.
2-я чашка - засевают равномерным распределением материала по поверхности среды (шпателем), после чего делают дорожку из чумного бактериофага.
3-я чашка (контрольная) - засевают только исследуемым материалом. Посевы инкубируют при 28° С. Через 12-14 ч чашки вынимают из термостата.
При наличии в исследуемом материале возбудителя чумы отмечают:
в 1-й чашке - негативные колонии (лизис колоний чумы), во 2-й чашке - стерильную дорожку, в 3-й чашке - типичные колонии чумных бактерий.
Проводят дифференциацию чумных бактерий от бактерий псевдотуберкулеза (табл. 43).
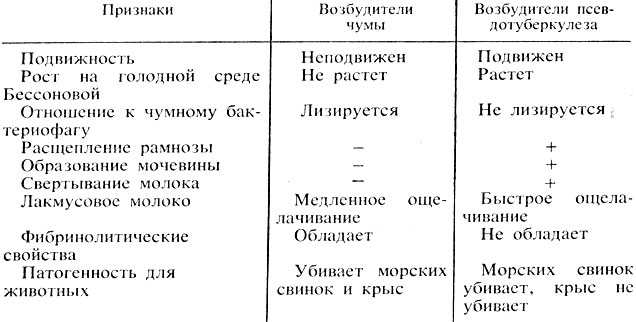
Таблица 43. Дифференциация возбудителей чумы и бактерий псевдотуберкулеза
Продолжают наблюдение за животными, зараженными в первый день исследования. Павших или убитых животных вскрывают. Изучают изменения в органах. Обычно у животных, павших от чумы, увеличены регионарные узлы, в органах - геморрагические и некротические участки. Печень и селезенка увеличены. При вскрытии из органов и крови делают мазки-отпечатки на специальные среды. Дальнейшее исследование ведут описанным выше способом.
1. Какой режим работы необходимо соблюдать при работе с возбудителями чумы?
2. Какие методы являются ведущими? В каких случаях следует прибавить в среду генциановый фиолетовый?
3. На каких животных ставят биопробу? Какие изменения обнаруживают у павших животных?
4. Как дифференцируют возбудителей чумы от бактерий псевдотуберкулеза?
Таксономия: Y.pestis вызывает чуму; отдел Gracilicutes, семейство Enterobacteriaceae, род Yersinia. Возбудитель – Yersinia pestis.
Морфологические свойства: грамотрицательные палочки, овоидной формы, окрашиваются биполярно. Подвижны, имеют капсулу, спор не образуют.
Факультативные анаэробы. Температурный оптимум +25С. Хорошо культивируются на простых питательных средах. Ферментируют большинство углеводов без образования газа. Психофилы - способны менять свой метаболизм в зависимости от температуры и размножаться при низких температурах. Вирулентные штаммы образуют шероховатые (R) колонии, переходные (RS) и сероватые слизистые гладкие авирулентные(S) формы.
Два типа колоний - молодые и зрелые. Молодые с неровными краями. Зрелые колонии крупные, с бурым зернистым центром и неровными краями. На скошенном агаре черед двое суток при +28 С образуют серовато - белый налет, врастающий в среду, на бульоне - нежную поверхностную пленку и хлопковидный осадок.
Биохимические свойства: фенментативная активнсть высокая: ферментация до кислоты ксилозу, синтез плазмокоагулазы, фибринолизина, гемолизина, лецитиназу, сероводород. Рамнозу, мочевину не ферментирует.
Группа белково - полисахаридных и липополисахаридных антигенов: термостабильный соматический О-антиген и термолабильный капсульный V,W антигены. С W-антигеном связывают вирулентность бактерий. Продуцирует факторы патогенности: фибринолизин, плазмокоагулазу, эндотоксин, экзотоксин, капсулу, V,W антигены.
Резистентность: чувствителен к антибиотикам (особенно стрептомицин), нестоек к окружающей среде при высокой температуре.
Обладает патогенным потенциалом, подавляет функции фагоцитарной системы, подавляет окислительный взрыв в фагоцитах и беспрепятственно в них размножается. Факторы патогенности контролируются плазмидами трех классов. В патогенезе выделяют три основных стадии - лимфогенного заноса, бактеремии, генерализованной септицемии. Имеют адгезины и инвазины, низкомолекулярные протеины (ингибируют бактерицидные факторы), энтеротоксин. Часть факторов контролируется плазмидами вирулентности.
Клинические особенности: Инкубационный период – несколько часов до 8 сут. Различают локальные – кожно-бубонная, бубонная; внешне-диссеминированные – первично-легочная, вторично-легочная и кишечная; генерализованная – первично-септическая, вторично-септическая формы чумы. Региональная лимфоаденопатия, энтероколиты, реактивные артриты, спондилит, лихорадка.
Эпидемиология: Чума - классический природноочаговый зооноз диких животных. Основные носители в природе - сурки, суслики, в городских условиях - крысы. В передаче возбудителя - блохи животных, способные заражать человека.
Иммунитет: клеточно-гуморальный, ограничен по длительности и напряженности.
Бактериоскопическое исследование. Из исследуемого материала готовят мазки, окрашивают по Граму и водным раствором метиленового синего. Бактерии чумы представляют собой грамотрицательные палочки овоидной формы Бактериологическое исследование. Исследуемый материал засевают на чашки с питательным агаром. Посевы инкубируют при 25С. Первичное изучение посевов производят через 10ч. К этому сроку появляются колонии, которые образованы вирулентными R-формами. Мало- и авирулентные бактерии формируют S-формы колоний. Идентификацию чистой культуры проводят по морфологии бактериальных клеток, характеру роста, антигенным и биохимическим свойствам, чувствительности к специфическому фагу и биопробе.
На бульоне бактерии образуют пленку; ферментируют многие сахара до кислоты, индола не образуют, желатин не разжижают. Содержат групповой термостабильный соматический антиген и специфический термолабильный капсульный антиген.
Биопроба. Проводится для выделения чистой культуры из материала, загрязненного посторонней микрофлорой. Наиболее чувствительными лабораторными животными являются морские свинки, которым материал вводят подкожно. Внутрибрюшинно материал вводят в том случае, если он не загрязнен другими бактериями. После гибели животных отмечают патологические изменения органов и проводят бактериологическое исследование
Экспресс-методы лабораторной диагностики:
1.Иммунофлюоресцентный метод позволяет обнаружить присутствие возбудителя как в патологическом материале, так и в объектах окружающей среды (вода, воздух), а также в пищевых продуктах и эктопаразитах. С этой целью используют люминесцентную видоспецифическую противочумную сыворотку, люминесцентные противокапсульную и противосоматическую сыворотку.
2.РПГА - для обнаружения антигенов бактерий в материале с помощью стандартной противочумной сыворотки, антитела которой нагружены на эритроциты.
Лечение: антибиотики –стрептомицин, препараты тетрациклинового ряда.
Профилактика: специфическая профилактика - живая ослабленная чумная вакцина EV. Имеется сухая таблетированная вакцина для перорального применения. Для оценки иммунитета к чуме (естественного постинфекционного и вакцинального) может применяться внутрикожная аллергическая проба с пестином.
Возбудитель антропозоонозной чумы — Yersinia pestis вызывает острую инфекционную болезнь, характеризующуюся тяжелой интоксикацией, поражением лимфатической системы, тенденцией к септицемии.
Чума — природно-очаговая болезнь, возбудитель которой в естественных условиях сохраняется благодаря циркуляции среди грызунов. Здоровых животных заражают переносчики болезни, в первую очередь блохи. Из сельскохозяйственных животных к чуме наиболее восприимчивы верблюды. Они заражаются в периоды интенсивных эпизоотий чумы грызунов и представляют опасный источник заражения людей.
Патогенность. Вирулентность различных штаммов возбудителя чумы неодинакова. Это относится и к штаммам, изолированным от животных и людей. Бактерия чумы выделена более чем от 160 видов грызунов. Этот микроб патогенен для верблюдов, ослов, кошек, шакалов, лисиц, хорьков и ласок, которые могут заразиться в естественных условиях и заболеть. Восприимчивы к микробу обезьяны и люди. В эксперименте удается заразить белых мышей, крыс, морских свинок, кроликов, сурков, песчанок, ондатр, водяных крыс и др. Морские свинки и белые мыши проявляют значительную инфекционную чувствительность к чуме и поэтому их используют для биопроб. Возбудитель чумы вырабатывает токсические вещества типа эндо- и экзотоксинов; в составе экзотоксина обнаружены ферменты патогенности — фибринолизин и гиалуронидаза.
Устойчивость. Возбудитель чумы хорошо переносит низкие температуры, при 0 °С не погибает в течение 6 мес, на одежде остается живым 5—6 мес, в стерильной почве и в молоке — 90 сут, на зерне и в трупах — 50, в воде — 30, в гное из бубонов — 20—30, в мокроте — 10, на овощах и фруктах — 6— 11 ,в хлебе — 4 сут. У бактерий чумы выявлены штаммы, резистентные одновременно к четырем антибиотикам.
Возбудитель чумы очень чувствителен к высыханию и высокой температуре, кипячение убивает его в течение 1 мин, нагревание до 60 °С — за 1 ч; от действия 5%-го раствора фенола он погибает через 5—10 мин, 5%-го раствора лизола — через 2—10 мин.
Антигенная структура. У этого микроба выделено около десяти антигенов. Важнейшими из них являются оболочечный, или капсульный, термолабильный белок и О-антиген, представляющий соматический термостабильный полисахарид. Оба антигена иммуногенны. У бактерий вирулентных штаммов субстратом вирулентности является антигенная система. Антиген V — белок клеточной стенки, У — антиген липопротеин, выделяемый в процессе роста в среду. Существует специфический чумной бактериофаг, применяемый для индикации микроба.
Иммунитет. После перенесения болезни вырабатывается стойкий и длительный иммунитет. В глубокой древности народы разных стран, где наблюдалась чума, знали об этом и использовали переболевших людей для ухода за больными и для захоронения трупов.
Иммунитет обусловлен преимущественно фагоцитарной активностью клеток лимфоидно-макрофагальной системы. Существенную роль в индуцировании иммунитета играет протективный антиген, который служит основой для приготовления химических противочумных вакцин.
Патогенез заболевания у человека. Возбудитель чумы проникает в организм человека через поврежденную кожу (иногда слизистые оболочки) при работе с заразным материалом, снятии шкур с грызунов. При легочной форме болезни бактерии чумы передаются воздушно-капельным путем с мокротой при кашле и разговоре больного человека.
Инкубационный период при чуме длится 3—6 сут, иногда несколько часов, в ряде случаев до 8-9 сут.
В зависимости от места локализации возбудителя, реактивности организма, вирулентности микроба, степени клеточного и гуморального иммунитета у человека могут наблюдаться кожная, бубонная, кишечная, первично-септическая, вторично-септическая, первичнолегочная, вторично-легочная формы чумы.
Начинается чума внезапно, без продромального периода: появляются потрясающий озноб, сильная головная боль и головокружение; лицо становится бледным, с синюшным оттенком и выражением страдания (ужаса) — fadespestica. Каждой форме чумы присущи специфические клинические признаки. Летальность до появления стрептомицина была очень высокой (40—100%).
Полный текст:
Демидова Галина Викторовна - кандидат биологических наук.
344002, Ростов-на-Дону, ул. М. Горького, 117/40, р.т. (863)240-27-03
1. Андрюков Б.Г, Сомова А.М., Тимченко Н.Ф. Исследование температурозависимых молекулярных механизмов развития инфекций — ключ к созданию современных профилактических средств. СТМ. 2016, 8(3):137-150.
3. Бывалов А.А., Оводов Ю.С. Иммунобиологические свойства антигенов Yersinia pestis. Биоорганическая химия. 2011, 37(4):452-463.
4. Гремякова Т. А. Структурно-функциональная вариабельность антигенов Yersinia pestis и методология конструирования противочумных иммунопрофилактических препаратов. Автореф. дисс. докт. мед. наук. Оболенск, 2003.
5. Демидова Г.В., Зюзина В.П., Соколова Е.П., Пасюкова Н.И., Беспалова И.А., Бородина ТН., Тынянова В.И. Токсичность различных форм липополисахаридов Y. pestis для белых мышей, сенсибилизированных Д-галактозамином. Проблемы особо опасных инфекций. 2014, 4:75-77.
6. Демидова Г.В., Соколова Е.П., Зюзина В.П., Рыкова В.А., Морозова И.В., Подладчикова О.Н., Тынянова В.И. Влияние внехромосомных элементов наследственности на токсические свойства Yersinia pestis. Журн. микробиол. 2017, 2:28-33.
7. Дмитровский А. М. Токсический компонент патогенеза чумного инфекционного процесса: инфекционно-токсический шок. Профилактика и меры борьбы с чумой. Алматы, 1994.
8. Домарадский И.В. Очерки патогенеза чумы М., Медицина, 1966.
9. Евсеева В. В. Платонов М. Е., Копылов П. Х., Дентовская С. В., Анисимов А. П. Активатор плазминогена чумного микроба. Инфекция и иммунитет. 2015, 5(1):27-36.
10. Желтенков А. И. О токсине чумного микроба и антитоксических противочумных сыворотках. Журн. микробиол. 1946, 3:81-82.
11. Зюзина В.П., Демидова Г.В., Соколова Е.П., Рыкова В.А., Бородина Т.Н., Подладчикова О.Н., Тынянова В.И. Роль резидентных плазмид в проявлении токсических свойств липополисахарида чумного микроба. В: Обмен веществ при адаптации и повреждении. Дни молекулярной медицины на Дону. Ростов-на-Дону, РостГМУ. 2016:20-24.
13. Кадникова Л. А., Копылов П. Х., Дентовская С. В., Анисимов А. П. Капсульный антиген чумного микроба. Инфекция и иммунитет. 2015, 5(3):201-218.
14. Кравцов А. Н. Тынянова В. И., Зюзина В. Повышение вирулентности бактерий Yersinia pestis при инкубации клеток в гемолизированных эритроцитах крови человека. Журн. микробиол. 1993, 4:3-6.
15. Подладчикова О.Н. Современные представления о молекулярных механизмах патогенеза чумы. Проблемы особо опасных инфекций. 2017, 3:33-40.
16. Рыжко И. В., Мишанькин М. Б., Тынянова В. И., Цураева Р. И., Молдован И.А. Способ прогнозирования клинической эффективности антибактериальных, вакцинных препаратов, средств пассивной антитоксической иммунотерапии на модели инфекционно-токсической формы чумы у мышей. Патент № 2303821 от 27.07.2007.
17. Соколова Е. П., Марченков В. И., Демидова Г. В., Зюзина В.П., Беспалова И.А., Павлович Н.В., Еременко Н.С., Веркина Л.М., Тынянова В.И. Комплексы “мышиного” токсина чумного микроба с модифицированными формами липополисахарида Yersinia pestis и с липополисахаридами других бактерий. Биотехнология. 2001, 4:53-58.
18. Соколова Е. П. Механизмы активации токсических субстанций чумного микроба. Автореф. дис. канд. биол. наук. Ростов-на-Дону, 2002.
19. Соколова Е.П., Зюзина В.П., Демидова ГВ., Подладчикова О.Н., Рыкова В.А., Тынянова В.И. Роль резидентных плазмид рМТ1, рCD1, pPCP1 Yersinia pestis в образовании экстрацеллюляр-ной формы липополисахарида. Проблемы особо опасных инфекций. 2017, 3:85-89.
20. Тынянова В.И., Демидова Г.В., Зюзина В.П., Плетницкий А.Э., Подладчикова О.Н., Гончаров Е.К., Кубанцева Е.П., Беспалова И.А. Влияние биологически активного вещества, усиливающего токсичность чумного микроба, на физико-химические свойства его капсульной субстанции. Биотехнология. 1996, 8:26-30.
21. Тынянова В.И., Демидова ГВ., Зюзина В.П., Анисимов Б.И., Плетницкий А.Э. Гликолипид — биоактиватор токсических субстанций чумного микроба. Биотехнология. 1999, 2:28-33.
22. Тынянова В.И., Зюзина В.П., Демидова ГВ., Соколова Е.П. Специфичность иммуномодулирующего действия эндотоксина чумного микроба. Журн. микробиол. 2016, 3:104-112.
23. Ценева Г.Я., Солодовникова Н.Ю., Воскресенская Е.В. Молекулярные аспекты вирулентности иерсиний. Клиническая микробиология и антимикробная химиотерапия. 2002, 4(3):248-266.
24. Andrews G.P., Heath D.G., Anderson G.W. et al. Fraction I capsular antigen (FI) purificationfrom Yersinia pestis CO92 and from an Escherichia coli recombinant strain and efficacy against lethal plague challenge. Infect. Immun. 1996, 64(6):2180-2187.
25. Botos I., Majdalani N., McCarthy J.G. et al. Structural and functional characterization of the LPS transporter LptDE from gram-negative pathogens. Structure. 2016, 24(6):965-976.
26. Brubaker R.R. Physiology of Yersinia pestis. Adv. Exp. Med. Biol. 2016, 918:79-99.
27. Dewoody R.S., Merritt P.M., Marketon M.M. Regulation of the Yersinia type III secretion system: traffic control. Front. Cell. Infect. Microbiol. 2013, 6, 3:4. doi: 10.3389.
28. Dodd D.C., Eisenstein B.I. Dependence of secretion and assembly of type I fimbrial subunits of Echerichia coli on normal protein export. J. Bacteriol. 1984, 159(3):1077-1079.
29. Eddy J., Gielda L., Caulfield A. et al. Production of outer membrane vesicles by the plague pathogen Yersinia pestis. PLoS One. 2014, 9 (9): e107002.
30. Edgren T., Forsberg A., Rosqvist R., Wolf-Watz H. Type III secretion in Yersinia: injectisome or not. PLoS Pathog. 2012, 8 (5): e1002669.
31. Eren E., van den Berg B. Structural basis for activation of an integral membrane protease by lipopolysaccharide. J. Biol. Chem. 2012, 8:23971-23976.
32. Galanos C., Freudenberg M. A., Reuter W Galactosamine-induced sensitization to the lethal effects of endotoxin. Proc. Natl. Acad. Sci USA. 1979, 76:5939-5943.
33. HanY., Fang H., Liu L., Zhou D. Genetic regulation of Yersinia pestis. Adv. Exp. Med. Biol. 2016, 918:233-256.
34. Huang H.Z., Nicolich M., Linder L. Current trends in plague research: from genomics to virulence. Clin. Med. Res. 2006, 4(3):1189-1199.
35. Kawahara K., Tsukano H., Watanabe H. et al. Modification of the structure and activity of lipid A in Yersinia pestis lipopolysaccharide by growth temperature. Infect. Immun. 2002, 70(8):4092-4098.
36. Ke Y., Chen Z., Yang R. Yersinia pestis: mechanisms of entry into and resistance to the host cell. Front. Cell. Infect. Microbiol. 2013, Dec; 24(3):106.
37. Knirel Y.A., Linder B., Vinogradov E.V. et al. Temperature dependent variations and intraspecies diversity of the structure of the lipopolysaccharides of Yersinia pestis. Biochemistry. 2005, 44:1731-1743.
38. Knirel Y.A., Anisimov A.P. Lipopolisaccharide of Yersinia pestis, the cause of plague: structure, genetics, biological properties. Acta Naturae. 2012, 4(3):46 — 58.
39. Liu L., Fang H., Yang H. et al. Reciprocal regulation of Yersinia pestis biofilm formation and virulence by RovM and Rov A. Open Biol. 2016, 6 (3).pii:150198.
40. Matsuura M., Takahashi H., Watanabe H. et al. Immunomodulatory properties of Yersinia pestis lipopolysaccharides on human macrophages. Clin. Vaccine Immunol. 2010, 17(1):49-55.
41. Matsuura M. Structural Modifications of bacterial lipopolysaccharide that facilitate gram-negative bacteria evasion of host innate immunity. Front. Immunol. 2013, 4:109-113.
42. Montminy S., Khan N., McGrath S.et al. Virulence factors of Yersinia pestis are overcome by a strong lipopolysaccharide response. J. Nature Immun. 2006, 7(10):1066-1073.
43. Munford R. Endotoxemia—menace, marker, or mistake? J. Leukoc Biol. 2016 Oct; 100(4):687-698.
44. Pha K., Navarro L. Yersinia type III effectors perturb host innate immune responses. World J. Biol. Chem. 2016, 7(1):1-13.
45. Runco L.M., Myrczek S., Bliska J.B., Thanassi D.G. Biogenesis of the FI capsule and analysis of tye ultrastructure of Yersinia pestis. J. Bacteriol. 2008, 190 (90):3391-3385.
46. Schneewind O. Classic sportlight: Studies on the low-calcium response of Yersinia pestis reveal the secrets of plague pathogenesis. J. Bacteriol. 2016, 198(15):2018.
47. Suomalainen M., Lobo L., Brandenburg K. et al. Temperature-induced changes in the lipopolysaccharide of Yersinia pestis affect plasminogen activation by the Pla surface protease. Infect. Immun. 2010, 78(6):2644-2652.
48. Straus D.C., Atkisson D.L., Garner C.W. Importance of a lipopolysaccharide-containing extracellular toxic complex in infections produced by Klebsiella pneumoniae. Infection Immun. 1985, 50(3):787-795.
49. Une T, Brubaker R. Roles of V antigen in promoting virulence and immunity in Yersinia. J. Immunol. 1984, 133:2226-2230.
50. Yang H., Wang T, Tian G. et al. Host transcriptomic responses to pneumonic plague reveal that Yersinia pestis inhibits both the initial adaptive and innate immune responses in mice. Int. J. Med. Microbiol. 2017, 307 (1):64-74.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Читайте также:


