Внутрибольничные инфекции особенности лабораторной диагностики
- Вебинар
- 17.04.2020
- 12:00
- stream.rosminzdrav.ru/live/prior
- Лекция
- 23.04.2020
- конференц-зал Большой бульвар, 46, стр.1
Департамент здравоохранения города Москвы информирует, что 7-8 апреля 2010 г. в конференц-залах здания Правительства Москвы (ул. Новый Арбат, 36\9) состоится VIII научно-практическая конференция "Внутрибольничные инфекции в стационарах различного профиля, профилактика, лечение осложнений".
Программа мероприятия:
Уважаемые коллеги!
Цель конференции: информирование специалистов отрасли о состоянии проблемы с внутрибольничными инфекциями в стационарах мегаполиса, о современных методах профилактики и борьбы с внутрибольничными инфекциями, внедрение современных медицинских технологий в клиническую практику.
Основные тематические направления конференции:
- проблемы госпитальных инфекций на современном этапе
- организация и проведение мероприятий по выявлению, учету, регистрации и профилактики ВБИ в разных типах учреждений здравоохранения (акушерские, хирургические, урологические, отделения реанимации и интенсивной терапии, стоматологические учреждения и др.)
- внутрибольничные инфекции различной локализации (инфекции, связанные с внутрисосудистыми устройствами (катетер-ассоциированные); инфекции органов дыхания и др.)
- инфекционный контроль по выявлению, учету, регистрации и профилактики ВБИ
- мониторинг возбудителей ВБИ, циркулирующих в учреждениях
- инфекционная безопасность медицинских работников на всех этапах оказания медицинской помощи
- особенности эпидемиологии нозокомиальных инфекций в лпу различного профиля
- современные средства дезинфекции, стерилизации и их использование в ЛПУ
- инновационные технологии дезинфекции и стерилизации
- подходы к выбору средств дезинфекции в ЛПУ, профилактическая дезинфекция
- стерилизационные мероприятия, критерии и выбор стерилизационного оборудования
- контроль процессов стерилизации, индикаторы стерильности
- предстерилизационная очистка инструментов, проблема предстерилизационной очистки инструментов при малоинвазивных операциях
- проблема устойчивости к дезинфектантам и пути ее решения
- микробиологическая диагностика госпитальных инфекций
- лабораторная диагностика внутрибольничных инфекций, возможности бактериологической диагностики
- профилактика внутрибольничных инфекций в учреждениях здравоохранения, современные методы
- профилактика инфекционных заболеваний при инструментальных методах исследования
- антимикробная терапия нозокомиальных инфекций, антибиотикорезистентность госпитальных патогенов
- обеззараживание воздуха помещений
- новое в санитарной обработки поверхностей в лпу
- обработка рук медицинского персонала, как один из факторов неспецифической профилактика ВБИ, современные методы гигиены и защиты
- уборка в учреждениях здравоохранения, профессиональный подход
Докладчики и аудитория:
В работе конференции примут участие руководители и врачи учреждений здравоохранения Москвы, Московской области и других регионов. Возглавят заседания и выступят с докладами главные специалисты и врачи учреждений Департамента здравоохранения города Москвы, Минздравсоцразвития РФ, руководители кафедр и медицинских центров, ведущие ученые и практики.
Выставочная экспозиция: В рамках конференции организуется тематическая выставочная экспозиция производителей и дистрибьюторов:
- современных средств дезинфекции и стерилизации
- кожных антисептиков
- антибиотиков, антимикробных препаратов
- индикаторов контроля параметров процесса стерилизации, контроля концентраций растворов дезсредств
- стерилизационных упаковочных материалов
- современных расходных материалов для дезинфекции и стерилизации
- моющих средств
- стерилизационного оборудования, автоклавов, сухожаровых шкафов, дистилляторов, моечно-дезинфекционных машин
- машинок для упаковки инструмента
- ультразвуковых моек
- камер для стерильного хранения инструмента
- УФ-обеззараживателей воздуха и поверхностей в помещении
- установок для обеззараживания воздуха
- одноразовых медицинских материалов
- асептических материалов и одноразового белья для операционных
- приборов и реактивов для клинической лабораторной диагностики инфекционных заболеваний
Адрес: г. Москва, ул. Новый Арбат, д. 36/9 (Проезд до ст. метро Краснопресненская, Смоленская (Филевской линии), Арбатская (Арбатско-Покровской линии)).
Время проведения: 7 - 8 апреля 2010г. с 9.00 до 18.00 (Посещение бесплатное, вход по пригласительным билетам).
Приглашаем Вас принять участие в работе конференции и выставки.
Основные возбудители бактериальных инфекций — стафилококки, пневмококки, грамотрицательные эягеробактерии, псевдомонады и анаэробы. Ведущую роль играют стафилококки (до 60% всех случаев ВБИ), грамотрицательные бактерии, респираторные вирусы и грибы рода Candida.
• Штаммы бактерий, выделенные от пациентов с нозокомиальными внутрибольничными инфекциями, как правило, более вирулентны и обладают множественной химиорезистентностью. Широкое использование антибиотиков с лечебной и профилактической целями лишь частично подавляет рост устойчивых бактерий и приводит к селекции устойчивых штаммов.
• Факторы, предрасполагающие к развитию внутрибольничных инфекций, многообразны.
19. Возбудитель сибирской язвы. Свойства. Заболевания у человека. Лабораторная диагностика. Иммунитет, специфическая профилактика и терапия. Эпидемиология.
Сибирская язва - острая антропонозная инфекционная болезнь, вызываемая Bacillus anthracis, характеризуется тяжелой интоксикацией, поражением кожи, лимфатических узлов.
Таксономия. Возбудитель относится к отделу Firmicutes, роду Bacillus.
Морфологические свойства. Очень крупные грамположительные палочки с обрубленными концами, в мазке из чистой культуры располагаются короткими цепочками (стрептобациллы). Неподвижны; образуют расположенные центрально споры, а также капсулу.
Культуральные свойства. Аэробы. Хорошо растут на простых питательных средах в диапазоне температур 10—40С, температурный оптимум роста 35С. На жидких средах дают придонный рост; на плотных средах образуют крупные, с неровными краями, шероховатые матовые колонии (R-форма). На средах, содержащих пенициллин, через 3ч роста сибиреязвенные бациллы образуют сферопласты, расположенные цепочкой и напоминающие в мазке жемчужное ожерелье.
Биохимические свойства. Ферментативная активность достаточно высока: возбудители ферментируют до кислоты глюкозу, сахарозу, мальтозу, крахмал, инулин; обладают протеолитической и липолитической активностью. Выделяют желатиназу, обладают слабой гемолитической, лецитиназной и фосфатазной активностью.
Выделяют желатиназу, проявляют низкую гемолитическую, лецитиназную и фосфатазную активность.
Антигены и факторы патогенности. Содержат родовой соматический полисахаридный и видовой белковый капсульный антигены. Образуют белковый экзотоксин, обладающий антигенными свойствами и состоящий из нескольких компонентов (летальный, протективный и вызывающий отеки). Вирулентные штаммы в восприимчивом организме синтезируют сложный экзотоксин и большое количество капсульного вещества с выраженной антифагоцитарной активностью.
Резистентность. Вегетативная форма неустойчива к факторам окружающей среды, споры чрезвычайно устойчивы и сохраняются в окружающей среде, выдерживают кипячение. Чувствительны к пенициллину и другим антибиотикам; споры устойчивы к антисептикам.
Эпидемиология и патогенез. Источник инфекции — больные животные, чаще крупный рогатый скот, овцы, свиньи. Человек заражается в основном контактным путем, реже алиментарно, при уходе за больными животными, переработке животного сырья, употреблении мяса. Входными воротами инфекции в большинстве случаев являются поврежденная кожа, значительно реже слизистые оболочки дыхательных путей и желудочно-кишечного тракта. В основе патогенеза лежит действие экзотоксина, который вызывает коагуляцию белков, отек тканей, приводят к развитию токсико-инфекционного шока.
Клиника. Различают кожную, легочную и кишечную формы сибирской язвы. При кожной (локализованной) форме на месте внедрения возбудителя появляется характерный сибиреязвенный карбункул, сопровождается отеком. Легочная и кишечная формы относятся к генерализованным формам и выражаются геморрагическим и некротическим поражением соответствующих органов.
Иммунитет. После перенесенной болезни развивается стойкий клеточно-гуморальный иммунитет.
Наиболее достоверным методом лабораторной диагностики сибирской язвы является выделение из исследуемого материала культуры возбудителя. Диагностическую ценность представляют также реакция термопреципитации по Асколи и кожно-аллергическая проба.
Бактериоскопическое исследование. Изучение окрашенных по Граму мазков из патологического материала позволяет обнаружить возбудителя, представляющего собой грамположительную крупную неподвижную стрептобациллу. В организме больных и на белковой питательной среде микроорганизмы образуют капсулу, в почве— споры.
Бактериологическое исследование. Исследуемый материал засевают на чашки с питательным и кровяным агаром, а также в пробирку с питательным бульоном. Посевы инкубируют при 37С в течение 18ч. В бульоне В. anthracis растет в виде хлопьевидного осадка; на агаре вирулентные штаммы образуют колонии R-формы. Авирулентные или слабовирулентные бактерии образуют S-формы колоний.
Биопроба. Исследуемый материал вводят подкожно морским свинкам кроликам. Готовят мазки из крови и внутренних органов, делают посевы для выделения чистой культуры возбудителя.
Экспресс-диагностика проводится с помощью реакции термопреципитации по Асколи и иммунофлюоресцентного метода.
Реакцию Асколи ставят при необходимости диагностировать сибирскую язву у павших животных или у умерших людей. Образцы исследуемого материала измельчают и кипятят в пробирке с изотоническим раствором хлорида натрия в течение 10 мин, после чего фильтруют до полной прозрачности.
Метод иммунофлюоресценции позволяет выявить капсульные формы В. anthracis в экссудате. Мазки из экссудата через 5—18 ч после заражения животного обрабатывают капсульной сибиреязвенной антисывороткой, а затем флюоресцирующей антикроличьей сывороткой. В препаратах, содержащих капсульные бациллы, наблюдается желто-зеленое свечение возбудителя.
Кожно-аллергическая проба. Ставится на внутренней поверхности предплечья — внутрикожно вводят 0,1 мл антраксина. При положительной реакции через 24 ч появляются гиперемия и инфильтрат.
Лечение: антибиотики и сибиреязвенный иммуноглобулин. Для антибактериальной терапии препарат выбора – пенициллин.
Профилактика. Для специфической профилактики используют живую сибиреязвенную вакцину. Для экстренной профилактики назначают сибиреязвенный иммуноглобулин.
Преципитирующая сибиреязвенная сыворотка. Получена из крови кролика, гипериммунизированного культурой В. anthracis. Применяется для постановки реакции термопреципитации по Асколи.
Сибиреязвенная живая вакцина СТИ. Высушенную взвесь живых спор В. anthracis авирулентного бескапсульного штамма. Применяется для профилактики сибирской язвы.
Противосибиреязвенный иммуноглобулин. Гамма-глобулиновая фракция сыворотки крови лошади, гипериммунизированной живой сибиреязвенной вакциной и вирулентным штаммом В.anthracis, используется с профилактической и лечебной целью.
На тему: Возбудители внутрибольничных инфекций. Особенности лабораторной диагностики.
Выполнил: Шмонин В.М.
Алматы, 2015 г.
Возбудители внутрибольничных инфекций.
Группы возбудителей внутрибольничных инфекций.
Методы лабораторной диагностики ВБИ.
Основные принципы лабораторной диагностики ВБИ.
Методы лабораторной диагностики.
Возбудители внутрибольничных инфекций. Группы возбудителей внутрибольничных инфекций.
Примерно 90% всех внутрибольничных инфекций имеют бактериальное происхождение. Вирусы, грибы и простейшие, а также эктопаразиты встречаются значительно реже. Попытка суммировать представления о микробной этиологии ВБИ не отражает всего многообразия и сложности их этиологической структуры. Некоторые из микроорганизмов (например, стафилококки, эшерихии, клебсиеллы, синегнойная палочка и др.) вызывают разные клинические формы ВБИ, другие выделяются только при определенных клинических состояниях (анаэробные микроорганизмы, например, встречаются преимущественно как возбудители ВБИ при глубоких инфекциях мягких тканей или при интраабдоминальных хирургических инфекциях). Некоторые возбудители поражают преимущественно определенные группы пациентов (парвовирус В19, вирусы кори, краснухи, ветряной оспы и эпидемического паротита в педиатрической практике; хламидии, микоплазмы, стрептококки группы В у новорожденных и родильниц и т. п.). Различия в экологических свойствах возбудителей ВБИ, среди которых присутствуют все возможные варианты (от облигатных внутриклеточных паразитов до свободноживущих микроорганизмов), также могут быть весьма существенными, определяя, в свою очередь, соответствующие особенности механизма развития эпидемического процесса в ЛПУ.
В таблице представлена группировка возбудителей внутрибольничных инфекций, в основе которой лежат эпидемиологические аспекты. Эта группировка отнюдь не претендует на право классификации возбудителей ВБИ, однако для эпидемиологов является полезной.
Первая группа возбудителей внутрибольничных инфекций — патогенные агенты — возбудители традиционных инфекций, не имеют в госпитальных условиях специфических черт. Они получают, как правило, большее распространение в стационарах в связи с высокой концентрацией и тесным общением в лечебном учреждении госпитализированных больных. Не исключено, что в какой-то степени сказывается и пониженная общая резистентность организма. Вторая подгруппа среди патогенных микроорганизмов также отражает интенсификацию в больницах процессов, которые могут быть и вне лечебного учреждения. Но в данном случае речь идет об интенсификации ятрогенного действия — медицинских вмешательств. В связи с тем, что госпитальный процесс является кратковременным эпизодом в циркуляции этих возбудителей, формирование вирулентных штаммов, опасных для госпитальных больных, не успевает произойти.
Группировка возбудителей внутрибольничных инфекций с учетом эпидемиологических данных 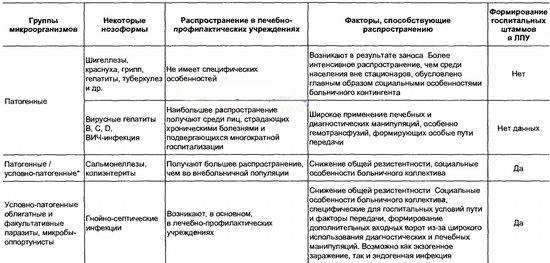
Вторая группа возбудителей внутрибольничных инфекций — это облигатные паразиты, но их патогенность более всего проявляется в госпитальных условиях. Разбираемая группа микроорганизмов вызывает заболевания, которые, в основном, регистрируются среди больничных контингентов. Связано это в первую очередь с пониженной сопротивляемостью организма госпитализированных больных и в определенной степени — с реализацией путей передачи, которые имеют определенный специфический характер. В таких условиях возможно формирование госпитальных штаммов.
Но наиболее специфична для стационаров третья группа возбудителей внутрибольничных инфекций — условно-патогенные микроорганизмы (УПМ), Возникновение и распространение заболеваний, вызванных УПМ, целиком и полностью определяются причинами, которые действуют лишь в госпитальных условиях.
Уже упоминалось, что условно-патогенные микроорганизмы могут вызвать сходные заболевания и по характеру патологического процесса, и по локализации. Однако это совсем не значит, что у них не проявляются определенные специфические характеристики.
Среди специалистов бытовало мнение, что имеет место смена возбудителей (УПМ) внутрибольничных инфекций. Утверждалось, что на смену золотистому стафилококку пришла синегнойная палочка и т. д. Однако современные данные показывают, что речь идет не о закономерной смене возбудителей ВБИ, а их способности существовать в условиях медицинских отделений, специализирующихся на лечении больных с определенной патологией.
Так, в хирургических стационарах общего профиля доминирует кишечная палочка, в урологических — кишечная палочка, протеи, синегнойная палочка, клебсиеллы, в травматологических — золотистый стафилококк, синегнойная палочка, протеи и т. п. При этом иногда наблюдается более или менее четкая закономерность смены возбудителя в ране: стафилококк — затем синегнойная палочка.
Диагностика инфекционных заболеваний является одной из самых сложных проблем в клинической медицине. Лабораторные методы исследования при ряде нозологических форм играют ведущую, а в целом ряде клинических ситуаций решающую роль не только в диагностике, но и в определении конечного исхода заболевания.
Диагностика инфекционных заболеваний почти всегда предусматривает использование комплекса лабораторных методов.

- бактериологические;
- серологические;
- метод полимеразной цепной реакции (ПЦР) для обнаружения ДНК или РНК возбудителя инфекционного заболевания в исследуемом материале.
У одних пациентов для диагностики этиологии инфекционно-воспалительного процесса достаточно провести бактериологическое исследование, в других клинических ситуациях решающее значение имеют данные серологических исследований, в третьих, предоставить полезную информацию может только метод ПЦР. Однако наиболее часто в клинической практике врачу-клиницисту необходимо использовать данные различных методов лабораторных исследований.
Бактериологические методы исследования
Бактериологические исследования наиболее часто проводят при подозрении на гнойно-воспалительные заболевания (составляют 40-60% в структуре хирургических заболеваний) с целью их диагностики, изучения этиологической структуры, определения чувствительности возбудителей к антибактериальным препаратам. Результаты бактериологических анализов способствуют выбору наиболее эффективного препарата для антибактериальной терапии, своевременному проведению мероприятий для профилактики внутрибольничных инфекций.
Возбудителями гнойно-воспалительных заболеваний являются истинно-патогенные бактерии, но наиболее часто условно-патогенные микроорганизмы, входящие в состав естественной микрофлоры человека или попадающие в организм извне. Истинно-патогенные бактерии в большинстве случаев способствуют развитию инфекционного заболевания у любого здорового человека. Условно-патогенные микроорганизмы вызывают заболевания преимущественно у людей с нарушенным иммунитетом.
Бактериологические исследования при заболеваниях, вызываемых условно-патогенными микроорганизмами, направлены на выделение всех микроорганизмов, находящихся в патологическом материале, что существенно отличает их от аналогичных исследований при заболеваниях, вызванных истинно патогенными микроорганизмами, когда проводится поиск определенного возбудителя.
Для получения адекватных результатов бактериологического исследования при гнойно-воспалительных заболеваниях особенно важно соблюдать ряд требований при взятии биоматериала для анализа, его транспортировки в лабораторию, проведения исследования и оценки его результатов.
Для идентификации вида возбудителя гнойно-воспалительных заболеваний и определения чувствительности к антибактериальным препаратам бактериологические лаборатории используют комплекс методов. Они включают:
- микроскопическое исследование мазка (бактериоскопия) из доставленного биоматериала;
- выращивание культуры микроорганизмов (культивирование);
- идентификацию бактерий;
- определение чувствительности к антимикробным препаратам и оценку результатов исследования.
Доставленный в бактериологическую лабораторию биоматериал первоначально подвергается микроскопическому исследованию.
Микроскопическое исследование мазка (бактериоскопия), окрашенного по Граму или другими красителями, проводят при исследовании мокроты, гноя, отделяемого из ран, слизистых оболочек (мазок из цервикального канала, зева, носа, глаза и т.д.). Результаты микроскопии позволяют ориентировочно судить о характере микрофлоры, ее количественном содержании и соотношении различных видом микроорганизмов в биологическом материале, а также дает предварительную информации об обнаружении этиологически значимого инфекционного агента в данном биоматериале, что позволяет врачу сразу начать лечение (эмпирическое). Иногда микроскопия позволяет выявить микроорганизмы, плохо растущие на питательных средах. На основании данных микроскопии проводят выбор питательных сред для выращивания микробов, обнаруженных в мазке.
Культивирование микроорганизмов. Посев исследуемого биоматериала на питательные среды производят с целью выделения чистых культур микроорганизмов, установления их вида и определения чувствительности к антибактериальным препаратам. Для этих целей используют различные питательные среды, позволяющие выделить наибольшее количество видов микроорганизмов. Оптимальными являются питательные среды, содержащие кровь животного или человека, а также сахарный бульон, среды для анаэробов. Одновременно производят посев на дифференциально-диагностические и селективные (предназначенные для определенного вида микроорганизмов) среды. Посев осуществляют на стерильные чашки Петри, в которые предварительно заливают питательную среду для роста микроорганизмов.

Микроскопия мазков, окрашенных по Граму
1 - стрептококки; 2 - стафилококки; 3 - диплобактерии Фридленда; 4 - пневмококки
Чашки Петри с посевами инкубируют в термостате при определенных температурных, а для ряда микроорганизмов газовых (например, для выращивания анаэробов создают условия с низким содержанием кислорода) режимах в течение 18-24 ч. Затем чашки Петри просматривают. Количественную обсемененность доставленного биоматериала микрофлорой определяют по числу колониеобразующих единиц (КОЕ) в 1 мл или 1 мг исследуемого образца. При просмотре чашек Петри выявляют некоторые особенности изменения цвета среды, ее просветления в процессе роста культуры. Многие группы бактерий образуют характерные формы колоний, выделяют пигменты, которые окрашивают колонии или среду вокруг них. Из каждой колонии делают мазки, окрашивают по Граму и микроскопируют. Оценивают однородность бактерий, форму и размер, наличие спор или других включений, капсулы, расположение бактерий, отношение к окраске по Граму. Вся эта информация служит важнейшей составляющей для выбора сред и получения в дальнейшем чистой культуры каждого микроорганизма.
Колонии отсевают на плотные, жидкие, полужидкие питательные среды, оптимальные для культивирования определенного вида бактерий.
Выделенные чистые культуры микроорганизмов подвергают дальнейшему изучению в диагностических тестах, основанных на морфологических, ферментативных, биологических свойствах и антигенных особенностях, характеризующих бактерий соответствующего вида или варианта.
Определение чувствительности к антибактериальным препаратам. Чувствительность к антимикробным препаратам изучают у выделенных чистых культур микроорганизмов имеющих этиологическое значение для данного заболевания. Поэтому в направлении на бактериологические анализы требуется указать диагноз заболевания у больного. Определение чувствительности бактерий к спектру антибиотиков помогает лечащему врачу правильно выбрать препарат для лечения больного.
Оценка результатов исследования. Принадлежность условно-патогенных микроорганизмов к естественной микрофлоре организма человека создает ряд трудностей при оценке их этиологической роли в развитии гнойно-воспалительных заболеваний. Условно-патогенные микроорганизмы могут представлять нормальную микрофлору исследуемых жидкостей и тканей или контаминировать их из окружающей среды. Поэтому для правильной оценки результатов бактериологических исследований необходимо знать состав естественной микрофлоры изучаемого образца. В тех случаях, когда исследуемый биоматериал в норме стерилен, как, например, спинномозговая жидкость, экссудаты, все выделенные из него микроорганизмы могут считаться возбудителями заболевания. В тех случаях, когда исследуемый материал имеет собственную микрофлору, как, например, отделяемое влагалища, кал, мокрота, нужно учитывать изменения ее качественного и количественного состава, появление несвойственных ему видов бактерий, количественную обсемененность биоматериала. Так, например, при бактериологическом исследовании мочи степень бактериурии (число бактерий в 1 мл мочи), равная и выше 10 5 , свидетельствует об инфекции мочевых путей. Более низкая степень бактериурии встречается у здоровых людей и является следствием загрязнения мочи естественной микрофлорой мочевых путей.
Установить этиологическую роль условно-патогенной микрофлоры помогают также нарастание количества и повторность выделения бактерий одного вида от больного в процессе заболевания.
Врач-клиницист должен знать, что положительный результат бактериологического исследования в отношении биологического материала, полученного из в норме стерильного очага (кровь, плевральная жидкость, спинномозговая жидкость, пунктат органа или ткани), всегда тревожный результат, требующий немедленных действий по оказанию медицинской помощи.
Серологические методы исследования
В основе всех серологических реакций лежит взаимодействие антигена и антитела. Серологические реакции используются в двух направлениях.
С внедрением в практику лабораторий метода иммуноферментного анализа (ИФА) стало возможным определять в крови больных антитела, относящиеся к различным классам иммуноглобулинов (IgM и IgG), что существенным образом повысило информативность серологических методов диагностики. При первичном иммунном ответе, когда иммунная система человека взаимодействует с инфекционным агентов в первый раз, синтезируются преимущественно антитела, относящиеся к иммуноглобулинам класса М. Лишь позднее, на 8-12 день после попадания антигена в организм, в крови начинают накапливаться антитела иммуноглобулинов класса G. При иммунном ответе на инфекционные агенты вырабатываются также и антитела класса А (IgA), которые играют важную роль в защите от инфекционных агентов кожи и слизистых оболочек.
2. Установление родовой и видовой принадлежности микроба или вируса. В этом случае неизвестным компонентом реакции является антиген. Такое исследование требует постановки реакции с заведомо известными иммунными сыворотками.
Серологические исследования не обладают 100 % чувствительностью и специфич-ностью в отношении диагностики инфекционных заболеваний, могут давать перекрестные реакции с антителами, направленными к антигенам других возбудителей. В связи с этим оценивать результаты серологических исследований необходимо с большой осторожностью и учетом клинической картины заболевания. Именно этим обусловлено использование для диагностики одной инфекции множества тестов, а также применение метода Western-blot для подтверждения результатов скрининговых методов.
В последние годы прогресс в области серологических исследований связан с разработкой тест-систем для определения авидности специфических антител к возбудителям различных инфекционных заболеваний.
Авидность - характеристика прочности связи специфических антител с соответствующими антигенами. В ходе иммунного ответа организма на проникновение инфекционного агента стимулированный клон лимфоцитов начинает вырабатывать сначала специфические IgM-антитела, а несколько позже и специфические IgG-антитела. IgG-антитела обладают поначалу низкой авидностью, то есть достаточно слабо связывают антиген. Затем развитие иммунного процесса постепенно (это могут быть недели или месяцы) идет в сторону синтеза лимфоцитами высокоспецифичных (высокоавидных) IgG-антител, более прочно связывающихся с соответствующими антигенами. На основании этих закономерностей иммунного ответа организма в настоящее время разработаны тест-системы для определения авидности специфических IgG-антител при различных инфекционных заболеваниях. Высокая авидность специфических IgG-антител позволяет исключить недавнее первичное инфицирование и тем самым с помощью серологических методов установить период инфицирования пациента. В клинической практике наиболее широкое распространение нашло определение авидности антител класса IgG при токсоплазмозе и цитомегаловирусной инфекции, что дает дополнительную информацию, полезную в диагностическом и прогностическом плане при подозрении на эти инфекции, в особенности при беременности или планировании беременности.
Метод полимеразной цепной реакции
Полимеразная цепная реакция (ПЦР) являющаяся одним из методов ДНК-диагностики, позволяет увеличить число копий детектируемого участка генома (ДНК) бактерий или вирусов в миллионы раз с использованием фермента ДНК-полимеразы. Тестируемый специфический для данного генома отрезок нуклеиновой кислоты многократно умножается (амплифицируется), что позволяет его идентифицировать. Сначала молекула ДНК бактерий или вирусов нагреванием разделяется на 2 цепи, затем в присутствии синтезированных ДНК-праймеров (последовательность нуклеотидов специфична для определяемого генома) происходит связывание их с комплементарными участками ДНК, синтезируется вторая цепь нуклеиновой кислоты вслед за каждым праймером в присутствии термостабильной ДНК-полимеразы. Получается две молекулы ДНК. Процесс многократно повторяется. Для диагностики достаточно одной молекулы ДНК, то есть одной бактерии или вирусной частицы. Введение в реакцию дополнительного этапа - синтеза ДНК на молекуле РНК при помощи фермента обратной транскриптазы - позволило тестировать РНК-вирусы, например, вирус гепатита С. ПЦР - это трехступенчатый процесс, повторяющийся циклично: денатурация, отжиг праймеров, синтез ДНК (полимеризация). Синтезированное количество ДНК идентифицируют методом иммуноферментного анализа или электрофореза.
В ПЦР может быть использован различный биологический материал - сыворотка или плазма крови, соскоб из уретры, биоптат, плевральная или спинномозговая жидкость и т.д. В первую очередь ЦПР применяют для диагностики инфекционных болезней, таких как вирусные гепатиты В, С, D, цитомегаловирусная инфекция, инфекционные заболевания, передающиеся половым путем (гонорея, хламидийная, микоплазменная, уреаплазменная инфекции), туберкулез, ВИЧ-инфекция и т.д.
Преимущество ПЦР в диагностике инфекционных заболеваний перед другими методами исследований заключается в следующем:
- возбудитель инфекции может быть обнаружен в любой биологической среде организма, в т.ч. и материале, получаемом при биопсии;
- возможна диагностика инфекционных болезней на самых ранних стадиях заболевания;
- возможность количественной оценки результатов исследований (сколько вирусов или бактерий содержится в исследуемом материале);
- высокая чувствительность метода; например чувствительность ПЦР для выявления ДНК вируса гепатита В в крови составляет 0,001 пг/мл (приблизительно 4,0 . 10 2 копий/мл), в то время как метода гибридизации ДНК с использованием разветвленных зондов - 2,1 пг/мл (приблизительно 7,0 . 10 5 копий/мл).
Читайте также:


