Вакцина против аденовирусной инфекции крс








АДЕНОВИРУСНАЯ ИНФЕКЦИЯ КРУПНОГО РОГАТОГО СКОТА
Возбудитель относится к семейству AdenoviridaeДНК-содержащих вирусов, которое включает аденовирусы человека, животных, в том числе птиц, и состоит из двух родов: Mastadenovirus — аденовирусы млекопитающих и Aviadenovirus — аденовирусы птиц [1].
Вирус впервые был выделен в 1954 г., в США. Впервые аденовирусы у животных, в частности, у свиней выделил и описал в 1950 г. американский ученый Олсен. Аденовирусная инфекция крупного рогатого скота была установлена Клейном в 1959 г. В последующие годы аденовирусная инфекция была установлена у лошадей, овец, птиц. В настоящее время инфекция зарегистрирована во многих странах мира: Италии, Польше, Великобритании, ФРГ, Канаде, Молдове, Беларуси, на Украине.
Инфекцией чаще болеют телята от 2-недельного до 4-месячного возраста. Болезнь регистрируют в зимне-весенние месяцы при комплектовании хозяйств. Аденовирусная инфекция чаще проявляется небольшими вспышками, поражая отдельные группы животных, быстро распространяется на все стадо.
Источник возбудителя инфекции - больные и переболевшие животные, выделяющие вирус с истечениями из носа и фекалиями.Факторы передачи возбудителя - корма, вода, подстилка, предметы ухода, загрязненные выделениями больных животных. Заражение происходит воздушно-капельным и алиментарным путями, а также через конъюнктиву. Заболеваемость телят составляет 50-80 %, летальность - 15-60 % [4].
Инкубационный период длится 4-7 дней. Течение болезни зависит от условий содержания животных. Сначала появляются слезотечение и слизистые носовые истечения, которые в течение 3-5 дней переходят в гнойные. У телят снижается аппетит, учащаются пульс и дыхание, сухой кашель.Со 2-3-х суток заболевания у телят развиваются тимпания и диарея. На 3-4-й день повышается температура тела до 41,5 °С и удерживается до 9 дней. Диарея длится несколько дней. Фекальные массы жидкие, серо-коричневого цвета с примесью кусочков слизистой оболочки, иногда с кровью. Возможны колики. Летальность составляет 40-60 % [2].
Диагноз ставят комплексно с учетом эпизоотологических данных, клинических признаков, патологоанатомических изменений и результатов лабораторных исследований. Биологическая промышленность выпускает набор для диагностики аденовирусной инфекции крупного рогатого скота.
Для лабораторной диагностики используют: РИФ, РСК, РНГА, РТГА, РДП. Также выделяют возбудителя в культуре ткани тестикул бычка, почки эмбриона коровы или легких эмбриона коровы [3].
У переболевших животных иммунитет сохраняется до 5 мес. Иммуногенные животные остаются вирусоносителями, и при различных стрессовых воздействиях и обработке гормональными препаратами становятся источником возбудителя аденовирусной инфекции и могут заболеть повторно смешанной респираторно-кишечной инфекцией.
Лечение аденовирусной инфекции как таковое не разработано. Лечение проводится симптоматически.В основе профилактики болезни лежит соблюдение системы ветеринарно-санитарных мероприятий. С целью повышения устойчивости телят рекомендуется облучать их ультрафиолетовыми лучами в течение 7-10 дней.
Для активной иммунизации молодняка и стельных коров применяют инактивированную и живую бивалентную вакцины против аденовирусной инфекции и парагриппа, а также вакцины в других ассоциациях с антигенами инфекционного ринотрахеита, парагриппа-3, реовирусной и хламидийной инфекций крупного рогатого скота [5].
Библиографический список
1. Иванов, А. И. Инфекционные болезни молодняка сельскохозяйственных животных [Текст]: учеб. пособие / А. И. Иванов. - М-во сел. хоз-ва РФ, Башкирский ГАУ. - Уфа: БашГАУ, 2012. - 234 с.
2. Госманов, Р.Г. Ветеринарная вирусология [Текст]: учебник / Р. Г. Госманов, Н. М. Колычев, В. И. Плешакова - СПб.: Лань, 2010. - 482 с.
3. Петрянкин, Ф.П. Болезни молодняка животных [Текст]: учебное пособие / Ф.П. Петрянкин, О.Ю. Петрова. - СПб.: Лань, 2014. - 352 с.
4. Барышников, П.И. Лабораторная диагностика вирусных болезней животных: учебное пособие / П.И. Барышников, В.В. Разумовская. - СПб.: Лань, 2015. - 672 с.
Представлены результаты опытов по подбору оптимальной прививочной дозы ассоциированной вакцины против аденовирусной, герпесвирусной инфекции типа I, и вирусной диареи — болезни слизистых оболочек, инактивированной эмульсионной для разных возрастных групп крупного рогатого скота. Установлено, что прививочная доза ассоциированной вакцины составила: для телят 25–30 суточного возраста — 1 см 3 , для глубокостельных коров, а также молодняка 4–6 месячного возраста и старше — 2 см 3 . Максимальный уровень гуморальных антител у подопытных животных регистсрировали на сутки после второй вакцинации.
Ключевые слова: вакцина, антитела, аденовирус, герпесвирус, вирус парагриппа-3, вирус вирусной диареи — болезни слизистых оболочек
Presents the results of the selection of the optimal dose of combined vaccine against adenovirus, herpesvirus type I, parainfluensa -3 virus and viral disease virus of cattle. Found that optimal dose of vaccine: for calves 25–30 days of age — 1 ml, for heavily pregnant cows and calves 4–6 month of age and is higher. The maximal level of gumoral specific antibody in experimental animals registered after the 30 days of vaccination.
Keywords: vaccine, antibody, adenovirus, herpesvirus type I, parainfluensa -3 virus, viral diarrhea — mucosal disease virus, cattle
Введение
Определение оптимальной иммунизирующей дозы ассоциированной вакцины, сконструированной на основе антигенов аденовируса и подгрупп, герпесвируса типа I, вируса и вируса вирусной диареи — болезни слизистых оболочек крупного рогатого скота.
В последние годы стало очевидным, что вирусные инфекции молодняка и различные формы патологий репродуктивных органов взрослого поголовья скота, индуцируемые большим набором вирусов, относящиеся к различным таксономическим группам, распространены повсеместно и представляют серьезную экономическую проблему для промышленного животноводства в большинстве стран мира, в том числе и России [2].
Среди большого числа вирусов, участвующих в этиопатогенезе респираторных заболеваний телят, протекающие преимущественно в виде смешанной инфекции, важное значение имеют и аденовирусы, разделенные на 2 подгруппы на основании культуральных свойств, антигенных различий и характера вызываемых ими цитоморфологических изменений, появляющихся в процессе репродукции в чувствительной биологической системе [15].
Серологические исследования показали, что аденовирусная инфекция крупного рогатого скота (КРС) широко распространена во всем мире, в том числе и РФ [1]; [12]. У телят она проявляется в виде энзоотических вспышек с массовыми пневмониями, а среди телят возраста — диареи с примесью крови и слизи, угнетения и дегидратации организма.
Кроме тех двух серотипов (1 и 2 серотипы) аденовируса КРС (соответственно штаммы и ), в Великобритании был изолирован штамм аденовируса , который имел другую антигенную структуру, в отличие от предыдущих штаммов и был определен как серотип 3 [10]. Из 10 серотипов аденовируса КРС, идентифицированных в настоящее время, третий серотип подгруппы был отнесен к роду Mastadenovirus, а четвертый серотип подгруппы включен к недавно утвержденному роду Atadenovirus [8], которые также, как и другие серотипы аденовирусов, представляют собой не имеющую оболочку икосаэдрическую частицу 75–80 нм в диаметре, содержащую двухцепочечную линейную геномную ДНК [7].
Для специфической профилактики аденовирусной инфекции в мировой практике используют моно-, би- и поливалентные вакцины, отличающиеся по набору аденовирусных компонентов, сочетанию их с другими возбудителями, методом изготовления и по эффективности их применения [9]; [13].
В последующие годы и в нашей стране были изготовлены и испытаны экспериментальные образцы моновакцины против аденовирусной инфекции КРС [4], бивалентной вакцины, содержащие антигены аденовируса и вируса [1] и комбинированной инактивированной вакцины на основе антигена аденовируса КРС первого серотипа [6].
Однако, несмотря на значительную роль аденовирусной инфекции в этиологической структуре патологии телят раннего возраста в молочных комплексах РФ проблема создания полноценной ассоциированной вакцины с включением в ее состав антигенных компонентов аденовирусов и подгрупп оставалась нерешенной.
Общеизвестно, что эффективность вакцины зависит от антигенной активности производственных штаммов возбудителей, выбора их типов и чувствительной системы для их репродукции, степени очистки и концентрации антигенов, входящих в состав биопрепарата, метода инактивации и оптимального соотношения адъюванта, стимулирующего процессы иммуногенеза. Кроме того, биологическая активность препарата определяется по уровню поствакцинальных антител и количеством специфического белка — иммуногенного антигена, являющегося одновременно единицей стандартизации, от которого зависит величина прививочной дозы.
В этой связи, целью наших исследований явилось определение оптимальной иммунизирующей дозы предложенной нами ассоциированной вакцины, обеспечивающей максимальное стимулирование иммунологической перестройки организма у привитых животных.
Для оценки безвредности использовали белых мышей (n=10) и телят (n=6) соответственно на каждую серию вакцины. Лабораторные опыты по оценки антигенной активности образцов ассоциированной вакцины проводили на кроликах живой массой 2,5–3 кг (n=3). Препарат вводили внутримышечно, двукратно с интервалом 21 день, в дозах по 1 см 3 и 2 см 3 соответственно, с последующим исследованием сыворотки крови, полученной через 21–30 суток после каждой вакцинации на наличие специфических антител в РМН, ИФА и РТГА.
Определение прививочной дозы экспериментальных серий ассоциированной вакцины проводилось в производственных условиях на крупном рогатом скоте в Кайбицкого района Республики Татарстан. Вакцинировали три возрастные группы животных: телят 25–30 — суточного возраста, молодняк 4–6 месячного возраста и старше, глубокостельных коров и нетелей. Для каждой возрастной группы испытывали три соответствующие дозы вакцины. Каждую дозу вакцины вводили 5 животным внутримышечно в среднюю треть шеи двукратно, с интервалом 21–30 суток по схеме: глубокостельным коровам и нетелям — по 1, 2, и 3 см 3 (первый раз — за 40–50 дней, второй раз — за 15–20 дней до отела); телятам 25–30 суточного возраста — по 0,5, 1 и 2 см 3 ; молодняку 4–6 месячного возраста и старше — по 1, 2, и 3 см 3 .
В период вакцинации за животными вели клиническое наблюдение. На месте введения вакцины наблюдалось небольшое уплотнение, которое самопроизвольно исчезало через 2–3 недели. других отклонений от физиологической нормы у привитых животных обнаружено не было.
Максимальное разведение сыворотки, полностью нейтрализующее ЦПД вируса в 50% инфицированных лунок, принимали за титр сыворотки.
В реакции использовали контроли: гипериммунную моноспецифическую сыворотку кролика, полученную к каждому штамму вирусов; в качестве отрицательного контроля — сыворотку крови КРС, не содержащую специфических антител к вирусам, используемым в опыте.
Статистическую обработку данных проводили с помощью стандартного пакета программ Microsoft Office Excel 2010.
В опытах установили, что экспериментальные образцы вакцины стерильны, безвредны для лабораторных и естественно восприимчивых животных, вызывают у кроликов формирование выраженного иммунного ответа ко всем антигенным компонентам (таблица 1).
Таблица 1 — Показатели антигенной активности ассоциированной вакцины на кроликах. (M±m, n=3, р
Шемелькова Г.О., Верховская А.Е., Соболева Г.Л.
ООО "Ветбиохим", г. Москва
Шемельков Е.В., Иванов Е.В., Непоклонова И.В.
АНО "Научно-исследовательский институт диагностики и
профилактики болезней человека и животных", г. Москва
Алипер Т.И. "НПО НАРВАК",
"ФГБУ НИИ вирусологии им. Д.И. Ивановского" МЗ РФ, г. Москва
Аденовирус крупного рогатого скота широко распространен среди поголовья и часто, в сочетании с другими вирусными агентами (вирусы инфекционного ринотрахеита, парагрип-па-3, вирусной диареи, респираторно-синцитиальным, рота- и коро-навирусами), является первопричиной возникновения и развития основных респираторных и кишечных инфекционных заболеваний телят, которые, в дальнейшем, осложняются вторичными инфекциями бактериальной этиологии [2, 5, 7, 10].
Установлено, что аденовирусы являются иммунодепрес-сантами и способствуют развитию других инфекционных патологий. Из-за сходства с другими инфекционными заболеваниями вирусной этиологии клинико-эпизоотологическая диагностика аденовирусной инфекции крупного рогатого скота затруднена [4].
Ввиду частой полиэтиологичности первичных вирусных инфекций и невозможности разграничения ведущей роли того или иного агента в развитии патологии, наиболее эффективным методом специфической профилактики таких заболеваний является применение комбинированных вакцин, содержащих антигены сразу всех или нескольких из указанных возбудителей [3, 7]. Вакцинации подвергают стельных коров для создания у новорожденного потомства пассивного колострального иммунитета, а также телят с 2-3-х недельного возраста для создания активного поствакцинального иммунитета [9].
В настоящее время имеется ряд поливалентных вакцин против двух, трех и более указанных респираторных и/или кишечных вирусных заболеваний телят, но отсутствуют зарегистрированные биопрепараты, предназначенные для специфической профилактики аденовирусной инфекции крупного рогатого скота. Однако, наряду с другими вирусными агентами, аденовирусы играют значительную роль в этиологии указанных заболеваний [1, 2, 8, 11].
В ранее проведенных исследованиях нам удалось выделить и идентифицировать методом секвенирования фрагмента генома аденовирус крупного рогатого скота I-го типа. Выделенный штамм аденовируса был адаптирован к перевиваемой культуре клеток и депонирован в государственной коллекции вирусов ФГБУ НИИ вирусологии им. Д.И. Ивановского МЗ РФ. В ходе проведенных исследований установили, что выделенный аденовирус обладает выраженными антигенными свойствами и пригоден для использования в составе инактивированных вакцин [6].
Целью настоящей работы была разработка комбинированной вакцины против аденовирусной инфекции, инфекционного ринотрахеита, парагриппа-3, вирусной диареи, респираторно-синци-тиальной, рота- и коронавирусной болезнях крупного рогатого скота, а также оценка эффективности ее применения в производственных условиях.
Материалы и методы. Для проведения серомониторинга использовали пробы сыворотки крови крупного рогатого скота, полученные из разных субъектов РФ, которые исследовали на наличие ви-руснейтрализующих антител к аденовирусу, вирусам инфекционного ринотрахеита, парагриппа-3, вирусной диареи, респираторно-синци-тиальному, рота- и коронавирусам крупного рогатого скота. Наличие специфических антител к возбудителям инфекционного ринотрахеита и респираторно-синцитиальной инфекции, так же определяли методом ИФА, с использованием соответствующих диагностических ИФА-наборов: "ИРТ-СЕРОТЕСТ" и "РСИ-СЕРОТЕСТ", производства ООО "Ветбиохим".
В качестве прототипа использовали инактивированную комбинированную вакцину "КОМБОВАК", производства ООО "Ветбиохим".
Экспериментальные образцы вакцины готовили из одной партии инактивированного аденовируса крупного рогатого скота I-го типа, штамм "Альфа" (выделен от 17-и суточного теленка) [6], а также инактивированных антигенов производственных штаммов вирусов инфекционного ринотрахеита, парагриппа-3, вирусной диареи, рес-пираторно-синцитиального, рота- и коронавирусов крупного рогатого скота.
При выборе адъюванта для вакцины провели исследования шести различных коммерческих и экспериментальных препаратов: ISA 50, ISA 71, ISA 206, ISA 773 (SEPPIC, Франция), адъювантный комплекс Акрум-С (комплекс высокомолекулярного синтетического полиэлектролита со смесью поверхностно-активных гликозидов), гель гидроокиси алюминия (ГОА). Соотношения антигенной части и адъюванта брали в пропорциях, рекомендованных производителем адъюванта или подбирали опытным путем.
В качестве лабораторной модели, для оценки безвредности использовали группы морских свинок и белых мышей (n = 5 и n = 10, соответственно, на каждый образец). Морским свинкам вакцину вводили внутримышечно в дозе 2,0 мл, белым мышам - подкожно в дозе 0,5 мл. За животными вели наблюдение в течение 15 суток.
Антигенную активность образцов на лабораторной модели, оценивали путем проведения однократной внутримышечной вакцинации группы морских свинок (n = 10, на каждый образец), сформированной по принципу аналогов в дозе 1,0 мл, с последующим исследованием сыворотки крови, полученной до и через 21 сутки после вакцинации, на наличие специфических антител в реакции нейтрализации (РН).
Безвредность и антигенную активность изготовленных образцов в опыте на естественно восприимчивых животных оценивали путем проведения двукратной внутримышечной иммунизации коров за 1-2 месяца до осеменения (n=30 на каждый образец вакцины), сформированных в соответствующие группы по принципу аналогов, в дозе 3,0 мл. Кровь брали выборочно по 10 голов из каждой группы перед вакцинацией (Д0) и через 21 сутки после первой (Д21) и второй иммунизаций (Д42), с последующим исследованием сыворотки крови по уровню специфических антител в РН.
Для определения оптимальной иммунизирующей дозы вакцины использовали три группы коров за 1-2 месяца до осеменения (n = 15 в каждой группе), которых иммунизировали внутримышечно двукратно с интервалом 21 сутки в дозах 2,0 мл (первую группу), 3,0 мл (вторую группу) и 4,0 мл (третью группу). А также две группы телят в возрасте 2,5-3 месяца (n = 15 в каждой группе), которых иммунизировали двукратно внутримышечно в дозах 1,0 мл (первую группу) и 2,0 мл (вторую группу). Кровь у животных брали перед вакцинацией (Д0) и через 21 сутки после второй иммунизаций (Д42), с последующим исследованием сыворотки крови по уровню специфических антител в РН. В качестве контроля использовали группы невакцинированных животных (по 10 голов коров и телят).
Постановку и учет результатов РН осуществляли по стандартным методикам с использованием соответствующих контрольных штаммов вирусов.
Оценку эффективности применения вакцины в производственных условиях проводили в животноводческом хозяйстве, неблагополучном по респираторным и кишечным инфекционным заболеваниям телят. В хозяйстве вакцинировали стельных коров - дважды: первый раз - за 50-60 суток до отела, второй - через 14-21 сутки в дозе 3,0 мл. Полученных телят первый раз вакцинировали в возрасте 25-30 суток, повторно через 20-25 суток в дозе 2,0 мл. В качестве контроля использовали группы невакцинированных стельных коров и телят, которые содержались в другом помещении. Эффективность применения вакцины определяли по эпизоотологическим показателям: заболеваемость телят респираторными и кишечными инфекциями, смертность телят, а также их вынужденная выбраковка в опытной и контрольной группах.
Статистическую обработку данных выполняли общепринятыми методами (компьютерные программы Microsoft Excel 2010, Stat Plus 2005).
Результаты исследований. На первом этапе работы (20102012 г.) мы провели исследование 869 проб сыворотки крови коров и телят, полученных от невакцинированных животных, из 12 неблагополучных по основным респираторным и кишечным инфекционным заболеваниям хозяйств Вологодской, Воронежской, Калужской, Московской, Тамбовской областей, Алтайского и Краснодарского краев, Республики Башкирия. В ходе проведенного серомониторинга было выявлено наличие специфических антител к возбудителям: аденовирусной инфекции (АВ) в 24% исследуемых проб, инфекционного ринотрахеита (ИРТ) - в 47%, парагриппа-3 (ПГ-3) - в 85%, вирусной диареи (ВД) - в 86%, респираторно-синцитиальной болезни (РС) - в 62%, ротавирусной болезни (РВ) - в 89%, коронавирусной болезни (КВ) - в 87% исследуемых проб (рисунок 1).
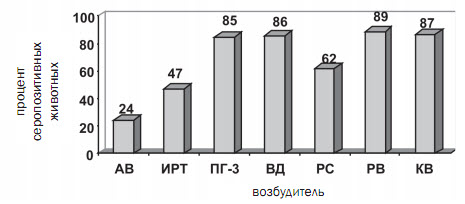
Рис. 1. Количество положительных проб сыворотки крови крупного рогатого скота
к соответствующему вирусу (в процентах от общего числа исследованных)
Результаты проведенных исследований свидетельствуют о широком распространении аденовирусной инфекции крупного рогатого скота в животноводческих хозяйствах, при этом, в подавляющем большинстве случаев, она встречается в сочетании с другими вирусными заболеваниями. Таким образом, аденовирус крупного рогатого скота играет существенную роль в этиологии основных вирусных заболеваний телят. Полученные результаты согласуются с данными других ученых, показывающими широкое распространение вирусных инфекций, в том числе и аденовирусной, среди поголовья крупного рогатого скота [1, 2, 5].
Кроме того, при проведении серологических исследований, установлена корреляция результатов по выявлению антител к вирусам ИРТ и РС, полученных в РН и ИФА.
На основании проведенных исследований, с учетом имеющихся литературных данных, мы пришли к заключению о целесообразности создания комбинированной вакцины против основных респираторных и кишечных вирусных заболеваний телят, включающей в себя аденовирус крупного рогатого скота.
Поскольку, по сравнению с прототипной вакциной "КОМБОВАК", в новой вакцине увеличивается количество вирусных антигенов и, следовательно, снижается объемная доля каждого отдельного антигена, то для нее требуется более иммунологически эффективный адъювант, способный обеспечить выраженный иммунный ответ на каждый антиген.
В ходе данной работы исследовали шесть адъювантов, с которыми изготовили экспериментальные образцы вакцины. Оценку изготовленных образцов проводили по показателям безвредности и антигенной активности в опытах на лабораторных и естественно восприимчивых животных.
Изучение безвредности показало, что экспериментальные образцы вакцины не вызывали заболевания или гибели подопытных животных, при этом у отдельных особей наблюдали образование плотных ограниченных припухлостей на месте введения образцов с масляными адъювантами.
В опытах на лабораторных и естественно восприимчивых животных установлено, что введение экспериментальных образцов вакцины вызывало развитие выраженного иммунного ответа (Р Таблица 1. Сравнительная оценка антигенной активности вакцины с разными адъювантами в опыте на лабораторных животных







480 руб. | 150 грн. | 7,5 долл. ', MOUSEOFF, FGCOLOR, '#FFFFCC',BGCOLOR, '#393939');" onMouseOut="return nd();"> Диссертация, - 480 руб., доставка 1-3 часа, с 10-19 (Московское время), кроме воскресенья
Автореферат - бесплатно , доставка 10 минут , круглосуточно, без выходных и праздников
Вазир Ясер. Технология приготовления и антигенные свойства ассоциированной инактивированной вакцины против аденовирусной инфекции и вирусной диареи крупного рогатого скота : диссертация . кандидата ветеринарных наук : 16.00.03 / Вазир Ясер; [Место защиты: Моск. гос. акад. ветеринар. медицины и биотехнологии им. К.И. Скрябина].- Москва, 2008.- 145 с.: ил. РГБ ОД, 61 08-16/37
Содержание к диссертации
Список условных обозначений и сокращений
1. ОБЗОР ЛИТЕРАТУРЫ
1.1. Вирусная диарея крупного рогатого скота
1.1.1. Таксономическое положение и основные биологические свойства вируса вирусной диареи крупного рогатого скота
1.1.2. Структурная характеристика вируса вирусной диареи крупного рогатого скота
1.2. Аденовирусная инфекция КРС
1.2.1. Общая характеристика аденовирусов
1.2.2.Сведения об аденовирусной инфекции крупного рогатого скота
1.2.3. Структурная характеристика аденовириона, структура вирусного нуклиокапсида
1.2.4. Основные структурные белки аденовириона
1.2.5. Антигенная структура белков.аденовирусов
1.3.Клинико-эпизоотологические особенности и патогенез вирусной диареи КРС
1.4. Клинико-эпизоотологические особенности и патогенез аденовирусной инфекции КРС
1.5. Специфическая профилактика ВД КРС
1.6. Специфическая профилактика аденовирусной инфекции КРС
1.7.Иммуномодуляторы, их природа и иммуномодулирующий эффект
2. СОБСТВЕННЫЕ ИССЛЕДОВАНИЯ
2.1. Материалы и методы и исследования
2.2гРезультаты исследований --_!_•_• • • — —
2.2.1. Отработка культивирования аденовируса и вируса вирусной диареи с инфекционными титрами не ниже 1060ТЦД5(/мл
2.2.2. Очистка и концентрирование аденовируса КРС и вируса вирусной диареи КРС
2.2.3. Отработка оптимальных условий инактивации полученных вирусов
2.2.4. Изготовление экспериментальных серий моно- и ассоциированных вакцин и сравнение их свойств на разных видах животных
2.2.5. Оптимизация схемы введения ассоциированной вакцины
2.2.6.Влияние срока хранения на антигенную активность ассоциированной инактивированной вакцины против аденовирусной инфекции и вирусной диареи крупного рогатого скота
2.2.7.Исследование влияния иммуномодуляторов на антигенные свойства вакцины
3. ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЙ
4. ВЫВОДЫ
5. ПРАКТИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ ПОЛУЧЕННЫХ НАУЧНЫХ РЕЗУЛЬТАТОВ
6. РЕКОМЕНДАЦИИ ПО ИСПОЛЬЗОВАНИЮ НАУЧНЫХ ВЫВОДОВ
Введение к работе
Актуальность проблемы. На протяжении многих лет животноводство всех стран мира, в том числе и России, несёт значительные экономические потери от респираторных и желудочно-кишечных заболеваний новорожденных телят. В основе сложившейся неблагоприятной ситуации лежит целый ряд неспецифических предрасполагающих факторов, среди которых наиболее важными являются содержание большого поголовья скота на ограниченном пространстве, механизация методов содержания и кормления, что ведет за собой ограничение двигательной активности у животных, возникновение стрессов, усложнение микробного и вирусного пейзажа в хозайствах и комплексах, снижение иммунитета. В этих условиях, особенно при нарушении санитарно-гигиенических норм, несвоевременной выпойки молозива телятам, а также при отсутствии на станциях исскуственного осеменения должного контроля за возможной контаминацией спермы вирусами, нередко возникают и очень быстро распространяются инфекционные заболевания, в том числе вирусной природы.
Аденовирусная инфекция и вирусная диарея крупного рогатого скота широко распространены во всем мире, в том числе и в России. Их возбудители занимают одно из ведущих мест в патологии респираторного и желудочно-кишечного тракта новорожденных телят. По данным отчетности последних годов по России, в 60-100% случаев при заболеваниях телят диареей, выделяют аденовирус и вирус ВД или их ассоциацию (Сюрин В. Н. и др 1998).
Величина экономического ущерба при этих заболеваниях, складывающаяся из падежа телят, снижения мясной и молочной продуктивности, уменьшения привесов, выбраковки животных, убытка от абортов, бесплодия и.т.д., огромна, а терапевтические меры борьбы с уже возникшим заболеванием малоэффективны. Поэтому в комплексе противоэпизоотических мер борьбы с аденовирусной инфекцией и вирусной диареей КРС специфическая профилактика является ведущей.
В арсенале биологической промышленности во всем мире имеется большое количество препаратов, предназначенных для специфической профилактики респираторных и кишечных заболеваний телят, которые широко используются в ветеринарной практике Массовое применение иммунобиологических средств защиты животных требует особого контроля на всех этапах их изготовления, производства и использования. Особенно это касается ассоциированных препаратов, поскольку их конструирование из различных антигенов является сложной задачей и подразумевает получение вакцины, обладающей высокими иммуногенными свойствами по каждому из компонентов.
В связи с этим изучение противоэпизоотической эффективности и иммуногенных свойств вакцинных препаратов, включающее количественное определение уровня специфических антител у животных, их динамику, а также влияние иммунизации на заболеваемость и сохранность поголовья, является главным практическим критерием оценки вакцин против вирусных инфекций телят, и, в конечном итоге, подтверждает или опровергает целесообразность их применения.
В последние годы значительно возрос интерес к проблеме иммунокорекции, что связано с усилением экологического неблагополучия и возрастающей нагрузкой на организм животных Кроме того, интерес к иммуномодуляторам со стороны практикующих ветеринарных врачей обусловлен возрастающей потребностью в высокоэффективных средствах профилактики вирусных инфекций Вирусная диарея крупного рогатого скота заболевание КРС, преимущественно молодых животных, характеризующееся широким спектром клинических проявлений, способное протекать в различных формах, как в острой с летальным исходом, так и латентной — вызывая у животного сероконверсию без каких- либо клинических проявлений. Возбудителем данного заболевания является вирус вирусной диареи КРС, который относится к роду pestivirus семейство Flaviviridae. В настоявшее время компанией НАРВАК выпускается ассоциированная вакцина инактивированная против инфекционного ринотрахеита, вирусной диареи, парагриппа-3 и лептоспироза крупного рогатого скота, а также сотрудникам института экспериментальной ветеринарии имени Н. Вышелесского (Белоруссия) разработаны ассоциированная живая культуральная вакцина против инфекционного ринотрахеита, вирусной диареи и парагриппа-3 крупного рогатого скота; ассоциированная инактивированная культуральная вакцина против инфекционного ринотрахеита, вирусной диареи, рота-и коронавирусной инфекций крупного рогатого скота.
Аденовирусная инфекция, зарегистрированная преимущественно у молодняка крупного рогатого скота характеризуется острым течением и поражением органов дыхания, пищеварения и конъюнктивитом. В 1982 г была разработана моновакцина против аденовирусной инфекции КРС и бивакцина, содержащая аденовирус и возбудитель пастереллеза, в которых были использованы в качестве инактиванта - димерэтиленимин, и адъюванта - аэросил (Сюрин В.Н., Литвинов О.Б., Белоусова Р.В).
Установлено, что вирус ВД КРС и аденовирусы являются иммунодепрессантами и способствуют развитию вторичной инфекции.
В настоящее время в распоряжении ветеринарных специалистов имеются моно- и поливалентные вакцины против аденовирусной инфекции и вирусной диареи КРС, однако на отечественном рынке ветеринарных препаратов отсутствуют ассоциированные вакцинные препараты против указанных инфекций. Поэтому разработка отечественных препаратов против указанных инфекций является своевременным и актуальным.
Целью исследований являлась разработка ассоциированной инакти-вированной-концентрированной-вакцины_против_аденовирусной_инфекции и вирусной диареи крупного рогатого скота.
Для достижения поставленной цели необходимо было решить следующие задачи:
1. Оптимизировать условия культивирования аденовируса и вируса вирусной диареи КРС с получением инфекционной активности не ниже 1060ТЦД5о/мл.
2. Отработать оптимальные условия инактивации полученных вирусов.
3. Получить концентрированные вирусные антигены и изучить их антигенную активность.
4. Изготовить экспериментальные серии моно- и ассоциированных вакцин и определить антигенные свойства на разных видах животных.
5. Испытывать ассоциированную вакцину на естественно восприимчивых животных.
6. Исследовать влияние иммуномодуляторов на антигенные свойства вакцины.
Научная новизна работы: Впервые разработана ассоциированная инактивированная концентрированная вакцина против аденовирусной инфекции и вирусной диареи крупного рогатого скота.
Предложена модифицированная методика получения очищенных и концентрированных препаратов аденовирусов и вируса вирусной диареи КРС, пригодных для создания вакцин.
Дано научное обоснование и показана эффективность применения иммуномодуляторов и ассоциированной инактивированной вакцины против аденовирусной инфекции и вирусной диареи крупного рогатого скота.
Практическая значимость работы. Результаты исследований вошли^в-нормативную^техническую_,документацию_:_временная инструкция по изготовлению и контролю вакцины ассоциированной концентрированной инактивированной против аденовирусной инфекции и вирусной диа! 10 реи крупного рогатого скота; технические условия изготовления и контроля вакцины ассоциированной концентрированной инактивированной против аденовирусной инфекции и вирусной диареи крупного рогатого скота; наставление по применению ассоциированной инактивированной концентрированной вакцины против аденовирусной инфекции и вирусной диареи крупного рогатого скота.
Публикации. По материалам диссертации опубликовано 11 научных статей, в т.ч. 8 статей в сборниках научных трудов, 3 статьи — в научных журналах, рекомендованных ВАК РФ. Структура и объем работы. Диссертация изложена на 145 страницах и содержит следующие разделы: введение, обзор литературы, собственные исследования, обсуждение результатов исследования, выводы, данные о практическом использовании научных результатов, рекомендации по использованию научных выводов, приложения. Список использованной литературы включает 297 источников, из которых 198 - иностранных авторов. Работа иллюстрирована 14 рисунками и 17 таблицами.
Личный вклад соискателя. Работа выполнена соискателем самостоятельно. В выполнении отдельных этапов, связанных с культивированием, очисткой и концентрированием вирусов, принимали участие к.б.н.
доцент И.В. Третьякова, к.б.н. Т.П. Лобова, д.б.н., профессор Е.И. Ярыгина, за что автор приносит им благодарность.
Основные положения и результаты, выносимые на защиту.
• технология очистки и концентрирования вирусов аденовирусной инфекции и ВД КРС;
• условия приготовления экспериментальных серий моно- и ассоциированных вакцин и результаты изучения их антигенных свойств на разных видах животных;
• схема введения ассоциированной вакцины;
• результаты исследований по оценке влияния иммуномодуляторов на антигенные свойства вакцины.
Читайте также:


