Условно патогенная инфекция что это такое у детей

Актуальность. До сих пор увеличение с каждым годом уровня заболеваемости инфекциями, передающимися половым путем (ИППП), и ассоциированными с ними воспалительными заболеваниями органов урогенитального тракта остается одной из неразрешенных задач современной медицины по всему миру 3.
В классификации, разработанной Всемирной организацией здравоохранения и касающейся этиологии (2006) и классификации Centers for Disease Control and Prevention, микроорганизмы семейства Mycoplasmataceae определены как возбудители неспецифических уретритов, а также воспалительных заболеваний органов малого таза (ВЗОМТ) [6].
Довольно частое выявление мико-, уреаплазменной инфекции у лиц наиболее социально и физически активного возраста, отсутствие яркой клинической симптоматики, бессимптомное течение, но способное вызывать структурно-воспалительные изменения в тканях органов мочеполовой системы, нередко приводящие к бесплодию, обусловливает актуальность ранней диагностики, рациональной терапии, направленной на предотвращение развития таких осложнений [7; 8]. Около 15% пар в Российской Федерации страдают бесплодием [9]. При этом даже эффективность применения вспомогательных репродуктивных технологий, в том числе экстракорпорального оплодотворения, не превышает 30-35%, что, в свою очередь, в очередной раз подчеркивает актуальность изучения данной проблемы.
Роль различных видов микоплазм в возникновении патологических процессов остается до настоящего времени до конца нерешенной. Российские и зарубежные авторы признают M. genitalium в качестве абсолютно патогенного микроорганизма, вызывающего ВЗОМТ, а именно негонококковый уретрит, сальпингит, цервицит, эндометрит [10].
Большинство авторов, ссылаясь на обнаружение M. hominis и Ureaplasma spp. в мочеполовой системе практически здоровых мужчин и женщин, считают их условно-патогенными возбудителями [11]. Тем не менее исследования других ученых свидетельствуют о продолжении идентификации роли этих микроорганизмов в развитии воспалительных заболеваний органов урогенитального тракта [12].
Однако работы других авторов говорят о значительном увеличении заболеваемостью ВЗОМТ, ассоциированных M. hominis и Ureaplasma spp. M. hominis и Ureaplasma spp. так же, как и M. genitalium, могут являться этиологическими агентами в развитии негонококковых уретритов, простатитов, эпидидимитов, вагинитов, цервицитов, кольпитов, эндометритов и сальпингитов [13; 14]. Данное мнение подтверждают исследования Батурина В.А. и др., в которых различные виды уреаплазм были выделены у 80% женщин с клинической симптоматикой урогенитальной инфекции и у 51% женщин с нарушениями репродуктивной функции [15].
Следует также отметить, что микоплазмы в большинстве случаев входят в структуру микст-инфекций. Таким образом, как моноинфекция мико-, уреаплазменная инфекция, выявляются до трети всех случаев, а в ассоциации с другой патогенной микрофлорой - до 88% [16; 17]. Так, по данным Летяевой О.И. и др. [18], комбинация с Chlamydia trachomatis выявляется до 30% случаев, с вирусом папилломы человека – до 40%, с кандидозной инфекцией – в 28%, с Gardnerella vaginalis – в 14%.
Клинические проявления. Микоплазменные инфекции, являющиеся довольно широко распространенной ИППП и вызывающие ВЗОМТ, имеют очень широкий спектр клинических проявлений, вплоть до их полнейшего отсутствия. Таким образом, пациенты могут не предъявлять никаких жалоб, что затрудняет диагностику и своевременное адекватное лечение, с развитием различного рода осложнений [19; 20].
В случае же возникновения клинических манифестаций, ассоциированных с микоплазменной инфекцией, например уретрита, последние не отличаются специфическими проявлениями. Пациенты могут жаловаться на жжение, зуд в уретре, болезненность при акте мочеиспускания, дискомфорт в области мочеиспускательного канала, учащенное мочеиспускание, болезненность при половом акте [21].
По данным Taylor-Robinson D., Jensen J.S. (2011), Wetmore (2011) практически всем мужчинам (90%), инфицированным M. genitalium, был выставлен диагноз уретрит. Причем у 3/4 пациентов определялись различные признаки заболевания, характеризующиеся слизисто-гнойными выделениями из наружного отверстия мочеиспускательного канала, зудом, нарушениями мочеиспускания, болевыми ощущения в области наружных половых органов [22; 23].
Тем не менее микоплазмы, длительно персистируя в мочеполовой системе человека и не вызывая никаких клинических проявлений, провоцируют вялотекущее воспаление, имеющее тенденцию к распространению и развитию ВЗОМТ, в том числе уретрита, простатита, эпидидимита, орхита, приводящих к мужской инфертильности, патологическим течениям родов, нарушениям развития плода [24; 25].
Диагностика. Микоплазмы и уреаплазмы имеют мелкие размеры, что затрудняет их диагностику [26]. Показаниями к обследованию на мико-, уреаплазменную инфекцию являются:
– признаки воспаления органов урогенитального тракта, подтвержденные клиническими и/или лабораторными методами диагностики;
– патологические процессы, склонные к рецидивам и связанные с дисбалансом вагинальной микрофлоры;
– обследование обоих половых партнеров при планировании беременности;
– планирующиеся оперативные вмешательства на органах малого таза;
– наличие в анамнезе акушерской или гинекологической патологии;
– риск инфицирования плода при неадекватном течении беременности [27].
Согласно клиническим рекомендациям Российского общества дерматовенерологов (2012), диагностика заболеваний, вызванных мико-, уреаплазменной инфекцией, базируется на данных молекулярно-биологических методов диагностики, основным принципом которых является выявление специфических фрагментов ДНК Ureaplasma spp. и M. hominis, или результатах культуральных методов исследования [28].
Некоторыми специалистами для выявления и количественной оценки U. parvum, U. urealyticum, M. hominis в биологическом материале больного традиционным признается бактериологическое исследование, отмечают его 100%-ную специфичность, а также возможность выделения чистой культуры и определения антибиотикорезистентности [29].
Многие исследователи считают, что для постановки окончательного диагноза и назначения адекватного лечения, помимо обнаружения Ureaplasma spp. и M. Hominis, необходимо определить количественное содержание микоплазм, титр, где клинически значимым является 104 КОЕ/мл [4; 30].
Такие методы серодиагностики, как реакция ингибиции роста, реакция связывания комплемента, реакция ингибиции метаболизма, реакция пассивной гемагглютинации и иммуноферментный анализ M. hominis и Ureaplasma spp., практически не применяются из-за наличия большого количества серотипов этих микроорганизмов и в связи с неизвестностью иммунологического состояния при поражении органов урогенитальной зоны микоплазмами [4; 31].
Однако многие исследователи указывают на то, что молекулярно-биологические методы, позволяющие определить небольшое количество возбудителя (полимеразная и лигазная цепные реакции (ПЦР и ЛЦР), метод транскрипционного анализа, ДНК-зонды), по чувствительности и специфичности выявления возбудителей микоплазменной инфекции превосходят культуральные методы [32; 33].
Лечение. Согласно Федеральным клиническим рекомендациям Российского общества дерматовенерологов и косметологов от 2015 года, препаратами выбора при лечении мико-, уреаплазменной инфекции являются джозамицин, назначаемый по 0,5 г трижды в сутки в течение 10 дней, или доксициклина моногидрат по 100 мг внутрь дважды в сутки на протяжении 10 дней. Альтернативной схемой представляется назначение левофлоксацина 500 мг внутрь 1 раз в сутки на протяжении 10 дней или же офлоксацина по 0,4 г внутрь 2 раза в сутки в течение 10 дней [35].
М.А. Гомберг и соавт. считают, что на данный момент в лечении микоплазменной инфекции из антибактериальных препаратов группы тетрациклина наиболее эффективным является доксициклин, из группы макролидов – это азитромицин и джозамицин, из группы фторхинолонов такими являются офлоксацин и спарфлоксацин [36].
В то же время многие отечественные и зарубежные исследователи указывают на постоянное повышение резистентности микоплазм и уреаплазм к антибиотикам, также наблюдается наличие особенностей устойчивости микоплазм в зависимости от региона [37]. К примеру, в исследовании, проведенном Байтяковым В.В. и др. в Республике Мордовия, М. hominis, выявленные у жителей данного региона, устойчивы к мидекамицину (76,0%) и линкомицину (50,0%). Низкая резистентность была выявлена к ципрофлоксацину (6,0%), доксициклину (6,0%) и офлоксацину (8,0%) [12].
Подобные же результаты получили В.И. Прохоренков и соавт., изучившие чувствительность U. Urealyticum к различным лекарственным средствам. В результате штаммы уреаплазменной инфекции были устойчивы к ципрофлоксацину, составляя 30,5%, эритромицину (22,0%), кларитромицину (16,7%) и азитромицину (11,9%). К тетрациклину оказались устойчивыми 8,5% штаммов, к офлоксацину – 6,8% штаммов, к доксициклину – 3,4% штаммов, к джозамицину – 1,7% штаммов [38]. В.В. Чеботарев, ссылаясь на результаты пятилетней давности, отметил, что почти 95% штаммов остаются чувствительными к джозамицину [39].
Сингур О.А. и соавт. изучали устойчивость возбудителей микоплазменной инфекции к антибактериальным препаратам. Выявлено возрастание резистентности U. urealiticum к ровамицину, достигающей 20%, к доксициклину (12), к макропену - 10%. В то же время уреаплазмы чувствительны к офлоксацину - 97%, левофлоксацину - 96% и азитромицину - 96%. Следует также обратить внимание на возрастание устойчивости M. hominis и M. genitalium к антибиотикам. Так, чувствительность M. hominis к доксициклину упала со 100% до 92%, к джозамицину устойчивость возросла до 5% [40].
А.Э. Карамова и др. при лечении больных с ВЗОМТ, ассоциированными с микоплазменной инфекцией, сравнили эффективность джозамицина и доксициклина. Микробиологический эффект терапии был выше на четверть у больных, получавших джозамицин. Побочные эффекты от назначенной терапии чаще выявлялись при применении доксициклина (20,7%), чем при назначении джозамицина (3,7%) [41].
Данные результаты подтверждаются зарубежными авторами, изучившими эффективность применения азитромицина и доксициклина при лечении уреаплазменной инфекции. Этиологическая излеченность была значительно выше в группе терапии азитромицином [42].
По данным многоцентровых международных исследований, джозамицин в дозировке 0,5 г 3 раза в сутки в течение 10 дней или азитромицин 1,0 г однократно в первый день, затем по 250 мг на протяжении трех дней подряд - самые эффективные схемы применения препаратов [43]. Согласно Европейскому руководству при подозрении и подтверждении инфекции M. genitalium назначается короткий курс азитромицина: 500 мг в первые сутки и по 250 мг на вторые-пятые сутки [44].
Европейские рекомендации по лечению M. genitalium указывают на отсутствие резистентности M. genitalium к антибиотикам группы макролидов. Эффективность применения азитромицина достигает 95%, а доксициклина – лишь 40% [45].
В рекомендациях центра по контролю инфекций, передаваемых половым путем США, CDC, лечение микоплазменной инфекции проводят также азитромицином: первый прием 500 мг перорально, следующие 4 дня по 250 мг, альтернативная схема включает использование доксициклина по 100 мг 2 раза в день внутрь на протяжении 7 дней [46].
Исследования S. Taylor, A. Wikstron, J. Jensen свидетельствуют о том, что при лечении M. genitalium предпочтительнее применять азитромицин, а не доксициклин. Последний, по выводам авторов, не вызывает эрадикации возбудителя [47; 48].
Подтверждают эти данные и рандомизированные исследования, проведенные у 398 мужчин с негонококковым уретритом: к терапии азитромицином оказались резистентными 16% лиц, а к доксициклину – у 64% [49].
Заключение
- Количество заболеваний, ассоциированных с инфекциями, передаваемыми половым путем, в том числе и мико-, уреаплазменной инфекцией, продолжает расти, влияя на социальные, экономические и демографические показатели большинства стран, и России в частности.
- Патогенность M. genitalium давно определена и показана. Большинство авторов подтверждают способность M. hominis и Ureaplasma spp. вызывать воспалительные заболевания органов мочеполовой системы.
- Для диагностических мероприятий наиболее целесообразно использовать молекулярно-биологические методы, в том числе полимеразно-цепную реакцию, обладающие большей чувствительностью и специфичностью в отношении микоплазм и уреаплазм по сравнению с другими методами диагностики.
- Учитывая антибиотикорезистентность мико-, уреаплазменной инфекции, а также побочные эффекты применяемых лекарственных средств, предпочтительным является применение антибиотиков группы макролидов, а именно джозамицина.

В организме человека присутствуют 2 микрофлоры. Это патогенная микрофлора и симбионтная микрофлора. Эти микроорганизмы проживают в теле человека, а точнее в кишечнике. Они питаются той едой, которую ест человек.
Она способствует перевариванию пищи и поставляет организму необходимые для существования витамины и полезные микроэлементы, помогает привести в норму обмен веществ. Она способствует сохранению здоровья человека. Микроорганизмы питаются углеводами и клетчаткой. В овощной и фруктовой диете присутствует множество этих веществ и небольшое количество белка. Это полезно влияет на микрофлору в кишечнике. В качестве пищи эти микроорганизмы могут использовать животные углеводы и клетчатку, которая присутствует в огромных количествах в овощах. Во время размножения симбионтные микроорганизмы поставляют в организм множество полезных питательных веществ, и одновременно растворяет клетчатку на более простые вещества. Эти вещества получили название аминокислоты. Их в качестве строительного вещества применяет организм.
1. Защита. Это препятствие проникновению в кишечник вредных патогенных микробов. Они производят вещества похожие на антибиотики, кислоты. Вещества препятствуют развитию вредных бактерий. Симбионтные микроорганизмы могут препятствовать развитию вирусов в кишечнике.
2. Пищеварение. Полезные элементы регулируют работу всего кишечника и сами перерабатывают полезные вещества.
3. Эта микрофлора может самостоятельно уничтожать и препятствовать развитию токсинов, которые производит патогенная микрофлора.
4. Производственная функция. Микроэлементы этой группы могут создавать в большом объёме полезные витамины, ферменты и гормоны, регулирующие деятельность кишечника.
5. Иммуногенная функция. Эта функция направлена на постоянную тренировку иммунной системы с помощью своих антигенов.
6. Регулирование холестерина в организме. Бифидобактерии не позволяют холестерину всасываться. Его связывают в специальное вещество, которое выводиться из организма.
В здоровом организме такой микрофлоры присутствует не более 1% от всех микроорганизмов в теле человека. Её рост подавляется с помощью полезных микроорганизмов находящихся в желудке. Вредоносные микробы оказываются в организме с помощью, не прожаренной пищи, с грязных рук. Они начинают действовать не мгновенно, а выжидают, до того момента когда иммунитет не ослабнет. Когда это происходит, начинается их активное размножение. Расплодившись до достаточного количества, микробы начинают уничтожать полезные микроорганизмы, вызывая болезни и дисбактериоз. В нормальном организме эта микрофлора присутствует в мизерном количестве, не влияя на его состояние. Наличие большого числа здоровых микроэлементов, способствует уничтожению патогенов и сохранению организма в хорошем состоянии.
Микрофлора возникает также и во время потребления неподходящей для организма пищи. В неё включена такая еда: жареная или копчёная пища, мучные изделия и продукты с большим числом сахара, квашеные продукты, жирная еда. При употреблении такой еды в кишечнике появляется вредная патогенная микрофлора. Эти микроорганизмы во время питания травят организм своими токсинами и ядами. Такие микроорганизмы присутствуют в любом теле человека, но их количество должно быть минимальным, и не вредить организму. Их предназначение в уничтожении несвойственной для тела человека пищи, если она случайно в него попадёт. Она является защитником организма. Со временем она уничтожает микрофлору.
Чтобы восстановить баланс в организме нужно свести к минимуму употребление вредной пищи или отказаться от него вообще. Поможет овощная или фруктовая диета, если её не злоупотреблять. Поедая даже полезные продукты в огромных количествах можно нанести вред организму.
• Условно патогенная микрофлора это кишечная палочка, стафилококки. Эти бактерии способны существовать в организме, обнаруживая своё присутствие только при снижении иммунитета.
• Патогенная микрофлора состоит из холерного вибриона, сальмонелл, клостридий. Эти вредные микробы не присутствуют в кишечнике постоянно, а поступают в него с пищей. Если это случается, в теле человека начинается уничтожение положительных элементов, которое способно создать серьёзные патологии.
В эту категорию входят стрептококки, а также стафилококки. Данные элементы попадают в кишечник через слизистую оболочку или кожу. Бактерии способны вызвать нагноение, пневмонию, стоматит. Если эти микробы распространятся по всему организму, то может развиться менингит, инфекция сердечной мышцы или почек. Klebsiella выделывает токсин уничтожающий флору. В тяжёлых случаях она провоцирует болезни кишечника, дыхательных органов, могут поражаться оболочка мозга, появиться менингит и сепсис. Вылечить болезнь сложно, так как бактерия не реагирует на антибиотики. У детей риск поражения болезнью выше, чем у взрослых.
Инфекции возбуждают патогенные бактерии сальмонеллы и кишечные палочки. Такая микрофлора способна вызвать диарею, тошноту, интоксикацию, лихорадку, инфекцию слизистой оболочки. Клостридии это опасные микроэлементы вызывающие паралич, отравление и гангрену. Во время этих болезней поражаются нервы и ткани. Холерный вибрион способен быстро размножаться и вызвать смерть. Чтобы обнаружить эти элементы выполняют анализы на наличие в кишечнике патогенных микроэлементов.
Эта микрофлора является причиной появления различных болезней. Среди них присутствует дисбактериоз.
Болезнь прогрессирует:
• Неравномерное питание. Приём в качестве пищи белка в крупных объёмах и углеводов вызывает метеоризм и гниение. К вредным веществам относятся нитраты, красители, консерванты, пестициды.
• Продолжительный приём лекарств.
• Химиотерапия, лекарства предназначенные против вирусов.
• Воспаление в кишечном тракте, способствующие уничтожению положительных бактерий.
• Присутствие в организме паразитов выделяющих вредные вещества и токсины. Они поражают иммунитет.
• Вирусы, снижающие производство антител. Это гепатит, иммунодефицит.
• Заражение печени.
• Серьёзный стресс, переутомление.
• Регулярное прочищение кишечного тракта с помощью клизм.
• Приём пищу просроченных продуктов и отсутствие гигиены.
У детей в кишечнике отсутствуют микроорганизмы. Из-за этого дети часто подхватывают различные инфекции. У них часто появляются колики или дисбактериоз. Это происходит когда в желудке малыша количество патогенных веществ превышает норму и полезные микроорганизмы не справляются с таким числом микробов. Своевременное лечение способствует выздоровлению. Во время кормления ребёнка с материнским молоком в его организм попадают полезные микроэлементы, которые размножаясь, способствуют пищеварению и борьбе с вредоносными микробами.
Все могут сделать выбор, как питаться. От этого решения зависит, какую микрофлору будет кормить человек, полезную или нет.
Патогенная микрофлора потребляет вещества, которые получаются после распада животного белка. Если в рационе человека слишком большое количество этих веществ, то патогенная микрофлора будет стремительнее развиваться и отравлять организм токсинами.
Чтобы предотвратить дисбактериоз в питание следует включить:
Бананы и яблоки могут вызвать процесс брожения. При наличии осложнений с кишечником, потребление этих продуктов следует ограничить. Исключение составляют печёные яблоки, которые по своим свойствам не вредят работе кишечника. Они могут впитывать в себя токсины, прекратить диарею, наполнить кишечник полезной клетчаткой.

Установление причинной роли кишечных палочек в возникновении острых кишечных заболеваний довольно затруднительно, поскольку эти микроорганизмы широко распространены в природе, постоянно присутствуют в кишечнике здоровых людей [9] и животных, очень устойчивы к различным физико-химическим факторам и способны развиваться на самых разнообразных средах, в том числе и на пищевых продуктах. Кишечные палочки являются по существу комменсалом человека и важным антагонистическим фактором для гнилостных микроорганизмов, ограничивающим их развитие в кишечнике. Характерно, что по количеству микробов различные отделы желудочно-кишечного тракта здорового человека резко различаются. Количество микроорганизмов возрастает по направлению от желудка к толстому отделу кишечника. При нормальном функционировании желудка микрофлора в нем почти полностью отсутствует. Желудочный сок обладает чрезвычайно выраженными бактерицидными свойствами. В толстом отделе кишечника содержится колоссальное количество микробов. В составе микрофлоры кишечника взрослых людей обнаружено более 260 видов микроорганизмов. Основную массу (96 - 99 %) составляют анаэробные бактерии (бифидобактерии, бактероиды). На факультативно-анаэробную микрофлору, к которой относятся кишечная палочка, лактобациллы, энтерококки, приходится около 1 - 4 % всей кишечной микрофлоры. Менее 0,01 - 0,001 % составляет так называемая остаточная микрофлора [6]. Кишечная палочка играет, безусловно, положительную роль в процессе пищеварения, витаминном балансе, а также в создании местного, кишечного, иммунитета. Большое значение имеет она и в построении общего иммунитета, предполагающего выработку специфических и неспецифических антител. Однако при известных обстоятельствах этот вид микроорганизма способен вызвать различные патологические состояния: колиты, энтериты, циститы, холециститы, сепсис. Иными словами, существует возможность превращения симбиозов нормально биологических в симбиозы патологические. Условно-патогенные микроорганизмы начинают играть роль паразита в том случае, если после окончания заболевания у макроорганизма не установятся с ним вновь симбиотические взаимоотношения [8].
Кишечная палочка (Escherichia coli) впервые была выделена из испражнений человека Т. Эшерихом в 1885 году [3]. Заболевания, вызываемые кишечной палочкой, называют коли-инфекциями, или эшерихиозами [6]. Кишечные инфекции, занимающие ведущее положение в структуре эшерихиозов, связаны с четырьмя различными группами, Е. coli-энтеротоксигенными (ЭТКП), энтероинвазивными (ЭИКП), энтеропатогенными (ЭПКП) и энтерогеморрагическими (ЭГКП) кишечными палочками. Штаммы этих групп различаются прежде всего по факторам патогенности, а также по клиническим проявлениям заболеваний, возбудителями которых они являются.
Энтеротоксигенные штаммы Е. coli вызывают диарею с выраженным болевым синдромом за счет воздействия на ганглиозидные рецепторы энтероцитов продуцируемых ими термолабильного и термостабилыюго энтеротоксинов, что приводит к активизации аденилатциклазиой системы, внутриклеточному накоплению цАМФ и, как следствие, секреции жидкости и электролитов в просвет кишечника [4].
Энтероинвазивные E. coli. обладают способностью к проникновению, инвазии, в слизистую оболочку кишечника и ведут себя в патогенетическом отношении как возбудители дизентерии [6]. Наиболее часто при этом заболевании выделяются О -124 [2], О-136 и О-144 серотипы кишечных палочек [5].
Энтеропатогенные эшерихии, группируемые в 2 класса на основе характера взаимодействия с клеточными культурами НЕр-2 и HeLa, колонизируют эпителий слизистой оболочки тонкой кишки, вызывая возникновение эрозий на его поверхности. Наличие у микроорганизмов плазмидокодируемого О-полисахарида с молекулярной массой 54 мДа способствует антифагоцитарной устойчивости возбудителей и развитию бактериемии.
Патогенез диареи, вызванной энтерогеморрагическими E. coli, связан с синтезом изолятами этой группы двух типов веротоксина, один из которых (SLT-1) имеет структурное и антигенное сродство с токсином S. dysenteriae
серовара 1.
В настоящее время в самостоятельную группу выделяют так называемые энтероадгезивные или аутоагглютинирующие штаммы Е. coli, однако их роль в развитии инфекций ЖКТ выяснена не до конца.
Штаммы патогенных эшерихии различаются также по антигенной структуре [4]. Они имеют три антигена:
- О-антиген (соматический) - термостабильный, не разрушается при длительном кипячении и автоклавировании при температуре
120 °С. - К-антиген - комплекс поверхностно расположенных антигенов, среди которых различают термолабильные (L,В,Vi) и термостабильные (А, М) антигены.
- Н-антиген - жгутиковый термолабильный антиген.
Диагностическое значение имеют все три комплекса антигенов. К настоящему времени патогенные формы кишечных палочек подразделяются на 149 разновидностей по О-антигену, на 94 серологическую разновидность по К-антигену и на 56 серологических разновидностей по Н-антигену [5].
Болезнь, вызываемая ЭПКП, ЭИКП и ЭТКП, клинически проявляется в основном одинаково, варьируя от умеренной диареи до тяжелого холероподобного состояния. Некоторые данные позволяют предположить, что болезнь, вызванная штаммами ЭТКП, вырабатывающими только термостабильный энтеротоксин, протекает быстрее, чем вызванная теми штаммами ЭТКП, которые вырабатывают оба энтеротоксина - термостабильный и термолабильный [6].
Инкубационный период длится от 3 до 6 дней (чаще 4-5 дней) [2]. Начало болезни чаще всего острое. Обычно заболевание начинается с болей в животе, поноса, рвоты и повышения температуры [7], протекая в форме энтерита. Энтерит может быть легкий, среднетяжелый и тяжелый. Стул бывает 3 - 5 раз, иногда до 15 раз в сутки. Испражнения жидкие, пенистые, зловонные. Выздоровление наступает через 5 - 7 дней. Относительно часто бывают рецидивы. В разгар заболевания наблюдаются небольшое повышение СОЭ, умеренный лейкоцитоз со сдвигом влево, моноцитоз, иногда повышение гематокрита [6]. В легких случаях явления токсикоза выражены слабо, температура повышается только до субфебрильной [2]. Среднетяжелые и особенно тяжелые формы сопровождаются повторной рвотой, упорными поносами и повышением температуры до 38 - 39 °С. В результате резкого обезвоживания (IV степень, потеря жидкости, составляющая 10 % массы тела) может наступить гиповолемический шок.
В диагностике эшерихиоза решающее значение приобретает высев возбудителя. Пробы (испражнения для выделения копрокультуры) от больного следует брать с 1 дня заболевания до принятия им антибиотиков или других химиотерапевтических препаратов, которые снижают возможность выделения возбудителя. Испражнения больных собирают в индивидуальное чистое подкладное судно или горшок (у грудных детей - с пеленок). Сбор материала можно производить, не дожидаясь дефекации, с помощью ректальных ватных или ватно-марлевых тампонов (укрепленных на деревянной палочке или проволочной петле), стеклянной ректальной трубки (длина трубки 15 - 20 см диаметр для детей 5 мм, для взрослых 10 мм). Ректальный тампон или трубку вводят в прямую кишку детям на 8-10 см, взрослым - на 10 - 15 см, укладывая больных на левый бок с полусогнутыми коленями [6].
Профилактические мероприятия сводятся к соблюдению санитарногигиенического режима и правил личной гигиены. Специфическую профилактику не проводят. Для лечения используют левомицетин, неомицин и другие антибиотики. При хронической инфекции применяют бактериофаги и аутовакцину. При кишечном дисбактериозе используют колибактерии, приготовленный из живой культуры штамма кишечной палочки М17 [1].
Золотистый стафилококк (Staphylococcus aureus) – грамположительная условно-патогенная бактерия, распространенная повсеместно. В норме золотистый стафилококк могжет находиться у человека на слизистой оболочке носа, в брюшной полости и на коже.
Попав в организм человека, золотистый стафилококк вырабатывает токсины и может стать источником сепсиса при снижении иммунитета, вызывая генерализованные инфекции с очагами воспаления во внутренних органах, коже и костно-мышечной системе.
Основные источники инфекции: здоровые (носители) и больные люди, домашние и сельскохозяйственные животные, а также пища, содержащая золотистый стафилококк и его мощные токсины (чаще всего это сахаросодержащие молочные продукты, мороженное, кондитерские изделия без термообработки, салаты и т.п.).
Дети могут инфицироваться от взрослых стафолококконосителей. У детей грудного возраста возможно выделение стафилококка в посевах фекалий.
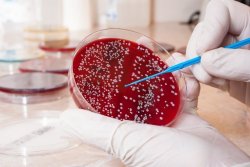
В эпидемиологических целях анализ на выявление патогенного стафилококка обязательно проводят во время ежегодных профилактических осмотров и при предварительных осмотрах для приема на работу в сферы обслуживания населения: медицины, образования, питания и торговли. В данном случае посев выполняется из носа и зева.
При наличии патогенного стафилококка в пробе обследуемого, через 18-24 часа наблюдается рост колоний золотистого цвета. В этом случае обязательно определяется количество стафилококка. Это необходимо врачу для решения вопроса о том, нужно ли проводить лечение.
Наличие золотистого стафилококка не обязательно означает инфекцию, это может быть бессимптомное носительство, например, при посеве мазков из носа и зева носительством считается количество бактерий до 10 3 КОЕ. Однако более высокие показатели говорят о том, что это уже не бессимптомное носительство, а то, что выявленный золотистый стафилококк может являться причиной заболевания.
- Для выяснения бактерионосительства или опасного инфицирования.
- Для подтверждения, что стафилококк является причиной возникшего заболевания (об этом свидетельствуют высокие показатели посева).
- Для определения целесообразности лечения.
- Для контроля за состоянием пациента после проведенного лечения.
Исследование можно пройти по направлению от лечащего врача вашей поликлиники, если есть клинические показания или на платной основе.
Лаборатория клинической микробиологии (бактериологии) Мурманской областной больницы предлагает следующие услуги по обнаружению патогенного стафилококка:
Микробиологическое (культуральное) исследование отделяемого зева на патогенный стафилококк
Микробиологическое (культуральное) исследование отделяемого носа на патогенный стафилококк
Микробиологическое (культуральное) исследование испражнений на стафилококк
Срок выполнения анализа: от 2 до 5 рабочих дней.
Подготовка к исследованию:
- Сбор материала проводится до начала лечения антибактериальными, иммунобиологическими препаратами (общего и местного значения).
- При контроле эффективности лечения (после окончания курса лечения) исследование проводится через 14 дней.
- Мазок из зева собирают натощак или через 3–4 часа после приема пищи.
- Перед взятием мазка из носа нельзя промывать носовые ходы.
- Желательно за 2–3 дня до взятия пробы находиться на диете, исключающей приём продуктов, усиливающих процессы брожения в кишечнике и молочнокислые продукты, а также алкоголь.
- За 3–4 дня до исследования необходимо отменить приём слабительных препаратов, касторового и вазелинового масла и прекратить введение ректальных свечей.
- Фекалии собираются ложечкой в стерильный одноразовый контейнер с завинчивающейся крышкой в количестве не более 1/3 объёма.
- Для получения достоверного результата - пробы фекалий храните в темном месте при температуре не выше 20—25 °С, во избежание чрезмерного размножения кишечной микрофлоры.
- Пробы фекалий не замораживайте.
Читайте также:


