Трансплантация костного мозга инфекции

Трансплантация костного мозга (ТКМ) / стволовых кроветворных клеток периферической крови (ТСКК) - метод лечения гематологических, онкологических и аутоиммунных заболеваний, при котором пациенту после проведения интенсивной иммуносупрессивной терапии с применением больших дозы цитостатических препаратов (иммуносупрессантов), вводят предварительно заготовленный костный мозг или стволовые кроветворные клетки периферической крови (СКК). Ежегодно в мире выполняется около 150 000 ТКМ и ТСКК, причем количество операций постоянно увеличивается.
ОБЩАЯ ИНФОРМАЦИЯ О СТВОЛОВЫХ КРОВЕТВОРНЫХ КЛЕТКАХ
Недифференцированная стволовая клетка, происходящая из бластоцисты, является родоначальницей всех клеток организма, в том числе и стволовой кроветворной клетки (СКК).
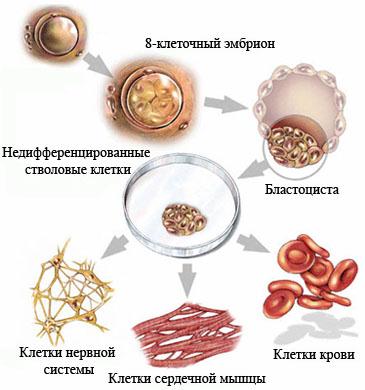
Основными свойствами стволовой кроветворной клетки являются возможность дифференцироваться в направлении любого из ростков кроветворения и способность к самоподдержанию.
 Колонии стволовых кроветворных клеток (электронная микроскопия) | 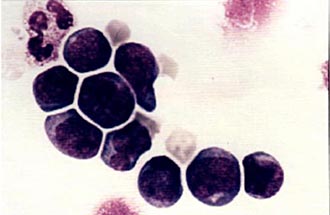 Мононуклеарная фракция, обогащенная клетками CD34, окрашена по Маю-Грюнвальду с докраской по Гимзе. Стволовые клетки, несущие маркер CD34, внешне напоминают малые и средние лимфоциты. |
ИСТОРИЧЕСКАЯ СПРАВКА
Первые работы, посвященные терапевтическому использованию костного мозга, были выполнены в последней декаде XIX века, независимо друг от друга Brown-Sequard, d"Arsonval, Fraser, Billings и Hamilton, которые применяли экстракт костного мозга животных для лечения больных различными видами анемий. Несмотря на положительный эффект, отмеченный всеми авторами, в течение последующих пятидесяти лет использование данной методики носило спорадический характер и не выходило за рамки клинического эксперимента до 1937 года когда Schretzenmayr впервые произвел парентеральное (внутримышечное) введение костного мозга, а в 1939 году Osgood выполнил первое внутривенное введение костного мозга.
Результаты экспериментальных исследований привели клиницистов к идее использования ТКМ при заболеваниях, связанных с поражением костного мозга (лейкозы, апластическая анемия), а также при радиационных воздействиях и проведении химиотерапии, однако основные теоретические и практические проблемы проведения ТКМ удалось преодолеть в 60-е годы. С этого времени ТКМ является одним из методов лечения различных заболеваний крови и иммунной системы.
ВИДЫ ТРАНСПЛАНТАЦИИ КОСТНОГО МОЗГА
Выделяют два основных вида ТКМ:
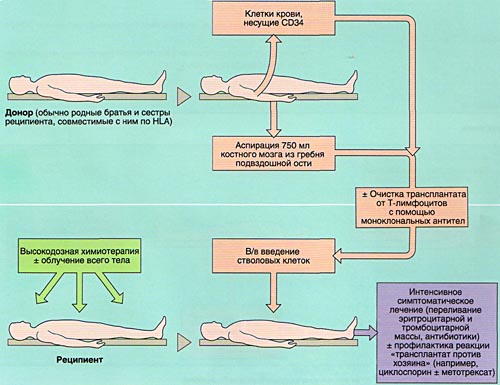
- 1)аллогенную (АллоТКМ) - при которой больному вводится костный мозг от родственного или неродственного совместимого донора;
Разновидностью АллоТКМ является сингенная ТКМ (трансплантация от однояйцевого близнеца).
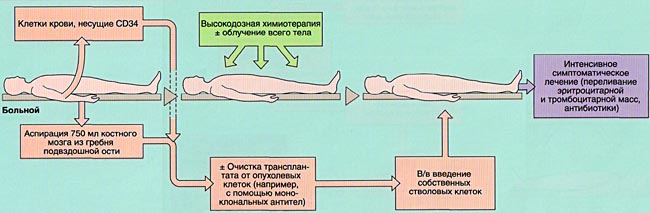
- 2)аутологичную (АутоТКМ) - когда реципиент получает предварительно заготовленный собственный костный мозг;
ПОКАЗАНИЯ К ТРАНСПЛАНТАЦИИ КОСТНОГО МОЗГА
Аллогенная трансплантация костного мозга:
- 1) острые лейкозы;
- 2) хронический миелолейкоз;
- 3) тяжелая апластическая анемия;
- 4) гемоглобинопатии;
- 5) врожденные иммунодефициты и нарушения метаболизма.
Аутологичная трансплантация костного мозга:
- 1) злокачественные лимфомы;
- 2) некоторые солидные опухоли;
- 3) аутоиммунные заболевания.
В связи с ограниченным количеством родственных гистосовместимых доноров, которые имеются лишь у 20- 25% больных, в последние годы нашла применение АлТКМ от неродственных HLA-идентичных доноров. Для этих целей созданы международные регистры, позволяющие подобрать потенциального донора костного мозга и оптимизировать прогноз у пациентов, для которых АллоТКМ предпочтительнее (острые лейкозы, хронический миелолейкоз) или является методом выбора (апластическая анемия, гемоглобинопатии, иммунодефициты, нарушения метаболизма). Общее число зарегистрированных доноров в мире превышает 5 миллионов человек, в том числе в России - около 10 тысяч.
С развитием появлением колониестимулирующих факторов и развитием технологий клеточной сепарации с 70-х годов для получения гемопоэтических клеток крови вмести костного мозга стали использовать стволовые клетки периферической крови.
Применение клеточных сепараторов значительно упростило проведение процедуры получения стволовых клеток крови, уменьшило число осложнений связанных с дачей наркоза и травматическим повреждения костной ткани.
Еще одним потенциальным источником СКК является пуповинная кровь, основным преимуществом которой является меньшая иммуногенность, однако малое количество стволовых клеток в материале ограничивает ее применение и используется преимущественно в педиатрии или у пациентов с массой тела до 50 кг.
Методика проведения миелотрансплантации различается в зависимости от ее вида (аллогенная или аутологичная), нозологической формы заболевания и ряда других факторов.
ПРАКТИЧЕСКИЕ АСПЕКТЫ МИЕЛОТРАНСПЛАНТАЦИИ
При любой методике ТКМ/ТСКК можно выделить следующие этапы:
- 1) определение показаний и противопоказаний;
- 2) выбор донора (при аллогенной трансплантации);
- 3) получение костного мозга/стволовых клеток их обработка, хранение и введение;
- 4) кондиционирование (иммуносупрессивная терапия);
- 5) профилактика и лечение осложнений периода цитопении;
- 6) профилактика и лечение поздних осложнений.
ОПРЕДЕЛЕНИЕ ПОКАЗАНИЙ И ПРОТИВОПОКАЗАНИЙ
Наиболее частыми показаниями к ТКМ/ТСКК являются онкогематологические и гематологические заболевания (лейкозы, злокачественные лимфомы, апластическая анемия, врожденные иммунодефициты и нарушения метаболизма).
Чаше всего ТКМ или ТСКК проводится во время полной ремиссии (ПР), частичной ремиссии (ЧР) или при рецидиве опухоли, чувствительном к химиотерапии. При первичной резистентности к цитостатической терапии результаты ТКМ резко ухудшаются, поэтому в этих случаях операция выполняется относительно редко.
При некоторых заболеваниях трансплантация является методом выбора (тяжелые формы апластической анемии, гемоглобинопатии, врожденных иммунодефицитов и нарушений метаболизма). В ряде случаев ТКМ/ТСКК проводится при солидных опухолях и аутоиммунных заболеваниях. Данная методика имеет возрастные ограничения: АутоТКМ/ТСКК может быть выполнена у лиц моложе 65 лет, АллоТКМ от HLA-идентичного родственника - моложе 55 лет, неродственная АллоТКМ - моложе 50 лет.
Проведение трансплантации противопоказано при:
- 1) нарушении функции внутренних органов (почек, печени, легких, сердечно-сосудистой системы);
- 2) активной инфекции;
- 3) плохом общесоматическом статусе (индекс ВОЗ > I)
- 4) резистентном к химиотерапии рецидиве солидной опухоли или
- онкогематологического заболевания;
- 5) рефрактерности к трансфузиям тромбоцитов.
ВЫБОР ДОНОРА
Совместимость костного мозга определяет результаты АллоТКМ. Родственными донорами считаются совместимые по системе HLA братья или сестры реципиента (сибсы). Родители и дети гаплоидентичны (имеют одну общую хромосому из каждой пары, т. е. совпадают между собой на 50%) и не могут быть донорами аллогенного костного мозга. Совместимые сибсы имеются лишь у 20-25% больных, в связи с чем в последние 10 лет активно внедряется АллоТКМ от неродственных HLA-идентичных доноров или частично совместимых родственных доноров.
МОБИЛИЗАЦИЯ, ОБРАБОТКА И ИНФУЗИЯ СТВОЛОВЫХ КРОВЕТВОРНЫХ КЛЕТОК
Аспирация костного мозга производится под эндотрахеальным наркозом из задних гребней подвздошной кости, при необходимости - также из передних гребней и грудины. Для этого используют удлиненные иглы типа иглы Кассирского и шприцы объемом 20 см3, содержащие гепарин. Во избежание значительного разведения периферической кровью из каждого прокола кости аспирируют не более 5-6 мл костномозговой взвеси, которую фильтруют и помещают в специальные контейнеры. В каждом контейнере подсчитывают количество ядросодержащих клеток. Для восстановления кроветворения при АутоТКМ требуется получить не менее 1,5x106 ядросодержащих клеток на кг массы тела реципиента, при родственной АллоТКМ - не менее 2х106/кг (у больных апластической анемией - не менее 3х106/кг), при неродственной АлТКМ - не менее 3х106/кг. Объем аспирируемой костномозговой взвеси составляет около 1,5 л.
Для сохранения жизнеспособного костного мозга перед АутоТКМ (между аспирацией и инфузией клеток проходит от 2-3 недель до нескольких лет) после фракционирования его консервируют в жидком азоте под защитой криопротектора (чаще всего - диметилсульфоксида).
 А) |  Б) |
Б) извлеченный из сосуда контейнер с костным мозгом
Инфузия аллогенного, размороженного аутологичного костного мозга или СКК периферической крови проводится внутривенно, капельно после предварительного введения антигистаминных препаратов для предотвращения аллергических реакций.
ИММУНОСУПРЕССИВНАЯ ТЕРАПИЯ (КОНДИЦИОНИРОВАНИЕ)
Задача кондиционирования - обеспечить глубокую депрессию иммунной системы, а при онкологических заболеваниях и уничтожение оставшихся опухолевых клеток при умеренной токсичности для других органов и систем, а также создании условий для успешного приживления трансплантата.
Для проведения кондиционирования используются стандартные протоколы, в которых указываются дни, часы, дозы и длительность введения цитостатиков, симптоматических препаратов (антибактериальных, седативных, противорвотных и др., объем и характер инфузии), при необходимости - порядок проведения лучевой терапии. Протоколы кондиционирования различаются в зависимости от характера заболевания и типа трансплантации.
ПРОФИЛАКТИКА И ЛЕЧЕНИЕ ОСЛОЖНЕНИЙ ПЕРИОДА ЦИТОПЕНИИ
Вскоре после окончания кондиционирования и введения СКК у больного развивается аплазия костного мозга (период отсутствия костного мозгового кроветворения), которая проявляется практически полным отсутствием клеток крови (панцитопенией) и продолжается в среднем 4 недели. Этот период опасен развитием тяжелых осложнений (инфекции, кровоточивость и т.д.).
Основную опасность в периоде цитопении представляют инфекционные осложнения, поэтому их профилактика, своевременное и адекватное лечение являются необходимым условием успешной ТКМ.
Профилактика инфекционных осложнений начинается в среднем за 2 недели до трансплантации и включает:
- 1) помещение больного в стерильный бокс и проведение необходимых санитарно-гигиенических мероприятий (обработка кожи, слизистых оболочек и перианальной области дезинфицирующими растворами);
- 2) подавление микрофлоры кишечника с помощью антибактериальных и противогрибковых препаратов.
Также по показаниям проводится переливание компонентов крови (эритроцитарная масса, тромбомасса, плазма).
Приживление костного мозга или СКК периферической крови констатируют по результатам анализа костного мозга. Вскоре количество нейтрофилов достигает > 0,5*109/л, а тромбоцитов > 20>
Резюме. Оценка возможностей терапии штаммспецифическими антителами

Инфицирование и реактивация цитомегаловирусной инфекции у пациентов после трансплантации костного мозга или гемопоэтических стволовых клеток являются распространенными и нередко фатальными осложнениями. Как было показано ранее, разработка эффективной вакцины против данной инфекции была затруднена, а применение противовирусной терапии, в свою очередь, ограничивалось ее токсичностью и появлением лекарственно-устойчивых штаммов. Ранее в исследованиях, сосредоточенных на поиске возможностей улучшения результатов терапии цитомегаловирусной инфекции, основное внимание уделялось разработке и совершенствованию противовирусных препаратов либо применению Т-клеточной иммунотерапии, позволяющей облегчить течение инфекционного процесса и снизить заболеваемость. В клинических исследованиях изучены факторы риска реактивации цитомегаловирусной инфекции у пациентов на фоне трансплантации костного мозга. Однако полученные данные имели ассоциативный характер.
Цитомегаловирусы — вирусы подсемейства бетагерпесвирусов семейства Herpesviridae. Известно, что в популяции более половины лиц в возрасте до 40 лет инфицированы данным вирусом. После первичного инфицирования и тех или иных клинических проявлений различной степени выраженности вирус персистирует в неактивном состоянии. Однако цитомегаловирусная инфекция является одним из наиболее распространенных осложнений у лиц, перенесших трансплантацию костного мозга. Предыдущие исследования по изучению механизмов реактивации цитомегаловирусной инфекции у таких пациентов были сосредоточены на изучении роли Т-лимфоцитов. Лишь отдельными исследователями рассматривались предположения о том, что антитела, продуцируемые В-лимфоцитами, играют определенную, но, похоже, вспомогательную роль в противовирусной защите. Более того, результаты проводимых клинических испытаний с применением антител не были удовлетворительными.
Тем не менее коллективом исследователей под руководством профессора Джеффри Р. Хилла (Geoffrey R. Hill) на моделях трансплантации костного мозга у лабораторных мышей было показано, что активность штаммспецифических антител В-лимфоцитов прямо определяет супрессию цитомегаловирусов без необходимости в каких-либо других иммунных клетках.
В ходе исследования ученые инфицировали лабораторных животных штаммами цитомегаловируса, после чего наблюдали симптомы первичной инфекции, вслед за чем — реконвалесценцию животных с закономерной персистенцией вирусной инфекции.
3 мес спустя лабораторным мышам проводили трансплантацию костного мозга на фоне эффективной иммуносупрессивной терапии. В серии дальнейших экспериментальных наблюдений командой исследователей установлено, что В-лимфоциты играют ключевую роль в контроле активности цитомегаловирусов. Так, у мышей, подвергшихся трансплантации костного мозга и не имеющих ранее синтезированных специфических антител вследствие терапевтической иммуносупрессии, наблюдалась реактивация цитомегаловирусной инфекции спустя 10 дней после трансплантации. После проведения оценки 8 различных штаммов цитомегаловирусов ученые констатировали, что животные, получавшие антитела того же штамма вируса, которому они ранее подвергались, были полностью защищены от вирусной реактивации.
Таким образом, наблюдаемые результаты позволили авторам описать механизмы реактивации цитомегаловируса после трансплантации, а также предложить потенциальную лечебную стратегию, позволяющую избежать ограничений клеточной терапии.
В заключение исследователи подчеркнули, что в будущем может быть разработана терапевтическая модель, основанная на заборе типоспецифических антител у пациентов, подвергшихся ранее вирусному инфицированию и в дальнейшем перенесших трансплантацию костного мозга. Далее, согласно дизайну модели лечения, такие антитела будут очищены и реплицированы в лабораторных условиях, а затем возвращены пациенту после трансплантации. В настоящее время командой исследователей проводятся клинические испытания по проверке предложенного терапевтического подхода.
- Fred Hutchinson Cancer Research Center (2019) Scientists learn how common virus reactivates after transplantation: Antibody-producing B cells, not disease-fighting T cells, protect against reactivation of cytomegalovirus. ScienceDaily, Jan. 17.
- Martins J.P., Andoniou C.E., Fleming P. et al. (2019) Strain-specific antibody therapy prevents cytomegalovirus reactivation after transplantation. Science, 363(6424): 288–293.
Наталья Савельева-Кулик
Отделение трансплантации костного мозга (ТКМ) в РДКБ было открыто в 1993 году для оказания специализированной помощи детям с гематологическими, онкологическими, иммунологическими заболеваниями и наследственными дефектами метаболизма, нуждающимся в трансплантации гемопоэтических стволовых клеток.
В отделении накоплен большой опыт по проведению трансплантаций у детей со следующими заболеваниями:
- Приобретенная и врожденная апластическая анемия;
- Острый миелобластный лейкоз;
- Острый лимфобластный лейкоз;
- Ювенильный миеломоноцитарный лейкоз;
- Миелодиспластический синдром;
- Первичный иммунодефицит (тяжелая комбинированная иммунная недостаточность, хроническая гранулематозная болезнь, синдром Вискотта-Олдрича, синдром Ниймеген, гемофагоцитарный лимфогистиоцитоз, синдром гипериммуноглобулинемии IgM 1 типа, врожденный агранулоцитоз, Х-сцепленный лимфопролиферативный синдром, синдром Чедиака-Хигаши, дефицит адгезии лейкоцитов);
- Остеопетроз;
- Рассеянный склероз;
- Оптикомиелит Девика;
- Мукополисахаридоз I типа (синдром Гурлер, Х-сцепленная адренолейкодистрофия, метахроматическая лейкодистрофия);
- Солидные опухоли (нейробластома, опухоли ЦНС);
- Лимфомы.
Отделение ТКМ оснащено 12 палатами, оборудованными климатическими установками, обеспечивающими стерильный режим. Мощность отделения рассчитана для ежегодного проведения 80–100 трансплантаций гемопоэтических стволовых клеток костного мозга, стволовых клеток периферической и пуповинной крови. Отделение имеет в своей структуре операционную для получения гемопоэтических клеток из периферической крови. Забор костного мозга проводится в условиях операционного блока РДКБ. В лаборатории отделения ТКМ осуществляется обработка трансплантатов и, при необходимости, хранение в криобанке.


В отделении проводят следующие виды трансплантаций:
- Аутологичные;
- Аллогенные:
- от HLA-идентичных родственных доноров;
- от неполностью HLA-совместимых родственных доноров (гаплоидентичных);
- от неродственных доноров.
Около 80% трансплантаций, выполняемых в РДКБ, являются аллогенными. В отделении организована собственная служба по поиску неродственных доноров костного мозга, разработан алгоритм работы с российскими и международными регистрами. Внедрены все виды трансплантации гемопоэтических клеток при всех показаниях. Достигнуты результаты выживаемости, полностью соответствующие лучшим стандартам. Разработаны новые эффективные протоколы трансплантации при широком спектре злокачественных и незлокачественных заболеваний. Осуществлен идеологический и технологический прорыв в области трансплантации от неродственных и гаплоидентичных доноров, позволивший резко снизить количество и тяжесть посттрансплантационных осложнений.

В плане оптимизации диагностики, профилактики и лечения инфекционных осложнений усовершенствован инфекционный контроль (модернизирован инфекционный мониторинг, своевременно внедряются в практику новые эффективные препараты, совершенствуется алгоритм проведения превентивной терапии при трансплантации), полностью решена проблема клостридиальной инфекции в отделении. Разработаны схемы клеточной терапии, позволяющие ускорить иммунореконституцию и решить вопрос гипофункции трансплантата. Оптимизированы и внедрены новые технологии для профилактики и лечения иммунных осложнений трансплантации, при этом предусмотрены методы иммуномодуляции и клеточной терапии (донорские лимфоцитарные фракции, мезенхимальные стволовые клетки, Т-регуляторные клетки). Модифицированы схемы профилактики и лечения с расширением иммуносупрессивного арсенала, развивается узконаправленная таргетная терапия, селективная иммуносупрессия.
Работа в плане минимизации риска токсических осложнений, обусловленных режимом кондиционирования (кондиционирование со сниженной токсичностью для пациентов с врожденной и приобретенной апластической анемией, промежуточного риска острого миелобластного лейкоза, использование треосульфан-содержащих режимов), привела к снижение частоты тяжелых мукозитов с 75% до 20%. Введение новых препаратов позволило эффективно профилактировать и лечить веноокклюзивную болезнь печени и тромботическую микроангиопатию. За последние 12 лет не было ни одного случая тяжелой веноокклюзионной болезни.
В 1992 году в РДКБ проведена первая трансплантация костного мозга (на базе отделения реанимации), в 1997 — первая в России трансплантация аллогенной пуповинной крови и первая неродственная трансплантация у ребенка. 2004 год — начало трансплантаций в России пациентам с метаболическими заболеваниями, с 2005 года началось использование аппаратной иммуномагнитной клеточной селекции/деплеции для трансплантаций от гаплоидентичного донора, 2010 год — первые в России трансплантации при рассеянном склерозе у детей и 2012 год — при оптикомиелите Девика.
РДКБ является членом Европейской группы по трансплантации костного мозга (EBMT CIC 411), входит в состав рабочих групп ЕВМТ по аутоиммунным и педиатрическим заболеваниям; Международного общества детской онкологии (SIOP). Сотрудники отделения ТКМ являются активными членами региональной общественной организации Национального общества детских гематологов и онкологов (НОДГО), Российского общества детских онкологов (РОДО). РДКБ ведет совместную работу с НМИЦ ДГОИ имени Дмитрия Рогачева и другими гематологическими, онкологическими и трансплантационными центрами.
Сотрудники отделения ТКМ принимают активное участие во Всероссийских и Международных симпозиумах и конференциях, посвященных проблемам трансплантации костного мозга. Только в 2018 году сотрудниками отделения опубликовано 25 оригинальных статей в отечественных и зарубежных журналах и сделано 22 устных и постерных доклада. Всего насчитывается более 250 публикаций.
В РДКБ внедрено качественное диспансерное наблюдение, профилактика и лечение поздних осложнений у больных после трансплантации костного мозга, разработаны методические рекомендации. Существует преемственность в работе отделений РДКБ, сопряженных с ТКМ: гематологии и химиотерапии № 1 и № 2, клинической иммунологии и ревматологии, онкологии, медицинской генетики, психоневрологии и дневного стационара.
Врачебный персонал

Скоробогатова Елена Владимировна
Зав. отделением — врач анестезиолог-реаниматолог

Буря Александра Евгеньевна
Врач анестезиолог-реаниматолог

Константинова Вероника Владиковна
Врач анестезиолог-реаниматолог
Благонравова Оксана Леонидовна
Врач клинической лабораторной диагностики

Филина Ольга Александровна
Врач-трансфузиолог

Мачнева Елена Борисовна
Врач-гематолог

Мезенцева Анастасия Владимировна
Врач анестезиолог-реаниматолог

Ольхова Людмила Владимировна
Врач детский онколог
Герасимова Юлия Владимировна
Врач-гематолог

Андропова Галина Васильевна
Старшая медицинская сестра

Центр трансплантации костного мозга (стволовых клеток)
В отделении трансплантации костного мозга вместимостью 20 стационарных койко-мест команда медиков отделения, состоящая из профессора гематологии со специализацией в области трансплантации стволовых клеток, врач-специалист в области биологии с опытом выполнения афереза и криоконсервации костного мозга, опытных медсестер и технического персонала, обеспечивает уход пациентов на уровне самых высоких стандартов.
Все палаты отделения предусматривают одноместное размещение пациентов и оснащены фильтрами HEPA на уровне мировых стандартов, которые обеспечивают очистку воздуха от пыли и бактерий. Содержание и качество продуктов питания для наших пациентов постоянно подвергается проверке опытным диетологом, при этом особое внимание уделяется нейтропенической диеты (без содержания бактерий).
До и после трансплантации обеспечивается психологическая поддержка пациентов специалистом-психологом. Помимо этого, фармацевт отвечает за подготовку и хранение химиотерапевтических и других фармацевтических агентов.
Что такое костный мозг и гемопоэтические стволовые клетки?
Костный мозг — это мягкая губчатая ткань внутри трубчатых костей скелета, содержащая кровь и стволовые клетки. Стволовые клетки преобразуются в красные кровяные клетки (эритроциты), белые кровяные клетки (лейкоциты) и кровяные пластинки (тромбоциты).
Что такое пересадка костного мозга?
Трансплантация костного мозга обеспечивает возможность выполнения лечения путем введения адекватных и целебных доз медикаментозных препаратов при определенных злокачественных или доброкачественных заболеваниях крови, лимфатической системы или костного мозга. При таких заболеваниях организм пациентов не способен продуцировать достаточное количество кроветворных клеток в течение длительных периодов времени и по этой причине могут возникнуть серьезные осложнения, такие как кровотечение и инфекция, которые могут привести к смерти. Таким образом, трансплантация костного мозга позволяет проводить терапию высокими дозами лекарственных препаратов и сократить период восстановления пациента.
Какие источники стволовых клеток используются при трансплантации костного мозга?
Существует три типа трансплантации костного мозга:
Аллогенная трансплантация: пациент получает стволовые клетки от другого человека — обычно от одного из братьев или сестер или члена семьи, а также иногда от неродственного донора с совместимостью по соответствующим тканевым группам.
Аутологичная трансплантация: для трансплантации используются предварительно собранные и хранящиеся собственные стволовые клетки пациента.
Сингенная трансплантация: пациент получает стволовые клетки, полученные от здорового генетически идентичного близнеца.
Как выполняется аутологичная трансплантация костного мозга?
Первоначально проводится лечение, направленное на уничтожение пораженных клеток. Затем вводятся определенные препараты для предупреждения рецидива заболевания, а стволовые клетки извлекают и замораживают. После этого этапа проводится химиотерапия с высокой дозой для уничтожения остаточных пораженных клеток. Наконец, здоровые стволовые клетки трансплантируются обратно пациенту.
Существует ли риск, связанный с аутологичной трансплантацией костного мозга?
Обычно процедура хорошо переносится пациентами. Поскольку используются собственные стволовые клетки пациентов, в этой группе пациентов значительно низкий уровень риска. Высокие дозы лекарственных препаратов могут вызвать побочные эффекты, такие как рвота, тошнота, понос или волос потери, которые исчезают самостоятельно после завершения лечения.
Как выполняется аллогенная трансплантация костного мозга?
Первоначально проводится лечение, направленное на уничтожение пораженных клеток у реципиента. Стволовые клетки извлекаются из крови братьев и сестер или неродственного донора с совместимостью соответствующих тканевых групп. На этом этапе применяются высокие дозы химиотерапевтических препаратов для уничтожения остаточных пораженных клеток. После завершения химиотерапии извлеченные стволовые клетки донора вводятся пациенту-реципиенту. Для родственных и неродственных доноров данная процедура не имеет абсолютно никаких рисков. Необходимые стволовые клетки быстро восстанавливаются в организме, продуцирующем новые стволовые клетки, таким образом, предотвращая возникновение каких-либо заболеваний или расстройств.
Существует ли риск, связанный с аллогенной трансплантацией костного мозга?
Как происходит сбор стволовых клеток?
Несмотря на то, что стволовые клетки могут быть извлечены непосредственно из костного мозга, в настоящее время этот метод редко используется. Вместо этого сбор выполняется методом выделения стволовых клеток из периферической крови, забираемой из вены на руке или шее, путем афереза в специальном устройстве. Процедура сбора стволовых клеток не требует анестезии ни для донора, ни для пациента.
Почему выполняется замораживание стволовых клеток при трансплантации костного мозга?
Как извлекаются стволовые клетки из периферической крови?
Что происходит после пересадки стволовых клеток?
После входа в кровообращение реципиента, стволовые клетки оседают в костном мозге и начинают продуцировать эритроциты, лейкоциты и тромбоциты. После трансплантации для начала производства кровяных клеток обычно требуется 2 -4 недели. Время полного восстановления иммунных функций зависит от типа трансплантата. Этот период занимает, как правило, несколько месяцев для получателей аутологичных стволовых клеток и от 1 до 2 лет в случаях выполнения аллогенной трансплантации.
Для каких пациентов может быть выполнена трансплантация костного мозга?
- Острый миелобластный лейкоз
- Острый лимфобластный лейкоз
- Неходжкинская лимфома
- Ходжкинская лимфома
- Множественная миелома
- Миелодиспластический синдром
- Хроническая миелоцитарная лейкемия
- Апластическая анемия
- Пароксизмальная ночная гемоглобинурия
- Первичный амилоидоз
- Генетические заболевания: талассемия
Как протекает жизнь после трансплантации костного мозга?
После выписки из больницы восстановление обычно занимает около 1 года — для пациентов после аллогенной трансплантацией, и 2-4 месяца для пациентов после трансплантации аутологичных стволовых клеток. Как правило, в течение 6 месяцев после трансплантации пациентам не разрешается работать полный рабочий день. В течение первых нескольких недель пациент может чувствовать сильную слабость. Вместе с этим пациентам следует двигаться в пределах дома. Перед выпиской каждому пациенту предоставляется подробный инструктаж по вопросам образа жизни, питания и последующих визитов к врачу.
Какие тесты выполняются для пациентов и доноров до трансплантации стволовых клеток?
Перед трансплантацией, как для пациента, так и для донора, выполняется анализ крови, мочи, исследования легких, печени, анализы на гепатит и инфекции. По результатам исследования, в случае необходимости, выполняется последующее лечение. В случае наличия проблем стоматологического характера, выполняется лечение зубов. Особое значение уделяется оценке дыхательной и сердечной деятельности пациента. Выполняется оценка проблем печени и психологического состояния. При необходимости, назначается поддерживающее лечение. Пациенту предоставляется подробная информация по трансплантации стволовых клеток. После получения информированного согласия пациента по мере необходимости начинается выполнение лечения.
Как происходит сбор стволовых клеток?
Читайте также:


