Стандарт лечения гнойные и инфицированные раневые поверхности
А.А. АЛЕКСЕЕВ, профессор; А.Э. БОБРОВНИКОВ, доцент
Ожоги являются одним из широко распространенных видов травматизма. В России ежегодно регистрируется более 400 тысяч пациентов с термическими ожогами. При этом только 30% из их числа нуждаются в госпитализации, остальные больные лечатся в поликлинике. Кроме того, большинство больных с последствиями термической травмы после выписки из стационара также продолжают лечение и реабилитацию в амбулаторных условиях. Поэтому эффективное лечение пострадавших от ожогов зависит не только от специалиста-комбустиолога, работающего в ожоговом центре. Во многом квалифицированная медицинская помощь при ожогах на поликлиническом этапе определяет их дальнейшее течение, возможность развития осложнений и исход травмы.
Местное лечение ожогов проводится на всех этапах эвакуации и лечения обожженных в соответствии с установленным объемом медицинской помощи для каждого из этапов.

Первая помощь пострадавшим от ожогов должна оказываться сразу, уже на месте происшествия и начинаться с прекращения действия термического агента и по возможности удаления всех материалов, соприкасающихся с обожженной поверхностью (одежда, украшения и т.д.). Далее при локальных ожогах до 10% поверхности тела необходимо охлаждение поврежденных участков кожи не менее 15—20 минут с помощью воды или использования холодных предметов. Немедленное, не позднее 30 минут после травмы охлаждение обожженной поверхности сокращает время перегревания тканей, препятствуя действию термического агента на глубжележащие ткани. Охлаждение уменьшает отек и снимает боль, оказывает большое влияние на дальнейшее заживление ожоговых ран, предупреждая углубление повреждения. Больному также следует дать обезболивающие и антигистаминные препараты, при обширных ожогах согреть и при отсутствии рвоты напоить. На период транспортировки пострадавших в лечебное учреждение при наличии ограниченных ожогов первичной повязкой может являться сухая асептическая повязка, при обширных ожогах для этих целей используют стандартные контурные повязки или стерильные простыни. Первичная повязка не должна содержать жиры и масла в связи с возникающими впоследствии трудностями при туалете ран, а также красители, т.к. они могут затруднить распознавание глубины поражения.

В поликлиниках и амбулаториях может оказываться медицинская помощь больным с термическими поражениями, в том числе по срочным показаниям и в порядке подготовки пострадавшего к транспортировке в специализированный или хирургический стационар. При этом тактика лечения определяется возможностью его продолжения амбулаторно или необходимостью госпитализации в стационар. Критериями для госпитализации обожженных являются обширность и глубина ожогов, их локализация, наличие термоингаляционного поражения, сочетанной травмы и сопутствующих заболеваний, а также возраст пострадавшего. Следует заметить, что при первичном осмотре определить глубину ожогов бывает нелегко. Чаще всего истинную глубину ожога удается установить только через 5—7 дней.
Для врача-хирурга амбулаторно-поликлинического звена необходимо иметь четкие представления о показаниях для госпитализации пострадавших от ожогов:
Глубокие ожоги IIIБ—IV степени.Поверхностные ожоги I—II степени — более 15% поверхности тела.Пограничные ожоги IIIA степени — более 5% поверхности тела.Ожоги особых локализаций (лицо, кисти, стопы или половые органы).Термоингаляционное поражение.Ожоговый шок.Общая электротравма.Комбинированная или сочетанная травма.Раневые инфекционные осложнения.
Показания для амбулаторного лечения обожженных
Взрослые пациенты с поверхностными ожогами I—II степени могут лечиться амбулаторно, если площадь поражения не превышает 10—15% поверхности тела, а при пограничных ожогах IIIA степени — 5% поверхности тела, также возможно амбулаторное лечение небольших по площади точечных глубоких ожогов, например от попадания брызг горячего масла. Для этой категории больных основным является местное консервативное лечение ожоговых ран.
Цели местного лечения ожогов I—II—IIIА степени
Местное лечение при ожогах I—II—IIIА степени должно быть направлено на создание наиболее благоприятных условий для их заживления в оптимальные сроки и предусматривать защиту раны от механического повреждения и инфицирования, а при необходимости и эффективное лечение раневой инфекции и стимуляцию репаративных процессов.
Первичный туалет ожоговой раны
Местное лечение начинается с первичного туалета ожоговой раны. После обезболивания осторожно, минимально травматично очищают ожоговую поверхность от загрязнения, инородных тел и обрывков эпидермиса. Рану обрабатывают растворами антисептиков. Вскрывшиеся пузыри удаляют. Крупные невскрывшиеся пузыри надрезают у основания и, не удаляя эпидермис, эвакуируют содержимое. Более мелкие пузыри можно не вскрывать. В случае нагноения содержимого пузырей отслоенный эпидермис следует удалить. Свернувшийся сухой фибрин лучше не удалять, так как при этом травмируются подлежащие ткани, лечение в этих случаях проводится под тонким струпом. Всем обожженным также показано проведение профилактики столбняка.
Местное лечение поверхностных и пограничных ожогов
Лечение ожогов I—II—IIIА степени можно проводить как открытым, так и закрытым методом. При этом в зависимости от характера создаваемой раневой среды эти методы реализуются с помощью сухого или влажного способов. Лечение ожоговых ран открытым методом возможно на лице, в области половых органов и промежности, где повязки затрудняют уход и физиологические отправления. В этих случаях применяют раствор йодопирона, аэрозоли, а также кремы, содержащие препараты серебра. Однако в амбулаторных условиях методом выбора является закрытый метод с использованием различных повязок.
У пострадавших с локальными ожогами I—II степени возможно применение аэрозольного препарата Ацербин, обладающего антисептическим и ранозаживляющим действием. Его можно использовать уже при оказании первой помощи. Ацербин при необходимости наносится несколько раз в день на рану, которая закрывается стерильной повязкой, пропитанной раствором.
После удаления отслоенного эпидермиса при отсутствии признаков инфекции достаточно применения атравматичных повязок (Парапран, Воскопран, Бранолинд и другие), однократного наложения которых на поверхностные ожоговые раны бывает достаточно для последующей эпителизации под повязкой. Можно использовать и другие раневые покрытия (Активтекс, Апполо), а также повязки с растворами антисептиков или антибиотиков, мазями на водорастворимой основе или кремами на основе сульфадиазина серебра.
При ожогах IIIА степени, а также мелких глубоких ожогах IIIБ степени лечение можно начинать с влажновысыхающих повязок с растворами Йодопирона (Бетадин, Повидон-йод), способствующих формированию тонкого, состоящего из некротизированных слоев кожи и фибрина, струпа. К недостаткам последних следует отнести болезненность при первых перевязках. Под сухим струпом ожоги могут заживать без нагноения. В случаях, когда сухой струп сформировать не удается, уже спустя неделю после травмы развивается его нагноение и отторжение. Лечение следует продолжить повязками с мазями на водорастворимой основе, а отторгающийся струп удалять во время перевязок.
В то же время использование в качестве носителя лекарственных препаратов марлевых повязок имеет ряд недостатков. Удаление присохших повязок из марли на перевязках, даже несмотря на отмачивание, приводит к травматизации молодого эпителия и нарушению спонтанной эпителизации раны, а сами перевязки болезненны. Поэтому
Одним из видов современных повязок являются раневые покрытия Активтекс, представляющие собой текстильную основу, пропитанную гелеобразующим полимером и содержащую различные лекарственные вещества в виде депо-системы. В зависимости от входящих в состав лекарственных препаратов могут применяться различные виды покрытий с антибактериальным, обезболивающим и кровоостанавливающим действием. Лечебное действие компонентов, входящих в состав покрытий Активтекс, проявляется только во влажном состоянии, в связи с чем требуется увлажнение повязки перед применением и в дальнейшем периодически 1—2 раза в день. Преимуществами противоожоговых повязок Активтекс являются отсутствие необходимости их предварительной (непо-средственно перед применением) подготовки и пролонгированные лечебные свойства.
Перевязки следует производит не реже 2 раз в неделю. Если у больного повышается температура, усиливаются боли и отек в области раны, повязка промокает гноем, ее следует заменять чаще. Перевязки следует выполнять щадяще, не травмируя тонкий слой растущего эпителия, особенно при лечении ожогов IIIА степени, когда идет эпителизация из сохранившихся дериватов кожи.
Современной альтернативой сухому способу местного лечения, когда эпителизация поверхностных ожогов происходит под струпом, является создание на ране влажной среды. Влажная среда благотворно влияет на процессы регенерации, при этом сами перевязки проходят атравматично.
Повязочный влажный способ местного лечения ожогов реализуется с помощью использования различных пленочных, гидрогелевых, гидроколлоидных и губчатых повязок, а также кремов на основе сульфадиазина серебра.
При лечении поверхностных и пограничных ожогов высокоэффективны различные пленочные повязки. В то же время отсутствие у пленочных повязок дренирующих свойств требует более частого (ежедневного) перевязывания, особенно при обильном раневом отделяемом. Поэтому применение окклюзирующих повязок противопоказано при лечении гнойно-некротических и инфицированных ожоговых ран с микробной обсемененностью более 104 микробных тел/см2.
При лечении ограниченных поверхностных и пограничных ожогов широко применяются повязки, содержащие гидрогели. Хорошую эффективность при лечении ожоговых ран II—IIIАБ степени, а также длительно существующих ран показывают формоустойчивые гидрогелевые покрытия (Гелепран, Гидросорб). Повязка Апполо на сетчатой основе с аморфным гидрогелем выгодно отличается от своих западных аналогов наличием анилокаина в качестве анестетика и йодовидона в качестве антисептика. Возможно также эффективное использование гидроколлоидных повязок (Гидроколл).
Применение биологических материалов при лечении поверхностных ожогов I и II степени нецелесообразно. При лечении пограничных ожогов IIIА степени в условиях поликлиники могут использоваться различные губчатые покрытия (Альгимаф, Альгикол, Сюспур-дерм и др.) Они не требуют частых перевязок, поглощают раневой детрит и способствуют регенерации.
Использование гидрогелевых, гидроколлоидных и губчатых повязок в связи с активной сорбцией отделяемого позволяет выполнять перевязки через 2—3 суток, а в случае отсутствия отделяемого и плотной фиксации повязок к ране их можно оставлять до полной эпителизации и самостоятельного отделения от зажившей поверхности.
Широкое распространение при лечении обожженных получили кремы с серебром, выпускаемые под различными названиями (Аргосульфан, Дермазин, Эбермин), которые поддерживают влажную раневую среду, создают благоприятные условия для эпителизации и являются эффективными средствами для местного лечения поверхностных и пограничных ожоговых ран, особенно в комплексе с пленочными покрытиями.
Применение этих препаратов целесообразно при клинических признаках инфекции и выраженном нагноении ожоговых ран. Кроме них возможно использование раствора Йодопирона (Бетадина) и Лавасепта. В лечении инфицированных ожоговых ран хорошо зарекомендовали себя марлевые повязки с многокомпонентными мазями на водорастворимой (полиэтиленгликолевой) основе (Левомиколь, Левосин, Диоксидиновая, Йодопироновая, Бетадиновая), которые можно использовать в I и II фазах раневого процесса.
При неосложненном течении раневого процесса, правильном выборе методов и средств местного лечения ожоги II степени заживают через 1—2 недели после травмы, ожоги IIIА степени — к 18—21 дню. Длительное консервативное лечение незаживающих ожоговых ран в условиях поликлиники является ошибкой. Все ожоговые раны, не зажившие в течение 3—4 недель, особенно занимающие площадь более 0,5% площади тела, являются глубокими и, скорее всего, нуждаются в проведении аутодермопластики.
Лечение обожженных, выписанных из стационара, с небольшими остаточными ранами, оставшимися после поверхностных ожогов и на участках приживших трансплантатов у оперированных по поводу глубоких ожогов, проводится по общим принципам местного лечения, указанным выше.
Критериями успешного лечения обожженных является не только заживление ран, но и хорошие функциональные и косметические результаты. По данным разных исследований, в 10% случаев после ожогов II степени, в 55—62% после ожогов IIIА степени и в 30—40% случаев после аутодермопластики по поводу глубоких ожогов IIIБ—IV степени развиваются гипертрофические и келоидные рубцы.
При проведении реабилитации перенесших ожоги важно учитывать, что у многих пациентов имеются психические отклонения, связанные с сознанием своей неполноценности. Данное обстоятельство требует особого подхода и часто необходимости медикаментозной коррекции. Кроме развития рубцов и деформаций у пациентов, перенесших тяжелую ожоговую болезнь, могут иметься различные нарушения функций внутренних органов, требующие привлечения к обследованию и лечению таких пострадавших соответствующих специалистов. В нашей стране пока еще нет единой системы реабилитации пострадавших от ожогов. Обучение хирургов поликлиник особенностям лечения и реабилитации пострадавших от ожогов с привлечением специалистов ожоговых отделений может являться одним из путей решения этой задачи. Большее внимание должно уделяться также совершенствованию системы врачебно-трудовой экспертизы лиц, перенесших ожоги, и их трудоустройству.
Появление и внедрение в клиническую практику новых лекарственных препаратов и раневых покрытий делает реальным повышение качества медицинской помощи больным с термическими поражениями, в том числе в условиях поликлиники, при условии соблюдения соответствующих протоколов и стандартов лечения.
Без сомнения, современные тенденции диктуют необходимость применение сорбционного дренажа при остром и хроническом воспалении мягких тканей, что приводит к снижению нагрузки на лимфатическую систему. В наших работах, мы уже рассматривали различные комбинации антисептических препаратов и их сочетание с ранозаживляющими компонентами при иммобилизации, как на гидрофильных, так и на гидрофобных основах[3,4,5,6].
Цель исследования. Изучить особенности изменения соединительной ткани передней брюшной стенки в раннем послеоперационном периоде при использовании различных сетчатых эндопротезов с антибактериальным покрытием.
Материалы и методы. На основании проведенного комплексного исследования были разработаны следующие составы мазей (массовые части):
Раствор Мирамистина 0,01% - 100,0
Раствор Мирамистина 0,01% - 100,0
Гистологическое изучение раневых биоптатов производили на 1-е, 3-и, 5-е, 8-е, 10-е и 15-е сутки от начала лечения после выведения животного из эксперимента. Забор материала осуществляли путем иссечения участка мягких тканей дна и прилежащего края раны лезвием. Взятый материал сразу фиксировали в 10% растворе нейтрального формалина с последующей проводкой по восходящим спиртам и заливкой в парафин по стандартной методике. Приготовленные парафиновые срезы окрашивали гематоксилин-эозином. При оценке гистологических срезов обращали внимание на выраженность воспалительных реакций, сроки появления грануляционной ткани, возникновение краевой эпителизации, а также структурную полноценность вновь образованного эпителия.
С целью определения отличительных особенностей процесса репаративной регенерации в сравниваемых экспериментальных сериях нами были исследованы макропрепараты раневой поверхности. С целью подтверждения статистической значимости расхождений средних величин в сериях эксперимента нами в соответствии со стандартами ИСО 3534-3-99, а также ГОСТ Р 50779.10-2000 (ИСО 3534-1-93) после определения типа распределения данных был выбран метод оценки достоверности отличий Вилкоксона-Манна-Уитни. Решение принято на основании высоких значений скоса и эксцесса графиков распределения данных, что свидетельствует о высоком отклонении от кривой Гауссова распределения. Учитывая низкую чувствительность методики определения доверительного интервала к типу распределения, а также допустимый для экспериментальных медико-биологических исследований уровень P≤ 0,05, для подтверждения статистической гипотезы был выбран именно такой уровень значимости. Все вычисления выполнялись с помощью аналитического пакета приложения Excel Office 2010.
Полученные результаты и их обсуждение
При изучении микропрепаратов установлено, что во всех сериях к первым суткам после моделирования раневого дефекта вся поверхность раны была покрыта массивным фибринозно-гнойными массами, в которых при микроскопии обнаруживалось большое количество погибших лейкоцитов. Подлежащие ткани резко отечны и инфильтрированы полиморфно-ядерными лейкоцитами (ПЯЛ) и макрофагами на разных стадиях дифференцировки, пучки коллагеновых волокон в сохранившихся участках дермы разрыхлены и разделены друг от друга очагами инфильтрата и скоплениями не гемолизированных эритроцитов. Фибробласты имели резко базофильную цитоплазму и набухшие, разрыхленные ядра. Кровеносные и лимфатические сосуды расширены. Отек тканей и инфильтрат в сочетании с пропитыванием эритроцитами распространялся за пределы раневого дефекта по всей толщине дермы и переходил на гиподерму. Ближайшие к краю раневого дефекта участки эпидермиса истончены за счет отсутствия рогового и уменьшения толщины шиповатого слоев. Непосредственно под истонченными участками эпидермиса отмечались свежие кровоизлияния в виде скоплений эритроцитов с тенденцией к слиянию очагов.
А Б 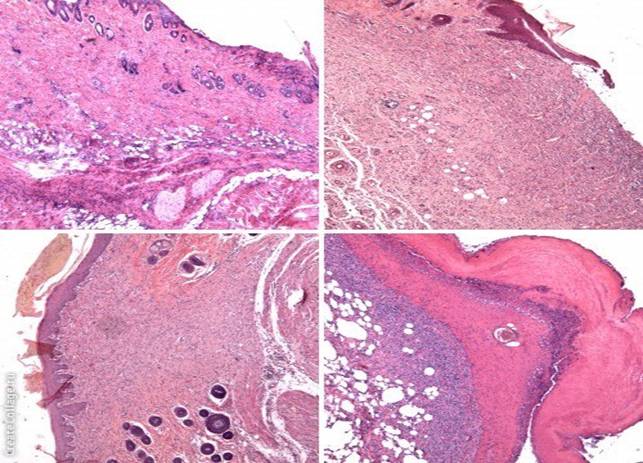
Рис.1. Микрофотографии поперечных срезов экспериментальных ран на 10-е сутки. Окраска Г+Э. Ув. х100. Примечание: А. Контрольная серия. Инфильтрация распространяется на всю глубину грануляций. Б. Серия сравнения Левомеколь. Грануляционная ткань отграничена от дермы и инфильтрирована ПЯЛ. В. Серия NaКМЦ+Мирамистин. Раневой дефект заполнен полностью созревшей новообразованной соединительной тканью. Г. Серия NaКМЦ+Мирамистин+Метронидазол. Участки регенерировавшего эпителия без выраженных морфологических изменений
Выводы. Таким образом, полученные нами морфологические данные проведенного нами исследования свидетельствуют о том, что применение иммобилизованных препаратов на основе NaКМЦ в лечении гнойных ран оказывают выраженное сорбирующее и противовоспалительное действие в фазу экссудации воспалительного процесса, а в фазу регенерации процесс эпителизации протекает более активно.
Рецензенты:
Бежин А.И., д.м.н., профессор, заведующий кафедрой оперативной хирургии и топографической анатомии им. профессора А.Д. Мясникова, ГБОУ ВПО КГМУ Минздрава России, г. Курск;
Иванов А.В., д.м.н., профессор, заведующий кафедрой гистологии, эмбриологии, цитологии, ГБОУ ВПО КГМУ Минздрава России, г. Курск.

Одним из современных способов моделирования ожоговой раны кожи, позволяющим быстро воспроизвести ожоговую рану точно заданной площади и глубины поражения кожи экспериментального животного, является предложение использовать излучение хирургического лазера. Данный способ был разработан, запатентован и апробирован нами в условиях эксперимента при лечении инфицированного ожога кожи [8]. В настоящее время научно обоснована антимикробная активность наночастиц ряда металлов, в частности, серебра, меди, железа и др. [1, 9]. Доказано ранозаживляющее действие синтезированного ультрадисперстного порошка меди, [6], который в отличие от антибиотиков не вызывает селекции резистентных штаммов, что позволяет в дальнейшем рекомендовать для использования при лечении гнойных заболеваний, вызванных полиантибиотикорезистентными штаммами [5].
Высоко оценивается эффективность применения НИЛИ в комплексном лечении гнойных ран [4, 13]. Применение НИЛИ способствует: более быстрому очищению ран от гнойно-некротических масс, раннему образованию грануляций, эпителизации раневых дефектов и сокращению сроков лечения [2, 10]; стимулирует макрофагальную реакцию, активирует биосинтетическую функцию фибробластов, оптимизирует процессы ангио- и фибриллогенеза; способствует более быстрому созреванию грануляционной ткани и её фиброзной трансформации, которая завершается к 7–8 суткам [3].
Сочетанное применение нанотехнологий и лазерного излучения нашло применение в экспериментальной онкологии [7, 11, 12]. В работах В.В. Алипова и соавт. (2011) сообщалось о потенцирующем действии НИЛИ и наночастиц меди при неосложненных ожоговых ранах кожи. Таким образом, актуальным направлением в экспериментальной хирургии является моделирование инфицированной ожоговой раны, применение наночастиц металлов, поиск усиления их бактерицидного действия в сочетании с лазерным воздействием на рану.
Цель работы – разработка способа моделирования инфицированных ожоговых ран и экспериментальное обоснование эффективности сочетанного применения наночастиц меди и низкоинтенсивного лазерного облучения для лечения инфицированных ожоговых ран кожи.
Материал и методы исследования
Получение и применение наночастиц меди при лечении ожоговых ран. Ультрадисперсный порошок меди получали термолизом в токе оксида углерода оксалата меди. Последний синтезировали из ацетата меди и щавелевой кислоты. Таким способом удаётся получить ультрадисперсный порошок меди, состоящий из её кластеров, включающих фрагменты от 60 до 80 нм и обладающих повышенной устойчивостью на воздухе. Наночастицы меди помещали в стерильные пробирки известной массы для удобства дальнейшего получения стерильных суспензий заданных концентраций. Суспензию наночастиц меди получали при соединении 0,8 мл стерильного подсолнечного масла с 1 мг наночастиц меди с конечной концентрацией 1 мкг/мл. Данное раневое покрытие наносилось на поверхность инфицированной раны в указанной дозе ежедневно каждому животному.
Сочетанное применение наночастиц меди и низкоинтенсивного лазерного излучения на ожоговую рану в эксперименте. Нами изучено влияние сочетанного применения наночастиц меди и низкоинтенсивного лазерного излучения на ожоговую рану в эксперименте на 50 белых лабораторных крысах массой 190–200 г. В целях оценки влияния сочетанного применения наночастиц меди и низкоинтенсивного лазерного излучения на процессы заживления ожоговой раны проведен эксперимент, в ходе которого животным после создания инфицированной термической ожоговой раны в течение 14-ти дней проводили лечение низкоинтенсивным лазерным излучением (серия 1), масляной эмульсией наночастиц меди (серия 2), сочетанным воздействием лазера и наночастиц меди (серия 3), левомиколем как препаратом сравнения (серия 4). Контролем (серия 5) служили животные, которым проводили только хирургическую обработку раны, включающую эвакуацию гноя, извлечение инфицированной марлевой салфетки, удаление некротической ткани и промывание ее антисептиком.
После 3-х суток хирургического лечения начинали второй этап специального лечения. Модель гнойной ожоговой раны создавали следующим образом. Под комбинированным наркозом дно раны подвергали размозжению зажимом Кохера и инфицировали раны лабораторными штаммами Pseudomonas aeruginosa и Staphylococcus aureus. Для этого из суточных агаровых культур по оптическому стандарту мутности МакФарланда готовили суспензию в физиологическом растворе хлорида натрия в конечной концентрации 3×107 КОЕ/мл и суспензией в объёме 0,1 мл взвеси однократно орошали рану. Для комплексной оценки течения раневого процесса в исследовании использовали методы планиметрического и микробиологического, исследования ран, которые осуществляли на 3-и, 5-е, 7-е, 10-е, 14-е сутки, ежедневно оценивали общее состояние животных. Бактериологическое исследование гнойных ран включало изучение качественного состава микробных возбудителей и количественный учет микроорганизмов. Учитывались следующие параметры течения раневого процесса: наличие и характер воспалительной реакции, состояние краев и дна раны, сроки очищения раны от некротических тканей и появления грануляций, характер грануляционной ткани, сроки начала эпителизации ран. Через 14 дней лечения, что соответствовало 17-м суткам после воспроизведения ожога, животных взвешивали и выводили из эксперимента передозировкой эфирного наркоза. У животных забирали фрагменты кожи из центра и периферии ожоговой раны (окраска парафиновых срезов гематоксилином-эозином и пикрофуксином). Статистическую обработку результатов проводили с учётом принципов доказательной медицины, с использованием параметрических и непараметрических методов.
Результаты исследования и их обсуждение
При исследовании гистологических препаратов через сутки эксперимента во всех сериях экспериментов в зоне термического воздействия были обнаружены изменения, характерные для ожога III Б степени: в дерме под базальной мембраной появлялись полиморфноядерные лейкоциты, коллагеновые волокна образовывали грубые конгломераты и фрагментировались, разрушались сальные железы и волосяные фолликулы. К 3-м суткам после воспроизведения ожога рана покрывалась толстым, жестким струпом буровато-коричневого цвета, спаянным с подлежащими тканями. Края раны у животных группы были утолщены и резко возвышались над струпом, при надавливании из-под струпа выдавливался серозно-гнойный экссудат. На 7-е сутки эксперимента ожоговая поверхность оставалась бледной, с редкими грануляциями, фибриновым налетом и подрытыми краями. На 14-е сутки в целом размеры раны уменьшились, но её края оставались подрытыми, местами сохранялся трудно отделяемый струп.
Анализ процессов формирования и заживления инфицированных ожоговых ран показал, что на 3-и сутки моделированной инфицированной ожоговой раны в межлопаточной области у животных формировалась гнойная рана со всеми характерными признаками гнойного воспаления. Отмечался отек и гиперемия кожи в области нанесения раны, припухлость, у некоторых животных между швами выделялся гной. При пальпации определялась местная гипертермия и флюктуация. Наличие инфицированности подтверждалось бактериологическим посевом раневого содержимого. В среднем перед началом лечения обсеменённость ран Pseudomonas aeruginosa и Staphylococcus aureus составляла 4300 ± 512 КОЕ/мл раневого отделяемого. Площадь ран во всех сериях с лечением была статистически значимо меньшей (p
1 Отдел медицинской химии и токсикологии, Российский национальный исследовательский медицинский университет имени Н. И. Пирогова, Москва
2 Лаборатория биологических испытаний, Институт трансляционной медицины, Российский национальный исследовательский медицинский университет имени Н. И. Пирогова, Москва
3 Кафедра медицинской кибернетики и информатики, медико-биологический факультет, Российский национальный исследовательский медицинский университет имени Н. И. Пирогова, Москва
4 Лаборатория экологии возбудителей инфекций, Национальный исследовательский центр эпидемиологии и микробиологии имени Н. Ф. Гамалеи, Москва
Для корреспонденции: Татьяна Анатольевна Шмиголь
ул. Островитянова, д. 1, г. Москва, 117997; moc.liamg@hsithsitat
Финансирование: исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 16-33-00970 мол_а.
Кожа служит физическим барьером и первой линией защиты организма от окружающих патогенов. При повреждении кожного покрова в ране может развиться инфекция и остановить процесс заживления раны, приведя к увеличению риска заболеваемости и даже смертности. Открытие антибиотиков произвело революцию в лечении инфекций, но наблюдающееся в последнее время увеличение резистентности к антибиотикам среди патогенных бактерий диктует необходимость поиска новых альтернативных методов лечения локализованных инфекций. Одним из таких методов стала ФДТ, которая ранее успешно применялась в лечении онкологии [1–3], а недавно была предложена для лечения бактериальных инфекций [4–7]. Суть антимикробной ФДТ заключается в местном применении в инфицированной ткани нетоксичного красителя — фотосенсибилизатора (ФС) с последующим воздействием монохроматическим светом с длинной волны, к которой чувствителен ФС [8–9]. Под действием света ФС активируется, генерируя свободные радикалы и/или синглетный кислород, губительные для инфекционных агентов.
Цель настоящего исследования заключалась в изучении влияния ФДТ с использованием анионного ФС МЦ540 в модели раневой инфекции на животных на бактериальную инактивацию и на процесс заживления ран. Мыши линии BALB/c были инфицированы полирезистентным клиническим штаммом Pseudomonas aeruginosa PA21. Инактивацию бактерий оценивали путем определения бактериологической нагрузки в ранах, процесс заживление ран контролировали прямым измерением штангенциркулем в двух проекциях, а также проведением патоморфологических исследований послойных срезов инфицированных ран.
МАТЕРИАЛЫ И МЕТОДЫ
Фотосенсибилизатор
Маточный раствор МЦ540 (Sigma-Aldrich, Швейцария) в концентрации 1×10–3 M готовили в 96% этаноле в день проведения опыта. Концентрацию МЦ540 определяли спектрофотометрически с использованием коэффициента экстинкции ε500 = 63 000 М–1см–1 в воде. В рабочих растворах концентрация МЦ540 составляла 25 мкМ, которую получали путем разведения маточного раствора МЦ540 (1×10–3 M) водой или 0,25 М раствором NaCl (ACROS, США).
Культуры клеток микроорганизмов
Бактериальная нагрузка ран
Антимикробная фотодинамическая терапия
Животных разделили на 4 группы (Таблица 1. План исследования на животных" data-note="" >табл. 1). Мыши из группы А (n = 18) служили в качестве абсолютного контроля, не получая никакого лечения; мыши из группы Б (n = 18) служили в качестве светового контроля и для лечения инфицированной раны облучались монохроматическим светом с длиной волны 530 нм и временем экспозиции 5 мин; мыши группы В (n = 18) получали ФДТ в присутствии 25 мкМ водного раствора МЦ540 с облучением монохроматическим светом с длиной волны 530 нм и временем экспозиции 5 мин; мыши группы Г (n = 18) получали ФДТ в 25 мкМ водном растворе МЦ540 в присутствии 0,25 М NaCl с облучением монохроматическим светом с длиной волны 530 нм и временем экспозиции 5 мин. Из каждой группы было оставлено по 3 животных для наблюдения за долгосрочными эффектами (36 сут.).
Мышей обрабатывали локально 50 мкл раствора 25 мкМ в 0,25 M NaCl, с экспозицией без облучения в течение 5 мин. Обработанные очаги были освещены светом с длиной волны 530 нм, обеспечивающим 2 мВт/см2 в течение 5 мин, что соответствует общей дозе 6 Дж/см2.
Гистология
Биологический материал фиксировали в буферном растворе 10%-го формалина. Фиксированные образцы заключали в парафин. Срезы толщиной 3–7 мкм окрашивали гематоксилин-эозином и использовали для микроструктурного анализа и морфометрических наблюдаемых процессов. Морфометрические данные были получены с помощью микроскопа-анализатора AxioimagerA-2 (Carl Zeiss, Германия).
Заживление раневого дефекта
При наблюдении за состоянием раневых дефектов оценивали наличие признаков воспаления, характер и количество раневого отделяемого и т. д. Измерение ран с помощью линейки и штангенциркуля в двух проекциях осуществляли за 1 ч до проведения ФДТ на 2-е, 4-е, 7-е и 14-е сут. Для выявления характера течения репаративных процессов в исследуемых группах животных вычисляли следующие показатели динамики заживления экспериментальных ран:
- Показатель изменения площади раневой поверхности в динамике (ΔS, %) : форм. 1 где S0 — исходная площадь раны, Sn — площадь раны на n-е сутки.
- Относительная скорость уменьшения площади раневого дефекта (νзаж., %/сутки): форм. 2 где S0 — исходная площадь раны, Sn — площадь раны на n-е сутки, n — порядковый номер суток эксперимента.
- Показатель скорости эпителизации раны (νэпит., мм2 / сутки): форм. 3 , где S0 — исходная площадь раны, Sn — площадь раны на n-е сутки, Т — число суток между измерениями.
Все цифровые данные обрабатывали с использованием компьютерной программы Universlab DeskTer River V3.3.3269.
Статистика
Рассчитывали средние значения определяемых величин и стандартную ошибку среднего по форм. 4 где s — выборочное среднее квадратичное отклонение.
На следующие сутки после моделирования ран и проведения ФДТ общее состояние животных можно было оценить как удовлетворительное. Животные были активны, слизистые оболочки без видимых изменений, шерстный покров гладкий. Раны у всех животных имели признаки развивающегося нагноения. Наиболее выраженное нагноение наблюдалось в контрольных группах.
Бактериальная нагрузка
Одним из значимых критериев оценки эффективности проведенного лечения гнойных ран мягких тканей является микробиологическое исследование. Определение бактериальной нагрузки производилось до начала проведения лечения, через 48, 96 и 168 ч после ФДТ. Количественные показатели бактериальной нагрузки ран представлены в Таблица 2. Изменение бактериальной нагрузки ран, КОЕ/мл" data-note="" >табл. 2.
Через 6 ч после инфицирования перед ФДТ исходная контаминация ран во всех группах животных была одинаковой и составила 5,03 ± 0,04×106 КОЕ/мл. В опытных группах В (ФДТ индуцированная МЦ540 в воде) и Г (ФДТ индуцированная МЦ540 в растворе натрия хлорида) через 48 ч после проведения ФДТ количество P. aeruginosa уменьшилось на 10 2 и 10 3 КОЕ/мл соответственно.
Сравнительная характеристика течения инфицированных раневых дефектов
Сравнительный анализ результатов наблюдения характеристик течения раневых дефектов в экспериментальных группах позволил установить межгрупповые различия динамики заживления раневых дефектов по показателю ΔS (Таблица 3. Морфометрический анализ состояния ремоделирования внутрираневого матрикса у мышей линии BALB/c" data-note="" >табл. 3).
Анализ полученных данных показал, что значения ΔS контрольных групп А и Б достоверно меньше (p табл. 3). Из полученных данных видно, что наибольшая скорость заживления наблюдается в группе Г, а в остальных группах на протяжении 14 сут., показатели νзаж. находились на достаточно стабильном уровне (p > 0,05). Отметим, что скорость заживления к 14 сут. снижается и становится практически одинаковой для всех групп.
Нами выявлены существенные изменения, а также межгрупповые различия показателей скорости эпителизации раневых дефектов (νэпит.) в процессе проведения эксперимента (Таблица 4. Морфофункциональная динамика репаративного эпителиального покрова инфицированных ран мышей линии BALB/c" data-note="" >табл. 4).
В исследованиях in vitro ранее нами было показано, что в случае ФДТ МЦ540 в присутствии 0,25 М NaCl инактивация P. aeruginosa возрастает в 10 раз по сравнению с ФДТ МЦ540 в воде [10]. Наблюдаемый эффект был объяснен разной степенью агрегации МЦ540 в воде и в присутствии соли. В воде МЦ540 находится как в мономерной, так и димерной формах [11], из которых только мономерная форма способна генерировать активные формы кислорода, в первую очередь — синглетный кислород [12, 13]. В солевых растворах МЦ540 образует крупные кристаллоподобные агрегаты, способные к генерации свободных радикалов [14–17].
Представленные в настоящем исследовании данные на животных моделях убедительно подтвердили ранее полученные данные in vitro по следующим показателям: гибель бактерий, препятствование их восстановлению и ускорение процесса заживления ран.
Действительно, согласно представленным в Таблица 2. Изменение бактериальной нагрузки ран, КОЕ/мл" data-note="" >табл. 2 данным, после проведенной ФДТ с МЦ540 в растворе натрия хлорида полное очищение раны от полирезистентного штамма P. aeruginosa происходит к 4 сут., тогда как при проведении ФДТ с МЦ540 в воде аналогичные изменения наблюдались лишь на 7-е сут.
Морфометрические данные (Таблица 3. Морфометрический анализ состояния ремоделирования внутрираневого матрикса у мышей линии BALB/c" data-note="" >табл. 3) подтверждают лучшую эффективность агрегатов МЦ540 по сравнению с его мономерами и димерами в отношении скорости заживления раневого дефекта и уменьшения его площади. Так, к 4 сут. площадь раневого дефекта у животных из группы Г уменьшилась на 45%, в то время как для группы В эта величина составляет 60%, что близко к показателям группы Б (68%).
Наблюдаемые изменения относительной скорости уменьшения дефекта (Таблица 3. Морфометрический анализ состояния ремоделирования внутрираневого матрикса у мышей линии BALB/c" data-note="" >табл. 3) в случае группы А имеют практически линейную зависимость (с учетом среднеквадратичного отклонения), для групп Б–В — параболическую с максимумом на 4-е сут., а для группы Г — экспоненциальную. Для животных всех исследованных групп на 14-е сутки наблюдалось снижение скорости заживления. Полученные данные согласуются с описанным ранее изменением показателя площади раневой поверхности (Таблица 3. Морфометрический анализ состояния ремоделирования внутрираневого матрикса у мышей линии BALB/c" data-note="" >табл. 3).
Регенерация эпителиального покрова ран происходит значительно быстрее, и становиться ярко выраженной уже на 4-е сут. в группе Г (см. Таблица 4. Морфофункциональная динамика репаративного эпителиального покрова инфицированных ран мышей линии BALB/c" data-note="" >табл. 4), в отличии не только от контроля, но и группы, получившей лечение на основе ФДТ с МЦ540 в воде.
Согласно данным, полученным в модели раневой инфекции на мышах, ФДТ с МЦ540 в растворе хлорида натрия способна намного эффективнее вызывать гибель бактерий, препятствовать их последующему восстановлению и значительно ускорять процесс заживления ран, по сравнению с контрольными группами и ФДТ с МЦ540 в воде.
Читайте также:


