Смешанная кишечная инфекция у молодняка
Аннотация научной статьи по ветеринарным наукам, автор научной работы — Белоусова Е.В., Чхенкели В.А.
Похожие темы научных работ по ветеринарным наукам , автор научной работы — Белоусова Е.В., Чхенкели В.А.
THE USE OF THE MEDICINE ‘TRAMETIN’ FOR THE TREATMENT OF MIXED BACTERIAL AND VIRAL INFECTIONS OF GASTROINTESTINAL TRACT IN THE CALVES OF YOUNGER AGE GROUP
УДК 636.2:579:6 Е.В. Белоусова, В.А. Чхенкели
E.V. Belousova, V.A. Chkhenkeli
THE USE OF THE MEDICINE 'TRAMETIN' FOR THE TREATMENT OF MIXED BACTERIAL AND VIRAL INFECTIONS OF GASTROINTESTINAL TRACT IN THE CALVES OF YOUNGER AGE GROUP
We conducted the study of antiviral properties of the medicine "Trametin". Experimental studies were carried out on the dairy farm of JSC "Vozrozhdeni-ye" of Irkutsk District, Irkutsk Region. The objects of experimental research were 15 calves at the age of
Keywords: bacterial and viral infections, young growth of cattle, "Trametin".
Введение. В скотоводстве очень важно в первые месяцы жизни телят, в подсосный период, создать соответствующие условия для их интенсивного роста и развития, что позволяет обеспечить высокий уровень приростов молодняка в последующий период интенсивного откорма [1].
На протяжении длительного времени животноводческие хозяйства несут значительные экономические потери, обусловленные распространением массовых желудочно-кишечных инфекций новорожденных телят, заболеваемость телят на животноводческих фермах и комплексах России достигает 60-90 % [3].
В первые дни жизни теленка особое место в патологии занимают вирусы, относящиеся к семействам рео-, пести- и коронавирусов. В более старшем возрасте - это миксо-, парамиксо-, ко-
рона-, герпесвирусы, поражающие главным образом респираторную систему. Некоторые вирусы, такие как возбудитель вирусной диареи и инфекционного ринотрахеита-вульвовагинита, лейкоза крупного рогатого скота, являются мощнейшими депрессантами иммунной системы, что, в свою очередь, также является фактором развития патологий в хозяйствах [2].
Исходя из цели, были поставлены следующие задачи:
• провести лабораторную диагностику отобранных для эксперимента животных;
• разделить животных на группы по принципу аналогов;
• проанализировать полученные результаты по эффективности лечения.
Гематологические исследования проводили на базе лаборатории Иркутской городской ветеринарной поликлиники с использованием ветеринарного автоматического гематологического анализатора VetAbc (Франция).
Результаты исследования. У телят опытных и контрольной групп были отобраны пробы фекалий для микробиологического и вирусологического исследования. В результате исследования были выявлены возбудители ротавирус-ной и короновирусной инфекций, возбудители вирусной диареи болезни слизистых оболочек, а также энтеробактерии Escherihia coli, Salmonella enteritidis, Sal. dublin, Sal. thyphymurium, патогенные для животных.
Результаты исследований представлены в таблицах 1-4.
В таблице 2 представлены результаты биохимических исследований крови. Показано, что содержание белка у телят 1-й группы фактически не изменилось; содержание кальция, в среднем, немного повысилось (на 0,1-0,2 мг/%); количество фосфора в крови телят варьирут от понижения на 0,3 мг/% до повышения на 0,1-0,4 мг/%; содержание щелочной фосфатазы не изменилось. Содержание белка в крови телят 2-й группы в среднем повысилось от 0,1 до 0,3 г/%; количество кальция у 2 телят 2-й группы понизилось от 0,1 до 0,3 мг/%; отмечено значительное повышение уровня фосфора (от 1,09 до 2,77 мг/%) и щелочной фосфатазы (от 0,54 до 1,38 ед.). Содержание белка и кальция в крови телят 3-й группы значительно не изменено; количество фосфора повышено от 1,1 до 1,71 мг/%; в уровне щелочной фосфатазы тоже отмечено повышение (от 0,73 до 2,1 ед.).
Результаты исследований фекалий до и после проведения лечения
Номер группы Номер теленка Ротавирус Коронавирус ВД-БС Бактериальные инфекции
до после до после до после до после
1 (контрольная) 419 + + - - - - 1 1
1.1. Смешанная кишечная инфекция - остропротекающая инфекционная болезнь молодняка разных видов сельскохозяйственных животных, которая имеет полиэтиологическую природу и вызывается двумя-тремя и более видами патогенных энтеробактерий, относящимся к родам Escherichia, Citrobacter, Proteus, Morganella, Klebsiella, Salmonella. Помимо указанных микроорганизмов возбудителями болезни могут быть также бактерии других родов и семейств - Yersinia, Pseudomonas, Staphylococcus, Streptococcus, Clostridium и пр. Наряду с бактериальными агентами нередко (особенно на крупных фермах) болезнь обусловливают корона- и ротавирусы.
1.2. Болезнь возникает в первые дни и недели жизни животных и проявляется чаще в виде энзоотической вспышки, развитию которой способствуют различные факторы, связанные с несоблюдением технологических и ветеринарно-санитарных требований воспроизводства стада, а также нарушением режимов содержания и кормления молодняка.
1.3. Смешанная кишечная инфекция может протекать в кишечной (энтеритной) и септической формах. При кишечной форме возбудители болезни локализуются только в желудочно-кишечном тракте и брыжеечных лимфоузлах, регионарных поражённым участкам кишечника; при септической форме - в паренхиматозных органах, различных тканях, а также в кишечнике и брыжеечных лимфоузлах. Основными клиническими признаками болезни являются: потеря аппетита, понос, переходящий в профузный, нарастающая слабость, депрессия, учащенное дыхание и сердцебиение, обезвоживание организма (при затяжном течении); нередко наблюдается поражение центральной нервной системы (возбуждение, судороги), иногда пневмония, артриты; температура тела в пределах нормы, в отдельных случаях повышена на 0,5 - 1 °С, в предагональном состоянии она снижается ниже нормы.
1.4. Патологоанатомические изменения у погибших животных имеют картину катарального или катарально-геморрагического гастроэнтерита, на слизистой желудка, тонкого отдела кишечника и слепой кишки могут встречаться язвы, нередко отмечаются множественные точечные, полосчатые и пятнистые кровоизлияния на слизистой желудка, толстого и тонкого отделов кишечника, под капсулой селезенки, эпи- и эндокарде (клапанах); иногда отмечается очаговая катаральная пневмония и отек легких, дистрофия печени; регионарные брыжеечные лимфатические узлы как правило увеличены, отечны, на разрезе розового или красно-вишневого цвета; при вскрытии черепной коробки - гиперемия кровеносных сосудов и отек ткани головного мозга. Указанные изменения могут быть в отдельных или одновременно в нескольких органах.
1.5. Диагноз на смешанную кишечную инфекцию в хозяйствах устанавливают на основании совокупности эпизоотологических данных (возраст заболевших животных, массовость поражения, стационарность и др.), клинических признаков болезни, патологоанатомической картины и результатов бактериологического (при необходимости еще и вирусологического) исследования патологического материала от больных или погибших животных.
2.1. Для посмертной бактериологической диагностики в лабораторию направляют 2 - 4 свежих трупа погибших или убитых с диагностической целью больных животных (желательно не подвергавшихся лечению антибактериальными препаратами). В случае невозможности доставки целого трупа посылают следующий патологический материал: голову, трубчатую кость, сердце, перевязанное лигатурой вблизи разреза сосудов и аорты, селезенку, долю печени с желчным пузырем, брыжеечные лимфатические узлы, регионарные воспаленному участку кишечника, а также пораженный отрезок тонкого отдела кишечника, перевязанный с двух концов лигатурой (в отдельной таре или полиэтиленовом пакете). Указанный патологический материал исследуют в день поступления его в лабораторию.
2.2. Для прижизненной бактериологической диагностики в лабораторию направляют фекалии больных диареей животных, не подвергавшихся лечению антибактериальными препаратами. Пробы фекалий берут от 5 - 6 больных животных одной фермы в стерильные пробирки по 2 - 3 г непосредственно из прямой кишки с помощью прокипяченного резинового катетера. Пробирки вместе с сопроводительной запиской упаковывают в полиэтиленовый пакет или картонную коробку.
При невозможности быстрой доставки проб фекалий в лабораторию (через 3 - 4 часа после взятия) их консервируют стерильным 30 %-ным глицериновым раствором в соотношении 1:2 (см. приложение).
2.3. Пробы фекалий и содержимого тонкого отдела кишечника (в количестве не более 0,5 г) разводят в 10 см 3 стерильного 0,85 %-ного раствора хлорида натрия, тщательно размешивают и затем выдерживают 10 - 15 минут при комнатной температуре для осаждения крупных частиц. Надосадочную жидкость используют для посева на питательные среды не позднее 1 - 2 часов после приготовления взвесей. При исследовании консервированных фекалий, их тщательно размешивают, после чего разводят физиологическим раствором в 5 - 10 раз.
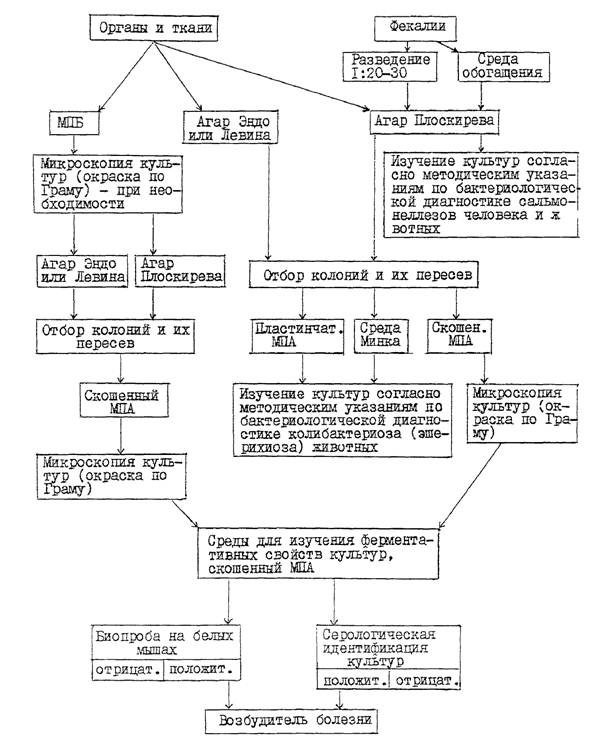
3.1. Патологический материал (за исключением содержимого тонкого отдела кишечника и фекалий) засевают в пробирки с МПБ и на плотные дифференциально-диагностические среды в чашках: Эндо (или Левина) и среду Плоскирева (или висмут-сульфит агар). Содержимое тонкого отдела кишечника и фекалий засевают только на указанные выше плотные среды в чашках. Кроме того для выделения из фекалий сальмонелл неразведенные пробы фекалий засевают еще в одну из сред обогащения (селенитовый бульон, магниевую, Мюллера или др.) в соотношении 1:5.
3.1.1. Посев материала в МПБ проводят пастеровской пипеткой. Посевы на плотные среды в чашках из внутренних органов и тканей, указанных в п. 2.3, делают путем отпечатков разрезанной поверхностью кусочка органа из предварительно профламбированного участка на подсушенную питательную среду или вносят материал пастеровской пипеткой на поверхность среды, а затем равномерно растирают его стеклянным шпателем.
3.1.2. Содержимое тонкого отдела кишечника, взятое путем соскоба с пораженного участка слизистой оболочки, суспендируют в 10 см 3 стерильного 0,85 %-ного раствора хлорида натрия, затем засевают суспензию бактериологической петлей на подсушенные в термостате плотные дифференциально-диагностические среды в чашках широким частым штрихом по всей поверхности среды. Аналогичным образом проводят посев разведенных фекалий.
3.2. Пробирки с посевами в МПБ из внутренних органов и тканей инкубируют при температуре 37 - 38 °С в течение 18 - 24 часов. При наличии в МПБ помутнения среды культуру микроскопируют и в случае обнаружения мелких грамотрицательных палочек пересевают ее на агар Эндо (или Левина) и среду Плоскирева (или висмут-сульфит агар) в чашках, которые помещают в термостат (37 - 38 °С ) на 18 - 24 часа.
Пересев культур, полученных в МПБ, на плотные селективные среды проводят в том случае, если отсутствует рост колоний на этих средах в первичных посевах из соответствующих органов и тканей.
При наличии на агаре Эндо (или Левина) роящегося налета, характерного для протея, пересевают его на скошенный МПА (культуры из двух-трех внутренних органов, тканей или фекалий). Чашки и пробирки с посевами инкубируют 18 - 20 часов при той же температуре.
3.4. Чашки с первичными посевами на агаре Плоскирева инкубируют при температуре 37 - 38 °С в течение 24 - 36 часов. После просмотра культур пересевают мелкие круглые колонии S-формы полупрозрачные, сероватого цвета с голубым оттенком в пробирки со скошенным МПА (по 1 - 2 колонии с культур из двух-трех внутренних органов, тканей или фекалий, каждую колонию в отдельную пробирку), которые помещают в термостат на 18 - 24 часа.
В том случае, если пересев проводят на комбинированную среду (Олькеницкого, Клиглера), то каждую колонию пересевают в одну пробирку с этой средой и в одну пробирку со скошенным МПА.
3.5. Суточные культуры бактерий на скошенном МПА или комбинированной среде, выделенные из внутренних органов, тканей или фекалий, микроскопируют (окраска по Граму) и при наличии в мазках однородных мелких грамотрицательных палочек, не образующих спор и капсул (бактерии вида Klebsiella pneumoniae образуют капсулу), используют для изучения ферментативных, патогенных, антигенных свойств, а также (при необходимости) определения подвижности в полужидком МПА. Для выявления у культур клебсиелл капсулы окраску мазков проводят по методу Гинса (тушью).
3.6. Ферментативные свойства изучают у 2 - 6 агаровых (в порядке исключения у бульонных) культур бактерий, выделенных из одного патологического материала, на наборе сред с углеводами и индикатором Андреде или полужидких средах с индикатором ВР, куда входят среды с глюкозой, лактозой, сахарозой, маннитом, мальтозой, а также на средах с мочевиной, сернокислым железом (определение сероводорода), агаре Симонса, в бульоне Хоттингера или МПБ (определение индола), мясопептонной желатине, среде с фенилаланином.
При использовании комбинированной среды Олькеницкого или Клиглера учитывают изменения, вызываемые представителями разных родов энтеробактерий в этой среде, после чего данную культуру изучают по другим необходимым биохимическим тестам.
Засеянные пробирки инкубируют при температуре 37 - 38 °С.
Предварительные результаты изучения ферментативных свойств культур учитывают через 24 часа, окончательные результаты - через 48 часов. Изучение ферментативных свойств культур энтеробактерий можно проводить также с помощью тест-системы для биохимической идентификации энтеробактерий. Родовую и видовую принадлежность культур устанавливают по показателям таблицы.
Следует учитывать, что у бактерий рода Proteus встречаются нероящиеся штаммы, образующие при росте на плотных питательных средах мелкие круглые колонии S-формы сероватого цвета. Важными признаками родовой идентификации таких штаммов является их способность дезаминировать фенилаланин и разжижать желатин.
При наличии у культур отклонений от основных показателей таблицы используют дополнительные тесты: реакции с метилротом и Фогес-Проскауэра, наличия образования оксидазы, определение подвижности и др.
СХЕМА
БАКТЕРИОЛОГИЧЕСКОГО ИССЛЕДОВАНИЯ ПАТОЛОГИЧЕСКОГО
МАТЕРИАЛА НА СМЕШАННУЮ КИШЕЧНУЮ ИНФЕКЦИЮ
Дифференциальные признаки энтеробактерий по ферментативным свойствам
В. А. Мищенко, Д.К. Павлов,
В.В.Думова, Т.Б. Никешина,
А.Л. Пономарев, А.В. Кононов,
С.В. Левченко.
В структуре заболеваний новорожденных телят основное место занимают нарушения функции пищеварения, проявляющиеся диареей и как следствие, резко выраженной дегидратацией, мембранопатологией, токсемией, энофтальмией, иммунодефицитом и пониженным тонусом.
Массовые гастроэнтериты новорожденных телят широко распространены во всех регионах мира, и по величине экономического ущерба они занимают второе (после респираторной патологии) место.
Диарея регистрируется у 50-100% новорожденных телят уже к концу первых суток после рождения, а гибель может достигать 30-50% особей. Гибель новорожденных телят, как правило, наступает на 2-5 или 7-10 сутки [13,16,17,21,24,25].
В этиопатогенезе массовых гастроэнтеритов новорожденных телят основная роль принадлежит ассоциации вирусов и бактерий. Вирусы, размножаясь в слизистой оболочки желудочно-кишечного тракта, вызывают дистрофию, некроз и десквамацию клеток эпителия, что способствует колонизации и проникновению в кровь патогенных бактерий или их метаболитов и развитию тяжелых патологических процессов [7,16, 23].
В основном диарея новорожденных телят протекает в виде смешанных инфекций. При смешанных инфекциях трудно определить роль того или иного инфекционного агента, который выделяется от больных телят. Факт обнаружения того или иного возбудителя от больных диареей новорожденных телят не служит убедительным доказательством его этиологической роли в патологии.
Существенное значение в развитии диарейных заболеваний играют микотоксикозы.
Основным путем заражения при диареях новорожденных телят является - алиментарный. Чаще всего в организм теленка возбудители попадают в первые часы после рождения.
Источником возбудителей инфекционных желудочно-кишечных болезней новорожденных телят являются больные и переболевшие животные, выделяющие патогенны во внешнюю среду.
Ведущей причиной массовых гастроэнтеритов новорожденных телят являются инфекционные агенты в том числе вирусы, микробы, простейшие и грибы, вирулентность которых повышается на фоне различных неблагоприятных условий кормления и содержания [10].
Значительному распространению заболевания способствует относительная устойчивость вирусов во внешней среде. Вирусы, размножающиеся в желудочно-кишечнолД тракте молодняка крупного рогатого скота (КРС), устойчивы к воздействию рН от 3.0 до 9.0, повышенной температуре и ультрафиолетовым лучам. В yc-J ловиях неблагополучной фермы вирусы циркулируют среди телят] разных возрастных групп.
Наиболее часто в пробах фекалий больных телят выявляются ротавирусы, коронавирусы, парвовирусы, реовирусы и торовиру-сы, а также грибы и микоплазмы.
При вирусных диареях наряду с воспалением желудочно-кишечного тракта, дистрофическими и дисциркуляторными процессами во внутренних органах обнаруживаются структурные изменения в органах иммунной системы, которые приводят к развитию иммунодефицита [12, 27].
У переболевших диареями вирусной этиологии телят отмечаются мутации в хромосомах, что не позволяет максимально реализовать генетический потенциал продуктивности животного [5].
Из бактериальных агентов, вызывающих диарею или осложняющих вирусные инфекции, это патогенные эшерихии, сальмонеллы, клостридии, цитробактерии, энтерококки, иерсинии, прови-денция, псевдомонас, кампилобактерии и другие [21, 28].
Телята, переболевшие ротавирусной или коронавирусной диареей, сильно отстают в росте, восстанавливают свою первоначальную массу к 20-30 дневному возрасту, но потенциал роста у них еще длительное время снижен, что обуславливает потерю до 20% будущей мясной продуктивности.
Коровы, переболевшие в раннем возрасте диареей, плохо оплодотворяются, а молочная продуктивность снижена на 10-18%. У телят, полученных от таких коров, отмечаются врожденная гипотрофия и низкая жизнеспособность.
Телята, переболевшие диареей, в дальнейшем, как правило, подвержены респираторной патологии.
Нами не установлено разницы в проявлении ротавирусной или коронавирусной диареи новорожденных телят, полученных от коров разных пород, а также условий содержания, кормления и их продуктивности.
В отличие отданных других исследователей, нами не установлено зависимости между количеством выживших телят и возрастом матерей, а также числом предыдущих отелов. Заболеваемость и гибель телят, родившихся ночью, значительно превышали показатели по "дневным" телятам. Это связано с несвоевременной выпойкой молозива телятам, родившимся ночью. Заболеваемость новорожденных телят ротавирусной или коронавирусной диареями и последующая гибель во все времена года были примерно в одинаковом соотношении к количеству телят, что указывает на отсутствие сезонности заболевания.
Важной экологической особенностью вирусов, вызывающих массовые гастроэнтериты новорожденных телят, является их способность поражать значительное число гетерологичных хозяев. Так, доказана возможность экспериментального перорального заражения ротавирусом КРС котят и щенят, которые выделяют возбудитель с фекалиями в течение двух недель. Ротавирус КРС был выделен из фекалий собак, бродящих на ферме. Все это подтверждает гипотезу о роли в развитии инфекционного процесса при ротавирусной инфекции обитающих на животноводческих фермах кошек и собак. Ротавирусы, выделенные от поросят, жеребят, оленей, цапель и детей были патогенными для новорожденных телят [16, 22]. Ротавирусом инфицируется до 95% всех детей в возрасте отЗ до 5 лет [9].
Особенностью коронавирусной инфекции является длительное персистирование возбудителя в организме переболевшего животного на фоне тканевого и гуморального иммунитета без потерь основных биологических свойств и способность индуцировать инфекцию у интактных особей. Персистирование коронавирусов у животных при бессимптомном течении инфекции служит объяснением способа их переживания в природе.
У крупного рогатого скота коронавирус вызывает заболевание, проявляющееся тремя различными клиническими симптомами: диареей новорожденных телят, характеризующейся нарушениями функции пищеварения; зимней дизентерии взрослого крупного рогатого скота, характеризующейся внезапностью, быстрым распространением среди животных в стаде, высоким уровнем заболеваемости (до 100%), сопровождающейся диареей (до 100%); респираторной патологией и резким снижением молочной продуктивности; респираторной патологией у молодняка КРС, включая синдром "транспортной лихорадки" [14].
При всех клинических формах болезни возбудитель выделяется во внешнюю среду с истечениями из носа и фекалиями. Изо-ляты коронавируса КРС, выделенные, как при кишечной, так и при респираторной инфекциях относятся к одному серотипу.
Парвовирусная инфекция у крупного рогатого скота в основном проявляется следующими клиническими симптомами:
- -диареей новорожденных телят;
- - респираторной патологией молодняка;
- - поражением органов воспроизводства, приводящим к внутриутробной интоксикации плода [11].
На фермах с большой концентрацией животных в одном помещении создаются ситуации, при которых могут одновременно или последовательно циркулировать несколько возбудителей, относящихся к различным таксономическим группам. Ассоциированные кишечные инфекции протекают тяжелее, а уровень заболеваемости и смертности по сравнению с заболеванием вызванным одним из ассоциантов существенно выше [10,16, 23, 28].
Подтверждением этого является то, что на фермах с более низкой санитарной культурой уровень заболевания и смертности новорожденных телят выше [13].
Выше изложенное свидетельствует о сложных экологических взаимосвязях при диареях новорожденных телят. Это позволяет обсуждаемую патологию рассматривать как патологию крупного рогатого скота, клинически проявляющуюся у новорожденных телят.
Традиционное отнесение ротавирусной и коронавирусной инфекций новорожденных телят к факторным болезням [3] только на основании того, что указанные возбудители выделяются от "клинически здоровых животных" не отвечает современному определению "вирус" и "вирусные болезни". Выделение вируса от животных и обнаружение в их сыворотках вирусспецифических антител свидетельствует о репликации возбудителя в клетках организма, что подтверждает развитие инфекционного процесса.
Широко используемая антибиотикотерапия диарей в большинстве случаев неэффективна вследствие резистентности секун-дарной микрофлоры к применяемым лечебным препаратам.
В литературе имеются различные мнения о способах профилактики ротавирусной и коронавирусной инфекций как "факторных" болезней [2,12,16,17].
Нами проведены исследования по выбору оптимального способа борьбы и профилактики вирусных диарей новорожденных телят. При этом было установлено, что кормление телят молозивом от коров-матерей, ранее иммунизированных инактивированной вакциной против ротавирусной и коронавирусной инфекций позволяет профилактировать диареи новорожденных телят.
- 1. Бетлинг Е.С., Шилкина Л.В./АБИО, 2004г9,17-18.
- 2. Джупина СИ.// Вет. консультант, 2004,11, 3-6.
- 3. Жирков И.Н./7 Ветеринария, 2001,10, 39-41.
- 4. Захаров П.Г., Петров Н.И..// Профилактика и лечение болезней новорожденных телят. С.-Петербург, "Петролазер", 2001, 48 с.
- 5. Клестова З.С.// Вет. мед. Украины, 1998, 5, 34-35.
- 6. Зеленов А.Е.// БИО, 2002, 11,17-21.
- 7. Гафаров Х.З. и др. Моно- и смешанные диареи новорожденных телят и поросят. - Казань: Изд-во ФЭН, 2002, 592 с.
- 8. Коромыслов Г.Ф.//Ветеринария, 1995,8, 3-7.
- 9. Малов В.А. и соавт.// Лечащий врач, 2002,11.
- 10. Мищенко В.А. и соавт.// Ветеринария, 1999, 9, 20-23.
- 11. Мищенко В.А. и соавт.// Ветеринария, 2000, 5,19-21.
- 12. Мищенко В.А. и соавт.// Ветеринария, 2001, 5, 5-6.
- 13. Мищенко В.А. и соавт.// Ветеринария, 2002,4,16-19.
- 14. Мищенко В.А. и соавт.// Ветеринария, 2005,5, 21-24.
- 15. Мищенко В.А. и соавт.//Научные основы производства ветеринарных и биологических препаратов, Щелково, 2005,143-148.
- 16. Онуфриев В.П. и соавт.// Вет. мед.: экономические, социальные и экологические проблемы, Харьков, 1990, 209.
- 17. Миськевич СВ., Скибицкий В.Т.// .// Вет. мед. Украины, 2001, 10,
- 18. Пономарев А.П., Мищенко В.А. Электронная микроскопия вирусов животных и некоторых условно-патогенных микроорганизмов, Владимир, Фолиант, 2005,106 с.
- 19. Сидоров М.А., Субботин ВВ.// Ветеринария, 1998, 1, 3-7.
- 20. Соколова Н.Л. Коронавирусный энтерит новорожденных телят. М.: ВАСХНИЛ, 1990, 60 с.
- 21. Субботин В.В., Сидоров МАМ Ветеринария, 2001, 4, 3-7.
- 22. Сюрин В.Н. и соавт. Вирусные болезни животных. М. 1998.
- 23. Терехов В.И..//Труды ВИЭВ, 1999, 179-182.
- 24. Федоров Ю.Н.// Ветеринария, 1996,11, 3-6. 25.Федоров Ю.Н.// Ветинформ, 2002,1,16-17.
- 26. Федоров Ю.Н.// Современная вет. защита высокопродуктивных коров. Воронеж, 2005, 27-29.
- 27. Урбанович П., Потапенко А. // Вет. мед. Украины, 1999,10, 10-11.Ушкалов В. // Животноводство Украины, 1997, 7,19-20

КОЛИБАКТЕРИОЗ МОЛОДНЯКА (Colibacteriosis), колибациллёз [колибациллез] , колиинфекция, колисепсис, колиэнтерит, острая инфекц. болезнь молодняка с.-х. животных (в т. ч. птиц) и пушных зверей, вызываемая кишечной палочкой патогенных серологич. вариантов (сероваров) и проявляющаяся гл. обр. диареей. К. м. распространён [распространен] во всех странах мира, наносит значительный ущерб жив-ву.
Этиология. Возбудитель болезни — патогенная кишечная палочка (Escherichia coli), относится к сем. Enterobacteriaceae роду Escherichia; включает большое кол-no серологии, вариантов. Энзоотич. вспышки К. м. наиболее часто вызывают кишечные палочки следующих 0-серогрупп: (18, 09, 078, OlO1; 0119. 086, 015, 020, 026, 0117, 0137, 02, 041, 0127—преим. у телят; 08, 0138, 0139, 0141, 0142, 0147, 0149, 026 - у поросят; 08, 09, 020, 035, 078, 0101, 0137, 015, 041—у ягнят; 02, 078, 041, 08, 0115, 0111, 026, 055, 015 — у птиц. Среди животных одного неблагополучного х-ва (фермы) нередки случаи одновременного циркулирования возбудителя нескольких серологич. вариантов.
Эпизоотология. Телята заболевают в первые 3—7 сут после рождения, поросята — в первые сут и недели жизни, а также в послеотъёмный [послеотъемный] период; ягнята — с первых сут жизни до 5—7 мес; щенки пушных зверей — в первые 10 сут, реже — в более старшем возрасте; птицы — в первые 3—5 мес жизни. Среди птиц наиболее восприимчивы цыплята 1—90-суточного возраста и куры в период начала яйцекладки. Источники возбудителя инфекции — больные и переболевшие животные, матери — носители патогенных вариантов кишечной палочки. Факторы передачи — инфицированные окружающие предметы, воздух, молозиво, молочная посуда, руки и спецодежда обслуживающего персонала, а также крысы и домовые мыши — обитатели животноводч. помещений в неблагополучных х-вах. Наиболее частый путь заражения — алиментарный, реже аэрогенный; возможно внутриутробное заражение. Эпизоотии К. м. возникают во все сезоны года, но чаще в зимне-весенний. Предрасполагающие факторы возникновения К. м.— пониженная естеств. резистентность организма новорождённого [новорожденного] , нарушение зоотехнич. и вет.-сан. правил содержания, кормления и ухода за матерями, новорождёнными [новорожденными] животными и молодняком в период его отъёма [отъема] от матерей. Колибактериоз у птиц как самостоятельная болезнь проявляется спорадич. случаями; эпизоотии возникают при смешанной инфекции с респираторным микоплазмозом, инфекц. бронхитом, пуллорозом — тифом, кокцидиозом или на фоне гиповитаминозом.
Иммунитет. У телят пассивный иммунитет (его продолжительность 10—14 сут) создаётся [создается] , если они получают молозиво коров, иммунизированных биопрепаратами, содержащими соответств. серологич. варианты Е. coli, или естественно иммунизированных коров, имевших контакт с возбудителем. Для иммунизации применяют поливакцины и гипериммунные сыворотки, при изготовлении к-рых используют кишечные палочки патогенных сероваров.
Течение и симптомы. Инкубационный период от неск. часов до 2—3 сут. Различают сверхострое, острое и подострое течение. Сверхострое и острое течение бывает чаще у животных в первые дни жизни, подострое — в более старшем возрасте и чаще в х-вах, стационарнонеблагополучных по К. м. У животных (кроме птиц) К. м. протекает в септич., энтеротоксемич. и энтеритной формах. При септич. форме возбудитель проникает в кровь, быстро размножается и распространяется по органам и тканям животного, вызывая его гибель в течение неск. часов или суток. Эта форма проявляется общим упадком сил, поносом, обезвоживанием организма, учащёнными [учащенными] дыханием и пульсом, развитием септич. процессов. В начальной стадии болезни отмечают кратковременное повышение темп-ры тела на 0,5—1 °С. При энтеротоксемической форме возбудитель размножается в желудке, тонких кишках и брыжеечных лимфатических узлах, вызывая их воспаление, диарею и общий токсикоз вследствие проникновения токсинов из кишечника в кровь; животные погибают от токсемии и коллапса. У поросят отъёмного [отъемного] возраста К. м. может протекать в форме отёчной [отечной] болезни, при к-рой отмечаются признаки поражения ц. н. с., кратковременная диарея, отёки [отеки] в области головы и подгрудка. Смерть наступает через неск. часов (редко через 1—2 сут) после появления признаков болезни. При энтеритной форме поражаются жел.-киш. тракт и брыжеечные лимфатич. узлы, характерен понос без признаков общего токсикоза. Инфицированные беременные матки нередко абортируют или рождают мёртвых [мертвых] животных. При сверхостром и остром течение могут наблюдаться признаки поражения ц. н. с. (судороги, парезы) без диареи. У птиц К. м. протекает в септич. форме, проявляется угнетением, потерей аппетита, затруднением дыхания, снижением или прекращением яйцекладки.
Патологоанатомические изменения. При вскрытии осн. изменения обнаруживают в жел.-киш. тракте: слизистая оболочка набухшая, гиперемированная, покрыта толстым слоем слизи, часто с кровоизлияниями различной величины; содержимое кишок жёлто-белого [желто-белого] цвета, со зловонным запахом и часто с примесью крови. Брыжеечные лимфатич. узлы увеличены, сочны, гиперемированы, иногда с кровоизлияниями. При септич. и энтеротоксемич. формах, кроме того, под эпикардом и на эндокарде точечные и пятнистые кровоизлияния, печень неравномерно окрашена, перерождена. Селезёнка [Селезенка] в большинстве случаев не увеличена, под её [ее] капсулой нередко точечные кровоизлияния, пульпа дряблая, тёмно-вишнёвого [темно-вишневого] цвета. Иногда обнаруживают очаговую пневмонию, воспаление суставов конечностей. При энтеритной форме поражаются жел.-киш. тракт и брыжеечные лимфатич. узлы. У птиц устанавливают аэросаккулит, перикардит, перигепатиг, сальпингит, оварит, перитонит.
Диагноз устанавливают на основании эпизоотол., клинич. и патологоанатомич. данных и результатов лабораторного (бактериол.) исследования патол, материала. Исследуют кал от 3—4 больных животных, а при наличии павших животных — 2—3 свежих трупа или от них патол. материал — сердце с перевязанными сосудами, трубчатую кость, селезёнку [селезенку] , долю печени с жёлчным [желчным] пузырём [пузырем] , брыжеечные лимфатич. узлы, голову. В отдельном сосуде направляют в лабораторию отрезок тонких кишок, перевязанный с двух сторон лигатурой. К. м. дифференцируют от жел.-киш. болезней неинфекц. природы (в т.ч. диспепсии), сальмонеллёза [сальмонеллеза] , диплококковой инфекции, пастереллёза [пастереллеза] , анаэробной энтеротоксемии, кандидамикоза, вибрионной диареи и вирусной диареи.
Лечение. Применяют специфич. препараты (иммунную сыворотку, гамма-глобулин, коли-фаг); антибактериальные средства (антибиотики в соответствии с результатами определения чувствительности выделенного возбудителя, сульфаниламидные и нитрофурановые препараты); диетич. и симптоматич. терапию, направленную на восстановление водно-солевого обмена, кислотно-щелочного равновесия, нейтрализацию токсинов и компенсацию в организме дефицита белков, углеводов и витаминов.
Профилактика и меры борьбы. Предупреждение К. м. основано на проведении комплекса организационно-хозяйств., зоотехнич., вет.-сан., зоогигиенич. и противоэпизоотич. (общих и специфич.) мероприятий, направленных на повышение резистентности организма матерей и молодняка, а также на предотвращение заражения животных через объекты внешней среды. Эффективное средство профилактики колибактериоза телят — постоянная смена мест отёла [отела] коров и содержания новорождённых [новорожденных] . В связи с этим ферма должна иметь двухсекционное родильное отделение (на 15% мест от общего числа коров) с неск. родильными боксами в каждой секции и многосекционный профилакторий. Кол-во родильных боксов и секций в профилактории определяется числом коров в стаде. В свиноводч. х-вах репродукторные помещения должны иметь изолированные секции (на 30—40 свиноматок), заполняющиеся свиноматками приблизительно одинакового срока беременности. После отъёма [отъема] поросят и перевода их в др. помещение секции подвергают санации. Из неспецифич. средств применяют глобулины, сыворотки крови животных, АБК, ПАБК, ацидофильное молоко. Для специфич. профилактики К. м. вакцинируют стельных коров и супоросных свиноматок; новорождённым [новорожденным] вводят специфич. иммунную сыворотку и гамма-глобулин в соответствии с наставлениями по применению этих препаратов. При возникновении К. м. в х-ве проводят комплекс противоэпизоотич. и вет.-сан. мероприятий, уделяя особое внимание качеству изоляционных, дезинфекционных и санитарных мер. При борьбе с К. м. руководствуются “Временной инструкцией о мероприятиях по борьбе с колибактериозом сельскохозяйственных животных”, утверждённой [утвержденной] Гл. управлением ветеринарии МСХ СССР в 1976.
Лит.: Рой Дж., Выращивание телят, пер. с англ., М., 1973; Артемьева С. А., Колибактериоз птиц, Л., 1977; Сидоров М. А., Профилактика колибактериоза новорожденных телят, “Ветеринария”, 1981, № 2, с. 41-43.
Читайте также:


