Прионные инфекции у животных их диагностика
Аннотация научной статьи по ветеринарным наукам, автор научной работы — Мудрикова Юлия Викторовна, Тустугашева Светлана Алексеевна
В статье рассмотрены механизмы действия патогенного прионного белка, который является инфекционным агентом. Авторы рассматривают различные варианты передачи патогенной формы приона через использование сырья животного происхождения в пищевых и медицинских целях. Обоснована необходимость разработки высокочувствительного воспроизводимого метода обнаружения патогенных прионных белков в различных образцах животного сырья.
Похожие темы научных работ по ветеринарным наукам , автор научной работы — Мудрикова Юлия Викторовна, Тустугашева Светлана Алексеевна
The article deals with the mechanisms of the pathogenic prion protein action that is an infection agent. The authors consider different ways of transferring pathogenic forms of prion through the use of animal raw materials for food and medical purposes. The necessity to develop a highly reproducible method of pathogenic prion protein detection in different samples of animal raw materials has been proved.
ISSN2074-9414. Техника и технология пищевых производств. 2011. № 1 УДК 636.2:591.2
Ю.В. Мудрикова, С.А. Тустугашева ПРИОННЫЕ ЗАБОЛЕВАНИЯ КРУПНОГО РОГАТОГО СКОТА
В статье рассмотрены механизмы действия патогенного прионного белка, который является инфекционным агентом. Авторы рассматривают различные варианты передачи патогенной формы приона через использование сырья животного происхождения в пищевых и медицинских целях. Обоснована необходимость разработки высокочувствительного воспроизводимого метода обнаружения патогенных прионных белков в различных образцах животного сырья.
Прионный белок, патогенность, губчатая энцефалопатия.
Одним из выдающихся научных достижений ХХ века в области биологии и медицины стало открытие в 1982 году американским молекулярным биологом, профессором Стенли Прюзинером, нового типа инфекционных агентов - прионов, однако при-онные болезни, например скрэйпи овец, были известны уже в середине XVIII века. Прионные болезни -это губчатые энцефалопатии млекопитающих, такие как бычья губчатая энцефалопатия или коровье бешенство, скрэйпи овец и некоторые нейродегенера-тивные заболевания человека - болезни Крейцфельда
- Якоба и Г ерстмана - Штраусслера - Шейнкера, семейная фатальная бессонница и куру. Эти заболевания характеризуются тяжелым прогрессирующим течением и неизбежным смертельным исходом [18].
Цель данной работы заключается в проведении аналитического обзора по тематике проблемы. В первую очередь это рассмотрение механизма инициирования инфекционным агентом, также рассмотрение методов контроля качества сырья животного происхождения, используемых в настоящее время.
Объекты и методы исследований
Большинство экспериментальных данных свидетельствует о том, что формирование патогенного
белка PrPSc происходит из-за конформационного перехода нормального клеточного белка в изоформу с уменьшением а-спиралей молекулы с 42 до 21 % (рис. 1) [2, 5, 6]. Содержание Р-складчатых структур в этой аномальной форме патогенного приона увеличивается с 3 до 54 % [12]. В бесклеточной системе продемонстрировано появление устойчивости к протеолизу изоформы прионового белка [11, 13], однако in vitro никому еще не удалось получить инфекционную форму PrPSc из нормального клеточного или рекомбинантного белка. Предполагается, что конформационный переход нормального белка в патогенную форму обеспечивают неизвестные до сих пор кофакторы, или помощники, аналогичные молекулярным шаперонам [8]. Полагают, что вновь образованная патогенная форма молекулы посредством неизвестного механизма, используя молекулы -посредники клетки хозяина, преобразует все большее количество нативных клеточных молекул PrP в аномальную форму, что аналогично цепной реакции расщепления атомного ядра. Накопление практически нерастворимой формы белка в клетках нейронов вызывает их вакуолизацию с последующей однозначной гибелью клеток.
Рис. 1. Предполагаемое изменение укладки полипеп-тидной цепи при превращении нормального прионного белка (а) в патогенную форму (б). Завитками показаны а-спирали, а стрелами - компоненты складчатого листка
Первоначально прионы были открыты как инфекционные агенты нового типа. Сейчас уже нет сомнений в том, что они представляют собой феномен общебиологического значения и, скорее всего, являются носителями биологической информации нового типа, информации, хранимой в конформации белка [4].
Прионные заболевания могут быть наследственными (примерно 15 % случаев), приобретенными ( Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Что же становится причиной возникновения данного заболевания у коров, а затем и у людей? Однозначного ответа нет до сих пор. Самым убедительным предположением является то, что фермеры используют продукты повторного цикла (переработанных туш коров, овец) в качестве прикорма для своих животных. Последняя эпидемия разразилась как раз в период изменения технологии производства костной муки. Предприниматели вместо жесткой температурной обработки ввели обработку растворителями с целью повышения питательной ценности получаемого прикорма [3]. Другой причиной может быть усиленная механическая переработка туш. В
результате такой компрессии может происходить изменение структуры мясных волокон и молекулярной конфигурации прионов.
5 декабря 2000 г. Совет министров сельского хозяйства Европейского союза (ЕС) запретил использование мяса и костной муки в корме для скота. Запрет начал действовать с 1 января 2001 г. Кроме того, также запрещена продажа мяса животных старше 2,5 лет. Стоимость указанных мер оценивается в 1,7 млрд долларов, 70 % из этой суммы выделила Комиссия ЕС. По правилам, мозг забитых животных исследуется на мясокомбинате и, если патогенных прионов не обнаружено, фирме-поставщику выдается сертификат, разрешающий экспорт мяса и его переработку.
В связи с этим необходимо проводить полномасштабные исследования на определение возбудителя губчатой энцефалопатии крупного рогатого скота (BSE), т.е. патогенной формы прионов в животном материале, который в дальнейшем поступает на производство.
Производитель должен учитывать классификацию факторов опасности, связанных с различными типами исходной ткани, которая была установлена и утверждена Всемирной организацией здравоохранения в 2006году (табл. 2) [19].
Инфективность различных тканей крупного рогатого скота
По возможности, соответственно местным обычаям и практикам, источники животной ткани должны подвергаться контролю и индивидуальной инспекции ветеринаром, а туша животного должна быть сертифицирована как годная для потребления человеком.
Была проведена оценка риска для лактозы и других производных молочной сыворотки, полученных с использованием сычужного фермента теленка, и сделано заключение, что риск BSE незначителен, если сычужный фермент теленка выработан в соответствии с процессом, описанным в отчете оценки риска Комитета по запатентованным лекарственным препаратам (CPMP) [9]. С учетом национального законодательства производные молока, выработанные согласно условиям, приведенным ниже, считаются представляющими приемлемый риск BSE:
- молоко получено от здоровых животных при тех же условиях, что и молоко, получаемое для потребления человеком;
- никакие другие материалы, полученные от жвачных, за исключением сычужного фермента теленка, не использовались в приготовлении таких производных (например, перевары казеина панкреатическими ферментами).
Доказательство, что инфективность не присутствует в молоке, включает пространственновременные эпидемиологические наблюдения, не обнаруживающие материнскую передачу, клинические наблюдения более чем ста телят, вскормленных инфицированными коровами и не развивших BSE, и опытные наблюдения, что молоко от инфицированных коров не передавало заболевание при внутри-церебральном или пероральном введении мышам. Также PrPSc не был обнаружен в молоке от скота, инкубирующего BSE после опытной пероральной проверки иммунности.
Сейчас по стандартам ЕС животные материалы, которые используются в медицине, пищевой промышленности, ветеринарии, должны проверяться на присутствие патогенной формы прионного белка.
Таким образом, наравне с контролем заболеваемости на первое место по значению выходят чувст-
Категория А Категория Б Категория В
Ткани с высокой инфективностью или PrPSc: мозг сетчатка глаза зрительный нерв твердая мозговая оболочка Ткани с более низкой инфективностью или PrPSc: печень почки язык кровь сердце желудок (сычуг) Ткани без обнаруженной ин-фективности или PrPSc: кожа жировая ткань молоко
вительные и быстрые методы диагностики BSE у животных, позволяющие осуществлять мониторинг эпизоотической ситуации среди популяции людей, крупного рогатого скота и парнокопытных дикой природы. В некоторых странах обязательным мероприятием, утвержденным Европейским союзом в январе 2001 г., является поголовное тестирование на BSE забиваемых животных старше З0 месяцев, а также отделение мяса, поступающего в продажу, от костей и ряд других мер, препятствующих проникновению прионных агентов в пищевые цепи людей и животных. Очевидно, что только развитие быстрых методов диагностики указанных возбудителей может отвечать поставленным задачам.
За последние 20 лет был разработан ряд методик для диагностики BSE, и все они, за редким исключением, рассчитаны на постмортальное исследование мозга.
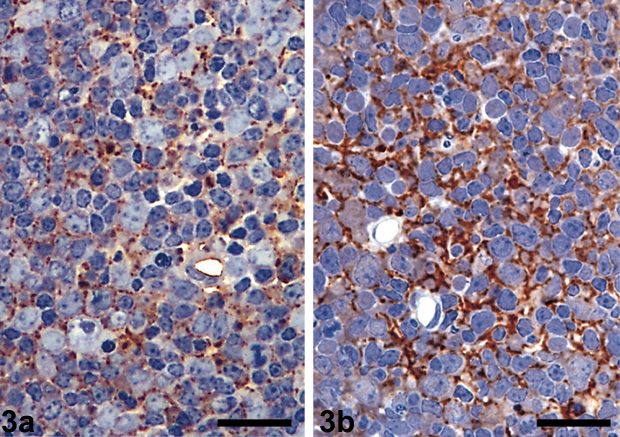
Основными методами диагностики данной патологии остаются различные варианты иммунологического анализа, а именно: иммуногистохимическое (ИГХ) выявление аномальной формы приона на срезах тканей мозга, вестерн-блоттинг и иммунофер-ментный анализ (ИФА) [12]. Во всех методиках в качестве объекта исследования используются ткани мозга животных [10].
Наибольшее распространение, в том числе и в России, получила система TeSeE™ (набор реагентов для очистки и определение методом ИФА in vitro патогенной формы прионного белка). Данная система в рамках Европейского союза утверждена в качестве экспресс-теста на губчатые энцефалопатии и скрепи крупного рогатого скота, овец и коз, она создана в со-
ответствии с Приложением III к Правилам (ЕС) № 999/2001 (BioRad). Однако реализация данной методики очень продолжительна по времени и велика по цене. В процессе переработки животного сырья возможна перекрестная контаминация, то есть заражение патогенной формой прионного белка при непосредственном контакте с неинфицированным материалом.
Результаты и их обсуждение
В связи с этим необходима разработка принципиально нового высокочувствительного метода идентификации патогенной формы прионного белка, позволяющего значительно расширить количество объектов исследования и их характер. И это возможно, если в основе создания тест-системы будет метод полимеразной цепной реакции; увеличение продуктов амплификации до концентрации, необходимой для идентификации патогенной формы прионного белка, позволит расширить наименования образцов, пригодных для исследования. Механизм развития прионных заболеваний (губчатой энцефалопатии) объясняют превращением нормального клеточного белка РгР в патогенный при контакте с изоформой PrPSc. С помощью ПЦР-тест-системы, когда анализируется конкретный образец (или продукт), исключается возможность неточности в результатах за счет перекрестной контаминации в процессе перевозки и хранения рядом с образцом, содержащим патогенную форму прионного белка. Безусловно, разработка подобной ПЦР-тест-системы требует тщательной проработки, в настоящее время проводятся работы по филогенетическому анализу с использованием международной базы данных.
1. Зуев, В.А. Медленные вирусные инфекции человека и животных / В.А. Зуев. - М., 1988.
2. Bolton, D.C. Identification of a protein that purifies with the scrapie prion / D.C. Bolton, M.P. McKinley, S.B. Prusiner // Science. - 1982. - V. 218. - P. 1309-1311.
3. Bradley, R. Prion Diseases / R. Bradley, J. Collinge, M.S. Palmer // eds. Oxford, 1997; 89-129.
4. Carrell, R.W. Conformational disease / R.W. Carrell, D.A. Lomas // Lancet, 1997; 350: 134-138.
5. Caughey, B.W. Secondary structure analysis of the scrapie-associated protein PrP 27-30 in water by infrared spectroscopy / B.W. Caughey, A. Dong, K.S. Bhat et al. // Biochemistry. - 1991. - V. 30. - P. 7672-7680.
6. Caughey, B.W. The scrapie-associated form of PrP is made from a cell surface precursor that is both protease- and phos-pholipase-sensitive / B.W. Caughey, G.J. Raymond // J. Biol. Chem. - 1991. - V. 266. - P. 18217-18223.
7. Collinge, J. Prion Diseases / J. Collinge, M. Palmer // eds. Oxford, 1997; 18-55.
8. Edenhofer, F. Prion protein PrPc interacts with molecular chaperones of the Hsp60 family / F. Edenhofer, R. Rieger, M. Famulok et al. // J. Virol. - 1996. - V. 70. - № 7. - P. 4724-4728.
9. EMEA/410/01 Rev. 2 - October 2003, Note for guidance on minimising the risk of transmitting animal spongiform encephalopathy agents via human and veterinary medicinal products adopted by the Committee for Proprietary Medicinal Products (CPMP) and by the Committee for Veterinary Medicinal Products (CVMP) - Official Journal of the European Union 28.1.2004.
10. Houston, F. Transmission of BSE by blood transfusion in sheep / F. Houston, J.D. Foster, A. Chong et al. // Lancet. -2000. - V. 356. - P. 999-1000.
11. Kocisko, D.A. Cell-free formation of protease-resistant prion protein / D.A. Kocisko, J.H. Come, S.A. Priola et al. // Nature. - 1994. - V. 370. - P. 471-474.
12. Prusiner, S.B. Prions / S.B. Prusiner // Proc. Natl. Acad. Sci. USA. - 1998. - V. 95. - P. 13363-13383.
13. Raymond, G.J. Molecular assessment of the potential transmissibilities of BSE and scrapie to humans / G.J. Raymond et
al. // Nature. - 1997. - V. 388. - P. 285-288.
14. Report of a WHO Consultation on Medicinal and other Products in Relation to Human and Animal Transmissible Spongiform Encephalopathies. Geneva, Switzerland, 24-26 March, 1997.
15. Supplement 1, Japanese Pharmacopoeia XIV, 17. Basic Requirements for Viral safety of Biotechnological/Biological Products listed in Japanese Pharmacopoeia, pp. 1618-1631, 2003.
16. Vilette, D. Ex vivo propagation of infectious sheep scrapie agent in heterologous epithelial cells expressing ovine prion
protein / D. Vilette, O. Andreoletti, F. Archer et al. // Proc. Natl. Acad. Sci. USA. - 2001.
17. Weissmann, C. PrP effects clarified / C. Weissmann // Curr. Biol. - 1996. - V. 6. - P. 1359.
18. Wilesmith, J. An epidemiologist’s view of bovine spongiform encephalopathy / J. Wilesmith // Philos Trans. R. Soc. of London, 1994; З4З: З57-З61.
19. WHO Guidelines on Tissue Infectivity Distribution in Transmissible Spongiform Encephalopathies 2006 (http://www.who.int/bloodproducts/cs/TSEPUBLISHEDREPORT.pdf).
650000, Россия, г. Кемерово, ул. Станционная, 2.
Тел./факс: (З842) З9-61-84 е-mail: biotek-kemerovo@rambler.ru
SUMMARY Yu.V. Mudrikova, S.A. Tustugasheva Cattle prion diseases
The article deals with the mechanisms of the pathogenic prion protein action that is an infection agent. The authors consider different ways of transferring pathogenic forms of prion through the use of animal raw materials for food and medical purposes. The necessity to develop a highly reproducible method of pathogenic prion protein detection in different samples of animal raw materials has been proved.
Prion protein, pathogenicity, spongiform encephalopathy.

Прототипом прионной болезни было трансмиссивное нейродегенеративное заболевание овец — таинственная смертоносная скрейпи (или почесуха овец). Ранние исследования показали, что агент скрейпи необычайно устойчив к лечению, которое нейтрализует другие патогены, и может годами оставаться на пастбищах. То, что агент скрейпи проявляет устойчивость, в частности, к радиации, привело к тому, что в 1960-х годах Дж. С. Гриффит и Тиквах Альпер предположили, что он представляет собой новый класс патогенов, который не имеет собственного нуклеинового генома и может быть аномальной самовоспроизводящейся формой белка или мембраны. Между тем описания патологии мозга, вызванной человеческой болезнью куру в Папуа — Новой Гвинее, которые выполнил Карлтон Гайдушек, привели Уильяма Хэдлоу к мысли, что куру похожа на скрейпи овец, и Хэдлоу порекомендовал, чтобы куру испытали на передаваемость от людей к другим приматам. Гайдушек успешно проделал эту работу и показал, что люди племени форе заболевали куру во время ритуальных каннибалистских праздников. Яркой особенностью куру и других прионных заболеваний, часто скрывавшей их причины, является длительный инкубационный период между заражением и появлением клинических признаков, который у людей может превышать четыре десятилетия.

Моя лаборатория в сотрудничестве с Питером Лэнсбери показала, что связанные с заболеваниями формы PrP сами могут вызвать трансформацию нормальных молекул PrP в аномальные формы. В этих реакциях превращения мы выявили поразительные биохимические особенности, которые помогли объяснить характеристики известных штаммов прионов и барьеры их передачи между разными видами. Однако, чтобы однозначно доказать, что прионы состоят из повторно свернутых агрегатов PrP и им не нужны специфически-прионные нуклеиновые кислоты, потребовалось разработать методы непрерывной бесклеточной амплификации прионов или реакции образования прионов de novo. Они первоначально были созданы лабораториями Сото, Супаттапоне и Прузинера в 2000-х годах; до того времени было трудно полностью исключить вероятность того, что эти заболевания вызваны неопознанными вирусами.

К сожалению, многие из стандартных методов, на которых долгое время базировались исследования обычных патогенов, — генетика патогенов, серология, рентгеноструктурный анализ, спектроскопия ядерного магнитного резонанса (ЯМР) — чрезвычайно трудно применить к прионам. Без каких-либо специфических патогенных генов, которые можно было бы секвенировать или подвергнуть мутации, многие стандартные генетические и обратные генетические подходы к выявлению структуры и функции патогенов не работают. Поскольку прионы состоят из белков организма-хозяина, иммунный ответ хозяина на патоген очень мал; таким образом, провести простое серологическое обнаружение прионных инфекций, основанное на взаимодействии с антителами, очень сложно. Кроме того, прионы млекопитающих, как правило, плотно упакованы, сильно гликозилированы и связаны с другими молекулами организма-хозяина, и поэтому даже специфические прионные конформационные эпитопы (поверхности, распознаваемые антителами) на агрегатах PrP трудно обнаружить и использовать. Все попытки определить трехмерные структуры прионов на протяжении уже долгого времени заходят в тупик, так как очищенные прионы имеют агрегированный, но некристаллический характер.
В течение многих лет единственным способом обнаружения и анализа прионов млекопитающих был биоанализ животных, который даже на самых быстрых моделях — грызунах — длился от нескольких месяцев до одного года. В конкретном организме разные штаммы обычно можно различить по периодам инкубации, невропатологическим паттернам и биохимическим признакам связанных с болезнью отложений PrP или прионов.
К счастью, в последнее время были разработаны мощные бесклеточные амплификационные анализы прионов, такие как циклическая амплификация прионной формы белка (PMCA), вибрационно-индуцированный конверсионный анализ в режиме реального времени (RT-QuIC) и анализ клеток скрейпи. Эти методы основаны на присущем прионам механизме репликации. И PMCA, и RT-QuIC чрезвычайно чувствительны: они могут усилить присутствие прионов в триллион раз, почти до точки обнаружения нескольких прионных частиц. Реакции PMCA распространяют инфекцию прионов, тем самым отражая и освещая многие аспекты прионной биологии, в то время как анализы RT-QuIC, как правило, не распространяют полностью инфекционные прионы, но обеспечивают более быстрые, более практичные и более высокопроизводительные методы их обнаружения, и, таким образом, они стали самыми современными инструментами в диагностике прионных заболеваний. Как PMCA, так и RT-QuIC в некоторых случаях помогают различать важные штаммы прионов у определенных видов организмов-хозяев.
В выявлении базовой структуры прионов наблюдается медленный прогресс. При помощи полупроводниковых ЯМР-исследований была обнаружена молекулярная архитектура некоторых прионов грибов и прионоподобных фибриллярных структур PrP млекопитающих. Электронная кристаллография, дифракция волокон и криоэлектронные микроскопические исследования помогли описать ключевые структурные ограничения прионов млекопитающих, но применение этих и, возможно, других структурных биологических методов еще нужно улучшить.

Разобраться в структуре и механизмах репликации прионов млекопитающих, по крайней мере на молекулярном уровне, крайне сложно. Сначала нужно объяснить, как неправильно свернутые белки могут распространяться в роли патогенов, не перенося своего собственного нуклеинового генома. Затем следует также объяснить, как белки с единой последовательностью аминокислот, такие как PrP того или иного животного-хозяина, могут образовывать разные штаммы прионов, которые исправно распространяются и вызывают различные фенотипы болезни без генетических мутаций, объясняющих вариации штаммов в обычных патогенах.
Множество исследований указывает на то, что прионы млекопитающих — это упорядоченные скопления нескольких молекул PrP, плотно упакованных и часто фибриллярных или нитевидных. Молекулы PrP (мономеры) в прионах по сравнению с нормальными свободными молекулами PrP пересвернуты практически полностью. Когда правильные молекулы PrP включаются в растущие прионные агрегаты, эти агрегаты вызывают их рефолдинг, причем прионы действуют как штамм-специфические шаблоны или затравки, которые каким-то образом придают свои собственные аберрантные формы каждой входящей молекуле, контролируя стабильную репликацию своего штамма.
За рамками этого грубого описания детали структуры и распространения прионов на молекулярном уровне остаются неясными. Также нерешенным остается вопрос о том, как прионы распространяются за пределы исходного места заражения в организме-хозяине. Существующие данные свидетельствуют о том, что наиболее эффективная межклеточная передача прионов связана с мембранозными структурами, такими как экзосомы или туннелирующие нанотрубки, — скорее всего, потому, что прионы обычно связаны с мембранами липидными якорями; однако возможность этих мембранных структур способствовать распространению прионов in vivo еще предстоит определить. Очень важно понять механизмы распространения прионов, поскольку способности различных неправильно свернутых белковых агрегатов распространяться внутри и между клетками, тканями и индивидами определяют то, действуют ли они как инфекционные патогены или являются относительно безобидными сбоями белкового метаболизма.
Многие виды млекопитающих, включая людей, низших приматов, крупный рогатый скот, овец, коз, оленей, лосей, кошек, норок, грызунов и различных экзотических копытных, восприимчивы к прионным заболеваниям PrP. Но такими являются не все виды: собаки и лошади, судя по всему, представляют собой заметные исключения. Разные виды обычно экспрессируют несколько разные нормальные молекулы PrP, и различия в аминокислотной последовательности PrP могут сильно влиять на восприимчивость хозяина к входящим прионным инфекциям. Например, люди, как известно, до некоторой степени восприимчивы к губчатой энцефалопатии крупного рогатого скота (ГЭКРС), но, по-видимому, устойчивы к скрейпи овец и, насколько нам известно, хронической изнуряющей болезни оленей. По какой-то причине лесные полевки и беличьи обезьяны необычайно восприимчивы к широкому спектру прионных инфекций других видов.
Механизмы, с помощью которых прионные инфекции вызывают нейродегенеративные заболевания, нам пока неизвестны. Агрегаты различных прионных штаммов в организмах-хозяевах разных видов могут накапливаться преимущественно в разных областях центральной нервной системы и вызывают ряд невропатологических расстройств. Очевидно, что конечным эффектом по крайней мере частичного повреждения является сбой в работе нейронов и их потеря, что вызывает множество клинических симптомов и приводит к летальному исходу. Известно, что ряд нейрофизиологических процессов и путей нарушается, но многое еще предстоит определить относительно того, связаны ли такие нарушения с прямой или косвенной токсичностью прионов и в какой степени та или иная недостаточность или комбинация недостаточностей наиболее ответственна за кончину больного.

У людей причины прионных заболеваний могут быть генетическими (из-за специфических мутаций гена PrP), приобретенными (вызванными заражением — например, воздействием куру, ГЭКРС или другим содержащим прионы материалом) или спорадическими (неизвестного происхождения; обычно предполагается, что они обусловлены спонтанным образованием прионов у конкретного индивидуума). Подавляющее большинство прионных заболеваний человека являются спорадическими, и среди них наиболее распространена спорадическая болезнь Крейтцфельдта — Якоба (sCJD), заболеваемость которой в год во всем мире составляет примерно один случай на миллион населения. Ряд различных мутаций в гене PrP может вызывать множество семейных прионных заболеваний, при этом некоторые мутации являются полностью пенетрантными (всегда вызывающими болезнь у носителей мутации), а другие — менее пенетрантными. Клинические симптомы и прогрессирование болезни могут заметно различаться в разных организмах-хозяевах и при разных типах прионных заболеваний, но могут включать деменцию, расстройство координации, бессонницу, галлюцинации, жесткость мышц, спутанность сознания, усталость и затрудненность речи.
В последнее время были достигнуты значительные успехи в том, чтобы точно и относительно неинвазивно диагностировать прионные заболевания человека у живых пациентов на основе новых прион-специфических тестов мазков из носа, спинномозговой жидкости, крови, мочи или кожи. Например, RT-QuIC-тестирование спинномозговой жидкости и/или материалов назальной щеточной биопсии может достигать 100% точности при диагностике спорадической болезни Крейтцфельдта — Якоба. Эти тесты выгодны потому, что измеряют возбудителей прионной болезни, но они еще не полностью проверены и не рекомендованы официально такими организациями, как ВОЗ. В остальном диагностика спорадических прионных заболеваний у людей зависит в первую очередь от совокупности клинических признаков, результатов сканирования мозга, электроэнцефалограмм и других биомаркеров, которые вместе могут иметь высокую диагностическую чувствительность, но не полностью специфичны для прионных болезней.
Несмотря на описанные выше недавние успехи в разработке новых прионных тестов, действующие руководящие принципы таковы: для окончательной диагностики спорадического или приобретенного прионного заболевания необходимо невропатологическое исследование тканей головного мозга, полученных в результате биопсии (что редко) или аутопсии. Полагаю, в скором времени эти рекомендации будут изменены, в них будут включены новые, менее инвазивные прижизненные тесты для выявления прионов. К сожалению, несмотря на то, что этот прогресс в раннем диагностировании прионных болезней должен улучшить перспективы разработки и применения терапевтических средств, в настоящее время доступных методов лечения, которые доказали бы свою эффективность в клинических испытаниях, не существует.

Действительно, последний вопрос представляет собой важный рубеж в изучении многих заболеваний, связанных с неправильным образованием белков, особенно тех, которые связаны с патогенным накоплением аномальных фибриллярных белковых отложений (например, амилоидных фибрилл и бляшек). Эти болезни включают в себя болезни Альцгеймера, Паркинсона и Гентингтона, а также боковой амиотрофический склероз, лобно-височные деменции, хроническую травматическую энцефалопатию и диабет второго типа. Различные белки организма-хозяина образуют скопления при этих и многих других заболеваниях, но, как и прионы, такие скопления обычно растут за счет включения в затравку нормальных растворимых молекул белка. Таким образом, потенциал для прионоподобного распространения белков существует на молекулярном уровне. Также растет количество доказательств того, что множество различных связанных с болезнями белковых отложений может расти и распространяться так же, как и прионы, вызывая патологии после инокуляции в локализованные участки у подопытных животных.
Результаты этих исследований поднимают насущные вопросы о том, могут ли многочисленные заболевания, основанные на повторном фолдинге белка, — а они зачастую гораздо более распространены, чем прионные заболевания, основанные на PrP, — быть переданы людям или животным в реальных условиях. Болезнь Крейтцфельдта — Якоба передается между людьми через трансплантацию тканей, инъекции гормонов, полученных от трупов, переливание крови и зараженные медицинские инструменты. Вторым фактором в таких ятрогенных передачах является тот факт, что прионы часто не полностью инактивируются стандартными процедурами клинической дезинфекции.
Еще предстоит установить, могут ли быть определены другие типы потенциально прионоподобных, ассоциированных с болезнями агрегатов белка, которые также могут быть устойчивы к инактивации и при этом способны инициировать или ускорять патогенные процессы у людей. Я не знаю никаких эпидемиологических указаний на то, что это так, но дальнейшее тщательное изучение этого вопроса кажется оправданным.
Читайте также:


