При дисбактериозе кишечника может повыситься соэ

Важность проблемы заболеваемости паразитозами заключается не только в масштабности данных заболеваний, но и в том, какой ущерб здоровью населения наносят осложнения, провоцируемые ими. Это аллергизация и иммуносупрессия, канцерогенез, анемия, поражения желудочно-кишечного тракта и мочеполовой системы, дисбактериоз. У детей, больных паразитозом, отмечается отставание в нервно-психическом развитии, раздражительность, ослабление памяти. Все эти факты ставят паразитозы в ряд важнейших проблем современного здравоохранения [1, 2].
Гельминтозы человека являются актульной проблемой для медицинской науки и практического здравоохранения. В последние годы отмечается тенденция к росту лямблиоза, так по данным экспертов ВОЗ, в странах Азии, Африки, Латинской Америки ежегодно лямблиозом заражаются около 200 млн человек [3].
Giardia lamblia – простейшее класса жгутиковых, возбудитель лямблиоза. В цикле развития простейшего выделяют две стадии – вегетативной формы и цисты. Цисты, выделяемые с фекалиями, устойчивы к факторам окружающей среды: в воде они остаются жизнеспособными до 3 месяцев, устойчивы к хлору. Это самый распространенный патогенный паразит, причиной, которой является неудовлетворительное состояние систем водоснабжения и очистных сооружений. Основным резервуаром инфекции служит человек, но и млекопитающие (собаки, кошки) могут быть заражены лямблиями и выделять цисты [4, 5].
Лямблиоз распространен повсеместно, цисты лямблий в фекалиях обнаруживаются у 20 % населения земного шара. Неблагополучная эпидемиологическая обстановка по заболеваемости лямблиозом обусловлена, прежде всего, неудовлетворительным обеспечением населения доброкачественной питьевой водой, загрязнением открытых водоемов неочищенными канализационными стоками. Немалый вклад в увеличение заболеваемости лямблиозом вносят различные неблагоприятные состояния: прежде всего несбалансированное питание в виде повышенного потребления легко усвояемых углеводов на фоне значительного дефицита белка, а так же нарушение микрофлоры кишечника после терапии антибиотиками (особенно при многократных курсах) [5, 6].
Клинические проявления лямблиоза регистрируются во всем мире почти у 500 млн. больных в год. Лямблиоз встречается повсеместно, в среднем выявляется у 20 % практически здорового населения. Является наиболее распространенной инвазией кишечника в развитых странах, во всех климатогеографических зонах. Лямблиоз регистрируется во всех возрастных группах. В развитых странах инвазированность среди взрослых составляет 3-5 %, а в развивающихся – свыше 10 %. [7,8].
По данным ВОЗ распространенность лямблиоза в детской популяции составляет 350 случаев на 100000 детского населения. Этот показатель в разных регионах может значительно колебаться в большую или меньшую сторону в зависимости санитарно-бытовых условий, возможности диагностики и настороженности врачей.
Частота манифестного лямблиоза составляет 13–43 %, субклинического – 49 %, бессимптомного – 25–28 % от числа инвазированных лямблий. Особенность возбудителя, состояние реактивности макроорганизма, полиморфизм клинических проявлений, наблюдение и лечение у специалистов разных профилей у терапевтов, гастроэнтерологов, дерматологов привили к росту хронических форм заболевания над острыми с длительной персистенцией лямблий и ухудшением качества жизнь пациента. [7, 8].
Согласно классификации ВОЗ выделяют:
1. лямблионосительство (бессимптомный лямблиоз);
2. лямблиоз (клинически выраженная форма), который проявляется, преимущественно, в виде:
– кишечной формы (дискинезия двенадцатиперстной кишки, дуоденит, энтерит, энтероколит);
– гепатобилиарной формы (дискинезия желчных путей, холецистит);
– лямблиоза как сопутствующего заболевания.
Среди клинических проявлений лямблиоза выделяют две основные формы:
– первичная инвазия или острый лямблиоз, чаще распространенный среди детей раннего возраста;
– затяжное рецидивирующее течение или хронический лямблиоз, регистрируемый у детей более старшего возраста и взрослых.
Цель исследования – современная клинико-эпидемилогическая характеристика лямблиоза.
Материалы и методы исследования
Оценивались объективные и субъективные данные, а также изменения лабораторных показателей. В ходе работы впервые разработана индивидуальная регистрационная форма, куда внесены полученные результаты по объективным и субъективным данным, дополнительных лабораторных исследований до и после традиционного лечения.
Критериями для включения в исследование являлись больные острой и хронической формой лямблиоза, диагноз у которых был подтвержден микроскопическим обнаружением вегетативных форм лямблий и их цист в кале.
Диагноз был верифицирован на основании клинико-анамнестических и лабораторных (копроскопия кала, результат дуоденального зондирования, ПЦР-диагностика). Вегетативные формы лямблий были обнаружены в дуоденальном содержимом и жидких испражнениях, цистированные формы – в нативных фекалиях в течение 2-х часов после сбора анализа. Дополнительно всем больным проводилось ультразвуковое исследование (УЗИ).
На основании полученных дополнительных лабораторных данных была проведена статистическая обработка с использованием критерия Стьюдента, или t-критерий. Проверка осуществляется на основе выборочных данных. Проверяется нулевая и альтернативная гипотезы:
Н(0): две генеральные средние равны, или, другими словами, две сравниваемые выборки принадлежат к одной и той же генеральной совокупности. Проверяемый t-критерий выражается в виде отношения:
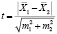
,
где m1, m2 – стандартные ошибки средних значений сравниваемых выборок.
tкрит находится по таблице для заданного α и числа степеней свободы

В 2000 году этой группой экспертов было предложено расширенное определение СРК, однако не меняющее сути предыдущего. СРК – это устойчивая совокупность функциональных кишечных расстройств продолжительностью не менее 12 недель на протяжении последних 12 месяцев, проявляющаяся болью и/или дискомфортом в животе, которые проходят после дефекации, сопровождаются изменениями частоты и консистенции стула и сочетаются на протяжении 25 % времени заболевания не менее чем с двумя стойкими симптомами нарушения функции кишечника (изменениями частоты стула, консистенции кала, самого акта дефекации (императивные позывы, тенезмы, чувство неполного опорожнения кишечника, дополнительные усилия при дефекации), выделением слизи с калом, метеоризмом).
Сложность курации пациентов с СРК заключается в том, что в каждом конкретном случае сочетание причинных факторов и механизмов развития болезни индивидуально. К наиболее значимым факторам риска развития СРК относятся: женский пол (риск в 4 раза выше); возраст (до 30-40 лет); место проживания (мегаполисы); образование (высшее, гуманитарное); профессиональная принадлежность (работники умственного труда и работники культуры); социальная среда обитания (неполные семьи, детские дома); низкий уровень социальной поддержки [3].
Актуальность проблемы СРК определяется и значительным снижением качества жизни пациентов. Так, сравнение качества жизни пациентов с СРК, а также пациентов с сахарным диабетом, острым инфарктом миокарда, бронхиальной астмой, артериальной гипертензией и депрессией, показало, что у лиц, страдающих СРК, качество жизни является наиболее низким среди всех указанных групп и сравнимо с пациентами, страдающими депрессией.
Постинфекционная форма СРК составляет 6–17 % всех случаев СРК и может развиться у каждого третьего больного, перенесшего острую кишечную инфекцию 12. К предрасполагающим факторам развития постинфекционной формы СРК относятся женский пол, наличие ипохондрии и неблагоприятные жизненные события на протяжении года, предшествующего заболеванию. Кроме этого, у части пациентов с СРК отмечается высокое бактериальное обсеменение кишечника.
Проведение первичного курса лечения с последующей переоценкой диагноза является ключевым моментом диагностики СРК. Целью такого лечения является устранение симптомов заболевания и проверка ex juvantibus правильности постановки диагноза, отсутствия необходимости дальнейшего поиска органической патологии и выполнения дополнительных диагностических процедур. В результате лечения пациент должен убедиться, что его состояние улучшается или хотя бы не ухудшается, что позволяет с большей уверенностью и по согласованию с пациентом принять решение не проводить дальнейшее обследование.
Пробиотики – живые микроорганизмы, которые при применении в адекватных количествах вызывают улучшение здоровья организма хозяина. К пробиотикам относятся лечебно-профилактические препараты, конструируемые на основе живых бактерий родов Bifidobacterium, Lactobacillus, Escherichia, Enterococcus, Aerococcus или апатогенных спорообразующих микроорганизмов и сахаромицет, при естественном способе введения положительно влияющие на физиологические, биохимические и иммунные реакции организма хозяина через стабилизацию функции его нормальной микрофлоры.
В зависимости от состава пробиотики подразделяются на три группы: моноштаммовые, содержащие один штамм бактерий определенного вида; мультиштаммовые, в состав которых входят несколько штаммов одного вида микроорганизмов, и многовидовые (многокомпонентные), состоящие из штаммов различных видов, принадлежащих к одному или к разным семействам бактерий [20].
В настоящее время в РФ зарегистрированы два многокомпонентных пробиотических препарата: РиоФлора Баланс Нео и РиоФлора Иммуно Нео. В состав пробиотика РиоФлора Баланс Нео входит 8 пробиотических микроорганизмов: 2 штамма бифидобактерий (B. lactis, B. bifidum) и 6 штаммов лактобацилл (L. plantarum, L. acidophilus W37, L. acidophilus W55, L. rhamnosus, L. paracasei, L. salivarius). Каждая капсула содержит не менее 2,5 х 109 KOЕ/г пробиотических микроорганизмов. Комбинация 9 штаммов пробиотических микроорганизмов содержится в составе пробиотика РиоФлора Иммуно Нео: 3 штамма бифидобактерий (B. lactis W51, B. lactis W52, B. longum), 4 штамма лактобацилл (L. acidophilus, L. plantarum, L. paracasei, L. salivarius), Lactococcus lactis и Streptococcus thermophilic. Каждая капсула содержит не менее 5,0 х 108 KOЕ/г пробиотических микроорганизмов.
Синбиотики представляют собой соответствующую комбинацию про- и пребиотиков. Синбиотический эффект совмещает эффекты тех и других. К синбиотикам можно отнести: Биовестин (бифидогенные факторы + В. adolescentis), Биовестин-лакто (бифидогенные факторы + В. bifidum + В. аdolescentis + L. рlantarum), Бион-3 (L. gasseri + B. bifidum + B. longum + 9 микроэлементов + 12 витаминов + инулин) и другие.
В ряде работ описан пробиотический эффект висмута трикалия дицитрата, который обусловлен широким спектром антибактериального действия препарата на патогенную кишечную микрофлору с последующим конкурентным замещением нормофлорой, выраженными противовоспалительными и адсорбирующими свойствами [6, 31-36].
Прием висмута трикалия дицитрата по 1 таблетке 3 раза в день в течение 3 недель способствует более быстрому купированию основных симптомов СРК (абдоминальная боль, метеоризм) [35] и достоверному восстановлению физиологической кишечной микрофлоры: примерно на порядок возрастает количество бифидо- и лактобактерий, в 7–8 раз увеличивалось содержание в кишечнике мукозной нормофлоры, при этом эффект висмута трикалия дицитрата сохраняется в течение не менее трех месяцев после завершения терапии [31]. В исследовании, проведенном под руководством профессора Е.И. Ткаченко [37] было проведено исследование эффективности препарата висмута трикалия дицитрата – Новобисмол® у пациентов с СРК по смешанному типу при отсутствии тяжелой сопутствующей патологии. Положительный клинический эффект был отмечен у всех наблюдаемых пациентов: уменьшилась выраженность болевого синдрома, снизилась частота встречаемости гастроинтестинальных и общих жалоб. При этом наблюдалась положительная динамика по всем шкалам качества жизни (статистически значимые различия были обнаружены в динамике показателей шкал общего состояния здоровья, жизненной активности и психического здоровья), была отмечена и благоприятная динамика психоэмоционального статуса пациентов, которая проявлялась уменьшением степени выраженности ситуационной тревожности, личностной тревожности и уменьшением проявлений депрессивных состояний.
Большой выбор препаратов с пробиотическим действием, расширяет терапевтические возможности интерниста в лечении пациентов с СРК и позволяет повысить эффективность проводимой терапии, поскольку часто лекарственные препараты, эффективные в лечении СРК у одного пациента, не дают практически никакого эффекта у другого.
Цель — баланс
Пищеварительный тракт — гетерогенная бактериальная экосистема. Вследствие низкого значения pH желудок здорового человека можно считать стерильной средой.
В кишечнике условия для роста микроорганизмов лучше. В тонком бактерий немного — 104–106/мл (высокое значение pH и быстрый транзит не способствуют увеличению их количества), а в толстом — в 100 000 раз больше.
Кишечник является строго анаэробной системой, богатой питательными веществами, с кислотностью среды от нейтральной до слабощелочной. Его бактериальная экосистема включает от 400 до 500 типов микроорганизмов, которые взаимодействуют. Многие являются компенсалами, помогают расщеплять неперевариваемые соединения, содержащиеся в пище.
У практически здоровых людей около 96% микрофлоры кишечника составляют представители облигатной (т. е. постоянно встречающейся) микрофлоры: бифидо- и лактобактерии, бактероиды, непатогенная кишечная палочка и др.
Вторая группа, куда входят факультативная (непостоянная) и условно-патогенная микрофлора, занимает лишь 2–4% от общего количества микроорганизмов. При определенных условиях (снижение местного, а тем более общего иммунитета) вызывает внутрикишечные и общие нарушения. Факультативная группа представлена микрококками, протеем, стафилококками, клостридиями, цитробактерами и др.
Третью группу составляет транзиторная (случайная) патогенная микрофлора: клостридии, синегнойная палочка, грибы рода Candida. На ее долю приходится 0,001–0,01%.
В процессе постоянного взаимодействия макро- и микроорганизмов формируется уникальная экосистема, находящаяся в состоянии динамического баланса. Существенную роль играют облигатные и факультативные анаэробы: бифидо-, лакто- и энтеробактерии, а также энтерококки. Бифидобактерии создают кислую среду и тем самым препятствуют размножению вредной микрофлоры. Кроме того, обладают выраженным антагонизмом в отношении патогенов, улучшают процессы пищеварения, поддерживают витаминный баланс и иммунный статус, участвуют в синтезе незаменимых аминокислот.
Нарушение бактериоэкологического равновесия в ЖКТ приводит к формированию дисбактериоза (дисбиоза) кишечника.
Нехорошие перемены
Дисбактериоз кишечника — это клинико-лабораторный синдром, возникающий при разных патологических состояниях. Характерны изменения количественного и (или) качественного состава нормофлоры, метаболические и иммунологические нарушения; у некоторых пациентов добавляются симптомы поражения кишечника.
При заболеваниях местного и общего характера изменяется микробный пейзаж толстой кишки. Дисбактериоз регистрируется у большинства пациентов с поражением ЖКТ инфекционной и неинфекционной природы, после острых вирусных и бактериальных инфекций внекишечной локализации, при хронической воспалительной и аллергической патологии, у страдающих злокачественными заболеваниями и лейкозами, на фоне применения цитостатиков и особенно антибиотиков. Антибиотикозависимые дисбиозы стабильны и требуют активной терапии.
Сдвиги в микрофлоре кишечника вторичны — отражают воздействие факторов, изменяющих статус кишечника или внутренний баланс самого микробиоценоза. Нарушение микробного равновесия может осложнять многие патологические состояния, быть атерогенным явлением, связанным с антибактериальной, гормональной и другой терапией, несбалансированным питанием и т. д.
Один из частых вариантов (удельный вес порой достигает 31%) дисбактериоза кишечника — кандидозный, при котором имеет место избыточный рост грибов рода Candida. Он нередко ассоциируется с пищевой аллергией и аллергическими заболеваниями вообще, а также с курением.
Лабораторные поиски
Клиническая картина дисбактериоза кишечника вариабельна, а выраженность симптоматики не всегда напрямую зависит от степени дисбиотических нарушений. Ранними и наиболее специфическими симптомами можно считать повышенное газообразование, нарушение переваривания пищи (кишечная диспепсия), изменение характера стула; при развитии дисбактериоза на фоне колита — болевой синдром, патологические примеси в кале (слизь). В более тяжелых случаях добавляются интоксикация, диарея и обезвоживание, снижение массы тела.
В диагностике и трактовке кишечного дисбактериоза большое значение имеет копрологическое исследование, дающее возможность охарактеризовать пищеварительную, ферментовыделительную, всасывательную и двигательную функции кишечника. В последнее время получили распространение методы, основанные на выявлении метаболитов микроорганизмов, — газожидкостная и ионная хроматография. В лабораториях проводят бактериологические исследования фекалий и посев на питательные среды соскобов со слизистых оболочек.
Золотым стандартом диагностики синдрома избыточного роста бактерий считается интестиноскопия с аспирацией содержимого тонкой кишки и посевом аспирата на питательную среду. Но эта методика сложна, требует общей анестезии и хорошей бактериологической базы с возможностью культивирования аэробов и анаэробов, а результат приходится ждать порядка 10 дней.
Синдром избыточного роста бактерий выявляется также по данным дыхательного теста с меченым Н2 — с лактулозой или галактозой. Бактерии разлагают лактулозу, в результате чего освобождается меченый Н2, концентрация которого затем может быть измерена в выдыхаемом воздухе. В норме лактулоза расщепляется лишь микрофлорой в толстом кишечнике. При дисбиозе и тонкая кишка заселяется микроорганизмами, расщепляющими лактулозу. При этом следует исключить ускоренное продвижение субстрата по тонкой кишке.
Посев дуоденального аспирата тоже подтверждает синдром избыточного роста бактерий: при патологии содержание микроорганизмов >106/мл (общее количество бактерий в просвете тощей кишки не превышает 104–106/мл).
Микрофлора различных отделов пищеварительного тракта значительно отличается количественно и качественно.+
Микробиологическое исследование фекалий лишь косвенно может свидетельствовать о микробном неблагополучии, т. к. состав фекальной микрофлоры отражает ситуацию только в толстой кишке, а точнее — в дистальном отделе.
Настрой на победу
Профилактика и особенно лечение дисбактериоза кишечника должны быть комплексными и предполагать:
- устранение избыточного бактериального обсеменения тонкой кишки;
- восстановление нормальной микробной флоры толстой кишки;
- улучшение кишечного пищеварения и всасывания;
- восстановление нормальной моторики кишечника;
- стимулирование реактивности организма.
Важнейшими нормальными обитателями толстого кишечника человека являются бифидобактерии (вид анаэробных палочковидных грамположительных бактерий) — 3–7% от общей фекальной микрофлоры взрослых. Нужны и лактобактерии.
Восстановлению качества и количества бифидобактерий способствует увеличение в рационе пектинов (растворимых пищевых волокон), а для лактобактерий лучшие продукты — кисломолочные. Антибиотическую активность последних повышают путем добавления никотиновой кислоты (на 1 л — 6–8 мг), тиамина (4–6 мг), токоферола (1–3 мг).
Для профилактики и лечения дисбактериоза широко используются пробиотики и пребиотики.
Пробиотики — это живые микроорганизмы (молочнокислые бактерии, чаще бифидо- или лактобактерии), нормальные обитатели кишечника здорового человека, улучшающие микробный баланс. Обладают антагонистическими свойствами по отношению к патогенам (третья группа): конкурируют за рецепторы на эпителиоцитах, питательные вещества; способны выделять ингредиенты (цитокины, масляную кислоту), ингибирующие рост патогенных бактерий. Монокультуру или комплекс живых микроорганизмов дополняют веществом, стимулирующим их колонизирующую способность и размножение.
Пробиотики содержатся в молочных продуктах со специальной закваской, кукурузных хлопьях, крупах, черном хлебе.
При наличии бродильных процессов в кишечнике надо ограничивать углеводы, пищевые волокна (клетчатку), при гнилостных — белки и жиры.
Каждому, у кого высок риск развития дисбиоза, следует избегать цельного молока, бобовых, а также продуктов, богатых эфирными маслами (чеснок, зеленый лук, репа, редька).
Для стабилизации микрофлоры кишечника в рацион включают морковный сок, сою, дрожжевой, тыквенный, картофельный и рисовый экстракты, молочную сыворотку и молозиво (обладают бифидогенным действием).
Используют растительные компоненты и при стафилококковом дисбактериозе. Полезны лесная земляника, рябина, малина, черника, шиповник, черная смородина. При протейном дисбактериозе нужны абрикосы и черная смородина; при наличии гнилостных бактерий — клюква и абрикосы. Если имеет место избыточный рост грибов рода Candida, стоит налегать на бруснику, стручковый перец, морковь.
При торпидно протекающем дисбактериозе рекомендуют дополнять лечение, подключая эффект от приема эвкалипта, календулы, аира, зверобоя. Когда подтвержден грибковый дисбактериоз с бродильной диспепсией, положительное влияние окажет цикорий растворимый.
Кроме пробиотиков, важное значение в профилактике и лечении дисбактериоза кишечника имеют пребиотики (к ним в основном относят растворимые пищевые волокна класса углеводов: фруктоолигосахариды, галактоолигосахариды). В желудке и тонкой кишке они избегают гидролиза пищеварительными ферментами и достигают толстой кишки в неизменном виде. Там подвергаются ферментации бифидо- и лактобактериями, что приводит к увеличению количества флоры и объема каловых масс. При этом важно подчеркнуть, что фруктоолигосахариды представляют собой энергетический субстрат для представителей нормальной микрофлоры кишечника (бифидо- и лактобактерий). В процессе ферментации образуются короткоцепочечные жирные кислоты (преимущественно уксусная, пропионовая, масляная), которые снижают рН в кишечнике, стимулируют перистальтику.
Укреплению защитного барьера толстой кишки при потреблении пребиотиков способствует и стимуляция выработки в ней слизи. Повышенное слизеобразование энтероцитами может быть следствием снижения рН при возросшем синтезе короткоцепочечных жирных кислот микрофлорой кишечника в ответ на введение пребиотиков. Свойствами пребиотиков в наибольшей степени обладают инулин, лактулоза, лактил, олигосахариды, лактоолигосахариды, хилак форте и др.
Инулин присутствует в клетках цикория, артишока, корней одуванчика, клубней топинамбура, фасоли, петрушки. Наиболее хорошо изучен как бифидогенный фактор — избирательно ускоряет рост и метаболизм бифидобактерий. Прием 5 г/день олигофруктозы или ≤8 г/день инулина обеспечивает значительное изменение состава кишечной микрофлоры, увеличивая численность бифидобактерий и снижая количество патогенов.
Пробиотики и пребиотики могут применяться для профилактики и лечения дисбактериоза кишечника, в т. ч. при назначении эрадикационных схем лечения Helicobacter pylori при гастроэзофагеальной рефлюксной, язвенной болезни желудка и двенадцатиперстной кишки, эрозивных гастро- и дуоденопатиях.
Применение антибиотиков нежелательно, т. к. они могут усугублять дисбиоз кишечника. Целесообразно использовать препараты, минимально влияющие на симбиотическую флору и в тоже время подавляющие рост патогенных микроорганизмов. К таким относятся нитрофураны (нифуроксазид, интетрикс) — т. н. кишечные антисептики.
Пациентам с кишечной диспепсией показаны ферментные препараты. Чаще используют панкреатин (мезим форте, трифермент, креон). При стеаторее и гипомоторной дискинезии кишечника к панкреатину добавляют желчные кислоты (панзинорм), при бродильных расстройствах — гемицеллюлозу (фестал, энзистал, дигестал). Для улучшения процессов всасывания можно назначать мембраностабилизирующие препараты (карсил, эссенциале).
При дисбактериозе, особенно в период реабилитации, показаны иммуномодуляторы (натрия нуклеинат, витамины), растительные адаптогены (элеутерококк, женьшень, эхинацея). Когда отмечена тенденция к лейкопении и требуется усилить эпителизацию слизистой оболочки, можно использовать метилурацил и пентоксил (не более двух недель).
Иван Броновец, профессор кафедры кардиологии и внутренних болезней БГМУ, доктор мед. наук
Медицинский вестник, 12 сентября 2016

Измерение скорости оседания эритроцитов (СОЭ) – один из ключевых тестов при диагностике воспалительных процессов и инфекционных заболеваний.

Исследование на СОЭ может назначаться в составе общего анализа крови в профилактических целях или для контроля течения болезни.
Сдать необходимые анализы без очередей и получить результаты всего
за 2 часа можно в специализированных лабораториях.

Нет возможности пройти обследование в лаборатории? Можно вызвать специалиста на дом – удобно и быстро.

Дисконтные программы – удачный способ сэкономить на медицинском обследовании.

Контроль качества клинических лабораторных исследований, осуществляемый по международным стандартам, — гарантия точного диагноза.
Состав крови очень чувствителен к любым изменениям в работе организма. Поэтому одной из самых распространенных диагностических процедур является клинический анализ крови. В его ходе определяются концентрация гемоглобина, эритроцитов, лейкоцитов, тромбоцитов и другие характеристики крови, например СОЭ. Давайте разберемся, что означает этот показатель и почему он так важен.
СОЭ в анализе крови
Механизм анализа на скорость оседания эритроцитов (СОЭ) довольно прост. Эритроциты значительно тяжелее плазмы крови и других форменных элементов, поэтому если кровь оставить в вертикально установленной пробирке, то через некоторое время на ее дне появится густой бордовый эритроцитарный осадок, а сверху останется полупрозрачная жидкость (плазма и буферный слой остальных элементов крови). Это совершенно естественный процесс, обусловленный действием силы тяжести.
Точность метода определения СОЭ зависит от некоторых факторов — от соблюдения правил подготовки пациента к исследованию, профессионализма сотрудника лаборатории и качества реагентов, используемых для проведения анализа. Если все требования соблюдены, то и в результате сомневаться не придется.
Анализ на СОЭ показывает наличие и интенсивность воспалительного процесса в организме пациента, поэтому исследование с успехом применяют в профилактических целях, а также для контроля течения болезни. При выявлении отклонений от нормы в анализе на СОЭ, скорее всего, придется сдать кровь на биохимический анализ. Это объясняется тем, что показатель неспецифичен, диагностировать конкретное заболевание на основании одного этого исследования невозможно. Поэтому при повышенном или пониженном уровне СОЭ для выявления болезни потребуется выяснить уровень определенных белков.
Сдача крови на СОЭ не требует от пациента сложной подготовки. Достаточно исключить употребление пищи как минимум за 4 часа до анализа.
Для пациента процесс длится 5–10 минут. Если требуется капиллярная кровь, то перед тем как проколоть 3-й или 4-й палец на левой руке, его протирают спиртом, а затем с помощью специального лезвия делают аккуратный надрез глубиной 2–3 миллиметра на подушечке. Выступившую каплю крови протирают салфеткой, потом приступают к забору биоматериала. После того как собрано нужное количество, место прокола смазывают дезинфекционным раствором и прикладывают смоченную в эфире ватку — при этом палец лучше прижать к ладони, чтобы кровотечение остановилось быстрее.
В случае, когда предметом исследования является венозная кровь, предплечье перетягивают специальным ремешком, а в вену на локтевом сгибе вводят иглу, предварительно смазав место прокола спиртом. Выпущенная кровь попадает в специальную пробирку, а когда набирается нужное количество материала, извлекают иглу и прижимают к проколу смоченную в спирте ватку.
После сбора крови сотрудник медицинской лаборатории приступает к процедуре определения скорости оседания эритроцитов.
Существует два метода определения уровня СОЭ в крови. Для каждого из них характерной особенностью служит смешивание материала анализа со специальным веществом, которое препятствует свертыванию крови — антикоагулянтом. Но точность результата и даже вид крови в обоих случаях различаются.
Этот способ определения СОЭ в крови является одним из самых распространенных в России. Но существует более чувствительный метод, эффективность которого признана международным медицинским сообществом.
После того как стало известно значение СОЭ, нужно показать результат исследования лечащему врачу — поставить диагноз или назначить дополнительные анализы может только профессионал. Тем не менее предварительно вы можете самостоятельно оценить полученный результат, сверившись со значениями нормы.
Существует три разновидности результатов, которые вы можете получить по окончании анализа. Давайте подробнее остановимся на каждом из них.
Скорость оседания эритроцитов крови здорового человека зависит от возраста и пола пациента. Для новорожденных детей (до 1 месяца) нормальным является значение СОЭ — 1–2 мм/ч. Это связано с очень низкой концентрацией белка в крови. От 1 до 6 месяцев показатель находится в границах от 12 до 17 мм/ч, такой резкий скачок объясняется специфическими процессами, происходящими в растущем организме. Далее показатели выравниваются — норма анализа на СОЭ для ребенка до 10 лет составляет 1–10 мм/ч.
В связи со спецификой химического состава крови и уровня ее вязкости норма СОЭ в крови мужчин и женщин различна.
Скорость оседания эритроцитов у здоровой пациентки от 10 до 50 лет составляет 0–20 мм/ч, а в более старшем возрасте верхняя граница поднимается до 30 мм/ч.
Для мужчин от 10 до 50 лет нормальное значение СОЭ — 0–15 мм/ч, а в возрасте от 50 лет и выше норма меняется на 0–20 мм/ч.
Если вы получили результат анализа с повышенным уровнем СОЭ, то сначала следует исключить физиологические причины такого нарушения. Для лиц любого пола они могут быть связаны с пожилым возрастом, а конкретно у женщин — с послеродовым периодом, беременностью или менструацией.
Если особенности физиологии не повлияли на результат, то повышенная СОЭ является следствием патологических причин. К ним относятся различные воспалительные процессы, отравление, острые и хронические инфекции, инфаркт миокарда, травмы и переломы, шоковые и послеоперационные состояния, наличие злокачественных опухолей, анемия, заболевания почек и так далее. Помимо этого высокие показатели СОЭ могут быть характерны для пациентов, проходящих курс лечения определенными видами лекарств (эстрогенов, глюкокортикоидов).
Низкая скорость оседания эритроцитов может быть признаком нарушения водно-солевого обмена в организме (гипергидратации) или наблюдаться при прогрессирующей дистрофии мышц (миодистрофия). Остальные причины нельзя отнести к патологическим — низкую СОЭ вызывают голодание, вегетарианская диета, беременность в 1-м и 2-м триместрах, а также прием некоторых стероидных гормонов (кортикостероидов).
Итак, мы рассмотрели основные методы измерения скорости оседания эритроцитов в крови, нормальные показатели СОЭ, а также причины повышенных и пониженных значений. Эта информация поможет вам составить предварительное представление о состоянии организма. Но в случае отклонения показателей исследования от нормы следует сразу же обратиться к врачу для уточнения окончательного диагноза.
Результаты анализа на СОЭ могут быть искажены не только физиологическим причинами (периодом менструации у женщин, например), но и психологическими. Если вы пребываете в состоянии сильного стресса, нервничаете, то это может повлечь за собой повышение скорости оседания эритроцитов. То же, как ни странно, касается и чересчур радостного настроя (хотя такое при посещении клиник встречается нечасто). Так что накануне исследования и в день его проведения постарайтесь пребывать в спокойном расположении духа.
Читайте также:


