Препараты при инфекции кожи чем лечить


Инфекции кожи и мягких тканей — наиболее частая причина обращения больных в хирургический стационар или поликлинику.
В 2004 году во Франции, Германии, Италии, Испании, Великобритании 1,3 миллиона пациентов были госпитализированы по поводу ИКМТ, в том числе из-за целлюлита (52,7 процента), локальной хирургической инфекции (15,8 процента), диабетической стопы (15,3 процента), пролежней (12 процентов).
По экспертным оценкам, в России инфекции кожи и мягких тканей составляют от 480 до 700 тысяч пациентов в год. Ежегодно в России за помощью в медицинские учреждения обращаются до 1,5 миллионов больных с трофическими язвами, около 500 тысяч больных с синдромом диабетической стопы.
Что вызывает инфекции кожи и мягких тканей?
Инфекции кожи и мягких тканей обычно вызываются несколькими микробами одновременно, но наиболее частым возбудителем в большинстве случаев является золотистый стафилококк (S. Aureus). Особую опасность представляет широкое распространение штаммов устойчивых к большинству антимикробных препаратов — бета-лактамным антибиотикам, аминогликозидам, линкозамидам, фторхинолонам.
Кроме того, в лечебных учреждениях широко распространены грамотрицательные бактерии семейства Enterobacteriaceae (Klebsiellaspp., Enterobacterspp., E. Coli), которые обычно резистентны к цефалоспоринам.
Как выбрать препарат для лечения инфекций кожи и мягких тканей?
При выборе средств антибактериальной терапии крайне важен подход к выбору препаратов, который определяется уровнем поражения мягких тканей, особенностями течения заболевания и наличием лекарственной устойчивости.
Следует помнить, что любая рана, независимо от места ее локализации и происхождения, всегда содержит определенное количество микроорганизмов (первичное микробное загрязнение). Главное назначение любой первичной повязки заключается в остановке кровотечения и предупреждении инфицирования раны, независимо от того, накладывают ли ее дома, врачи скорой помощи, врачи поликлиник или стационаров. В последующем лечение проводится в соответствии с фазой раневого процесса, видовым составом попавших в рану микробов.
Какие средства пришли на смену мази Вишневского?
В последние два десятилетия при лечении гнойно-воспалительных процессов и гнойных ран широко используются новые антисептики (йодопирон, мирамистин, диоксидин, лавасепт). Малоэффективные мази на ланолин-вазелиновой основе (мазь Вишневского, ихтиоловая мазь, стрептоцидовая, эритромициновая, тетрациклиновая, фурациллиновая и др.) практически полностью вытеснены из практики лечения больных с инфекцией кожи и мягких тканей. На смену этим препаратам пришли мази на полиэтиленгликолевой (ПЭГ) основе.
Особенные сложности всегда возникают при лечении больных с инфекцией кожи и мягких тканей (трофические язвы, пролежни, термические поражения кожи, послеоперационные и посттравматические раны) на фоне аллергии, лекарственных и микробных дерматитов, повторяющегося инфицирования ран госпитальными высокорезистентными микроорганизмами (S.аuereus, S.pyogenes, Enterococcus spp., P.аeruginosa, Enterobacteriaceae, Bacteroides sp.). Эта инфекция может попасть в ткани с кожи пациента при недостаточном соблюдении правил личной гигиены, а также гигиены постельных принадлежностей, рук медицинского персонала и т.д. Реинфицирование вызывает грубое нарушение процессов заживления раны.
Крем Аргосульфан
В современном мире, где широко распространены штаммы микроорганизмов устойчивых к большинству лекарственных средств, препаратами выбора в таких ситуациях можно считать серебросодержащие лекарственные средства, например 2% крем сульфатиазола серебра (крем Аргосульфан). Крем Аргосульфан обладает высокой антимикробной активностью по отношению ко всем потенциальным возбудителям инфекций мягких тканей (в том числе при пролежнях и трофических язвах). Гидрофильная основа Аргосульфана защищает молодую эпителиальную ткань, активизирует рост поверхностного эпителия, тем самым крем позволяет быстро восстановить целостность кожных покровов. Основа крема также обеспечивает болеутоляющее действие и хорошую переносимость. Слабая растворимость серебряной соли сульфатиазола позволяет поддерживать постоянную концентрацию лекарства в тканях, а также обуславливает отсутствие токсичности. Особое значение имеет тот факт, что многолетние наблюдения показывают отсутствие устойчивости микробов к этому препарату.
Таким образом, Аргосульфан сегодня может рассматриваться как препарат выбора для местного лечения и профилактики инфекции кожи и мягких тканей: трофических язв, пролежней, ожогов, посттравматических и послеоперационных длительно незаживающих ран.
Резюме. Инфекции кожи легкой и средней степени тяжести — патология, которую наблюдают достаточно часто. В США в отделения скорой помощи ежегодно обращаются около 10 млн человек с травматическими повреждениями мягких тканей различной степени тяжести. Наиболее частым осложнением в этих случаях является инфицирование раны. Начиная с 60-х годов для лечения инфекций кожи стали использовать антибиотики для перорального применения. Пероральную терапию иногда сочетали с препаратами для местного применения, однако их расценивали как менее эффективные по сравнению с препаратами, принимаемыми внутрь. В настоящее время доказано, что лекарственные препараты для местного применения в некоторых случаях более эффективны, чем препараты, принимаемые перорально.
ПЕРВИЧНЫЕ ИНФЕКЦИИ КОЖИ
Первичными инфекциями кожи называют такие инфекции, при которых кожа, окружающая место локализации инфекционного процесса, не повреждена. К патогенным микроорганизмам, в большинстве случаев вызывающим развитие первичных инфекций кожи, относятся Staphylococcus aureus и стрептококки группы А (Str. pyogenes).
Наиболее часто встречающимися первичными инфекциями кожи являются импетиго, фолликулит, целлюлит и фурункулез. Импетиго характеризуется наличием элементов сыпи типа пузырей, при разрыве которых образуется глубокая эрозия; при подсыхании экссудата эрозии формируются толстые, рыхлые корки светло-желтого цвета. Ранее считали, что контагиозное импетиго имеет стрептококковую этиологию, а развитие буллезного импетиго вызывает S. аureus. В настоящее время результаты многих клинических исследований свидетельствуют об изменении распространенности этих возбудителей: чаще первичным возбудителем контагиозного импетиго оказывается S. aureus. По данным некоторых авторов, в 7798% случаев развитие импетиго вызывают стафилококки, в 3% случаев только стрептококки. Следует отметить, что исследования проводили среди лиц, проживающих в странах с развитой экономикой и относительно высоким уровнем жизни. В странах с тропическим климатом и низким уровнем жизни наиболее частым возбудителем контагиозного импетиго остается Str. pyogenes.
ВТОРИЧНЫЕ ИНФЕКЦИИ КОЖИ
Вторичные инфекции кожи развиваются в тех случаях, если кожа в месте локализации инфекционного процесса уже была повреждена. В качестве примера можно назвать вторично инфицированные травматические повреждения кожи и вторично инфицированные дерматозы.
Наиболее часто вторичному инфицированию, в 8090% случаев обусловленному стрептококками и стафилококками, подвергаются такие повреждения кожи, как порезы, ожоги, раны, в том числе хирургические. Вторично инфицированные дерматозы развиваются вследствие суперинфекции уже существующего патологического процесса, например экземы. Поврежденная кожа является входными воротами для возбудителя инфекции, а последующая инвазия и размножение бактерий приводят к развитию инфекционного процесса. Наиболее часто развитие вторично инфицированных дерматозов вызывают S. aureus и стрептококки. Предполагают, что стафилококки не только являются основной этиологической причиной развития экземы, но и способствуют возникновению рецидивов заболевания, а также ухудшают течение уже существующего патологического процесса.
СОВРЕМЕННАЯ ТЕРАПИЯ ИНФЕКЦИЙ КОЖИ ЛЕГКОЙ И СРЕДНЕЙ СТЕПЕНИ ТЯЖЕСТИ
С 60-х годов использование антибиотиков для перорального применения было основным направлением терапии инфекций кожи легкой и средней степени тяжести. В большинстве стран современными препаратами выбора являются эритромицин, цефалексин и флуклоксациллин.
Несмотря на то, что пероральная антибиотикотерапия эффективна во многих случаях, она не лишена недостатков. Антибиотики для перорального применения вследствие своей системной активности часто вызывают развитие побочных реакций со стороны пищеварительного тракта, например диарею или тошноту. Важным условием для поддержания соответствующей концентрации антибиотика в крови является его регулярный и частый прием. Любое нарушение режима приема или дозирования препарата может значительно повлиять на его эффективность. При использовании антибиотиков для системного применения также могут развиваться аллергические реакции.
Еще одним недостатком лечения антибиотиками, применяемыми перорально, является быстрое развитие резистентности возбудителей к препаратам. Например, устойчивость S. aureus, обусловленная применением лактамных антибиотиков, достаточно распространена. По некоторым данным, ее уровень в мире достигает 90%. Около 10 лет назад чувствительность S. aureus к эритромицину достигала 90%. Наблюдение, в котором изучали течение различных инфекций кожи, показало, что 51,5% штаммов S. aureus, обнаруженных при бактериологическом исследовании гноя при фурункулезе, были устойчивы к эритромицину, при импетиго этот показаталь достигал 26,2%.
Некоторые антибиотики для системного применения используют для лечения внутрибольничных инфекций, что также приводит к развитию резистентности возбудителей к этим препаратам. В настоящее время многие специалисты не рекомендуют назначать для местной терапии антибиотики, в состав которых входят компоненты, оказывающие системное действие. По данным литературы, резистентность возбудителей развивается в результате использования аминогликозидов, эритромицина и клиндамицина для местного применения.
ФАКТОРЫ, ВЛИЯЮЩИЕ НА ВЫБОР ТЕРАПИИ
Выбор местной или пероральной антибиотикотерапии зависит от многих факторов, однако локализация и распространенность инфекционного процесса являются определяющими. Местная терапия эффективна в том случае, если инфекционный процесс поверхностный и локализованный. Если патологический процесс достигает более глубоких структур кожи или поражена ее большая площадь, можно использовать антибиотики для перорального применения. Если есть проявления системной инфекции, например лихорадка, лимфаденопатия или сопутствующий стрептококковый фарингит, предпочтительнее назначить антибиотики перорально. В некоторых случаях больному с распространенной инфекцией кожи или при тяжелом течении инфекционного процесса врач может назначить и местную, и системную антибактериальную терапию.
Результаты многих клинических исследований не подтвердили предположения о том, что при лечении инфекций кожи легкой и средней степени тяжести местная терапия менее эффективна, чем прием препаратов внутрь. Например, доказано, что при инфекциях кожи легкой и средней степени тяжести монотерапия мупироцином (торговое название БАКТРОБАН) в форме крема или мази также эффективна и даже в некоторых случаях превышает по эффективности терапию эритромицином, клоксациллином и цефалексином, назначаемыми перорально. Лекарственные средства для местного применения удобны при использовании, их легче дозировать, чем препараты для перорального приема. При возможности выбора метода лечения многие пациенты отдали бы предпочтение местной терапии.
При проведении местной терапии риск развития системных побочных эффектов, в том числе со стороны пищеварительного тракта, минимален. При пероральном приеме антибиотик воздействует на микрофлору пищеварительного тракта, что нередко приводит к появлению резистентных к действию препарата штаммов микроорганизмов, заселяющих пищеварительный тракт. На фоне применения некоторых антибиотиков местно, например мупироцина, устойчивость возбудителей развивается очень медленно в отличие от антибиотиков, назначаемых внутрь. Кроме этого, более высокая концентрация антибиотика, которая создается в месте локализации инфекции, способствует эрадикации большего числа патогенных микроорганизмов.
Результаты сравнительного исследования эффективности и безопасности местного применения мупироцина и эритромицина, назначаемого перорально, при лечении импетиго у детей, показали, что мупироцин в отличие от эритромицина значительно реже вызывает развитие побочных эффектов.
ТРЕБОВАНИЯ К ПРЕПАРАТАМ ДЛЯ МЕСТНОЙ ТЕРАПИИ ИНФЕКЦИЙ КОЖИ
Антибактериальные препараты для местного применения должны:
- обладать такой же эффективностью, как и препараты, предназначенные для перорального приема;
- обладать хорошей переносимостью; обладать активностью в отношении всех основных возбудителей, вызывающих инфекции кожи легкой и средней степени тяжести;
- выпускаться в лекарственных формах, удобных для применения как при первичных, так и при вторичных инфекциях кожи.
Антибактериальные препараты для местного применения не должны:
- вызывать перекрестной резистентности к другим сходным антибиотикам, которые применяют для лечения тяжелых системных инфекций;
- содержать компонентов, оказывающих системное действие.
Мупироцин, предназначенный для лечения инфекций кожи легкой и средней степени тяжести, является именно таким лекарственным препаратом, который отвечает этим требованиям. Он обладает уникальными фармакологическими свойствами, отличающими его от других антибиотиков:
- высокоэффективен в отношении как стрептококков, так и стафилококков;
- антибактериальная активность эквивалентна таковой пероральных антибиотиков;
- не содержит в своем составе компонентов, оказывающих системное действие;
- по химическому составу отличается от других антибиотиков невозможно развитие перекрестной резистентности микрофлоры;
- не вызывает раздражения кожи; после 10 лет применения во всем мире устойчивость возбудителей к этому препарату выявляют с частотой менее 1%.
Эти факторы в сочетании с хорошей переносимостью и безопасностью позволяют считать применение мупироцина надежным альтернативным методом местной терапии инфекций кожи легкой и средней степени тяжести.
- Atherton D.J. (1996) The clinical efficacy of mupirocin in the treatment of primary skin infections. International Clinical Practice Series, 12: 2535.
- Burnett J.W. (1962) Management of pyogenic cutaneous infections. N. Engl. J. Med., 266: 164169.
- Burnett J.W. (1963) The route of antibiotic administration in superficial impetigo. N. Engl. J. Med., 268: 7275.
- Barton L.L., Friedman A.D. (1987) Impetigo: a reassessment of etiology and therapy. Pediat. Dermatol., 4: 185188.
- Crawford W.W. et. al. (1979) Laboratory induction and clinical occurrence of combined erythromycin resistance in Corynebacterium acnes. J. Invest. Dermatol., 72: 187.
- Dajani A., Ferrieri P., Wannamaker L. (1972) Natural history of impetigo II. Etiologic agents and bacterial interactions. J. Clin. Invest., 51: 28632871.
- Dillon H.C. (1968) Impetigo contagiosa: suppurative and nonsuppurative complications I. Clinical, bacteriologic and epidemiologic characteristics. Am. J. Dis. Child, 115: 530541.
- Finnerty E.F., Folan D.W. (1979) Changing antibacterial sensitivities of bacterial skin diseases: office practice 19771978. Cutis, 23: 227230.
- Graham D.R. et al. (1980) Epidemic neonatal gentamycin methicillin-resistant Staphylococcus aureus infection associated with non-specific topical use of gentamycin. J. Paediat., 97: 972.
- Grunberg R.N. et al. (1996) Results of the Alexander Project: a continuing, multicenter study of the antimicrobial susceptibility of community-acquired lower respiratory tract bacterial pathogens. Diagn. Microbiol. Infect. Dis., 25: 169181.
- Kraus S. et al. (1997) Comparison of a new formulation of mupirocin calcium with oral cephalexin in the treatment of secondarily infected traumatic lesions (SITL). Proceedings of 37 th ICAAC, Toronto, Canada.
- Leyden J.J. (1997) Therapy for acne vulgaris. N. Engl. J. Med., 336(16): 1156-1162.
- Leyden J.J. (1990) Mupirocin: a new topical antibiotic. J. Am. Acad. Dermatol., 22(5Pt1): 879883.
- Leyden J.J. (1992) Review of mupirocin ointment in the treatment of impetigo. Clin. Pediatr. (Phila), 31(9): 549553.
- Martin de Nicolas M.M. et al. (1995) In vitro activity of mupirocin and eleven other antibiotics against 1500 Spanish clinical isolates of Staphylococcus aureus causing hospital infections Rev. Esp. Quimioterap., 8(2): 145150.
- Ohana N. et al. (1989) Skin-isolated community-acquired Staphylococcus aureus: in vitro resistance to methicillin and erythromycin J. Am. Acad. Dermatol., 3: 544546.
- Rice et al. (1990) Cost effectiveness of erythromycin versus mupirocin for the treatment of impetigo in children. Am. J. Dis. Child, 144: 443444.
- Rogers M. et al. (1987) A three-year study of impetigo in Sydney. Med. J. Aust., 147: 6365.
- Schachner L. et al. (1983) A therapeutic update of superficial skin infections. Pediatr. Clin. North Am., 30: 397404.
- Tunnessen W. (1983) Cutaneous infections. Pediatr. Clin. North Am., 3: 515532.
- Tunnessen W. (1985) Practical aspects of bacterial skin infections in children Pediatr. Dermatol., 2: 255265.
- White A.R. et al. (1984) Antibacterial activity of mupirocin, an antibiotic produced by Pseudomonas fluorescens. Royal Society of Medicine International Congress and Symposium Series, 80: 4355.
- Williams R.E.A. (1996) The clinical efficacy of mupirocin in the treatment of secondary skin infections. International Clinical Practice Series, 12: 923.
Резюме. Інфекції шкіри легкого і середнього ступеня тяжкості — патологія, яку спостерігають достатньо часто. В США у відділення швидкої допомоги щорічно звертаються біля 10 млн чоловік з травматичними пошкодженнями м’яких тканин різного ступеня тяжкості. Найчастішим ускладненням у цих випадках є інфікування рани. Починаючи з 60-х років для лікування інфекцій шкіри стали використовувати антибіотики для перорального застосування. Пероральну терапію інколи поєднували з препаратами для місцевого застосування, однак їх розцінювали як менш ефективні у порівнянні з препаратами, що приймають всередину. У нинішній час доведено, що лікарські препарати для місцевого застосування в деяких випадках більш ефективні, ніж препарати, що приймають перорально.
Ключові слова: інфекція, шкіра, антибіотики, мупіроцин, БАКТРОБАН
Summary. Mild to moderate skin infections are quite often seen in general medical practice. In USA, about 10 mln patients with traumatic soft tissue injuries of various severity are admitted to emergency departments. The most common complication in such cases is wound infection. Since 1960-ies oral antibiotics were implemented for treatment of skin infections. Oral antibiotics are sometimes combined with topical treatment, the latter usually being considered as less efficacious compared to oral drugs. For the time being it has been established that topical drugs in certain instances are more efficacious as compared to oral therapy.
Key words: infection, skin, antibiotics, mupirocin, BACTROBAN
Публикация подготовлена по материалам, предоставленным представительством компании СмитКляйн Бичем Фармасьютикалз в Украине.
Адрес представительства: 252070, Киев, Контрактовая пл., 10А, 3-й этаж. Тел.: (044) 4625947, 4906685
Расширение ассортимента лекарственных препаратов для локальной консервативной фармакотерапии раневого процесса позволяет проводить дифференцированное лечение ран и ожогов, которое осуществляется путем последовательного применения различных лекарственных средств с разнообразным механизмом их действия (Ляпунов Н.А. и соавт., 1995), влияющих на определенные фазы раневого процесса. Активный поиск эффективных лекарственных веществ в разных лекарственных формах является актуальным и в настоящее время.
Нанесение лекарственных препаратов для наружного применения на рану определяют как местное медикаментозное лечение. Для успешной терапии ран необходимо комплексное воздействие на раневой процесс (Кузнецов Н.А., 2006) с учетом не только степени тяжести его течения, но и уровня его распространения в глубину, количества вовлеченных в воспалительный процесс анатомических структур и т.д. (таблица; алгоритм обработки поверхностных ран).
| Таблица | Классификация хирургической инфекции мягких тканей (Ahrenholz D., 1991; Блатун Л.А., 2007) |
| Уровень | Поражение | Заболевания |
| I | Собственно кожи | Фурункул |
| Фурункулез | ||
| Рожа | ||
| Эризипелоид | ||
| II | Подкожной клетчатки | Карбункул |
| Гидраденит | ||
| Абсцесс | ||
| Целлюлит | ||
| III | Поверхностной фасции | Некротизирующий фасциит |
| IV | Мышц и глубоких фасциальных структур | Пиомиозит |
| Инфекции мышечных футляров | ||
| Клостридиальный мионекроз | ||
| Неклостридиальный мионекроз |
Терапия включает локальное назначение широкого спектра лекарственных веществ в форме мазей, гелей, порошков, масел и раневых покрытий (Кузин М.И., 1999; Блатун Л.А., 2007).
Поверхностные инфицированные раны лечат дренирующими сорбентами и протеолитическими ферментами. При лечении гнойных глубоких ран в первой фазе проводят терапию мазями под повязками (Блатун Л.А., 2009), причем успех профилактики и лечения ран в данной фазе определяется своевременным назначением различных лекарственных средств с антимикробным действием. А вот во второй фазе — регенерации, образования и созревания грануляционной ткани применяют мази, раневые покрытия, гелевые повязки и масла с активными компонентами, уже способствующими стимуляции этих процессов (алгоритм обработки поверхностных ран).
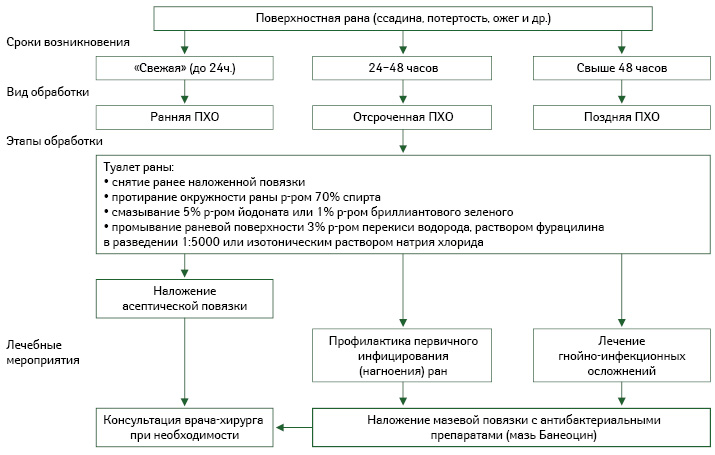
Неомицин — представитель антибиотиков-аминогликозидов, оказывает бактерицидное действие путем подавления синтеза бактериального белка и угнетения генетического кода бактерий. Для него характерен широкий спектр противомикробного действия (рис. 1).
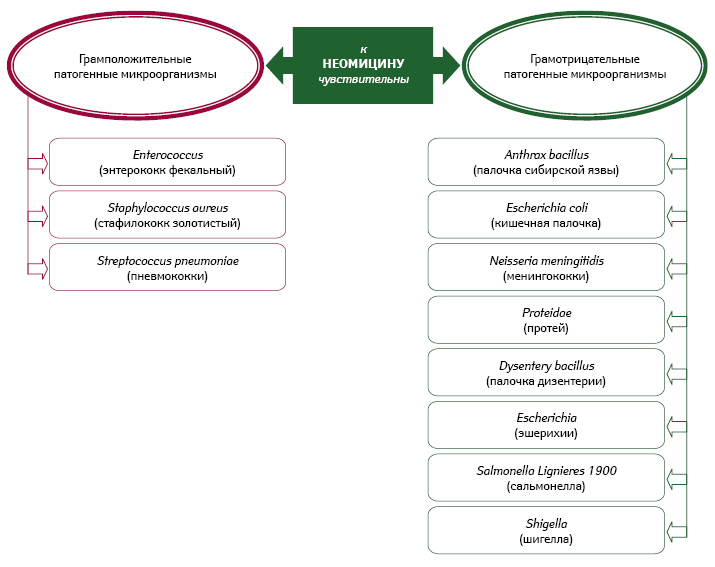
Очевидно, что неомицин проявляет широкий спектр антибактериальной активности, оказывая бактерицидное действие на чувствительную к нему микрофлору (Даценко Б.М. и соавт., 1989). Характерно медленное формирование устойчивости микроорганизмов к неомицину. Наружное применение неомицина в форме порошка или мази не позволяет развиться его токсическим проявлениям, которые могут возникать при парентеральном применении (ото-, нефротоксичность, блокада нейромышечной передачи). Неомицин не применяют перорально ввиду возможности его кумулирования в плазме крови, отмечающееся при нарушенной функции почек (Коваленко В.Н., 2012).
Бацитрацин — полипептидный антибиотик. Он угнетает синтез клеточной стенки путем подавления кругооборота липидных переносчиков субъединиц пептидогликанов (блокада синтеза пептидогликанов), что также реализуется в виде бактерицидного действия. Спектр антибактериального действия бацитрацина представлен на рис. 2.
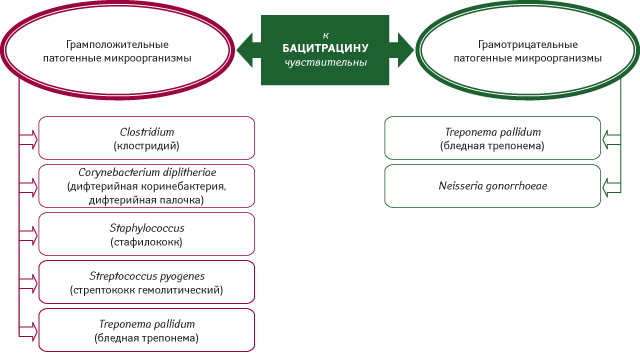
К бацитрацину устойчивость развивается крайне редко, механизмы ее развития не установлены. Он хорошо переносится тканями организма человека и не инактивируется кровью, тканевыми компонентами, биологическими продуктами (Паршина В.Л., 2007). Особенно актуально то, что при локальном его применении снижается риск проявлений повышенной чувствительности к составляющим Банеоцина .
Таким образом, фармацевтическая композиция неомицина и бацитрацина ( Банеоцин ) приводит к синергическому фармакологическому взаимодействию двух лекарственных средств. Такое объединенное действие в итоге превышает сумму действий этих действующих веществ (усиление действия друг друга) по сравнению с их раздельным использованием.
Эта комбинация антибактериальных средств выпускается в виде двух лекарственных форм — порошка и мази.
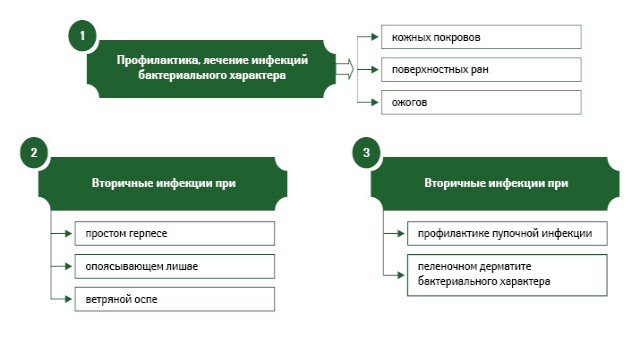
Показания к применению Банеоцина в форме мази и порошка представлены на рис. 3 и 4.

В качестве вспомогательного вещества в состав порошка Банеоцин входит крахмал кукурузный, содержащий не более 2% магния оксида (основа порошковая стерилизованная) (Коваленко В.Н., 2012). Ранее уже были отмечены высокие абсорбционные свойства порошковой основы, которые как раз и проявляются за счет легковесных аморфных порошков — магния оксида и крахмала кукурузного.
Порошок Банеоцин в короткие сроки купирует проявления воспалительного процесса, упреждает возможное возникновение нагноения (Зорин А.Н. и соавт., 2005). При нанесении на кожу порошок Банеоцин обусловливает активное поглощение раневого экссудата, осушение раны и на протяжении нескольких часов обеспечивает дренаж из раны с одновременным образованием защитного антибактериального слоя (Буслаев О.А. и соавт., 2006).
Также порошок Банеоцин обладает замечательными дополнительными действиями: охлаждающим и успокаивающим. Это особенно важно для лечения ран у пациентов детского возраста ввиду их высокой чувствительности к боли и страха перед спиртосодержащими средствами, традиционно используемыми для обработки ран.
Эффективность Банеоцина подтверждена комплексным изучением клинико-лабораторных показателей в лечении пациентов с гнойным поражением кожи и мягких тканей (бактериологическая эффективность составляла 92,5%, а клиническая — 95%) (Блатун Л.А., 2009). Это обусловлено длительным осмотическим действием порошка Банеоцин , что особенно эффективно в лечении гнойных ран в первой фазе раневого процесса, когда происходит активное впитывание раневого отделяемого. Ценным качеством Банеоцина является быстрое разрешение кожных проявлений инфекционных поражений кожи, таких как атопический дерматит, импетиго, фолликулит и т.д., которое отмечается в течение 1 или 2 сут от начала лечения (Шерстобитов А.С., 2008). Банеоцин успешно применяется в лечении пациентов с трофическими язвами и у больных с аллергологическим анамнезом, когда они не могут применять традиционные локальные препараты (Буслаев и соавт., 2006; Блатун Л.А., 2007; 2009). Кроме того, обработка ран, возникших вследствие лазерной деструкции (Соколовский Е.В. и соавт., 2004), порошком Банеоцин с дальнейшим переходом на мазь Банеоцин оказывается более щадящим методом по сравнению с традиционной обработкой (Хорук С.А., 2008).
В свою очередь, мазь Банеоцин представляет собой комбинированный мягкий лекарственный препарат с антибиотиками, введенными в дифильную абсорбционную основу, состоящую из гидрофобного компонента — вазелина, и вещества с дифильными свойствами — ланолина, обладающего эмульгирующей способностью (Хишова О.М., 2009).
Вазелин можно отнести к веществам, которые давно и успешно используют в качестве средства для смягчения кожных покровов, защиты кожи после некоторых косметических процедур и т.д. Это связано с тем, что вазелин способен удерживать влагу в клетках кожи, что, в свою очередь, позволяет смягчить загрубевшие участки кожи, устранить раздражение, защитить слизистую оболочку и саму кожу от агрессивного и вредного воздействия лекарственных препаратов или окружающей среды. При этом вазелин и введенные в него вещества, не проникают в глубокие слои кожи и, тем более, под кожу. Последнее особенно актуально, если рассматривать его в аспекте безопасности применения Банеоцина . Как уже было отмечено выше, использование как неомицина, так и бацитрацина предполагает их исключительно локальное применение с целью предотвращения побочного действия на организм.
Ланолин, относящийся к натуральным вспомогательным веществам, кроме прочего обладает увлажняющими и смягчающими свойствами, позволяющими защищать кожу от неблагоприятных внешних факторов, а также связывать и удерживать в коже влагу. Именно эти позитивные качества ланолина успешно используются в медицине и косметологии с целью обеспечения уменьшения потери влаги и восстановления натуральной мягкости и эластичности кожи. В качестве одного из свойств чистого ланолина отмечают положительное местное его применение у кормящих грудью, помогающее заживлению трещин на сосках и предотвращающее их появление.
Так, учитывая вышеизложенные свойства вспомогательных веществ, входящих в состав мази Банеоцин , можно резюмировать: мазевая основа обладает умеренными абсорбционными свойствами на фоне низких показателей осмотической активности; не нарушает аэрацию кожи и не всасывается в глубокие слои; гидрофобные компоненты, покрывая кожу, препятствуют сухости кожи вследствие исключения излишней потери влаги.
С точки зрения биофармацевтических аспектов создания мягких лекарственных средств, мазевая основа сегодня является не только носителем действующих веществ, поэтому основа мази Банеоцин , отвечая медико-биологическим требованиям к мазям определенного назначения, активно участвует в терапевтическом процессе.
Банеоцин в форме мази эффективен в лечении поверхностных ран, во второй фазе раневого процесса (где может быть использован наряду с порошком) (Буслаев и соавт., 2006). Банеоцин в высоких концентрациях скапливается в гнойном очаге, оказывая бактерицидное действие, не оказывая системного эффекта. При его нанесении образуется тонкая пленка, защищающая молодой эпителий от деструктирующих факторов. Нанесение Банеоцина под повязки приводит к полной эридикации болезнетворных микроорганизмов в короткие сроки и обеспечивает профилактику повторного инфицирования поверхности раны госпитальной инфекцией (Оболенский В.Н., 2013). Уместно использовать мазь Банеоцин в третьей фазе раневого процесса для организации рубца и эпителизации, когда пленка, образуемая мазью, защищает эпителий от повреждения и способствует ускорению эпителизации. Неоспоримые достоинства фармакологического действия Банеоцина объясняют его активное назначение и на этапе стационарного комплексного лечения больных, и в поликлинических условиях.
Доказана высокая клиническая эффективность Банеоцина при распространенной форме акне средней и тяжелой степени (Кунгуров Н.В., 2009; Шабардина О.В., 2010). При локальном применении Банеоцина снижен риск возникновения гиперчувствительности к его компонентам (Ширшов О.Н., 2008). Характерна достаточно хорошая переносимость Банеоцина . Отмечается успешное использование Банеоцина в педиатрии при топическом дерматите, осложненном вторичной инфекцией (Ahrenholz D.H., 1991; Зорин А.Н. и соавт., 2005), а также при сочетании топического дерматита с пиодермией, и даже в неонатологической практике применение порошка Банеоцина позволяет сокращать сроки эпителизации пупочной ранки новорожденных. Назначение Банеоцина предупреждает развитие серьезных гнойно-септических осложнений у новорожденных, позволяет эффективно купировать клинические проявления инфицированного пеленочного дерматита и эксфолиативного дерматита Риттера (Паршина В.Л., 2007).
Таким образом, благодаря комбинации двух антибактериальных компонентов достигается широкий спектр действия препарата и синергизм в отношении широкого ряда микроорганизмов, в который не попадают лишь псевдомонады, нокардии, грибы и вирусы. При местном нанесении на кожные покровы, раневые поверхности Банеоцин переносится хорошо, не вызывая раздражения; через интактную кожу препарат не всасывается, а через поврежденные кожные покровы всасывание незначительно, что позволяет создать максимальную концентрацию препарата непосредственно в месте применения. А две лекарственные формы Банеоцина ориентированы на последовательное его применение на различных стадиях раневого процесса (Буслаев О.А. и соавт., 2006).
Особые указания при применении Банеоцина
- Нельзя допускать попадания мази и порошка Банеоцин в глаза.
- С осторожностью наносить препарат на участки кожных покровов со значительными повреждениями.
- Нельзя применять Банеоцин в наружный слуховой проход в случае, если у пациента нарушена целостность барабанной перепонки и имеется сквозной дефект.
- Кратность нанесения порошка составляет 2–4 раза в сутки.
- Мазь Банеоцин наносится 2–3 раза в сутки.
- Суточная доза не должна превышать 1 г Банеоцина .
- Курс лечения обычно составляет 7 дней.
- При назначении повторного курса максимально допустимая доза снижается в 2 раза.
- Банеоцину присуща фотосенсибилизация. Поэтому рекомендуется предотвращать доступ прямых солнечных лучей к месту нанесения препарата.
Фармацевтическая опека при применении Банеоцина
- Не применять Банеоцин у пациентов с повышенной чувствительностью к бацитрацину, неомицину и другим антибиотикам аминогликозидного ряда.
- Не допускать сочетанного применения антибиотиков аминогликозидного ряда местного и системного действия из-за возможной их кумуляции и, как следствие, — риска развития токсичности.
- С осторожностью применять при миастении и других заболеваниях нервно-мышечной системы, а также при аллергических реакциях в анамнезе.
- При обширных поражениях кожи возникает риск абсорбции бацитрацина и неомицина, что может привести к развитию токсических проявлений у пациентов с нарушенной функцией печени или почек.
- Дисфункция вестибулярной и кохлеарной систем, патология почек с нарушением их выделительной функции является противопоказанием для приема Банеоцина , особенно при возможности его всасывания в системный кровоток.
- При ожоговых поражениях кожи площадью более 20% поверхности тела больного порошок Банеоцин наносится только 1 раз в сутки.
- При развитии аллергии или суперинфекции Банеоцин следует отменить.
- Избегать инсоляции из-за возможности возникновения фотосенсибилизации и фототоксических реакций.
- При лечении в период беременности и кормления грудью фармакотерапию Банеоцином следует проводить с осторожностью.
- Применение мази Банеоцин в педиатрии проводится по показаниям, аналогичным таковым у взрослых.
- Порошок Банеоцин применяется у детей с первых дней жизни при преобладании пользы от применения Банеоцина над риском развития его побочных эффектов.
- Нет сведений о способности Банеоцина изменять скорость реакций при управлении транспортными средствами и работе с другими механизмами.
Список использованной литературы
Информация для профессиональной деятельности медицинских и фармацевтических специалистов
БАНЕОЦИН (BANEOCIN) . Код АТС : D06A X54**. Состав и форма выпуска: мазь, туба 20 г, № 1 (бацитрацин цинк — 250 МЕ/г, неомицина сульфат — 5000 МЕ/г) — р.с. № UA/3951/01/01 от 28.04.2011 г. до 28.04.2016 г.; порошок накожный, контейнер 10 г, № 1 (бацитрацин цинк — 250 МЕ/г, неомицина сульфат — 5000 МЕ/г) — р.с. № UA/3951/02/01 от 11.05.2011 г. до 11.05.2016 г.). Показания . Порошок — бактериальное инфицирование ограниченных участков кожи при герпетических инфекциях, в том числе при ветряной оспе; инфицированные варикозные язвы; экзема; бактериальный пеленочный дерматит; профилактика пупочной инфекции у новорожденных; после хирургических манипуляций: как вспомогательная терапия в послеоперационный период (в том числе лечение разрывов промежности и эпизиотомии, мастита при дренировании, посттравматических инфекций); инфекции при ожогах. Мазь — местное лечение и профилактика бактериальных инфекций кожи, вызванных чувствительными к препарату микроорганизмами: фурункулы, карбункулы (после хирургического вмешательства), абсцессы (после разреза), сикоз, в том числе глубокий, на участке подбородка, гнойный гидраденит, псевдофурункулез, паронихии; бактериальные инфекции кожи ограниченной степени, в том числе контагиозное импетиго, инфицированные варикозные язвы, вторичные инфекции при экземе, инфекции при ожогах, после косметической хирургии и пересадки кожи (также с профилактической целью и при применении повязок); как вспомогательная терапия при лечении послеоперационных инфицированных ран (например при наружном отите, вторичном инфицировании хирургических рубцов). Побочные эффекты . Обычно препарат переносится хорошо. При продолжительном лечении возможно развитие аллергических реакций (гиперемия, сухость и шелушение кожи, сыпь, зуд). Если поражения распространяются или раны не заживают, это может быть следствием аллергической реакции (очень редко — в виде контактной экземы). Для пациентов со значительным поражением кожи следует учитывать возможную абсорбцию препарата и развитие таких побочных эффектов, как нарушения вестибулярной и кохлеарной функции, слуха, нервно-мышечной проводимости. Более детальная информация изложена в инструкции по медицинскому применению.
Читайте также:


