Поражение глаза от инфекции токсоплазмоз
Возбудитель токсоплазмоза − toxoplasma gondi.
Токсоплазмы − облигатные внутриклеточные паразиты, проникающие в клетки хозяина с помощью коноида, выделяемых ферментов и стимулированного фагоцитоза.
Источником заражения для человека являются кошки, собаки, сельскохозяйственные животные (крупный рогатый скот, козы, овцы, свиньи), домашние птицы (куры, гуси, индейки). У 80-99% больных с врождённым токсоплазмозом наблюдается хориоретинит.

Как правило, на обоих глазах в области жёлтого пятна, реже в других отделах глазного дна, располагаются одиночные или множественные очаги с атрофией сетчатки и сосудистой оболочки и отложением пигмента в форме розетки. Характерной особенностью является рецидивирующее течение, которое объясняется длительной персистенцией возбудителя в тканях глаза и периодическим освобождением токсоплазм из цист.
Клиническая классификация приобретённого токсоплазмоза
По классификации Y. Siim (1971) различают 5 форм приобретённого токсоплазмоза: лимфогландулярную, экзантемную, энцефалитическую, глазную и миокардитическую.

При приобретённом токсоплазмозе наблюдается поражение всех оболочек глаза, зрительного нерва и наружных мышц глазного яблока, но наиболее типичным является поражение увеального тракта и сетчатки. Наблюдаются конъюнктивиты (катаральный, фолликулярный, язвенный), кератосклериты, кератоувеиты, кератосклероувеиты. Поражение сосудистого тракта при токсоплазмозе может быть в форме переднего, заднего и генерализованного увеита.
Особенности переднего увеита при приобретённом токсоплазмозе
Проявляются в виде умеренно выраженного воспаления радужки и цилиарного тела, экссудативнофибринозного характера с наличием преципатитов разной величины, формированием узелков и новообразованных сосудов в радужной оболочке. Течение заболевания рецидивирующее.
Типичные признаки заднего увеита при токсоплазмозной инфекции
Задний увеит протекает в форме очагового рецидивирующего хориоретинита с образованием рубцово-атрофических очагов с отложением ретинального пигмента.
Симптомы генерализованного увеита при приобретённом токсоплазмозе
Для такого вида поражения характерно острое начало заболевания, смешанная инъекция глазного яблока, наличие крупных преципитатов на эндотелии роговицы, экссудата во влаге передней камеры, помутнения стекловидного тела, хориоретинальных очагов на глазном дне. Могут наблюдаться признаки нейроретинита, перифлебита. Исходом генерализованного увеита могут быть осложненная катаракта, вторичная глаукома, вторичная хориоретинальная дистрофия.
Принцип диагностики токсоплазмоза глаза

Различают методы клинической диагностики и лабораторные методы, которые в свою очередь разделяются на паразитологические и иммунологические. Клиническая диагностика трудна, так как клинические симптомы многообразны и не имеют чёткой специфичности. Паразитологические методы включают метод прямой микроскопии и биопроб. Производится микроскопия мазков различных жидкостей, клеток различных тканей, но положительные результаты получают редко. Материалом для биопроб является кровь, слюна, цереброспинальная жидкость, грудное молоко, пунктат лимфатических узлов, костного мозга и др. Этот метод диагностики токсоплазмоза является наиболее достоверным, но из-за сложности выполнения не получил широкого распространения. Иммунологические методы являются основными в диагностике токсоплазмоза. Наиболее эффективными из них и получившими широкое распространение явились РСК (реакция связывания комплемента), РНИФ (реакция непрямой иммунофлюорисценции) и РНГА (реакция непрямой гемагглютинации.)
Схема лечения токсоплазмоза глаза
Лечение должно быть направлено на устранение возбудителя и воспалительных изменений в тканях глаза и стимуляцию зрительных функций. Для воздействия на возбудителя токсоплазмоза применяют сульфаниламиды, антипротозойные препараты и антибиотики.
Задайте вопрос офтальмологу
, MD, University of Virginia School of Medicine
Last full review/revision February 2017 by Richard D. Pearson, MD

Человек может подвергаться заражению токсоплазмозом везде, где есть кошки; по оценкам, 15% жителей США серопозитивны, что свидетельствует о том, что они были инфицированы. Риск развивающейся болезни очень низок за исключением плода, зараженного внутриутробно, и людей с ослабленным иммунитетом.
Патофизиология
T. gondii очень распространена среди птиц и млекопитающих. Этот облигатный внутриклеточный паразит проникает и размножается делением, в виде тахизоитов в цитоплазме любой клетки, содержащей ядро ( Жизненный цикл Toxoplasma gondii). Когда иммунитет хозяина активен, то размножение тахизоитов прекращается и формируются псевдоцисты в тканях; псевдоцисты сохраняются в состоянии покоя в течение многих лет, особенно в головном мозге, глазах и мышцах. Токсоплазмы Toxoplasma в пределах цист называют брадизоиты.
Половое размножение T. gondii происходит только в кишечном тракте кошек; получающиеся в результате ооцисты выходят с экскрементами, остаются заразными во влажной почве в течение многих месяцев.
Единственными окончательными хозяевами T. gondii являются представители семейства Felidae (домашние кошки и их родственники).
1a. Ооцисты выходят с экскрементами кошки. Большие количества теряются, но обычно только в течение 1-2 недель. Ооцистам требуется 1-5 дней, чтобы стать инфекционными.
1b. Кошки повторно заражаются, проглатывая спорулированные ооцисты.
2. Почва, вода, материал растений или наполнитель для кошачьего туалета становятся заражёнными ооцистами. Промежуточные хозяева в природе (например, птицы, грызуны, дикие звери, животные, разводимые для потребления человеком), становятся зараженными после поглощения зараженных материалов.
3. Ооцисты развиваются до тахизоитов вскоре после приема пищи.
4. Тахизоиты распространяются по всему телу и формируют цисты в ткани мышц и нервов.
5. Кошки заражаются после употребления в пищу промежуточных хозяев, содержащих цисты.
6a. Люди могут заразиться, употребляя в пищу недоваренное мясо, содержащее цисты.
6b. Люди могут заразиться, употребляя еду или воду, заражённую экскрементами кошки или другими материалами, заражёнными экскрементами (например, почва), или при контакте с вещами домашней кошки.
7. Редко человеческая инфекция следует после переливания крови или трансплантации органа.
8. Редко происходит трансплацентарная передача от матери к плоду.
9. В хозяине-человеке паразиты формируют цисты, обычно в скелетных мышцах, миокарде, головном мозге и глазах; эти цисты могут оставаться в течение жизни хозяина и могут возвращаться к жизни, если у хозяина слабеет иммунитет.
Инфицирование может произойти
Приемом пищи с ооцистами
При проглатывании тканевых цист
При трансплацентарной передаче
При переливании крови или трансплантации органа
Попадание ooцист с едой или водой, зараженной экскрементами кошки, является наиболее распространенным способом оральной инфекции. Инфицирование может также произойти при употреблении сырого или недоваренного мяса, содержащего цисты, обычно ягнятина, свинина или редко говядина.
После приема пищи с ооцистами или цистами ткани выделяются тахизоиты, которые распространяются везде по телу. Эта острая инфекция сопровождается развитием защитных иммунных реакций и формированием цист ткани во многих органах. Цисты могут возвращаться к жизни, прежде всего у пациентов с ослабленным иммунитетом. Токсоплазмоз начинается снова у 30–40% больных СПИДом, которые не принимают профилактически антибиотики и триметоприма/сульфаметоксазол для профилактики Pneumocystis.
Токсоплазмоз может передаваться трансплацентарно, если мать заражается во время беременности или если ослабление иммунитета оживляет предшествующую инфекцию. Передача Toxoplasma плоду чрезвычайно редка у иммунокомпетентных матерей, у которых раньше был токсоплазмоз.
Передача может произойти через общее переливание крови или белых телец крови или через трансплантацию органа от сероположительного донора.
У в остальном здоровых людей возможна повторная активация врожденной или приобретенной инфекции. Перенесенная инфекция обуславливает резистентность к повторной инфекции.
Клинические проявления
Инфекции могут проявиться несколькими способами:
Диссеминированное или не-ЦНС заболевание у пациентов с ослабленным иммунитетом
Острая инфекция является обычно бессимптомной, но у 10–20% пациентов начинается двустороннее, неболезненное цервикальное или подмышечное увеличение лимфатических узлов. У некоторых из них также проявляется гриппоподобный синдром: лихорадка в легкой форме, недомогание, миалгия, гепатоспленомегалия и реже фарингит, который может быть похож на инфекционный мононуклеоз и включать лимфаденит. Нетипичный лимфоцитоз, легкая анемия, лейкопения и немного повышенные уровни ферментов печени распространены. Синдром может сохраняться в течение многих недель, но почти всегда самоограничивается.
У большинства пациентов со СПИДом или у других пациентов с ослабленным иммунитетом токсоплазмоз проявляется энцефалитом и массивным кольцевым внутричерепным поражением, наблюдаемыми при КТ с контрастом. Риск является наибольшим среди тех, у кого число CD4 200/мкл. У этих пациентов, как правило, присутствуют головная боль, нарушения психического состояния, приступы, кома, лихорадка и иногда фокальный неврологический дефицит, такой как потеря моторного или сенсорного контроля, параличи черепного нерва, отклонения по зрению и фокальные приступы.
Этот тип следует после первичной, часто бессимптомной инфекции, приобретенной матерью во время беременности. Женщины, зараженные перед зачатием, обычно не передают токсоплазмоз плоду, если инфекция не рецидивирует во время беременности ослабленным иммунитетом. Возможен самопроизвольный аборт, мертворождение или врожденные пороки. Процент выживающих детей, рожденных с токсоплазмозом, зависит от того, когда приобретена материнская инфекция; он увеличивается с 15% в течение 1-го триместра к 30% во время 2-го и 60% во время 3-го.
Болезнь у новорожденных может быть тяжелой, особенно если она приобретена на ранней стадии беременности; признаки включают желтуху, сыпь, гепатоспленомегалию и характерную тетраду отклонений:
Гидроцефалия или микроцефалия
Задержка психомоторного развития
Много детей с менее тяжелыми инфекциями и большинство младенцев, родившихся у матерей, зараженных в течение 3-го триместра, кажутся здоровыми при рождении, но находятся в группе риска по приступам, умственной недостаточности, ретинохориоидиту или другим симптомам, развивающимся через месяцы или даже несколько лет спустя.

Этот тип обычно результат врожденной инфекции, которая реактивизировалась, часто в возрасте 10–20–30 лет, но это редко случается с приобретенными инфекциями. Фокальный некротизирующий ретинит и вторичное гранулематозное воспаление сосудистой оболочки могут развиваться и вызывают боль в глазах, затуманенное зрение и иногда слепоту. Рецидивы распространены.
Болезнь без поражения глаз и ЦНС намного менее распространена и наблюдается только у пациентов с ослабленным иммунитетом. У них могут появиться пневмонит, миокардит, полимиозит, диффузная пятнисто-папулезная сыпь, высокая температура, озноб и недомогание.
При токсоплазмозном пневмоните диффузные интерстициальные инфильтраты могут быстро прогрессировать до консолидации и вызвать респираторную недостаточность, тогда как эндартериит может привести к инфаркту малых сегментов легкого. Миокардит, при котором дефекты проводимости являются распространенными, но часто бессимптомными, может быстро привести к сердечной недостаточности.
Нелеченные диссеминированные инфекции являются обычно смертельными.
Диагностика
При поражении ЦНС: КТ или МРТ и поясничная пункция
Гистопатологическое исследование биоптатов
ПЦР-анализ крови, СМЖ, тканей и амниотической жидкости (при беременности)
Токсоплазмоз обычно диагностируется на основе серологических исследований с использованием непрямой реакции флюоресцирующих антител (НРФА) или иммуноферментного анализа (ИФА) на антитела IgG и IgM ( Интерпретация серологических тестов к Toxoplasma *). Специфические антитела IgM появляются во время первых 2 нед. острой болезни, достигая пика в пределах 4–8 недель и в конечном счете становятся необнаруживаемыми, но могут присутствовать до 18 мес. после острой инфекции. Антитела IgG появляются более медленно, пик через 1–2 месяца, уровень может оставаться высоким и устойчивым в течение многих месяцев – лет. Исследования на IgM к микроорганизмам Toxoplasma обладают недостаточной специфичностью.
Нет признаков инфекции
Вероятно, начальная стадия инфекции или ложноположительный результат IgM
Вероятно, острая инфекция или ложноположительный результат IgM
Вероятно, острая инфекция
Инфекция в течение 6 месяцев и больше
Вероятно, инфекция в течение > 1 года или ложно-положительный результат IgM
Вероятно, недавнее заражение в течение последних 12 мес. или ложно-положительный результат IgM
*За исключением детей.
† В случае, если результаты сомнительные или интерпретация недостоверна, информативными могут быть исследование образцов в референтной лаборатории или дополнительное исследование взятых позже образцов.
Диагноз острого токсоплазмоза во время беременности и у плода или новорожденного может быть трудным, рекомендуется консультация эксперта. Если пациентка беременна и IgG и IgM положительны, должен быть сделан авидент-анализ на IgG. Высокие авидент-антитела в первые 12–16 недель беременности по существу исключают инфекцию, приобретенную во время беременности. Но низкий результат авидент-анализа по IgG не может интерпретироваться как указание на недавнюю инфекцию, потому что у некоторых пациентов есть постоянный низкий авидент-показатель IgG в течение многих месяцев после инфекции. Подозреваемая недавняя инфекция у беременной женщины должна быть подтверждена перед вмешательством путем проверки образцов в референс-лаборатории по токсоплазмозу. Если у пациента есть клинические признаки, похожие на токсоплазмоз, но титр IgG низок, то следует повторно определить титр 2–3 нед. спустя; если есть увеличение титра антител, то это может указывать на наличие острого токсоплазмоза, если только у пациента не ослабленный иммунитет.
Как правило, обнаружение специфических антител IgM у новорожденных предполагает врожденную инфекцию. Материнский IgG проходит через плаценту, а IgM – нет. Обнаружение Toxoplasma-специфичных антител IgA более чувствительно, чем IgM у врожденно зараженных младенцев, но это доступно только в условиях референс-лаборатории (например, Медицинский фонд Пало-Альто (Palo Alto Medical Foundation)[телефон 650-853-4828]). С экспертом нужно консультироваться, когда подозревается эмбриональная или врожденная инфекция.
Toxoplasma иногда определяется гистологически. Тахизоиты, которые присутствуют во время острой инфекции, окрашиваются по Гимза или Райту, но их бывает трудно выявить в обычных образцах иссеченных тканей. Цисты не отличаются при острой и хронической инфекции. Toxoplasma нужно отличать от других внутриклеточных организмов, таких как Histoplasma, Trypanosoma cruzi и Leishmania. ПЦР тесты на ДНК паразита в крови, спинномозговой жидкости или амниотической жидкости доступны в некоторых консультативных лабораториях. Анализ на основе ПЦР амниотической жидкости является предпочтительным методом диагностики токсоплазмоза во время беременности.
Если подозревается токсоплазмоз ЦНС, пациентам нужно провести МРТ головы, КТ с контрастом или использовать оба метода диагностики плюс люмбальную пункцию (если нет признаков увеличенного внутричерепного давления). МРТ более чувствительна, чем КТ. МРТ и КТ с контрастом, как правило, показывают единичные или множественные округленные, кольцевые поражения. Хотя эти поражения не патогномоничны, их присутствие у пациентов со СПИДом и признаками поражения ЦНС требует назначения химиотерапии T. gondii. В ЦСЖ может определяться лимфоцитарный плеоцитоз и повышенный уровень белка.
Об острой инфекции нужно думать, если у пациентов с ослабленным иммунитетом положительные результаты IgG. Однако уровни антител IgG у больных СПИДом с энцефалитом, вызванным Toxoplasma, обычно низкие или умеренные, IgG иногда могут отсутствовать; антитела IgM не обнаруживаются.
Если диагноз токсоплазмоза подтверждается, клиническое и рентгенологическое улучшение должно стать очевидным в течение 7–14 дней. Если симптомы усугубляются в течение 1 недели или не уменьшаются к концу 2 недели, стоит рассматривать вопрос о проведении биопсии мозга.
Заболевание глаз диагностируется на основании вида повреждений глаза, симптомов, течения болезни и результатов серологического тестирования.
Лечение
Пириметамин и сульфадиазин плюс лейковорин (для предупреждения подавления функции костного мозга)
Клиндамицин или атоваквон плюс пириметамин, если у пациента аллергия на сульфаниламиды или непереносимость сульфадиазина
Лечение токсоплазмоза не показано для иммунокомпетентных пациентов без клинических проявлений заболевания или у пациентов с легкой неосложнённой формой острой инфекции. Лечение требуется только при наличии симптомов поражения внутренних органов либо при тяжелой или персистирующей форме заболевания.
Однако специфическое лечение показано при остром токсоплазмозе в следующих случаях:
Окулярный токсоплазмоз - инфекционное заболевание, которое может быть причиной слепоты из-за развития заднего увеита. Чаще всего токсоплазмоз возникает у детей и молодых людей в возрасте 25-45 лет и нередко принимает рецидивирующее течение. Лечение окулярного токсоплазмоза не всегда приводит к полному выздоровлению и не может предупредить развитие рецидивов заболевания.
Возбудитель заболевания Toxoplasma gondii - облигатный внутриклеточный паразит. Источником инфекции чаще всего являются кошки. Только у незначительного процента инфицированных токсоплазмами лиц развиваются клинически выраженные поражения глаз, которые чаще всего проявляются снижением остроты зрения.
Необходимость лечения, выбор препарата и продолжительность терапии решаются индивидуально у каждого пациента с окулярным токсоплазмозом. Это определяется следующими факторами: локализация поражения, тяжесть воспалительного процесса, угроза потери зрения, состояние другого глаза и иммунной системы пациента. Как правило, изолированное поражение глаз и развитие только окулярной формы токсоплазмоза встречается у пациентов с нормальным функционированием иммунной системы. Если в процесс вовлечена только периферическая сетчатка, воспалительные процессы в глазном яблоке выражены слабо и нет вовлечения оптического диска и области пятна сетчатки, назначения лечения не требуется.
Чаще всего в лечении окулярного токсоплазмоза в течение 6-12 недель нуждаются иммунокомпрометированные пациенты (ВИЧ-инфицированные лица, пациенты, получающие иммуносупрессивную и цитостатическую терапию, пациенты со злокачественными новообразованиями, реципиенты трансплантации органов).
Наиболее часто для терапии окулярного токсоплазмоза используются пириметамин, сульфадиазин, клиндамицин, азитромицин, спирамицин, топические глюкокортикоиды. Обычно применяют комбинации клиндамицина и глюкокортикоидов, или пириметамин, сульфадиазин и глюкокортикоиды.
Пириметамин является ингибитором фермента дегидрофолатредуктазы. Механзм действия препарата состоит в нарушении обмена фолиевой кислоты. Лечение состоит в назначении ударной дозы 25 мг 3 раза в день в течение первого дня, затем 25 мг в день. При применении пириметамина могут развиваться гематотоксические реакции (лейкопения, тромбоцитопения), рвота, НЛР со стороны ЖКТ.
Клетки человеческого организма могут утилизировать экзогенные фолаты, в то время как у токсоплазм нарушаются трансмембранные транспортные механизмы для утилизации фолатов. Поэтому назначение 15 мг фолиевой кислоты 3 раза в неделю per os обеспечивает адекватные потребности организма в фолиевой кислоте и предупреждает возникновение нежелательных реакций, особенно со стороны костно-мозгового кроветворения.
Сульфадиазин является аналогом ПАБК, конкурентно ингибируя синтез предшественника фолиевой кислоты дигидрофолиевой кислоты. Лечение состоит в назначении ударной дозы 2 г, затем 1 г 4 раза в день. Среди НЛР отмечаются реакции гиперчувствительности и диспептические явления, редко могут развиваться кристаллурия и гематотоксичное действие.
Клиндамицин часто применяется в виде монотерапии или в комбинации с глюкокортикоидами, при этом достигается высокая эффективность терапии. Рекомендуемый режим дозирования: 300 мг 4 раза в сутки в течение 3-4 дней, затем последующие 3-4 недели 150 мг 4 раза в сутки. Из НЛР при применении клиндамицина могут возникать диарея и псевдомембранозный колит. Клиндамицин так же применяется интраокулярно (инъекции в стекловидное тело).
Азитромицин создает высокие концентрации в тканях, хорошо проникает через гемато-офтальмический барьер при воспалении. Рекомендуемый режим дозирования: назначение ударной дозы 500 мг, затем 250 мг в сутки.
Спирамицин рекомендуется для терапии окулярного токсоплазмоза у беременных; режим дозирования - 1 г 2 раза в день.
Кроме вышеперечисленных антимикробных препаратов для лечения токсоплазмоза применяются топические глюкокортикоиды и препараты, снижающие внутриглазное давление.
Ng P., McCluskey P.J.
Treatment of ocular toxoplasmosis.
Aust Prescr 2002; 25: 88-90
окулярные токсоплазмоз, лечение, токсоплазмы, Toxoplasma gondii, пириметамин, сульфадиазин, клиндамицин, азитромицин, спирамицин, топические глюкокортикоиды
В очередной раз придя к врачу на плановый осмотр в связи с беременностью, Dorte Remmer увидела объявление, в котором женщинам предлагалось принять участие в научном исследовании. От матерей требовалось разрешение на скрининг их новорожденных детей на предмет токсоплазмоза. Будучи медработником, она захотела внести вклад в медицинскую науку, и была потрясена, когда оказалось, что ее новорожденный ребенок одного дня от роду инфицирован Toxoplasma gondii.
В Европейском регионе ВОЗ факторы риска заражения Toxoplasma gondii, особенно для беременных женщин, и его последствия для детей или для взрослых с ослабленной иммунной системой, изучены мало.
Токсоплазмоз – болезнь, вызываемая простейшим паразитом Toxoplasma gondii, и в Европейском регионе ВОЗ ею заболевают свыше 2 миллионов человек в год.
Toxoplasma может передаваться трансплацентарным путем (то есть от матери ребенку), при контактах с зараженной почвой или водой, при потреблении зараженной пищи или, в единичных случаях, при трансплантации крови или органов. Считается, что половина всех случаев заражения связана с потреблением зараженной пищи – ненадлежащим образом приготовленного мяса животных или немытых фруктов и овощей. Заражение может происходить при контакте с кошачьими фекалиями, однако следует учитывать, что кошки выделяют ооцисты в окружающую среду только в течение нескольких недель жизни, обычно – в раннем возрасте. Кошки играют в жизненном цикле паразита немалую роль, но все же не являются главным путем передачи инфекции.
По имеющимся оценкам, у 95% людей со здоровой иммунной системой клинические симптомы заражения токсоплазмой не проявляются вообще или проявляются в виде легкого гриппоподобного состояния, которое быстро проходит.
Именно поэтому многие люди даже не подозревают о том, что заражены. У людей с ослабленным иммунитетом токсоплазмоз может проявляться в виде более серьезных поражений глаз, мозга и других органов, например – воспаления глаз, которое способно привести к потере зрения.
Франциска – одна из женщин, у которых мы брали интервью, – обнаружила, что заражена токсоплазмозом, когда она была беременна уже несколько месяцев. Она помнит, что ощущала легкие симптомы простудного заболевания, но точно не знает, как она могла приобрести болезнь, которая потребовала множества анализов и нескольких месяцев лечения.
Качество эпиднадзора за токсоплазмозом значительно варьируется между странами, что затрудняет оценку бремени заболевания и его последствий.
При заражении токсоплазмой во время беременности или непосредственно перед зачатием простейшие паразиты могут передаться плоду. Клинические признаки заболевания проявляются не у всех детей, инфицированных в утробе матери, но заражение может стать причиной выкидыша, рождения мертвого ребенка, врожденных патологических изменений мозга и частичной или полной потери зрения. Нарушения зрения развиваются у вплоть до 85% детей, зараженных в утробе матери, и хотя чаще всего симптомы проявляются в течение первого года жизни, болезнь может протекать вплоть до подросткового возраста.
Определить, была ли беременная женщина когда-либо инфицирована токсоплазмой, можно при помощи серологического исследования. Если женщина уже заражалась ранее, до беременности, то риск передачи паразита плоду минимален. В противном случае ей угрожает риск заражения токсоплазмой во время беременности, с последующим инфицированием ребенка.
Если исследование показывает, что беременная женщина была заражена недавно или заражена в настоящее время, она может принять решение об исследовании плода через плацентарную кровь или околоплодные воды. Вместе с тем, скрининг на предмет токсоплазмоза в большинстве стран Европейского региона не входит в число плановых процедур и не является обязательным. Соответствующие рекомендации основываются на анализе затрат и выгод, с учетом распространенности и последствий болезни в конкретной стране и рисков, связанных со скринингом.
Для профилактики токсоплазмоза пищевого происхождения следует выполнять 5 принципов безопасного питания, сформулированных ВОЗ. Выполнение правил гигиены, включая мытье рук и использование чистой воды при производстве и приготовлении пищевых продуктов, имеет решающее значение. Беременным женщинам следует избегать употребления в пищу мяса, которое не было подвергнуто достаточной тепловой обработке. Фрукты и овощи следует тщательно мыть в чистой воде.
Сотрудники ВОЗ провели серию интервью с людьми, которые работают с этим распространенным, но при этом малоизученным заболеванием, или же сталкивались с ним непосредственно. Полученные сведения помогут лучше информировать население, рассказывать о рисках для беременных женщин и их детей, и в целом вести профилактику токсоплазмоза.
Интервью с Dorte Remmer, медработником из Дании
Интервью с Franziska, консультантом из Германии
Интервью с Maria Vang Johansen, профессором паразитологии и зоонозов в Копенгагенском университете (Дания)
Интервью с Joke W. B. van der Giessen, ветеринарным микробиологом/паразитологом в Центре зоонозов и микробиологии окружающей среды при Национальном институте общественного здравоохранения и окружающей среды Нидерландов (RIVM)




Европейское региональное бюро ВОЗ
UN City
Marmorvej 51
DK-2100 Copenhagen Ø
Denmark
Тел.: +45 45 33 70 00
Факс: +45 45 33 70 01
Расположение и схема проезда
Направьте нам электронное сообщение
Токсоплазмоз — широко распространенное инфекционное заболевание человека и животных, характеризующееся длительным хроническим течением, полиморфностью клинической картины (от бессимптомного носительства до летальных форм болезни) и возможностью внутриутробного инфицирования плода.
Возбудитель токсоплазмоза — Toxoplasma gondii — внутриклеточный паразит, размером 4—7 мкм. Если взглянуть на этот живой организм под микроскопом, он напоминает дольку апельсина (рис.1).
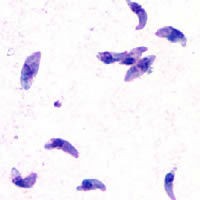
Рис. 1 Toxoplasma gondii –окрашенный препарат по Романовского-Гимзе
Можно ли заразиться токсоплазмозом от домашних животных? Да, ведь токсоплазмозом болеют около 60 видов птиц и 300 видов млекопитающих (одомашненных и диких), которые с фекалиями попадают во внешнюю среду выделяют цисты и приводят к заражению других организмов.
Но имея сложный путь развития (половой и бесполый) и тот факт, что половой процесс происходит только лишь в кишечнике животных семейства кошачьих, с образованием устойчивых форм (цист), которые долгое время сохраняются во внешней среде (до 2 лет), не боятся действия низких и высоких температур, высушивания. Бесполое размножение не приводит к образованию стойких форм паразита.
Источником инфекции выступают больные животные, которые выделяют паразитов со слюной, молоком, мочой, фекалиями. Люди лишь промежуточные хозяева этого простейшего.
Заражение возбудителем токсоплазмоза происходит:
- при употреблении в пищу сырого или плохо прожаренного мяса;
- при контакте с сырым или недостаточно термически обработанным мясом слизистой оболочки полости рта (многие хозяйки пробуют сырой фарш);
- при уходе за зараженными животными, например, уборка кошачьего туалета;
- при употреблении в пищу немытых овощей, фруктов, зелени, на которых могут быть цисты паразита;
- при пересадке внутренних органов или переливание крови.
В подавляющем большинстве случаев при токсоплазмозе наблюдается бессимптомное носительство паразита, сопровождающееся наличием специфических антител в крови. Инфицированность населения колеблется от 10 до 90%.
Клинические симптомы токсоплазмоза у человека отличаются разнообразием. Выделяют врожденный и приобретенный токсоплазмоз.
Врожденный токсоплазмоз протекает тяжелее всего. При заражении на ранних сроках беременности происходит внутриутробная гибель плода, так как у него формируются уродства, которые несовместимы с жизнью. Если инфицирование наступает во второй половине беременности, ребенок рождается с генерализованным поражением всех органов и систем. Для него характерны повышение температуры тела, желтушность кожи, слабость, низкий тонус мышц, увеличение печени, лимфатических узлов, селезенки, кожная сыпь, патологии нервной системы (энцефаломиелит). Также возможно развитие косоглазия, слепоты, нарушение формирования головного или спинного мозга.
Токсоплазмоз входит в группу TORCH- инфекций, считающихся потенциально опасными для внутриутробного развития плода. Только первичное заражение женщины во время беременности может привести к инфицированию плода. Таким образом, практически важным является вопрос о моменте инфицирования беременной: задолго до, непосредственно перед, либо во время беременности.
При попадании токсоплазм в организм человека через 7—14 дней начинается первичный гуморальный иммунный ответ — продуцируются специфические IgM. Максимальный уровень их концентрации достигается к 20— 30-му дню от момента инфицирования. Полное их исчезновение в большинстве случаев (около 70%) происходит в течение 3—4 месяцев, однако, возможно присутствие специфических IgM и более длительное время — до 1 года и более (около 10% случаев). Следовательно, присутствие в крови специфических IgM предполагает, но не доказывает свежее инфицирование, поскольку они могут находиться в крови от 3 мес. до 1,5 лет. Дифференцировать первичную инфекцию от паст-инфекции помогает комплексный подход к диагностике — это сопоставление данных всего спектра серологических маркеров инфекции, а именно:
- результатов выявления специфических IgM, IgA;
- определения индекса авидности IgG и концентрации IgG в динамике.
Анализ серологического профиля пациента позволяет определить вероятный срок инфицирования T.gondii.
В случае отрицательного результата беременные относятся к группе риска по инфицированию Toxoplasma gondii во время беременности и каждые 1—2 месяца должны обследоваться на токсоплазмоз. В случае положительного результата иммуноферментного анализа на поздние специфические антитела IgG у беременных важно определить срок инфицирования.
Приобретенный токсоплазмоз у человека чаще всего имеет латентное течение. Инкубационный период длится от 5 до 23 дней. Больные жалуются на высокую температуру тела, озноб, слабость, головные боли, болезненные ощущения в суставах и мышцах, увеличение печени, селезенки, шейных лимфатических узлов. Возможно развитие пневмонии, энцефалита, эндокардита, поражения глаз.
Течение хронического токсоплазмоза бессимптомное или характеризуется незначительными клиническими проявлениями на протяжении многих лет. Наиболее распространенные симптомы этой формы болезни:
- повышение температуры до субфебрильных цифр;
- слабость, которая возникает даже после сна, ухудшение памяти, апатия к окружающему миру, раздражительность;
- тупые головные боли;
- болезненные ощущения в мышцах и суставах, затруднение передвижения;
- увеличение в размерах селезенки, печени и лимфатических узлов;
- при поражении желудочно-кишечного тракта: тупые боли в животе, сухость во рту, снижение аппетита, метеоризм;
- патологии сердечно - сосудистой системы, которые сопровождаются снижением артериального давления, давящими болями в сердце и изменениями его ритма;
- нарушения эндокринной системы: болезни поджелудочной железы, сбои менструального цикла, импотенция;
- расстройства зрения, близорукость.
В то же время возможны и клинически выраженные варианты течения первичной инфекции (как правило, возникающие у лиц с нарушением иммунитета) с развитием энцефалита, миокардита, миозита, увеита, формированием хронической инфекции.
Весьма актуальна проблема генерализации латентного токсоплазмоза у ВИЧ-инфицированных с развитием тяжелого некротического энцефалита с большой вероятностью летального исхода.
Среди возможных осложнений токсоплазмоза выделяют: инфекционно-токсический шок, поражения центральной нервной системы (энцефалит, арахноидит, отек мозга, эпилептиформный синдром, параличи, парезы, отставание детей в развитии), болезни глаз (атрофия зрительного нерва), патологии сердца (эндокардит), недуги дыхательных органов (пневмония).
Так как клинические симптомы недуга очень разнообразны, диагностика токсоплазмоза на основании жалоб больного невозможна. Следует обязательно собрать эпидемиологический анамнез, выяснить, употреблял ли больной сырое иди недостаточно прожаренное мясо, контактировал ли с больными животными (в особенности кошками).
В лабораторной диагностике токсоплазмоза широко используются иммунологические методы, которые выявляют антитела к токсоплазмозу. Наиболее распространенным среди них является иммуноферментный анализ. Для его проведения у человека берут кровь на токсоплазмоз. Также можно применять и другие биологические жидкости. На основании выявления антител двух разных классов данное исследование позволяет судить о давности заражения, так как иммуноглобулины класса M появляются сразу после инфицирования и в течение года после него, а иммуноглобулины класса G сохраняются в крови на всю последующую жизнь.
Можно ли вылечить токсоплазмоз? У здоровых людей болезнь заканчивается полным выздоровлением с формированием иммунитета на всю дальнейшую жизнь и не имеет каких-либо последствий. Тяжелые поражения разных органов и систем при токсоплазмозе развиваются у людей с дефектами иммунитета, например, ВИЧ-инфицированных. Последствия токсоплазмоза особенно тяжелые при врожденной форме болезни. Она приводит к внутриутробной гибели плода или наличию у него выраженных патологий.
Профилактика токсоплазмоза также включает следующие мероприятия:
- тщательное мытье фруктов, овощей и зелени;
- употребление в пищу достаточно термически обработанных мясных блюд;
- мытье рук после земельных работ и ухода за животными;
- в период беременности следует избегать контакта с кошками;
- уничтожение мух, тараканов и грызунов, которые могут переносить цисты паразитов.
С целью предупреждения врожденного токсоплазмоза необходимо проводить обследование с определением уровня антител в крови всем женщинам, которые планируют беременность.
Читайте также:


