Парвовирусная инфекция клинический случай
Полный текст:
Ильенко Лидия Ивановна – доктор медицинских наук, профессор, заведующая кафедрой госпитальной педиатрии №2 педиатрического факультета РНИМУ им. Н.И. Пирогова МЗ РФ.
Пашинян Альбина Гургеновна - доктор медицинских наук, профессор кафедры дерматовенерологии лечебного факультета РНИМУ им. Н.И. Пирогова МЗ РФ.
Васенова Виктория Юрьевна - доктор медицинских наук, профессор кафедры кожных болезней и косметологии РНИМУ им. Н.И. Пирогова МЗ РФ.
1. Cossart Y.E., Field A.M., Cant B., Widdows D. Parvovirus-like particles in human sera. Lancet .1975;11(1):72—3.
2. Candotti D., Etiz N., Parsyan A., Allain J.P. Identification and characterization of persistent human erythrovirus infection in blood donor samples. J Virol .2004; 78(22):12169—78.
3. Parsyan A,. Szmaragd C., Allain J.P., Candotti D. Identification and genetic diversity of two human parvovirus B19 genotype 3 subtypes. J Gen Virol .2007; 88( 2):428—31.
4. Filippone C., Zhi N., Wong S., Lu J., Kajigaya S., Gallinella G., Kakkola L., Söderlund-Venermo M., Young N.S., Brown KE.VP1u phospholipase activity is critical for infectivity of full-length parvovirus B19 genomic clones. Virology. 2010; 374(2):444-52. doi: 10.1016/j.virol.2008.01.002
5. Anderson L.J., Tsou C., Parker R.A., Chorba T.L., Wulff H., Tattersall P., Mortimer P.P. Detection of antibodies and antigens of human parvovirus B19 by enzyme-linked immunosorbent assay. J Clin Microbiol. 1986; 24:522—6.
6. Marano G., Vaglio S., Pupella S., Facco G., Calizzani G., Candura F., Liumbruno G.M, Grazzini G. Human Parvovirus B19 and blood product safety: a tale of twenty years of improvements. Blood Transfus. 2015;13(2):184—196. doi:10.2450/2014.0174.14
7. Lamont R.F., Sobel J.D., Vaisbuch E., Kusanovic J.P., Mazaki-Tovi S., Kim S.K., Uldbjerg N., Romero R. Parvovirus B19 infection in human pregnancy. BJOG. 2011;118(2):175—86.
8. Subtil D., Garabedian C., Chauvet A. Parvovirus B19 infection and pregnancy. Presse Med. 2015; 44(6):647—53. doi: 10.1016
9. Enders M., Klingel K., Weidner A., Baisch C., Kandolf R., Schalasta G., Enders G. Risk of fetal hydrops and non-hydropic late intrauterine fetal death after gestational parvovirus B19 infection. Journal of clinical virology: the official publication of the Pan American Society for Clinical Virology. 2010; 49(3):163—8. doi: 10.1016/j.jcv.2010.07.014
10. Shabani Z., Esghaei M., Keyvani H., Shabani F., Sarmadi F., Mollaie H., Monavari S.H. Relation between parvovirus B19 infection and fetal mortality and spontaneous abortion. Med J Islam Repub Iran. 2015; 7(29):197.
11. Ugai S., Aizawa Y., Kanayama T., Saitoh A. Parvovirus B19: A Cause of Sepsislike Syndrome in an Infant. Pediatrics. 2018; 141(6). pii: e20171435. doi: 10.1542/peds.2017—1435.
12. Сидорова И.С., Кулаков В.И., Макаров И.О. Руководство по акушерству. М.: Медицина, 2006: 362.
13. Пашинян А.Г., Рунихина Н.К., Мокеева Е.Ю. Инфекционная эритема: клинический случай. Росс журнал кожн и венер болезней. 2016;19(4):206—209.
14. Gustafsson I., Kaldensjö T., Lindblom A., Norbeck O., Henter J.I., Tolfvenstam T., Broliden K. Evaluation of parvovirus B19 infection in children with malignant or hematological disorders. Clin. Infect. Dis. 2010; 50(10):1426—7 doi: 10.1086/652286.
15. Dingli D., Pfizenmaier D.H., Arromdee E., Wennberg P., Spittell P.C., Chang-Miller A., Clarke B.L. Severe digital arterial occlusive disease and acute parvovirus B19 infection. Lancet. 2000; 356:312—314. doi: 10.1016/S0140-6736(00)02512—5.
16. Kerr J.R. Pathogenesis of human parvovirus B19 in rheumatic disease. Ann. Rheum. Dis. 2000; 59:672—683. doi: 10.1136/ard.59.9.672.
17. Bock C.T., Düchting A., Utta F., Brunner E., Sy B.T., Klingel K., Lang F., Gawaz M., Felix S.B., Kandolf R. Molecular phenotypes of human parvovirus B19 in patients with myocarditis. World J Cardiol. 2014; 26;6(4):183—95. doi: 10.4330/wjc.v6.i4.183.
18. Tesapirat L., Wanlapakorn N., Chieochansin T., Poovorawan Y. Parvovirus b19 infection presenting as acute hepatitis and transient anemia in a previously healthy child. Southeast Asian J Trop Med Public Health. 2015; 46(2):226—30.
19. Valencia Pacheco G., Nakazawa Ueji Y.E., Rodríguez Dzul E.A., Angulo Ramírez A.V., López Villanueva R.F., Quintal Ortiz I.G., Rosado Paredes EP. Serological and molecular analysis of parvovirus B19 infection in Mayan women with systemic lupus erythematosus in Mexico. Colomb Med (Cali). 2017; 48(3):105—112. doi: 10.25100/cm.v48i3.2981.
20. Peterlana D., Puccetti A., Corrocher R., Lunardi C. Serologic and molecular detection of human parvovirus B19 infection. Clin Chim Acta. 2006; 372:14—23.
21. Koppelman M.H., van Swieten P., Cuijpers H.T. Real-time polymerase chain reaction detection of parvovirus B19 DNA in blood donations using a commercial and an in-house assay. Transfusion. 2011; 51(6):1346—54. doi: 10.1111.
22. Juhl D., Gorg S., Hennig H. Persistence of parvovirus B19 (B19V) DNA and humoral immune response in B19V-infected blood donors. Vox Sang. 2014; 107:226—232.
23. Nadimpalli S.S., Miller R.S., Kamath V.M., Farkouh C.R., NhanChang C.L., Rathe J.A. Collins A., Duchon J.M., Neu N., Simpson L.L., Ratner A.J. Congenital Parvovirus B19 Infection: Persistent Viremia and Red Blood Cell Aplasia. Open Forum Infect Dis. 2015; 2(2):049. doi:10.1093/ofid/ofv049
24. Bonvicini F., Puccetti C., Salfi N.C., Guerra B., Gallinella G., Rizzo N., Zerbini M. Gestational and Fetal Outcomes in B19 Maternal Infection: a Problem of Diagnosis. J Clin Microbiol. 2011; 49(10):3514—3518. doi: 10.1128/JCM.00854-11

Контент доступен под лицензией Creative Commons Attribution 4.0 License.

ПАРВОВИРУСНАЯ ИНФЕКЦИЯ. ИНФЕКЦИОННАЯ ЭРИТЕМА
B08.3 Эритема инфекционная [пятая болезнь]
B34 Вирусная инфекция неуточненной локализации:
B34.3 Парвовирусная инфекция неуточненная
Возбудитель –парвовирусВ19, вирус семейства парвовирусов. Мелкий вирус диаметром 20-25 нм без внешней оболочки. Икосаэдрический капсид из двух структурных белков окружает одну плюс- или минус-цепь ДНК. Парвовирус В19 высокоустойчив: он сохраняет жизнеспособность при 16-часовом нагревании при 60°С. В культурах клеток, обычно применяющихся в лабораторной практике, он не размножается и инфекции у лабораторных животных не вызывает. Культивировать его удается в клетках-предшественниках эритроцитов, полученных из костного мозга человека, крови, пуповины или печени плода.
- Эпидемиология
- Источник инфекции – больной человек (чаще больной ребенок дошкольного возраста).
- Механизм заражения – воздушно-капельный, контактный, трансплацентарный, парентеральный
- Патогенез
В развитии болезни выделяют две фазы. Первая совпадает с виремией, развивающейся примерно через 6 суток после попадания вируса восприимчивым (серонегативным) лицам. Виремия продолжается около 1 нед; в первые 2-3 сут. наблюдаются общие симптомы (головная боль, недомогание, миалгия, озноб, лихорадка, зуд), в крови — ретикулоцитопения. В этот период вирус выделяется с секретами дыхательных путей. Через несколько дней происходит снижение уровня гемоглобина, сохраняющееся в течение 7-10 сут. Исследование костного мозга в этот период выявляет значительное обеднение эритроидного ростка. Возможны: умеренная лимфопения, нейтропения и тромбоцитопения. Вторая фаза заболевания наступает через 17-18 сут. после заражения. К этому времени появляются специфические IgM-антитела и виремия прекращается. На несколько дней позже IgM появляются IgG-антитела, которые сохраняются неопределенно долго (постинфекционный иммунитет). В этой фазе количество ретикулоцитов в крови нормализуется, в последующем может появиться пятнисто-папулезная сыпь, на 1-2 суток позже — артралгия или артрит.
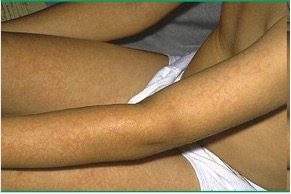
Таким образом, пациент с инфекционной эритемой и артритом фактически не заразен. Развитие симптоматики связано с иммунокомплексными реакциями. Заразность сохраняется среди иммунодефицитных больных и пациентов с хроническими формами анемии и гипопластическими кризами.
- Критерии диагностики
4.1 Анамнестические:
4.2 Клинические:
Инфекционная эритема.
- Самое часто диагностируемое проявление парвовирусной инфекции.
- Заболевание встречается преимущественно у детей.
- Появлению экзантемы предшествует продромальный период (до 7 дней), проявляющийся гриппоподобной симптоматикой.
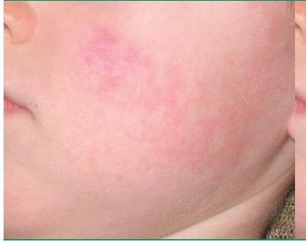
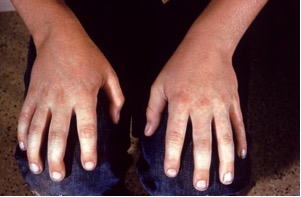
Артралгия и артрит.
- Симметрично поражаются периферические суставы (коленные, суставы кисти и запястья)
- Продолжительность заболевания – 3 недели, иногда несколько месяцев, в редких случаях – несколько лет
- Исход болезни – восстановление движения, без деструктивных изменений в тканях суставов.
Преходящие апластические кризы.
- За несколько дней до криза появляются общие симптомы (головная боль, недомогание, миалгия, озноб, лихорадка, зуд)
- Критическое падение уровня гемоглобина вплоть до угрожающих жизни величин;
- Выраженная ретикулоцитопения до 7-10 суток болезни;
- Отсутствие клеток эритроидного ростка при достаточном количестве клеток гранулоцитарно-моноцитарного ростка в костном мозге
- Внезапно развивающиеся, динамично протекающие апластические кризы у больных хроническими гемолитическими анемиями, в т.ч. серповидноклеточной анемии, ферментопатиях, т.д.
Хроническая анемия.
- Характерна для пациентов с иммунодефицитом, в т.ч. ВИЧ-инфекцией (при повреждении Т-клеточного звена)
- Развитие анемии связывают с разрушением клеток-предшественников эритропоэза в костном мозге
- Анемия может быть единственным проявлением иммунодефицита, характеризуется волнообразным течением.
- Улучшения удается добиться при введении эритропоэтина и гемотрансфузиях.
Неиммунная водянка плода.
4.3 Лабораторные критерии диагностики:
- Обнаружение специфическихIgMиIgGс помощью готовых наборов для ИФА
- Обнаружение вируса или его ДНК в сыворотке или в тканях методом ПЦР при апластических кризах. Однако при артрите и инфекционной эритеме результат обычно отрицательный.
- Обнаружение гигантских эритробластов и гипоплазии эритроидного ростка в костном мозге.
- Показания к госпитализации
Больных с апластическим кризом и хронической анемией госпитализируют в отдельные палаты и соблюдают контактную и респираторную изоляцию.
Специфической терапии нет. При тяжелом и затяжном артрите используются нестероидные противовоспалительные средства. При анемии у больных с иммунодефицитом – внутривенное введение иммуноглобулинов, содержащих антитела к парвовирусу.
- Противоэпидемические мероприятия
При контакте с больным парвовирусной инфекцией беременным, лицам с иммунодефицитом, больным с хронической гемолитической анемией вводят в/внормальный иммуноглобулин. Специфическая профилактика не разработана. Больные с апластическим кризом и хронической инфекцией, вызванной парвовирусом В19, в отличие от больных инфекционной эритемой и артритом представляют собой источник больничной инфекции. Их госпитализируют в отдельные палаты и соблюдают контактную и респираторную изоляцию.
Пример формулировки диагноза:
Парвовирусная инфекция (инфекционная эритема) средней тяжести
РЕЗЮМЕ
При контакте с больным парвовирусной инфекцией беременным, лицам с иммунодефицитом, больным с хронической гемолитической анемией с целью профилактики вводят в/в нормальный иммуноглобулин. Больные с апластическим кризом и хронической инфекцией, вызванной парвовирусом В19, в отличие от больных инфекционной эритемой и артритом представляют собой источник больничной инфекции. Их госпитализируют в отдельные палаты и соблюдают контактную и респираторную изоляцию.
Информация только для специалистов в сфере медицины, фармации и здравоохранения!

Т.М. Чернова, к.м.н., М.Ф. Дубко, к.м.н. Санкт-Петербургский государственный педиатрический медицинский университет Минздрава России
В статье впервые представлен случай парвовирусной В19-инфекции у ребенка, протекавшей в виде кардита и миозита. В клинике отмечалось стремительное прогрессирование симптомов острого рабдомиолиза с резким повышением в крови уровня креатинфосфокиназы, лактатдегидрогеназы, миоглобина, ферритина и тропонина 1. Ультразвуковое исследование позволило выявить диффузные воспалительные изменения мышц верхних и нижних конечностей с множественными очагами дезорганизации мышечной ткани. Количественным методом ПЦР определен высокий уровень ДНК PVВ19, что позволило верифицировать парвовирусную В19-инфекцию. Быстрый клинический и лабораторный ответ у наблюдаемой пациентки явился результатом адекватной комплексной терапии, в том числе за счет раннего применения препаратов с противовирусным и иммуномодулирующим действием.
Парвовирусная В19-инфекция (PVB19) - широко распространенное заболевание, встречающееся преимущественно в детском возрасте. В международной классификации болезней десятого пересмотра (МКБ 10) парвовирусная инфекция имеет коды:
• В08.3 - эритема инфекционная (пятая болезнь);
• B97.6 - парвовирусы как причина болезней, классифицированных в других рубриках;
• B34.3 - парвовирусная инфекция неуточненная.
В 1995 г. возбудитель был классифицирован как еrythrovirus в связи с его тропизмом к предшественникам эритроцитов в костном мозге и селезенке, на поверхности которых имеется P-антиген - мембранный рецептор, облегчающий проникновение вируса внутрь клеток. В дальнейшем доказана его экспрессия на поверхности зрелых эритроцитов, мегакариоцитов, гранулоцитов, эндотелиальных и гладкомышечных клеток сосудов, гепатоцитов и других клеток [1]. У лиц с генетически детерминированной недостаточностью P-рецепторов парвовирусная инфекция не развивается [2].
Геном PVB19 представлен одноцепочечной ДНК (5596 нуклеотидов), кодирующей структурные белки VP1 и VP2 и неструктурный белок NS1. Возбудитель подвержен значительной изменчивости, что подтверждается данными иммуноферментного анализа (ИФА), полимеразной цепной реакции (ПЦР) и методом секвенирования. Обычно мутации происходят в последовательностях, кодирующих VP1 и VP2, тогда как область NS1 стабильна. В то же время изменчивость парвовируса B19 не объясняет различия в клинических проявлениях инфекции, которые зависят не только от свойств самого вируса, но и возраста, гематологического и иммунологического статуса инфицированного человека [3].
В крови ДНК PVB19 определяется в высоких концентрациях на первой неделе заболевания и быстро исчезает с появлением специфических IgM (10-12-е сутки после инфицирования), которые циркулируют в течение 3-4 месяцев и более. Антитела класса IgG обнаруживаются через 5-7 дней после появления IgM, высокоавидные IgG обеспечивают пожизненный иммунитет к инфекции. Низкий уровень ДНК-вируса (ниже 100 МЕ/мл) может определяться в сыворотке крови иммунокомпетентных лиц в течение 1-3 лет после перенесенной острой инфекции [4, 5]. При иммунной дисфункции и недостаточном количестве нейтрализующих антител в редких случаях возможно формирование персистирующей и хронической инфекции. Маркером персистирующей инфекции является выявление в крови специфических IgG к вирусному белку NS1 через 6 недель после инфицирования. При хронической инфекции у больных отмечается постоянная виремия, наличие вирусной ДНК в костномозговых клетках, может наблюдаться длительное тяжелое угнетение всех трех ростков кроветворения [6].
Репликация возбудителя сопровождается лизисом инфицированных клеток и приводит к незначительному снижению продукции эритроцитов и уровня гемоглобина в течение 7-10 суток, что не влияет на самочувствие больного. В ряде случаев возможны субфебрильная лихорадка, слабость, головная боль, насморк, першение в горле, миалгии, слабовыраженные ретикулоцито- лимфоцито-, нейтро- и тромбоцитопения. Появление в крови специфических IgM к вирусному белку VP2 и IgG к вирусному белку VP1 способствуют элиминации PVB19 из организма.
Таким образом, в большинстве случаев заболевание протекает в бессимптомной или стертой формах и практически не диагностируется. Это подтверждается данными эпидемиологических исследований - 40-60% населения серопозитивны уже к 30 годам и до 90% лиц старше 60 лет имеют антитела к парвовирусу B19 при отсутствии клинических проявлений заболевания в анамнезе [7]. У больных с гемолитической анемией и гемоглобинопатиями (серповидноклеточная анемия, наследственный микросфероцитоз, талассемии, ферментопатии) разрушение клеток-предшественников эритроцитов при репликации PVB19 и нарушение эритропоэза обычно приводит к транзиторному апластическому кризу.
Предполагается, что типичные клинические проявления парвовирусной инфекции - инфекционная эритема и артрит - развиваются у лиц с иммунной дисфункцией и обусловлены осаждением иммунных комплексов (ИК) в коже и синовиальных оболочках суставов, так как начало симптомов совпадает с появлением в крови IgM и IgG против вирусных структурных белков. Доказано, что при парвовирусной B19-инфекции существует корреляция между клиническими особенностями и специфичностью иммуноглобулинов: у пациентов с инфекционной эритемой преимущественно индуцируются IgG-антитела против кератина, тогда как при артрите - преимущественно против коллагена типа II [8].
Артропатии у детей наблюдаются достаточно редко (8-10% случаев), возникают на фоне сыпи, после ее исчезновения или могут быть основным клиническим проявлением инфекции. Характерно симметричное поражение мелких суставов рук и ног (голеностопные, межфаланговые и пястно-фаланговые), коленные или тазобедренные суставы вовлекаются редко. В области поражения отмечается отечность, болезненность, которая может затруднять самостоятельное передвижение, возможна локальная гипертермия. Течение артропатий при PVB19-инфекции доброкачественное, продолжительность процесса обычно не превышает 2-3 недель. Возможно затяжное течение без деструкции и дегенеративных изменений суставов [9].
PVB19 является одной из наиболее распространенных причин вирусных миокардитов, что обусловлено экспрессией P-антигена кардиомиоцитами. Кроме того, недавно установлена способность вируса реплицироваться в клетках эндотелия коронарных сосудов [10]. Как следствие, развивается спазм коронарной артерии, ишемия миокарда и нарушение функции сердечно-сосудистой системы в целом. У детей парвовирусные миокардиты в основном характеризуются транзиторным нарушением сердечной деятельности и способностью к полному восстановлению. Редкие случаи выраженных нарушений функции левого желудочка с формированием тяжелой декомпенсированной сердечной недостаточности без трансплантации заканчиваются неблагоприятно [11]. В то же время имеются сообщения о выздоровлении детей с декомпенсированными миокардитами после длительной комплексной терапии (экстракорпоральная мембранная детоксикация, диуретики, ингибиторы ангиотензинпревращающего фермента, иммунодепрессанты, глюкокортикоиды) [12].
В настоящее время известно, что парвовирусная B19-инфекция может протекает в виде васкулита, гломерулонефрита, гепатита, менингита, энцефалита, тромбоцитопении, нейтропении. Обнаружена связь инфекции с идиопатической тромбоцитопенической пурпурой, пурпурой Шенлейна - Геноха, гемофагоцитарным синдромом. Кроме того, описаны случаи периферической нейропатии (плечевой плексит, парезы двигательных черепных нервов), обусловленные PVB19. Имеется сообщение об обнаружения ДНК PVB19 в мышечных биоптатах у двух пациентов с воспалительной миопатией [13, 14, 15].
Атипичные формы инфекции, протекающие без характерной инфекционной эритемы, представляют значительные трудности для диагностики. В связи с этим приводим клиническое наблюдение случая парвовирусной В19-инфекции у ребенка, протекавшей в виде кардита и миозита.
Девочка 7 лет поступила в клинику СПбГПМУ с жалобами на лихорадку в течение 5 дней, выраженную слабость, сильные боли в мышцах.
Из анамнеза жизни известно, что девочка от 2-й беременности, протекавшей с угрозой прерывания на ранних сроках. Роды срочные, вес при рождении - 3220 г, длина - 50 см. Оценка по шкале Апгар 8/9 баллов.
Растет и развивается по возрасту. На диспансерном учете на состояла. Привита по возрасту в соответствии с Национальным календарем профилактических прививок. Перенесенные инфекционные заболевания: ветряная оспа, редкие ОРЗ (последнее 4 месяца назад).
Настоящее заболевание началось остро с повышения температуры тела до 38,0 С, снижения аппетита, катаральных симптомов не было. На 4-й день сохранялась фебрильная лихорадка, появились боли в эпигастральной области, однократная рвота, отечность лица. Осмотрена педиатром, назначены пробиотик, энтеросорбент. На следующий день продолжала лихорадить до 37,8 С, наросла общая слабость, стала вялой, сонливой, отказывалась от еды, жаловалась на боли в спине, верхних и нижних конечностях, в связи с чем была госпитализирована.
При поступлении состояние средней тяжести, в сознании, очень вялая. Кожа обычной окраски, мраморность, сыпи нет. Слизистая задней стенки глотки слабо гиперемирована. Небные миндалины I-II степени, налетов нет. Периферические лимфоузлы - не увеличены. Тоны сердца ясные, ритмичные, тахикардия до 140 ударов в минуту. Дыхание жесткое, хрипов нет, одышка до 44 в минуту. Живот мягкий, безболезненный. Печень, селезенка не пальпируются. Стула не было. Мочится достаточно. Менингеальные симптомы отрицательные. При обследовании в клиническом анализе крови: лейкоциты - 10,6 х 109/л, нейтрофилез до 76%, тромбоцитопения до 92 х 109/л, СОЭ 3 мм/час. В биохимическом анализе крови: аспартатаминотрансфераза (АСТ) - 161 Ед/л (норма до 38), лактатдегидрогеназа (ЛДГ) - 555 Ед/л (норма до 220). Общий анализ мочи - без патологии.
В течение ночи нарос отек лица, появился акроцианоз. С подозрением на миокардит по тяжести состояния переведена в реанимационное отделение (6-й день болезни).
Диагноз острого кардита подтвержден по результатам инструментального исследования - Rg-графии органов грудной полости (умеренное увеличение размеров сердца, сглаженность талии) и ЭХО-кардиографии (гипертрофия левого и правого желудочков, без нарушения сократительной способности и диастолической дисфункции, сепарация листков перикарда жидкостью по задней стенке ЛЖ до 19 мм), а также лабораторных данных - повышение уровня натрийуретического пептида (NT-proBNP) до 7020 (норма до 125,0).
Кроме того, в течение первых 5 дней наблюдения прогрессировали симптомы миопатии – отек кистей, стоп и голеней, резкая болезненность мышц конечностей при пальпации, невозможность самостоятельных движений. Учитывая выраженный болевой синдром, диффузное снижение мышечного тонуса и мышечной силы конечностей до 1-2 баллов, проведено МРТ-исследование (исключены объемные образования и воспалительные процессы в головном и спинном мозге). По данным электронейромиографии (ЭНМГ) исключена полинейропатия. В то же время при ультразвуковом исследовании выявлены диффузные воспалительные изменения мышц верхних и нижних конечностей (выраженный отек подкожной жировой клетчатки, повышенная васкуляризация мышц, множественные очаги дезорганизации мышечной ткани до 1-2 мм в диаметре). При динамическом наблюдении в крови наблюдались признаки нарастающего рабдомиолиза в виде значительного повышения содержания клеточных ферментов (КФК до 113571 Ед/л (норма до 168), КФК-МВ до 273,4 Нг/мл (норма до 3,4), АЛТ до 742 Ед/л (норма до 55), АСТ до 2459 Ед/л, ЛДГ до 3769 Ед/л), а также ферритина до 302 мкг/л (норма до 120), миоглобина до 9283,4 нг/мл (норма до 65,8) и тропонина 1 до 0,51 нг/мл (норма до 0,01). В клиническом анализе крови на фоне нарастания лейкоцитоза до 20,8х109/л и СОЭ до 26 мм/час наблюдалось снижение количества эритроцитов до 2,8 х 1012/л, гемоглобина до 76 г/л, тромбоцитов до 81 х 109/л. В моче - транзиторные признаки инфекционной нефропатии (белок до 3 г/л, эритроциты - до 5-8 в поле зрения, гиалиновые цилиндры до 2-4).
В процессе дифференциального диагноза был получен отрицательный результат иммуноблота на антинуклеарные антитела и антитела при полимиозите, что позволило исключить и аутоиммунный генез рабдомиолиза. С целью выявления этиологической причины воспалительной миопатии проведено лабораторное исследование на инфекционные возбудители. Учитывая фебрильную лихорадку, боли в животе, боль в мышцах, кардиопатию, лабораторные маркеры рабдомиолиза, ребенок был обследован на энтеровирусную инфекцию, иерсиниозы, герпесвирусные инфекции - результаты отрицательные. Количественным методом ПЦР в крови выявлена ДНК PVВ19 (5,2 х 103 МЕ/мл), что в сочетании с клиническими проявлениями (выраженные анемия и тромбоцитопения) позволило диагностировать парвовирусную В19-инфекцию.
Получала комплексную этиопатогенетическую терапию, которая включала рекомбинантный человеческий интерферон-альфа ректально (Виферон), иммуноглобулин человека внутривенно два введения через 3 дня, метилпреднизолон 3 дня, фосфокреатин, ибупрофен, проводилась коррекция электролитных нарушений и диуреза. На фоне лечения через 2 дня перестала лихорадить, с 3-го дня отмечалось улучшение самочувствия, аппетита, с 6-го дня зафиксирована стабилизация миолиза и сердечно-сосудистой деятельности, начала самостоятельно переворачиваться и садиться в постели, переведена в педиатрическое отделение кардиоревматологического профиля. Со второй недели к терапии добавлены комплекс витаминов группы B, массаж, лечебная физкультура. На третьей неделе (4-я неделя болезни) движения восстановились в полном объеме, начала самостоятельно ходить. По результатам контрольного лабораторного и инструментального обследования отмечались остаточные признаки мышечного и сердечного вовлечения. Выписана в удовлетворительном состоянии на 25-й день наблюдения с диагнозом: парвововирусная В19-инфекция, смешанная форма (кардит, миозит). Осложнение: острый рабдомиолиз, интраинфекционная нефропатия.
Острый миозит является достаточно редкой патологией детского возраста и возникает в основном как осложнение гриппа. При этом выраженность проявлений варьирует от легкой миалгии до тяжелого рабдомиолиза с развитием декомпенсации миокарда и нарушением мышечных функций. Мы наблюдали первый случай парвовирусной В19-инфекции у ребенка, протекавшей в виде сочетанного поражения сердца и скелетной мускулатуры.
Парвовирус B19 как причина миозита регистрируется крайне редко. В настоящее время в зарубежной литературе имеются лишь единичные сообщения о данной патологии. В связи с малым количеством наблюдений патогенез миопатии при парвовирусной В19-инфекции остается неясен. Так, в двух случаях у детей миозит развился во время сыпи (стадия продуцирования антител и образования ИК), что позволило авторам предположить иммунокомплексную природу миолиза [16, 17]. Однако Ishikawa A. с соавт. наблюдали случай нарастания мышечной слабости и КФК в крови у ребенка с легкими симптомами респираторной инфекции, контактного с больной инфекционной эритемой сестрой [18]. Несмотря на отсутствие экзантемы, диагноз был подтвержден выявлением в крови специфических IgM и ДНК PVB19, а острый рабдомиолиз был расценен как возможное проявление парвовирусной B19-инфекции.
В приведенном наблюдении начало кардита и миопатии у ребенка в первые дни заболевания также свидетельствовало против иммунокомплексной природы поражения. К тому же введение иммуноглобулина во время активной циркуляции вируса в крови так и не привело к развитию иммуноопосредованных симптомов (сыпи и артропатии) [19].
До настоящего момента прямых доказательств роли PVB19 в развитии миозита не получено. Однако быстрый клинический и лабораторный ответ у наблюдаемой пациентки явился результатом адекватной комплексной терапии, в том числе за счет раннего применения препаратов с противовирусным и иммуномодулирующим действием. Это может служить косвенным доказательством прямого вирусного эффекта в развитии миопатии.
Таким образом, PVB19 следует рассматривать как потенциальный причинный фактор у пациентов с миозитом, особенно при отсутствии инфекционной эритемы. Для выявления истинных механизмов поражения мышечных клеток необходимы углубленные исследования, в том числе с проведением биопсии пораженных мышц.
Литература
К нам обращается встревоженный фермер, описывая клиническую картину выкидышей в последней трети беременности, слабых новорожденных поросят, мертворожденных, мумифицированных поросят, агалактии, свиноматок с лихорадкой и маленькими пометами.
Ферма расположена на северо-западе Испании, она относительно изолирована от других ферм.

Ее потенциал составляют 1000 свиноматок. Производство в фазе 1 и фазе 2 осуществляется в одном и том же месте, а вот часть фазы 3 (5000 свиней на откорме) – в километровой удаленности. Остальные свиньи делокализованы от фаз 1 и 2.
Состояние здоровья: РРСС, микоплазма, АПП, грипп, положительный результат на чесотку и илеит, и отрицательный результат на ринит и болезнь Ауески.
Свиней вакцинировали против ЦВС-2, микоплазмы, РРСС (только ремонтных животных, живой вакциной и ревакцинационной дозой), гриппа, кишечной палочки – клостридий, парвовируса – рожи (вакцинация в возрасте 6 месяцев и ревакцинация для ремонтных свинок, и одна доза на 7-й день лактации для многоплодных свиноматок).
Ремонтные животные: обычно ремонтные свинки массой 100 кг (45% ежегодно) до конца 2013 года. В начале 2014 года было принято решение закупить племенных свиноматок; таким образом, 100 - килограммовые животные все еще покупались на протяжении 2014 года до начала 2015 года, когда ферма стала в состоянии обеспечивать себя собственными ремонтными животными.
Первое проявление заболевания
В марте 2014 г. к нам обращается встревоженный фермер, описывая клиническую картину выкидышей в последней трети беременности, слабых новорожденных поросят, мертворожденных, мумифицированных поросят, агалактии, свиноматок с лихорадкой и маленькими пометами.

Фото 1. Выкидыш в загоне для опороса.

Фото 2. Положение поросят, чья свиноматка прекратила производство молока и обнаружила лихорадку.

Фото 3. Выкидыш на 30-й день по причине лихорадки.
Мы немедленно отправились туда из-за серьезности клинической картины.
Мы замечаем очень большое количество выкидышей, около 30% в 4-х последовательных еженедельных партиях. У недавно опоросившихся многоплодных свиноматок наблюдается острая агалактия, а также увеличение числа слабых, мумифицированных, мертвых и нежизнеспособных поросят, что приводит к снижению количества поросят-отъемышей от одной опоросившейся свиноматки с 11,5 до 3,2. Эта ситуация продолжалась с понижающейся степени тяжести в течение 1 месяца. Как оказалось, заболевание оказывает воздействие на ремонтных свинок и многоплодных свиноматок в той же степени. Что касается анализа клинической картины в зависимости от цикла, то существует разница, которая, на мой взгляд, весьма назидательна.
Признаки у ремонтных свинок включали несколько живорожденных, некоторое количество ослабленных поросят и мумий разных размеров, без каких-либо случаев отхода от обычной агалактии, в то время как клиническая картина у многоплодных свиноматок прекрасно согласовалась с инфекцией РРСС: мертворождения, слабые поросята, крупные и одного размера мумифицированные поросята, агалактия, свиноматки с лихорадкой и высокой смертностью у поросят.

Фото 4. Помет из нежизнеспособных поросят из-за инфекции вируса РРСС.

Фото 5. Положение голодного поросенка из-за гипогалаксии свиноматки.
Подозревается и парвовирус, и вирус РРСС, так что тестирования проводятся у симптоматических многоплодных свиноматок и у ремонтных свинок.
Средние результаты у ремонтных свинок
- Титр парвовируса: 1: 20,000
- Титр вируса РРСС: 1: 60
- Анализ мумий поросят:
- Парвовирус +
- ПЦР вируса РРСС -
- Парвовирус +
Средние результаты у многоплодных свиноматок
- Титр парвовируса: 1:300
- Титр вируса РРСС: переменный показатель, но ПЦР +
- Анализ поросят:
- Парвовирус -
- ПЦР вируса РРСС +
- Парвовирус -
Изначально казалось ясным, что причиной наличия мумифицированных плодов у ремонтных свинок была рециркуляция парвовируса, к тому же казалось, что они были защищены от вируса РРСС. Тем не менее, ситуация с многоплодными свиноматками была прямо противоположной, то есть, они были подвержены вирусу РРСС и защищены от парвовируса.
Почему это происходило?
Учитывая, что многоплодные свиноматки не были вакцинированы против вируса РРСС, а циклическая вакцинация защищала их от парвовируса, их симптомы прекрасно объясняются рециркуляцией вируса РРСС.
Что касается ремонтных свинок, они были защищены от вируса РРСС в результате вакцинации до вовлечения их в производственный процесс, но почему они не были защищены от парвовируса, если и вакцинация, и ревакцинация были применены до начала их эксплуатации?
Был возможен только один ответ: интерференция с материнскими антителами.
Были немедленно взяты образцы крови у вновь прибывших ремонтных животных, которые подтвердили наши подозрения: титры были очень высокими до семимесячного возраста, что привело к интерференции с введенной вакциной.
- Вирус РРСС: поголовная вакцинация и ревакцинация на 21 день живой вакциной, затем циклическая вакцинация на 90-й день беременности инактивированной вакциной. Алгоритм действий, применяемый в настоящее время: поголовная вакцинация против вируса РРСС живой вакциной два раза в год; плюс инактивированная вакцина на 90-й день беременности. Ремонтные свинки получают две дозы живой вакцины против вируса РРСС и вовлекаются в производственный процесс через 50 дней после последней дозы.
- Парвовирус: .Вакцинация откладывается как можно дольше для ремонтных животных, которые в конечном итоге получают 3 дозы с 21-дневными интервалами до их первого использования. Ремонтные свинки, которые уже были беременными, были вновь вакцинированы и ревакцинированы против парвовируса.
- Были улучшены все нормы биологической безопасности.
- Перемещения в период лактации были сведены к минимуму..
- Передвижение поросят было ограничено для их развития , внося ясность, что маленькие поросята не должны задерживаться для их совместного содержания с более молодыми животными, пока они не достигнут желаемого веса.
Дальнейшая разработка проблемы
Принятые меры работали очень хорошо. Производство постепенно приходило в норму, но возникла непредвиденная ситуация: 20% многоплодных свиноматок стали приносить мумифицированных поросят разных размеров в течение лета 2014 года; количество мумифицированных поросят увеличилась с 1% до 5%.

Фото 6. Мумии различных размеров, появившиеся в результате инфекции парвовируса, и преждевременный опорос, вызванный вирусом РРСС в блоке для опороса.
После того, как пострадавших свиноматок отследили в производительной системе, было установлено, что почти все они были свиноматками, которые имели поздние выкидыши или которые были оставлены без поросят по причине рециркуляции вируса РРСС и опоросов с низким числом родившихся живыми из-за парвовируса.
Ответ заключается в том, что они не были привиты против парвовируса на 7-й день лактации, потому что к тому времени от них отлучили поросят , поэтому они прошли невакцинированными почти через два цикла, и титры вакцины не могли защищать их так долго. Титры вакцины могут сохраняться в течение 4-5 месяцев, и материнские титры в течение 6 месяцев; титры от полевых вирусных инфекций сохраняются более двух лет, а материнские титры могут присутствовать вплоть до 9 месяцев. После этого события все вернулось в нормальное состояние.
Что мы узнали из этого случая болезни?
- Очень важно не ослаблять стандарты в области биологической безопасности, как только на ферме достигается стабильность на высоком уровне в отношении РРСС, и его изолированности бывает достаточно, чтобы сдерживать его подобным образом, потому что через несколько дней ситуация может быть совершенно иной.
- Даже если случается рециркуляция вируса РРСС, есть вероятность, что не все проблемы на ферме могут быть отнесены на счет этого вируса. Ситуация должна быть оценена должным образом, и должна быть достигнута правильная постановка дифференциального диагноза и проведена проверка результатов лабораторных анализов.
- Важно проверить уровень материнских антител против парвовируса у ремонтных свинок, так как они могут препятствовать схемам вакцинации и эффективности. Принятие вещей само собой разумеющимися приводит к ошибкам более чем в одном случае.
- Мы должны принимать во внимание, что все эти свиноматки, у которых отнимают поросят до того дня, когда проводится циклическая вакцинация (в данном случае на 7-й день лактации) должны быть вакцинированы против парвовируса. Последствия становятся более серьезными, если число невакцинированных свиноматок велико (20%), а тем более, если есть рециркуляция вируса РРСС, как это имело место на этой ферме.
Читайте также:


