Остеомиелит новорожденных внутриутробная инфекция
7. 3. ПАТОГЕНЕЗ И ФАКТОРЫ РИСКА РАЗВИТИЯ ОСТРОГО ГЕМАТОГЕННОГО ОСТЕОМИЕЛИТА
В настоящее время установлено, что ключевым звеном патогенеза ост-рого гематогенного остеомиелита является формирование очага острого вос-паления в кости, который чаще локализуется в метафизарном отделе и харак-теризуется комплексом стандартных сосудистых и тканевых изменений.
Формирование систематизированных представлений об этиологии и патогенезе ОГО началось с сосудистой или эмболической теории, предло-женной в 1884г. E. Lexer. Он считал, что большое значение в возникновении и развитии остеомиелита у детей имеют анатомические возрастные особен-ности кровоснабжения и строения костей. Кости имеют грубоволокнистое, сетчатое строение; межуточное вещество состоит из переплетающихся в раз-ных направлениях пучков, между которыми располагаются крупные костные клетки. Губчатое вещество рыхлое, с широкими сосудистыми промежутками. Характерна обильная васкуляризация костей; многочисленные артерии име-ют широкий диаметр. Кровоснабжение длинных трубчатых костей у детей осуществляется тремя системами сосудов: диафизарной, метафизарной и эпифизарной. Около эпифизарной линии (наиболее частая локализация очага ОГО) сосуды в растущей кости оканчиваются слепо, не соединяясь друг с другом. Автор считал, что наличие густой сети способствует значительному замедлению тока крови и механической задержке бактериального эмбола в одном из концевых сосудов. Осевший эмбол вызывает нарушение крово-снабжения, развитие воспаления и некроз костной ткани.
Указанная точка зрения нашла продолжение в работах ряда современ-ных авторов, придерживающихся теории бактериальной эмболии (Щитинин В.Е. и соавт., 2000). Бактериологическое исследование костномозгового пунктата позволило сделать заключение о том, что микробная обсеменен-ность не измененных ранее отделов костномозговой полости исходит из ос-новного очага в метафизе. Именно отсюда идет заброс инфекта в ниже- и вышележащие отделы кости, которым соответствуют границы отека мягких тканей.
Однако особенности кровоснабжения метаэпифизарных зон трубчатых костей, обеспечивающих специфическое распространение возбудителя при остром гематогенном эпифизарном остеомиелите, нивелируются к 1-2 годам жизни, что и отличает остеомиелит у детей раннего возраста от такового у старших.
Нервно-рефлекторная теория хорошо описывает влияние внутрикост-ного очага на ЦНС, сердечно-сосудистую систему, механизмы воспалитель-ной реакции и т.п., но не объясняет главного звена патогенеза – первичные причины возникновения патологического процесса в кости.
Вышеуказанная нервно-рефлекторная теория патогенеза ОГО находит подтверждение в последующих работах отечественных и зарубежных авто-ров, рассматривающих закономерности развития типовых патологических процессов в нервной системе, в частности, формирование и активацию пато-логической детерминанты на фоне разнообразных афферентных воздействий (Крыжановский Г. Н., 1996).
Согласно концепции Г.Н. Крыжановского (1996г.) в основе нейроген-ных расстройств при различных формах патологии инфекционной и неин-фекционной природы лежит формирование генераторов патологически уси-ленного возбуждения. К числу воздействий, вызывающих формирование ге-нераторов патологически усиленного возбуждения, относятся физические, химические факторы, рубцовые деформации, а также каскад ферментов гид-ролиза фосфолипидов, избыточного образования арахидоновой кислоты и ее метаболитов. Эти процессы активируются в условиях тромбоза, ишемии ко-стной ткани в динамике развития острого гематогенного остеомиелита. Кро-ме того, возникновению генераторов патологически усиленного возбуждения способствуют эндогенные биологически активные вещества: прооксиданты, гидроперекиси, продукты фосфолипазного гидролиза, усиленное перекисное окисление липидов, оксид азота.
Необходимые пусковые условия для развития острого воспаления ко-стного мозга хорошо обоснованы, по нашему мнению, аллергической теори-ей С.М. Дерижанова (1937-1940 гг.). С.М. Дерижанов впервые в мире полу-чил экспериментальную модель гематогенного остеомиелита, полностью идентичную клиническим формам заболевания по механизму возникновения и клинико-морфологическим проявлениям. Область поражения кости опре-делялась локализацией травматического воздействия. С.М. Дерижанов свои-ми опытами показал, что в патогенезе остеомиелита важная роль принадле-жит повышенной реактивности и сенсибилизации организма.
Необходимо отметить, что наиболее значимыми факторами риска раз-вития ОГО у детей младшего возраста являются: неблагоприятный премор-бидный фон (гнойно-воспалительные заболевания матери, отягощенная бе-ременность и роды, внутриутробная гипоксия и внутриутробное инфициро-вание плода), перинатальное поражение центральной нервной системы, инва-зивные медицинские манипуляции в раннем постнатальном периоде (рис.7.2) (Миронов П.И., Хуссамова Н.Р., 2002; Морозова О.Л., Чеснокова Н.П. и со-авт., 2004; Lamprecht E., 1997).
В настоящее время доказано, что имеется пять основных путей про-никновения возбудителя в организм плода: восходящий (через родовые пу-ти), трансплацентарный, гематогенный, нисходящий (из воспалительно-изменен-ных придатков матки, аппендикса), смешанный (Айламазян Э.К., 1995). С помощью методов антенатальной диагностики подтверждено транс-плацентарное вовлечение скелета плода в инфекционный процесс во время внутриутробного развития (при наличии очагов инфекции у беременной женщины) (Wathne K.O., Babovic A., Nordshus T., 2001).
Данные литературы свидетельствуют о том, что воспаление как типо-вой неспецифический комплекс сосудистых и тканевых изменений еще не сформирован на ранних этапах эмбриогенеза. В период формирования бла-стулы, эмбрио- и трофобласта действие экзогенных раздражителей инфекци-онной природы приводит к гибели зародыша или к частичному повреждению его структуры с последующим формированием множественных пороков раз-вития (Серов В.В., Пауков В.С., 1995).
Продуктивный компонент воспалительной реакции начинает формиро-ваться в конце эмбриогенеза и в начальный период фетогенеза. В случае воз-действия инфекционного патогенного фактора на материнский организм и плод в этот период возникают процессы фиброза паренхиматозных органов, фиброэластоза миокарда, пролиферации миелоидной ткани.
В позднем фетальном периоде еще не окончательно сформированы ме-ханизмы развития воспаления у плода. В ответ на внутриутробное инфици-рование у плода развиваются альтеративно-пролиферативные изменения. К ним присоединяются типовые нарушения со стороны микроциркуляторного русла. Однако характерной особенностью воспалительного процесса в фе-тальном периоде является отсутствие эффективных местных и системных специфических и неспецифических механизмов защиты, обеспечивающих формирование барьеров. Последнее определяет быструю генерализацию ин-фекции при внутриутробном инфицировании.
Внутриутробная инфекция является одной из причин перинатального развития ОГО у детей до трех месяцев, генерализации воспалительного процесса и летальных исходов, что связано с устойчивой тенденцией к ухудшению здоровья населения. Патогенной для плода может стать любая (даже сапрофитная) флора, попавшая в кровеносное русло материнского ор-ганизма эндогенным или экзогенным путем (внесение при медицинских ма-нипуляциях) (рис.7.2).
Рис.7.2. Факторы риска развития острого гематогенного остеомиелита у детей младшего возраста
Следует отметить, что аутогенные (эндогенные) источники микрофло-ры (пупочная ранка и пупочные сосуды, легко ранимая кожа, слизистые обо-лочки дыхательных путей и пищеварительного тракта) являются одним из факторов риска развития ОГО. По мнению ряда исследователей, для развития ОГО у новорожденных необходимы, прежде всего, высокий уровень одно-моментной контаминации (например, в родах или во время реанимационных мероприятий) или формирование в организме ребенка резервуара условно – патогенной флоры, откуда в последующем происходит проникновение воз-будителя в метафиз и эпифиз кости гематогенным или лимфогенным путем.
Однако в большинстве случаев воспаление костей новорожденного развивается в постнатальном периоде в результате бактериемии, обусловлен-ной внедрением микроорганизмов через пупочную ранку или после катете-ризации пупочной вены (Альес В.Ф., Миронов П.И., Шадчнев А.П., 2002; Морозова О.Л., Чеснокова Н.П., Гисак С.Н. и соавт., 2004).
Известно, что у детей первых месяцев жизни имеются несостоятель-ность многих механизмов саногенеза и превалирование системных реакций организма над местными, то есть факторами риска развития ОГО могут быть следующие:
1. Преобладание альтеративного и продуктивного компонентов воспале-ния, недостаточность процессов экссудации и связанных с ней механизмов защиты.
2. Недостаточность фагоцитоза в связи с незрелостью рецепторного аппа-рата мембран фагоцитов, отсутствием достаточного количества опсонинов и хемоаттрактантов, в роли которых выступают комплемент и иммуноглобу-лины. В связи с этим не формируются нейтрофильный и моноцитарный барь-еры, обеспечивающие элиминацию инфекционных возбудителей за счет про-цессов килинга и переваривания в фаголизосомах.
3. Недостаточный синтез в печени плазменных факторов свертывания крови, поэтому отмечается относительное преобладание антикоагулянтных механизмов, а соответственно, резкое угнетение процессов тромбообразова-ния в кровеносных сосудах и фиксации патогенного агента в зоне его иноку-ляции.
4. Врожденная или приобретенная недостаточность специфических меха-низмов защиты.
Так, многими исследователями отмечается, что имеющиеся у новорож-денного физиологические изменения иммунологической реактивности явля-ются предрасполагающими факторами для развития воспалительного про-цесса, в частности, для острого гематогенного остеомиелита. У детей первого месяца жизни низка цитотоксическая активность Т- лимфоцитов и естествен-ных киллеров, наблюдаются функциональный дисбаланс отдельных субпо-пуляций Т- лимфоцитов, несоответствие супрессорной или хелперной функ-ции клеток (Цуман В.Г. и соавт., 2001; Зафранская М.М. и соавт., 2002). Осо-бенности регуляции межклеточного взаимодействия в иммунном ответе у новорожденных обусловлены ограниченной продукцией интерлейкинов и интерферона. В то же время у детей первых месяцев жизни имеется выра-женное ослабление процессов активации системы комплемента, в частности его альтернативного пути (дефицит фактора В и пропердина) (Володин Н.Н., Дегтярев М.В. и соавт., 2001).
Количество В- лимфоцитов у детей первых месяцев жизни повышено по сравнению со взрослыми, но функциональная активность их резко сниже-на (только ограниченное число В–лимфоцитов способно к синтезу и секре-ции иммуноглобулинов класса М). Гуморальный иммунитет обеспечивается материнскими антителами, относящимися к классу Ig G. Миграционная ак-тивность лейкоцитов снижена и достигает значений, сопоставимых с под-вижностью лейкоцитов взрослых, через 3 недели после рождения. Таким об-разом, период новорожденности является первым критическим периодом, ко-гда организм встречается с большим количеством антигенов, а иммунная система подвержена сильным супрессорным влияниям, поэтому отмечается склонность к генерализации микробно-воспалительных процессов.
Очевидно, что воздействие инфекционных патогенных факторов на макроорганизм не всегда приводит к развитию инфекционного процесса. Лишь в случае формирования первичного или вторичного А-, В-, Т-зависимого иммунодефицита, комбинированной недостаточности специфи-ческих им-мунных механизмов защиты или неспецифических факторов рези-стентности, прорыва гистогематических барьеров возникает активизация па-тогенной и условно-патогенной микрофлоры, создаются условия для диссе-минации инфекции, а в ряде случаев - и для развития септического состоя-ния.
Таким образом, анализ данных литературы и результаты собственных исследований свидетельствуют о том, что основными этиологическими фак-торами и факторами риска, обусловливающими и предопределяющими ком-плекс локальных деструктивных и системных метаболических расстройств при ОГО у детей младшего возраста, являются:
1. Цитотоксическое воздействие инфекционных возбудителей на орга-низм ребенка, факторов патогенности и продуцируемых ими токсинов в зоне инокуляции.
2. Отсутствие или недостаточность нормальной микрофлоры у ребенка в момент инфицирования, обеспечивающей подавление патогенного конку-рентного штамма возбудителя.
3. Неблагоприятный преморбидный фон (наличие очагов гнойной ин-фекции у матери, осложненное течение беременности и родов, сопровож-дающиеся кровопотерей, травмой, инфицированием плода).
4. Высокий уровень одномоментной контаминации ребенка в постна-тальном периоде при инвазивных медицинских манипуляциях.
5. Недостаточность специфических иммунологических механизмов за-щиты в виде врожденного или приобретенного иммунодефицита по Т-, В-системам лимфоцитов, или комбинированной форме иммунопатологии.
6. Недостаточность неспецифических факторов резистентности.
7. Недостаточность механизмов формирования типовых патологических процессов, в частности воспаления, обеспечивающих инкапсуляцию и инак-тивацию инфекционных патогенных факторов в очагах инфекции.
8. Воздействие на организм ребенка стрессорных патогенных факторов неспецифического характера (травма, переохлаждение и т.д.), развитие реак-ции дезадаптации в виде универсального лизиса лимфоидной ткани и недос-таточности специфического иммунного ответа.

Гематогенный остеомиелит – одно из самых тяжелых гнойно-септических заболеваний, приводящих при несвоевременной диагностике и неадекватном лечении к развитию тяжелого сепсиса с полиорганной недостаточностью, септическому шоку и летальным исходам [3]. Совершенствование методов диагностики и лечения позволили снизить летальность при остром гематогенном остеомиелите до 0,5-2,7 % [1, 4] и хронизацию процесса до 3,1 % [4, 5], но по-прежнему при данной патологии достаточно часто встречаются ортопедические осложнения [2,5].
Диагностика острого гематогенного остеомиелита у детей в ранние сроки заболевания представляет определенныетрудности, поэтому наряду с общепринятой диагностикой очень важным является использование современных неинвазивных методов диагностики (УЗИ,КТ) [5].
Цель исследования: определение наиболее значимых критериев диагностики, выявление наиболее частой локализации процесса и особенностей клинического течения, оценка эффективности комплексного лечения гематогенного остеомиелита у детей.
Материалы и методы исследования
Работа основана на анализе результатов диагностики, клиники и лечения 83 детей в возрасте от периода новорожденности до 15 лет с острым гематогенным остеомиелитом, находившихся на лечении в детском гнойном хирургическом отделении ГБУЗ СО СОКБ им. В.Д. Середавина (г. Самара) за последние 4 года. Всем детям проводилось клиническое обследование, лабораторные, ультразвуковые, рентгенологические методы исследования. Комплексное лечение включало в себя хирургическое вмешательство и интенсивную терапию.
Результаты исследования и их обсуждение
От периода новорожденности до 2 лет на лечении находилось 13 пациентов, из них 5 новорожденных; от 3 лет до 15 – 70 детей.
Локализация процесса при остром гематогенном остеомиелите:
– бедренная кость – 28 детей;
– большая берцовая – 21 ребенок;
– плечевая кость – 13 детей;
– кости предплечья – 10 детей;
– кости стопы – 7 детей;
– седалищная кость – 3 ребенка;
– надколенник – 1 ребенок.
Дети в возрасте от 3 до 15 лет предъявляли жалобы на боли в пораженной конечности, нарушение функции конечности (ограничение подвижности), повышение температуры тела до фебрильных значений (до 38-39 °С), слабость, утомляемость. При клиническом обследовании у детей с поражением длинных трубчатых костей отмечалось вынужденное положение конечности; у 21 ребенка (экстрамедуллярная фаза) выявлены признаки флегмоны мягких тканей (припухлость, гиперемия, болезненность при пальпации, местная гипертермия, флюктуация); в 27 наблюдениях (интрамедуллярная фаза) отмечался незначительный отек мягких тканей, расширение подкожных вен, болезненность при перкуссии, ограничение подвижности и усиление боли в конечности при попытке пассивных движений. Лабораторные данные указывали на выраженные признаки воспаления (лейкоцитоз до 19х109 г/л, повышение С-реактивного белка до 100 мг/л, повышение РСТ более 5 нг/мл). Изменения на рентгенограммах костей выявлялись лишь к концу 2 недели от начала заболевания (периостит, очаги деструкции) и поэтому не могли служить критериями ранней диагностики. Ультразвуковое исследование, проведенное у пациентов с интрамедуллярной фазой, позволило при поражении бедренной и плечевой костей выявить уже на 3-5 день от начала заболевания увеличение объема и снижение эхогенности мышц. Компьютерная томография (КТ), выполненная у 8 пациентов с острым гематогенным остеомиелитом в возрасте от 3 до 15 лет, выявила на 3-4 сутки от начала заболевания отек мышц в области поражения и утолщение надкостницы.
У 57 детей с острым гематогенным остеомиелитом диагностирован синдром системного воспалительного ответа, в 3 наблюдениях – сепсис (септикопиемическая форма по Т.П. Краснобаеву).
Лечение детей с острым гематогенным остеомиелитом было комплексным и включало хирургическое вмешательство, иммобилизацию, антибактериальную терапию, адекватное патогенетическое воздействие, симптоматическое лечение.
Хирургическое лечение у детей в возрасте от периода новорожденности до 2 лет заключалось в большинстве наблюдений в пункции сустава и иммобилизации (повязка Дезо, вытяжение по Шеде) – 6 пациентов. Двум детям выполнены артротомии, дренирование суставов, иммобилизация. Трем пациентам этой возрастной группы произведены артротомия, вскрытие параартикулярной флегмоны, остеоперфорация метафиза и иммобилизация. Двое недоношенных детей с внутриутробной инфекцией получали консервативное лечение.
Детям в возрасте от 3 до 15 лет при остром гематогенном остеомиелите длинных трубчатых костей в 21 наблюдении (больные с интрамедуллярной фазой остеомиелита), выполнена остеоперфорация с введением в костно-мозговой канал внутрикостных игл для последующего введения антибиотиков. При экстрамедуллярной фазе процесса (27 детей) произведено вскрытие флегмоны мягких тканей и дренирование, остеоперфорация с введением внутрикостных игл. При других локализация процесса (седалищная кость, надколенник, кости стопы) выполняли вскрытие и дренирование гнойного очага. У всех детей после оперативного вмешательства производили иммобилизацию, необходимую для данного вида поражения с использованием современных фиксирующих материалов.
Во время пункции сустава, операции полученный гной обязательно брали на посев для идентификации микробной флоры и определения ее чувствительности к антибиотикам. У детей от периода новорожденности из патологического очага во всех наблюдениях высеян золотистый патогенный стафилококк. У детей более старшего возраста отмечалось преобладание золотистого стафилококка (35 наблюдений), у 5 пациентов из очага выделен эпидермальный стафилококк, в 3 – пиогенный стрептококк, в 9 – грамотрицательная флора (протей, кишечная палочка, энтеробактер, ацинетобактер), в 18 наблюдениях роста микрофлоры не получено.
При назначении первого курса антибиотиков использовали эмпирический принцип, отдавая преимущество препаратам из группы цефалоспоринов II и III поколения и аминогликозидов. Назначая последующие курсы антибактериального лечения ориентировались на результаты полученных посевов и наличие у препаратов тропности к костной ткани.
С целью патогенетического воздействия в комплексное лечения детей с острым гематогенным остеомиелитом были включены антикоагулянты, дезагреганты, протеолитические ферменты, иммунопрепараты. Симптоматическая терапия заключалась в назначении обезболивающих и противовоспалительных препаратов. Все пациенты с острым гематогенным остеомиелитом получали адекватную инфузионную терапию, направленную на восполнение объема циркулирующей крови и дезинтоксикацию. В комплексное лечение входили сеансы гипербарическойоксигенации (ГБО-терапия). Больным с сепсисом применяли экстракорпоральную детоксикацию (гемофильтрацию).
При стабилизации состояния больным назначали физиолечение: магнитные поля, электрофорез с антибактериальными препаратами ,хлоридом кальция.
Все дети выписаны в удовлетворительном состоянии.
Летальнывх исходов не было. В двух наблюдениях процесс перешел в хроническую стадию. Всем детям старше 3 лет рекомендовано санаторно-курортное лечение в местном профильном санатории. Всем пациентам рекомендовано диспансерное наблюдение.
1. Острый гематогенный остеомиелит – тяжелая гнойно-септическая патология, поражающая детей всех возрастных групп.
2. При ОГО у детей чаще всего поражаются длинные трубчатые кости.
3. Острый гематогенный остеомиелит у детей разных возрастных групп имеет определенные особенности течения.
4. В ранней диагностике острого гематогенного остеомиелита важная роль принадлежит малоинвазивным методам – УЗИ и КТ.
5. Залогом успешного лечения острого гематогенного остеомиелита являются своевременная диагностика и адекватное патогенетически обоснованное лечение.
6. Дети, перенесшие ОГО, должны обязательно находиться на диспансерном учете для решения вопроса о дальнейшей реабилитации.



Острый гематогенный метаэпифизарный остеомиелит (МЭО) у детей ранней возрастной группы продолжает оставаться тяжелым гнойно-септическим заболеванием в педиатрической хирургической практике [1,2]. В последнее десятилетие он занимает одно из первых мест в гнойно-септической хирургии по частоте исхода в бактериальный сепсис. Динамика количества случаев заболевания не имеет четкой тенденции к снижению, что подтверждается высокой частотой встречаемости патологического процесса среди новорожденных, в т.ч. маловесных недоношенных детей, имеющих ряд физиологических и иммунологических особенностей, усугубляющих тяжесть течения заболевания [3]. Значимым в этиологии является патоморфоз возбудителей последнего десятилетия, характеризующийся уменьшением частоты роста культур моностафилококковой флоры (Stafilococcusaureus) до 50 %. Отмечается активный рост микст-культур эпидермального стафилококка с другими микроорганизмами (клебсиеллами, энтерококками), их ассоциации с анаэробами и культурами грибов рода Кандида [4]. Многообразие клинических проявлений процесса и наличие атипичных форм могут увести от своевременной постановки диагноза МЭО. Этиопатогенез заболевания отличается тем, что до оссификации эпифизов имеет место морфофункциональная незрелость ростковой зоны, хондробласты расположены хаотически, их упорядочивание происходит параллельно оссификации эпифиза (от центра зоны роста в направлении к периферии), и в соответствии с этим зона роста постепенно приобретает барьерные свойства. Вот почему при отсутствии ядра окостенения, воспалительный процесс пенентрирует зону роста в центральной части, при появлении ядра оссификации пенентрация происходит в периферической части.
Поражение эпифиза сопровождается деструкцией последнего, с вовлечением в патологический процесс сустава и возникновением артрита, который в свою очередь приводит к патологическому вывиху и параартикулярной флегмоне. Дискредитированная ростковая зона частично или полностью погибает, и это в дальнейшем обусловливает возникновение приобретенных пороков развития (укорочение или удлинение, деформации конечностей).
Таким образом, исходом заболевания могут быть ортопедические осложнения, влекущие инвалидизацию ребенка, от 10 до 40 % случаев. МЭО представляет собой один из наиболее сложных вариантов течения гнойно-воспалительного процесса, требующего детального анализа течения заболевания, а также применения доступных для использования эффективных методов диагностики [5].
Цель исследования: изучить особенности клинического течения метаэпифизарного остеомиелита, провести сравнительный анализ возможностей различных методов диагностики.
Материалы и методы
В исследование включено 64 ребенка в возрасте от 0 до 3-х лет с острым гематогенным метаэпифизарным остеомиелитом, находившихся на стационарном лечении по поводу данного заболевания в отделении гнойной и экстренной хирургии ДОКБ г. Твери с 2005 по 2015 г. Для уточнения особенностей клинического течения различных форм МЭО был проведен анализ результатов стандартного комплекса клинико-диагностических мероприятий, проведенного у всех поступивших. Диагноз ставился на основании анализа жалоб больного, данных анамнеза, клинического осмотра, использовались методы бактериологической и лабораторной диагностики, методы медицинской визуализации (рентгенография, ультразвуковое исследование, компьютерная томография, магнитно-резонансная томография).
Результаты исследования и их обсуждение
В структуре обследуемых больных наибольшую группу составили дети до 1 года (n=4875 %), наиболее часто заболевание возникало в возрасте до 1 месяца (n=30; 46.8 %), от 1 г. до 3-х лет госпитализировано 16 (25 %) детей (таблица 1).
Число пациентов, n
От 1 месяца до 1 года
От 1 года до 3-х лет
По половой принадлежности преобладали мальчики (n=39; 60.9 %). Больные из районов области составили 60.9 % (n=39). В первые трое суток болезни был госпитализирован 21 ребенок (32.8 %). Наибольшее число пациентов (n=33; 51.5 %) обратилось за помощью детского хирурга на 4–7 сутки заболевания. Оставшиеся в более поздние сроки (n=10; 15.5 %). Анализ сроков поступления в специализированный хирургический стационар выявил достаточно позднее обращение за медицинской помощью, что связано с трудностями ранней диагностики МЭО из-за многообразия клинических проявлений заболевания, отсутствия ранних патогномоничных жалоб, преобладания у малышей общих реакций над местными, особенностями психофизиологического статуса пациентов раннего возраста. Немаловажная роль принадлежит ошибкам диагностики на догоспитальном этапе. Учитывая распределение больных по месту обращения, замечено, что достаточно большая группа детей поступала из род. домов (n=17; 26.5 %), из стационара (отделение патологии новорожденных) – (n=21;32.8 %). По направлению участковых педиатров, хирургов травматологов (n=23;35.9 %), 3 человека обратились самостоятельно.
Для характеристики клинического течения МЭО использовалась классификация Т.П. Краснобаева. Встречалась местная форма (n= 53;82.8 %) заболевания, септикопиемическая (n= 11; 17.2 %), токсическая форма не зарегистрирована. Из септических осложнений на первом месте оказалась пневмония (n= 6;54.5 %). Также имели место перикардит (n=3;27.2 %), поражение почек (n=1; 9 %), средний гнойный отит (n=1;9 %). Локальная форма заболевания превалировала в возрастной группе от 1 г. до 3-х лет. Результаты оценки степени тяжести состояния показали, что дети поступали в стационар преимущественно в состоянии средней степени тяжести (n=36;56.2 %). В тяжелом состоянии доставлено 28 детей (43.7 %). Это связано с поздним обращением за специализированной хирургической помощью, низкой иммунологической резистентностью детского организма, быстрым нарастанием симптомов интоксикации ввиду выраженности альтеративного компонента воспалительной реакции в раннем возрасте. Дети, поступившие в тяжелом состоянии, были госпитализированы в отделение реанимации, где проводилось непрерывное мониторирование жизненно важных функций организма и интенсивная комплексная терапия заболевания. В типичных случаях заболевание начиналось остро: (n=52; 81.2%), возникала резкая боль в пораженной конечности (n= 49; 76.5 %). Появлялись и нарастали симптомы интоксикации: повышение температуры тела (n=60; 93.7 %), вялость, отказ от еды (n= 44; 68.7 %). В тяжелых случаях возникала тахикардия (n=9; 14 %), тахипноэ (n=8; 12.5 %) менингеальные явления (n=4; 6.25 %).
При клиническом осмотре обращало на себя внимание вынужденное положение конечности, ограничение или отсутствие активных движений, болезненность при пальпации и попытке пассивных движений. (n=56; 87.5 %), отмечалась выраженная стойкая контрактура суставов (n=48; 75 %), что связано с вовлечением в процесс связочного аппарата и параартикулярных тканей. В более поздние сроки появлялось увеличение объема сустава из-за наличия в его полости жидкости (2–5 сутки и позже), гиперемия над очагом поражения –(n= 43; 67 %).
Факторы риска развития заболевания выявлены в 34 (53.1 %) случаях. Это –неблагоприятный антенатальный период: внутриутробная гипоксия плода разной степени выраженности, очаги хронической инфекции, синдром интоксикации у матери, оперативные роды, травматизация в родах, недоношенность, перинатальное поражение ЦНС, катетеризация центральной вены, низкая оценка по шкале Апгар, предшествующие гнойные заболевания. Важная роль отводится гипоксии не только как промоутеру каскада метаболических нарушений, но и фактору, способствующему развитию генерализованных форм МЭО. Результаты проведенных исследований показали, что у всех больных с септикопиемической формой выявлены факторы риска [6,7].
По локализации остеомиелитического очага преобладало поражение эпифизов длинных трубчатых костей скелета с поражением суставов в виде гнойных артритов: бедренной кости с поражением тазобедренного сустава (n=26;40.6 %), большеберцовой (n=13; 20 %), малоберцовой (n=11; 17.1 %), костей предплечья (n=5;7.8 %). Множественное поражение костей при МЭО отмечено у 2 (3 %) детей.
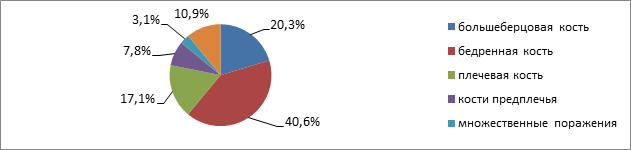
Рис.1. Локализация очага воспаления
С целью выявления этиологического фактора заболевания применялись бактериоскопический и бактериологический методы исследования с определением чувствительности микрофлоры к антибиотикам. При первичном заборе биоматериала идентифицирован возбудитель у 46(71.8 %) больных. Анализ полученных результатов показал, что в большинстве случаев основным этиологическим фактором является золотистый стафилококк (n=28;43.7 %), также были обнаружены другие виды стафилококка (n=4;8.6 %), энтерококк и клебсиелла (n=2;3.1 %) в равных количествах, гемолитический стрептококк (n=3;4,6 %), протей (n=1;1.5 %), кишечная и синегнойная палочка (n=2;3.1 %) и (n=1;1.5 %) соответственно, полифлора (n=3;4.6 %).
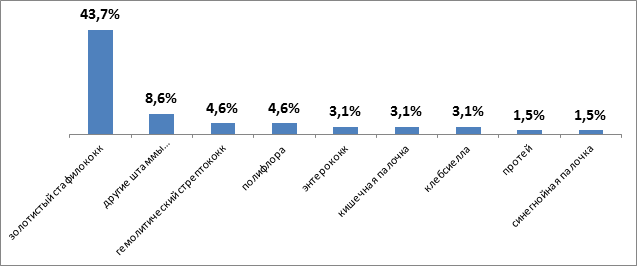
Рис. 2. Результаты высева микрофлоры из очага поражения
При анализе изменений состава периферической крови, констатирована анемия (n= 34;53.1 %), лейкоцитоз (n= 57;89 %), палочкоядерный сдвиг (n= 49; 76.5 %), ускорение СОЭ (n=28; 43.7 %). У больных с септикопиемической формой регистрировалась тромбоцитопения (n=11;7.2 %) у большинства пациентов имелись признаки системного воспалительного ответа (нейтрофильный лейкоцитоз со сдвигом формулы влево). В биохимическом анализе крови сохранялась нормогликемия (n=58; 90.6 %). Гипергликемия зарегистрирована с максимальным значением 13 ммоль/л (n=4; 6.25 %). Гипогликемия с минимальным значением 2.8 ммоль/л (n=2; 3.1%). Изменения белкового спектра крови проявлялись умеренной гипопротеинемией (n=29; 45.3 %). Повышение уровня С-реактивного белка как неспецифического маркера воспаления определялось качественным методом, было положительным (n= 44; 68.7 %) и резко положительным (n=13;20.3 %). Также имел место отрицательный результат (n= 7; 10.9 %). Лабораторные показатели, характеризующие функцию почек, оставались в пределах референтных значений. Средние значения электролитного обмена соответствовали возрастной норме. В ряде случаев отмечено изменение фибринолитической активности (n= 24;37.5 %).
В последнее десятилетие МЭО занимает одно из первых мест в гнойно-септической хирургии по частоте исхода в бактериальный сепсис. Для ранней диагностики септического процесса, в случае ухудшения состояния ребенка проводился прокальцитониновый тест сыворотки крови экспресс-методом по Brachms (n= 14; 21 %). Выполнение исследования позволило определить клиническую форму заболевания. В результате была диагносцирована местная форма (n=5;7.8 %) – прокальцитонин сыворотки крови 2 состояние трактовалось как сепсис, осложнивший остеомиелит – (n= 9;14 %).
На диагностическом этапе установления МЭО применяли различные методы медицинской визуализации. В качестве стандартизированного лучевого метода исследования опорно-двигательного аппарата стартовым являлась рентгенография пораженного отдела скелета. (n=64; 100 %). Метод позволял оценить форму, контуры, соотношения между костями. Ранние рентгенологические признаки заболевания в виде утолщения мягких тканей на уровне поражения, расширения суставной щели, размытости контуров эпифиза, остеопороза края метафиза выявлены в среднем на 3–5 день болезни (n=19;29.6 %). На 10–14 день болезни регистрировалась периостальная реакция и очаги деструкции в метаэпифизарной зоне (n= 47; 73.4 %). Рентгенографический метод не обладает достаточной чувствительностью к визуализации хрящевых структур в начальные периоды развития заболевания.
Магнитно-резонансная томография (МРТ) является высокоинформативным методом, обладающим высокой чувствительностью и достаточной специфичностью в интрамедуллярную фазу МЭО, позволяет выявить изменения костного мозга, определить так называемые участки патологической гидратации, а также оценить суставные поверхности и околосуставные мягкие ткани. К недостаткам метода следует отнести необходимость проведения анестезиологического пособия для исключения двигательной активности пациентов младшей возрастной группы во время исследования. МРТ использовали в качестве уточняющей методики в интрамедуллярную фазу (n=4 ;6.25 %) [8].
Компьютерная томография (КТ) – метод выбора для оценки суставных поверхностей, мягких тканей, изменений костного мозга, позволяет выявить отек мягких тканей и деструкцию кости, не замеченную на обычных рентгенограммах, наилучший метод выявления секвестров. КТ недавно внедрена в работу клиники (n=8;12.5 %). Сопряжена с лучевой нагрузкой, зарекомендовала себя как оптимальный способ ранней диагностики МЭО, уже на 2-е сутки заболевания в кортикальном слое проявляются отчетливые рентгенодеструктивные изменения костных структур.
Ультразвуковая диагностика выполнена всем пациентам с МЭО (n=64;100 %), в дебюте заболевания (n=29;45.3 %). Методика показала высокую информативность (80 %), верифицируемую во время операции. Проникающая способность ультразвука у детей раннего возраста большая, чем у более старших, что связано с незавершенным процессом остеогенеза, когда эпифизы костей состоят в основном из хрящевой ткани. Исследование позволило оценить состояние мягких тканей, определить анатомические взаимоотношения в суставе, состояние капсулы (уплотнение и утолщение), суставной полости, ядер окостенения, определить утолщение надкостницы, распознать поднадкостничные абсцессы, визуализировать участки деструкции кости в метаэпифизарной зоне [9,10]. В процессе проведения исследования были обнаружены следующие УЗ-признаки изменения анатомических структур: утолщение мягких тканей, повышение эхогенности, жидкостные парартикулярные скопления (n=32;50 %); изменения внутрисуставной полости (утолщение капсулы сустава, наличие внутрисуставной жидкости – n=39;60.9 %); изменения однородности эпифизарного хряща (n=34;53 %); изменение формы и структуры ядра окостенения эпифизарного конца конечности (n=27;42.1 %); изменения метаэпифизарной зоны (нечеткость, неровность дефект зоны предварительного обызвествления, анэхогенные участки и включения – n=43 67.1 %); изменения надкостницы (неровность наружного контура, утолщение, повышение эхогенности n=25;39 %). Основной УЗ-признак МЭО –изменения в метаэпифизарной зоне – появлялся на 4–7 день болезни.
Выводы и заключение
Т.о., резюмируя полученные результаты, отмечено, что метаэпифизарный остеомиелит наиболее часто встречается в группе новорожденных детей, у каждого из которых обнаружены факторы риска возникновения заболевания в виде внутриутробной гипоксии плода, наличия очагов хронической инфекции и синдрома интоксикации у матери, недоношенности. В большинстве случаев в дебюте заболевания преобладало наличие общей симптоматики. Локальные проявления прогрессировали медленно. Основным этиологическим фактором являлся золотистый стафилококк. Первичный очаг воспаления локализовался преимущественно в эпифизах длинных трубчатых костей нижних конечностей. В ранней диагностике заболевания методом выбора является компьютерная томография и ультразвуковое исследование.
Читайте также:


