Организация работы при исследованиях методом пцр материала инфицированного
Купить МУ 1.3.1794-03 — бумажный документ с голограммой и синими печатями. подробнее
Распространяем нормативную документацию с 1999 года. Пробиваем чеки, платим налоги, принимаем к оплате все законные формы платежей без дополнительных процентов. Наши клиенты защищены Законом. ООО "ЦНТИ Нормоконтроль"
Наши цены ниже, чем в других местах, потому что мы работаем напрямую с поставщиками документов.
- Срочная курьерская доставка (1-3 дня)
- Курьерская доставка (7 дней)
- Самовывоз из московского офиса
- Почта РФ
Определяют принципы организации лабораторий и этапы выполнения ПЦР-анализа: взятие проб, первичная обработка, хранение, условия транспортирования, обеззараживание материала, выведение нуклеиновых кислот, проведение ПЦР (ОТ-ПЦР), учет и регистрация результатов при исследовании биологического материала, пищевых продуктов, материала из объектов окружающей среды.
Взамен МУ 1.3.1794-03 с 5 апреля 2010 г. введены МУ 1.3.2569-09
Оглавление
1 Область применения
2 Нормативные ссылки
3 Общие положения
4 Требования к организации работ
5 Требования к помещению и оборудованию ПЦР-лабораторий
6 Требования к проведению работ
7 Требования к защитной одежде
8 Требования к обработке помещений и обеззараживанию материала
9 Проведение внутрилабораторного контроля
Приложение 1 Принципиальная схема размещения ПЦР-лаборатории
Приложение 2 Примерное размещение оборудования в рабочих зонах ПЦР-лаборатории
Приложение 3 Использование средств индивидуальной защиты в рабочих зонах ПЦР-лаборатории
Приложение 4 Обеззараживание исследуемого материала
Приложение 5 Режимы дезактивации при постановке ПЦР
Приложение 6 Действия при контаминации лаборатории нуклеиновыми кислотами
Приложение 7 Взятие материала на исследование
| Дата введения | 05.12.2003 |
|---|---|
| Добавлен в базу | 01.09.2013 |
| Завершение срока действия | 05.04.2010 |
| Актуализация | 01.02.2020 |
- Раздел Экология
- Раздел 13 ОХРАНА ОКРУЖАЮЩЕЙ СРЕДЫ, ЗАЩИТА ЧЕЛОВЕКА ОТ ВОЗДЕЙСТВИЯ ОКРУЖАЮЩЕЙ СРЕДЫ. БЕЗОПАСНОСТЬ
- Раздел 13.020 Охрана окружающей среды
- Раздел 13.020.99 Охрана окружающей среды, прочие аспекты
- Раздел 13.020 Охрана окружающей среды
- Раздел 13 ОХРАНА ОКРУЖАЮЩЕЙ СРЕДЫ, ЗАЩИТА ЧЕЛОВЕКА ОТ ВОЗДЕЙСТВИЯ ОКРУЖАЮЩЕЙ СРЕДЫ. БЕЗОПАСНОСТЬ
- Раздел Автомобильные дороги
- Раздел 2 Экологические разделы проектной документации
- Раздел 1. Реконструкция и строительство
- Раздел 1. Охрана окружающей среды
- Раздел 1.5. Охрана окружающей среды, прочие аспекты
- Раздел 1. Охрана окружающей среды
- Раздел 1. Реконструкция и строительство
- Раздел 2 Экологические разделы проектной документации
- Раздел Строительство
- Раздел Нормативные документы
- Раздел Нормативные документы органов надзора
- Раздел Нормативные документы Госкомсанэпиднадзора и Минздрава Российской Федерации
- Раздел Нормативные документы органов надзора
- Раздел Нормативные документы
| 05.12.2003 | Утвержден | Главный государственный санитарный врач Российской Федерации |
|---|---|---|
| Издан | Информационно-издательский центр Госкомсанэпиднадзора России | 2004 г. |
| Разработан | Биоком | |
| Разработан | ГНЦ биотехнологии и вирусологии Вектор | |
| Разработан | Противочумной центр Минздрава России | |
| Разработан | ЦНИИ эпидемиологии Минздрава России | |
| Разработан | Центр по генной диагностике особо опасных инфекционных заболеваний Минздрава России | |
| Разработан | Ставропольский научно-исследовательский противочумный институт Минздрава России | |
| Разработан | Иркутский научно-исследовательский противочумный институт Минздрава России | |
| Разработан | Ростовский-на-Дону научно-исследовательский противочумный институт Минздрава России | |
| Разработан | ГИСК им. Л.А. Тарасевича | |
| Разработан | Федеральный центр госсанэпиднадзора Минздрава России | |
| Разработан | Департамент госсанэпиднадзора Минздрава России |
Чтобы бесплатно скачать этот документ в формате PDF, поддержите наш сайт и нажмите кнопку:
Государственное санитарно-эпидемиологическое нормирование
Российской Федерации
Организация работы при исследованиях
методом ПЦР материала, инфицированного
микроорганизмами I - II групп патогенности
Методические указания
МУ 1.3.1794-03
Минздрав России
Москва 2004
Организация работы при исследованиях методом ГЦР материала, инфицированного микроорганизмами I - II групп патогенности: Методические указания. - М.: Федеральный центр Госсанэпиднадзора Минздрава России, 2004.
2. Рекомендованы к утверждению Комиссией по государственному санитарно-эпидемиологическому нормированию при Министерстве здравоохранения Российской Федерации (протокол № 20 от 2 декабря 2003 г.).
3. Утверждены и введены в действие Главным государственным санитарным врачом Российской Федерации, Первым заместителем Министра здравоохранения Российской Федерации Г.Г. Онищенко 5 декабря 2003 г.
4. Введены впервые.
1. Область применения. 2
2. Нормативные ссылки. 2
3. Общие положения. 3
4. Требования к организации работ. 4
5. Требования к помещению и оборудованию ПЦР-лабораторий. 4
6. Требования к проведению работ. 7
7. Требования к защитной одежде. 7
8. Требования к обработке помещений и обеззараживанию материала. 8
9. Проведение внутрилабораторного контроля. 9
Приложение 1. Принципиальная схема размещения ПНР-лаборатории. 9
Приложение 2 Примерное размещение оборудования в рабочих зонах ПЦР-лаборатории. 10
Приложение 3 Использование средств индивидуальной защиты в рабочих зонах ПЦР-лаборатории. 12
Приложение 4 Обеззараживание исследуемого материала. 14
Приложение 5 Режимы дезактивации при постановке ПЦР. 14
Приложение 6 Действия при контаминации лаборатории нуклеиновыми кислотами. 16
Приложение 7 Взятие материала на исследование. 17
санитарный врач Российской Федерации,
Первый заместитель Министра
здравоохранения Российской Федерации
05 декабря 2003 г.
Дата введения: с момента утверждения
Организация работы при исследованиях методом ПЦР материала, инфицированного микроорганизмами I - II групп патогенности
Методические указания
МУ 1.3.1794-03
1. Область применения
1.1. Методические указания предназначены для органов и учреждений государственной санитарно-эпидемиологической службы, а также могут быть использованы юридическими лицами, независимо от организационно-правовых форм и форм собственности, и индивидуальными предпринимателями, выполняющими в установленном порядке работы с объектами и материалами, содержащими или подозрительными на содержание микроорганизмов I - II групп патогенности:
- диагностические (исследование объектов окружающей среды и клинического материала, в том числе от больных с подозрением на ТОРС);
- производственные (работы по производству и контролю генодиагностических препаратов при условии соблюдения требований GMP).
1.2. Методические указания определяют принципы организации лабораторий и этапы выполнения ПЦР-анализа: взятие проб, первичная обработка, хранение, условия транспортирования, обеззараживание материала, выделение нуклеиновых кислот, проведение ПЦР (ОТ-ПЦР), учет и регистрация результатов при исследовании биологического материала, пищевых продуктов, материала из объектов окружающей среды.
1.3. Методические указания регламентируют выполнение исследований с использованием ПЦР-анализа, осуществляемого сертифицированными тест-системами и оборудованием и предусматривающего учет результатов методом электрофореза или габридизационно-ферментного анализа (ГиФА).
2. Нормативные ссылки
2.12. Руководство по профилактике чумы. Саратов: Слово, 1992.
2.14. Инструкция по проектированию санитарно-эпидемиологических станций СН 535-81. М.: Стройиздат, 1982.
3. Общие положения
3.1. Полимеразная цепная реакция (ПЦР) основана на амплификации (многократном увеличении числа копий) фрагмента ДНК-мишени в условиях in vitro и позволяет обнаружить специфичный участок генома микроорганизма.
3.2. Аналитическая чувствительность тест-систем для выявления ДНК (РНК) микроорганизмов методом ПЦР составляет 1 × 10 2 - 1 × 10 4 м.к. (геномных эквивалентов)/мл, специфичность - 85 - 100 %, возможно исследование любого биологического материала и объектов окружающей среды, время выполнения анализа 4 - 8 ч.
3.3. Для выявления ДНК (РНК) микроорганизмов I - II групп патогенности ПЦР-анализ используют:
- в качестве экспрессного метода при исследовании материала от больного (подозрительного на заболевание) и индикации патогенных биологических агентов (ПБА) в объектах окружающей среды;
- как ускоренный предварительный тест при выполнении культурального и биологического методов исследования и для идентификации подозрительных культур;
- для определения эпидемиологической значимости изолятов на основании выявления генетических маркеров вирулентности, например, ctxА- и tcpА-генов у возбудителя холеры;
- в научных целях для генотипирования штаммов или их ретроспективного анализа.
4. Требования к организации работ
4.1. Проведение исследований по выявлению ДНК (РНК) микроорганизмов I - II групп патогенности сопряжено с необходимостью одновременного обеспечения правил биологической безопасности работ и требований к организации и проведению ПЦР-анализа с целью предотвращения контаминации исследуемых проб нуклеиновыми кислотами (НК).
4.3. Все этапы исследования материала, зараженного или подозрительного на зараженность вирусами I группы, проводят в условиях максимально изолированных лабораторий с использованием изолирующих средств индивидуальной защиты или в боксах биологической безопасности III класса в защитном костюме IV типа, дополненном резиновыми перчатками.
4.4. Исследования материала, инфицированного микроорганизмами I - II групп патогенности, методом ПЦР проводят в организациях, имеющих лицензию на деятельность, связанную с возбудителями инфекционных заболеваний человека, в лабораториях, имеющих санитарно-эпидемиологическое заключение о возможности проведения соответствующих работ (с указанием конкретных видов микроорганизмов). В этой же лаборатории могут проводиться ПЦР-исследования с микроорганизмами III - IV групп патогенности.
4.5. Допускается проведение исследований крови методом ПЦР на бруцеллез, парентеральные вирусные гепатиты, ВИЧ-инфекцию в лабораториях, имеющих санитарно-эпидемиологическое заключение о возможности проведения работ с возбудителями III группы патогенности, выданное в установленном порядке.
4.7. Работу по ПЦР-диагностике организует специалист с высшим образованием, прошедший обучение на лицензированных курсах специализации (повышения квалификации) по работе с ПБА I - II групп патогенности и по ПЦР-диагностике.
5. Требования к помещению и оборудованию ПЦР-лабораторий
5.2. Рабочая зона ПЦР-лаборатории в соответствии с этапами ПЦР-анализа должна включать следующий минимальный набор последовательно расположенных самостоятельных помещений (прилож. 1) или отдельно выделенных рабочих зон (в составе других функциональных помещений):
- приема, разборки, первичной обработки материала;
- подготовки проб, выделения нуклеиновых кислот (НК);
- приготовления реакционных смесей, проведения ПЦР и обратной транскрипции (ОТ);
- учета результатов методом электрофореза или ГиФА.
5.3. Комнату выделения НК располагают вблизи от комнаты приема материала, а помещение для учета результатов - по возможности в отдалении от других перечисленных помещений для обеспечения условий, исключающих занос в них продуктов амплификации (ампликонов) с воздушным потоком.
5.4. Не допускается выполнение ПЦР-исследований в помещениях для проведения работ с использованием культуральных (накопление патогенных биологических агентов) и генно-инженерных методов, в том числе связанных с получением (клонированием) и выделением рекомбинантных плазмид.
5.6. Зону по подготовке проб и выделению нуклеиновых кислот размещают в боксированном помещении (микробиологический бокс с предбоксом) или в комнате заражения и вскрытия животных. Работу проводят в боксе биологической безопасности II или III класса. В рабочей зоне располагают оборудование и предметы, необходимые только для предварительной обработки, выделения НК (примерный перечень представлен в прилож. 2).
5.7. Зону приготовления реакционных смесей и проведения ОТ и ПЦР-амплификации располагают в боксированном помещении или боксе биологической безопасности II класса (или ПЦР-боксе) - для подготовки реакционных смесей для ОТ и ПЦР.
5.8. Работу по подготовке реакционных смесей для ПЦР и ОТ-ПЦР проводят до доставки в бокс проб, поступающих из зоны выделения НК. Смесь может быть приготовлена также за пределами помещений лаборатории, предназначенных для работы с заразным материалом, например, в комнате (боксе) для розлива питательных сред.
5.9. При необходимости этап подготовки проб и выделения нуклеиновых кислот может выполняться в одной комнате с этапом ПЦР при наличии в ней бокса биологической безопасности II или III класса защиты для выделения НК и бокса биологической безопасности II класса (или ПЦР-бокса) - для подготовки реакционных смесей для ОТ и ПЦР. Каждый бокс рассматривается как соответствующая рабочая зона.
5.10. Зону детекции результатов располагают в боксированном помещении. При отсутствии боксированного помещения работу проводят в отдельной комнате, при возможности в ПЦР-боксе.
5.11. При одновременном использовании двух методов детекции продуктов амплификации - электрофоретического и ГиФА - следует выделить отдельные помещения или две рабочие зоны. Оборудование и принадлежности для каждого вида анализа маркируют применительно к каждой зоне. Обмен посудой и пипетками между зонами не допускается.
5.12. Помещения ПЦР-лаборатории покрывают кафелем (пол, стены) или масляной краской (стены, потолок), устойчивой к действию моющих и дезинфицирующих средств.
5.13. Во всех помещениях устанавливают бактерицидные лампы. Рекомендуется дополнительная установка переносного ультрафиолетового бактерицидного облучателя-рециркулятора.
5.14. Окна должны быть плотно закрыты. Для защиты рабочих столов от попадания прямого солнечного света используют светозащитные пленки из материала, устойчивого к дезинфицирующим средствам. Использование жалюзи не рекомендуется из-за адсорбции пыли.
5.15. Каждая рабочая зона должна иметь свой набор мебели, лабораторного оборудования, реагентов, автоматических пипеток, наконечников, пластиковой и стеклянной посуды, защитной одежды, обуви, резиновых перчаток, уборочного инвентаря и пр., используемых только в данной комнате (рабочей зоне).
5.16. Имущество каждой рабочей зоны должно иметь маркировку указанной зоны. Применение его в других помещениях или для других видов исследований не допускается.
5.17. В рабочих зонах должен быть свой набор холодильников (прилож. 2):
- в комнате приема материала от 4 до 8 °С, минус 20 °С и минус 70 °С (при необходимости длительного хранения материала);
- в комнате выделения нуклеиновых кислот от 4 до 8 °С и минус 20 °С для хранения набора выделения НК; от 4 до 8 °С - для хранения препаратов НК; не допускается хранение проб материала или препаратов НК в одном холодильнике с компонентами набора для выделения НК;
- в комнате ПЦР-амплификации от 4 до 8 °С и минус 20 °С - для хранения наборов обратной транскрипции и амплификации НК;
- в комнате детекции продуктов амплификации от 4 до 8 °С - для хранения наборов электрофоретической детекции и ГиФА.
5.19. При выполнении ПЦР воздухообмен внутри и между помещениями может повышать опасность контаминации проб из-за вероятности проникновение молекул НК и продуктов амплификации через фильтры. Снижение этой опасности достигается указанной ниже системой вентиляции лаборатории:
- следует полностью исключить воздухообмен между помещением для детекции продуктов амплификации (пост-ПЦР-помещение) и остальными комнатами ПЦР-лаборатории, а также другими помещениями организации (давление воздуха в пост-ПЦР-помещении должно быть ниже, чем в указанных помещениях);
- при смежном расположении комнаты приема материала и комнаты выделения нуклеиновых кислот давление в последней должно быть не ниже, чем в комнате приема материала;
- если обе названные комнаты, входящие в пре-ПЦР-помещение, имеют смежное расположение с помещением для проведения ПЦР, давление воздуха в них должно быть ниже, чем в ПЦР-помещении; при отдаленном размещении ПЦР-помещения давление воздуха в нем должно быть не ниже, чем в пре-ПЦР-помещении.
Кратность воздухообмена (м 3 /ч)
Зона приема и первичной обработки материала
Взятие, доставку и оформление материалов для проведения лабораторных исследований методом ИФА на ВИЧ-инфекцию и СПИД - индикаторные заболевания, для проведения лабораторных исследований методом ПЦР на ВИЧ - инфекцию, вирусные гепатиты В и С, а также для иммунологических исследований в КДЛ ГБУЗ РЦПБ СПИД и ИЗ производить строго в соответствии с правилами (приложение 1, 2, 3).
Наиболее частыми нарушениями указанных правил являются следующие:
1) при оформлении сопроводительной документации не указывается наименование диагностической тест-системы, ее серия, срок годности
2) не полностью указываются паспортные данные обследуемых, а также дата и место взятия материала
3) зачастую в лабораторию ГБУЗ РЦПБ СПИД и ИЗ доставляется материал, уже непригодный для исследования: сыворотки, хранившиеся дольше установленного срока хранения (для разных методов исследования сроки хранения составляют от 3 до 48 часов); проросшие, гемолизированные сыворотки, в недостаточном для исследования количестве (в зависимости от метода минимально необходимый объем материала составляет от 2 до 5 мл);
4) номера, проставленные на флаконах, не соответствуют указанным в направлении; количество проб крови не соответствует количеству, указанному в направлении;
5) неправильно производится взятие материала, в пробах крови, доставляемых для исследований методом ПЦР и для иммунологические исследований, обнаруживаются сгустки,
6) при заборе материала не всегда медицинский персонал ЛПУ обращает внимание на сроки годности пробирок.
Правила взятия и доставки крови для проведения лабораторных исследований методом ИФА на ВИЧ-инфекцию и СПИД-индикаторные заболевания.
Взятие крови производится из локтевой вены в чистую сухую пробирку в количестве 3-5 мл. У новорожденных можно брать пуповинную кровь с указанием об этом в направлении. Полученный материал не рекомендуется хранить более 12 часов при комнатной температуре и более 1 суток в холодильнике при +4-8 0С. Наступающий гемолиз может повлиять на результаты анализа. В случае невозможности доставки материала в течение суток следует сразу после взятия крови отобрать из нее сыворотку. Сыворотка отделяется центрифугированием. Отделенная сыворотка переносится в чистую (лучше стерильную) пробирку, флакон или пластиковый контейнер, и в таком виде она может храниться до 7 дней при температуре +4-8 0С. На пробирке следует указать порядковый номер, фамилию и инициалы пациента, в строгом соответствии с направлением. Для транспортировки в КДЛ диагностики ВИЧ штативы с пробирками помещают в термоконтейнер, легко подвергающийся дезинфекции. Полученный материал в КДЛ диагностики ВИЧ доставляет медицинский персонал, прошедший специальный инструктаж в установленном порядке.
Утв. МЗ СССР от 05.09.1988 г. №690
Направление №__________________
на исследование образца крови в ИФА на ВИЧ-инфекцию
В_________________________________________________________
(наименование учреждения)
Должность лица, направляющего материал___________________________________
Взятие материала для исследования производить только при предъявлении пациентами паспорта или иного документа, удостоверяющего его личность (кроме анонимного обследования).
Коды контингентов
Наименование кода
код
Доноры (крови, биологических жидкостей, органов и тканей)
Медицинский персонал, работающий с ВИЧ - инфицированными лицами и инфицированным материалом
Гомо- и бисексуалисты
Больные заболеваниями, передающимися половым путем
Лица, находящиеся в местах лишения свободы
Обследованные по клиническим показаниям
Беременные (доноры плацентарной и абортной крови)
Обследованные при эпидемиологическом расследовании
Для лабораторий диагностики ВИЧ-инфекции в обменном журнале и направлении обязательно дополнительно указываются результаты исследования (ОП сыворотки, ОП критическое), а также дата постановки, название, серия, срок годности используемой тест-системы.
Правила взятия, хранения и доставки материала для проведения исследований методом полимеразной цепной реакции (ПЦР).
В направлении должны быть четко указаны: учреждение, направившее материал, Ф.И.О. (полностью), год рождения, код контингента, домашний адрес, дата, точное время и место взятия материала, фамилия и подпись ответственного лица с указанием номера контактного телефона.
Правила взятия и доставки материала для проведения иммунологических исследований.
Материал должен быть доставлен в лабораторию сразу после взятия. Недопустимо замораживание биологического материала. Флаконы должны быть четко промаркированы с указанием фамилии пациента, даты и времени взятия. Маркировка флаконов должна строго соответствовать данным, указанным в направлении.
В направлении должны быть четко указаны: учреждение, направившее материал, Ф.И.О. (полностью), год рождения, код контингента, домашний адрес, дата, время и место взятия материала, фамилия и подпись ответственного лица с указанием номера контактного телефона.

Полимеразная цепная реакция (ПЦР) – экспериментальный метод молекулярной биологии, позволяющий добиться значительного увеличения малых концентраций определённых фрагментов нуклеиновой кислоты (ДНК/РНК) в биологическом материале (пробе).
Открытие метода ПЦР стало одним из наиболее выдающихся событий в области молекулярной биологии за последние десятилетия. Метод продолжает развиваться, появляются новые модификации, но мы предлагаем рассмотреть методику проведения классической ПЦР.
Методика полимеразной цепной реакции
Метод постановки ПЦР требует наличия в реакционной смеси ряда основных компонентов: праймеры, Taq-полимераза, смесь дезоксинуклеотидтрифосфатов, буфер, анализируемый образец.
Праймеры – искусственно синтезируемые олигонуклеотиды, как правило, размером от 15 до 30 нуклеотидов, которые идентичны соответствующим участкам ДНК-мишени. Играют ключевую роль в амплификации, образуя продукты реакции.
Для полимеразной цепной реакции последовательности праймеров очень важны, потому что реакционный цикл имеет определенные величины температур, используемые на этапах нагрева и охлаждения.
Кроме того, большой избыток праймеров в реакционной смеси ПЦР приводит к тому, что они с большей вероятностью сталкиваются с частично комплементарным праймером, чем с полностью комплементарной ДНК матрицой. Таким образом, следует избегать комплементарностипраймеров друг другу.
Taq-полимераза – термостабильный фермент, который обеспечивает достраивание З’-конца второй цепи ДНК по принцип комплементарности. Этот фермент довольно часто используется при проведении стандартной ПЦР.
Taq ДНК полимераза имеет оптимальную температуру репликации – 75–80°C и выдерживает длительное воздействие температур до 96°C. Таким образом, она может оставаться активной после каждого из шагов денатурации.
Для оптимального включения оснований в синтезируемую цепь ДНК их обычно добавляют к реакционной смеси ПЦР в эквимолярных количествах. Как правило, конечная концентрация каждого дезоксинуклеозидтрифосфата составляет 0,2 мМ.
Буфер – смесь катионов и анионов используемая в определенной концентрации, обеспечивающая оптимальные условия для реакции, а также стабильное значение рН. Значение рН буфера колеблется от 8,0 до 9,5 и стабилизируется Трис-HCl.
Одним из компонентов буфера Taq-полимеразы является ион калия (KCl), который способствует отжигу праймеров. Буферная концентрация ионов магния является еще одним важным фактором для правильного функционирования ДНК-полимеразы. Ионы магния служат кофактором для ДНК полимеразы.
Анализируемый образец – вносимый в реакционную смесь препарат, обычно содержащий искомую ДНК, служащую мишенью для амплификации. В случае отсутствия ДНК-мишени продукт не образуется.
Иногда для удобства детекции или контроля эффективности в состав реакционной смеси могут быть внесены дополнительные компоненты.
Внутренние контроли – несвойственный данному организму фрагмент ДНК, как правило, большего размера, ограниченный специфическими праймерами. Практически представляет собой альтернативную матрицу ПЦР и позволяет контролировать эффективность амплификации в каждой конкретной пробирке.
ДНК-зонды – искусственно синтезированные олигонуклеотиды небольшого размера (около 30 нуклеотидов), комплементарные специфическим ампликонам (продуктам реакции). Могут использоваться для детекции продуктов ПЦР, благодаря прикрепленным к ним изотопным или флуоресцентным меткам.
Для улучшения результатов ПЦР используются различные ПЦР добавки. Эти компоненты способны понижать температуру денатурации матрицы или стабилизируют ДНК-полимеразу.
Обычно используемые ПЦР-добавки включают диметилсульфоксид (ДМСО), сульфат аммония, полиэтиленгликоль, бычий сывороточный альбумин (BSA), желатин, N-триметилглицин и глицерин.
Если в пробе имеется искомая ДНК, с ней происходит ряд последовательных цикличных реакций, которые различаются температурными режимами.
Амплификация может включать в себя множество циклов, но все они состоят из трёх этапов: денатурация, отжиг, элонгация [1].
Денатурация – процесс перехода двухнитевой формы ДНК в однонитевую из-за разрыва водородных связей между комплементарными парами оснований при воздействии высоких температур.
Отжиг – процесс присоединения праймеров к одноцепочечной ДНК-мишени. Отжиг происходит благодаря правилу комплементарностиЧаргаффа. Без соблюдения этих условий праймеры не отжигаются.
Элонгация (синтез). Taq-полимераза достраивает вторую цепь ДНК с 3’-концапраймера.
Температура в реакционной смеси доводится до оптимума работы Taq-полимеразы. Затем она максимально эффективно начинает синтезировать вторую цепь ДНК от 3’-конца праймера, который связан с матрицей, и продвигается в направлении от 3’ к 5’ концу.
Результатом ПЦР будет экспоненциальное увеличение количества специфического фрагмента ДНК, описываемое формулой
где А – количество специфических (ограниченных праймерами) продуктов реакции амплификации; М – начальное количество ДНК-мишеней; n – число циклов амплификации.
Таким образом, специфические фрагменты, ограниченные на концах праймерами, впервые появляются в конце второго цикла, накапливаются в геометрической прогрессии и очень скоро начинают доминировать среди продуктов амплификации.
Помимо классического варианта ПЦР существует также множество других вариантов постановки ПЦР, которые направлены на решение многих задач: увеличение эффективности реакции и снижения риска образования неспецифических продуктов; реализацию возможности проведения качественного и количественного анализа искомых участков молекулы ДНК/РНК [2].
В клинико-диагностических лабораториях наиболее распространенными модификациями ПЦР являются:
В момент постановки ПЦР полимеразная активность фермента блокируется антителами или небольшими молекулами типа Affibody, имитирующими антитела, до наступления первой денатурации (при 95°C в течение 10 минут).
ПЦР с обратной транскрипцией (ОТ-ПЦР, RT-PCR) – предназначен для амплификации, выделения или идентификации последовательности РНК. Сперва проводят синтез одноцепочечной молекулы ДНК (кДНК), с помощью ревертазы (обратной транскриптазы), используя для матрицы мРНК. Затем образовавшуюся кДНК используют для последующей ПЦР.
Возможность использовать РНК в качестве мишени для ПЦР расширяет спектр применения метода, например, геномы многих вирусов (гепатит С, вирусы гриппа, ВИЧ и т.д.) представлены именно РНК.
Для этого используются флуоресцентные красители, которые интеркалируют в двуцепочечные молекулы ДНК или модифицированные дезоксинуклеоты, флуоресцирующие после гибридизации с комплементарными участками ДНК.
Мультиплексная (мультипраймерная) ПЦР – амплификация двух и более последовательностей ДНК в одной пробирке одновременно. Преимущество этого метода заключается в возможности выявления ряда патогенов, генетических модификаций организмов или генотипирования множественных аллелей и т.д., поместив проб в одну пробирку.
Все перечисленные виды ПЦР не могут быть проведены без необходимого пространства и оборудования.
Организация ПЦР-лаборатории и необходимое оборудование
Для предотвращения контаминации исходных образцов используют одноразовые пробирки с плотно закрывающимися крышками и наконечники к микродозаторам, термостаты с твердотельнымтермоблоком, специальные контейнеры для сброса использованных наконечников и пробирок. Смена наконечников является обязательной после каждой проведенной манипуляции [3].
Для каждого отдельного помещения предусмотрено наличие холодильников и морозильников для поддержания определенной температуры, вортексов и ротаторов для перемешивания, центрифуг различной мощности для перемешивания и разделения образцов. Также необходимо наличие комплекта дозаторов различного диапазона объемов и подходящих для них наконечников, штативов для микропробирок, самих микропробирок (центрифужных, градуированных и пр.) различных объемов. Все комнаты должны быть оснащены бактерицидными рецикуляторами для дезинфекции воздуха при помощи УФ, все рабочие поверхности и наружные поверхности корпусов приборов должны быть устойчивы к дезинфекции. Помимо перечисленного списка каждая зона лаборатории должны содержать конкретный набор приборов, необходимых для выполнения соответствующих задач.
Организация зон лаборатории представлена на схеме [4].
Зона приема, регистрации и первичной обработки материала должна быть оборудована центрифугами для осаждения и разделения компонентов проб.
В зоне выделения НК необходимо наличие:
• абактериального бокса для защиты исследователя от патогенных агентов, передающихся воздушно-капельным путем;
• процессора магнитных частиц для экстракции НК;
• нанофотометра для определения количества и качества выделенной из образка ДНК/РНК;
• термостата для поддержания постоянной температуры в пробирках, помещенных в гнезда термоблока;
• дистиллятора для получения дистиллированной воды.
• Зона приготовления реакционной смеси и проведения ПЦР должна содержать:
• амплификатор, необходимый для нагрева/охлаждения пробирок;
• бокс для стерильных работ для обеспечения защиты от контаминации при выделении ДНК и подготовке реакционной смеси.
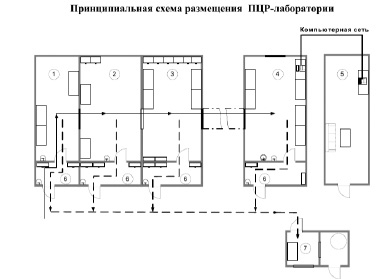
1 – зона приема, разбора и первичной обработки материала;
2 – зона подготовки проб и выделения НК;
3 – зона приготовления реакционных смесей, проведения ОТ и ПЦР;
4 – зона детекции результатов методом электрофореза и ГиФА;
5 – комната анализа результатов;
7 – комната обеззараживания материала.

Обязательными для зоны детекции результатов являются:
• камера для электрофореза – разделения продуктов амплификации нуклеиновых кислот, а также источник питания, преобразующий переменный ток в постоянный;
• система гель-документации для регистрации результатов и воспроизведения электрофореграмм, включающая в себя трансиллюминатор для детекции результатов в УФ спектре, а также компьютер;
• электронные прецизионные весы для приготовления агарозного геля, который используется при электрофорезе;
• электрическая плитка для тех же целей.
В последней, но немаловажной зоне дезинфекции материалов необходим паровой стерилизатор для обработки образцов водяным паром под давлением.
Состав оборудования может варьировать в зависимости от размера лаборатории и других факторов.
Метод ПЦР находит применение в различных областях диагностики. Его применяют для выявления в клинических образцах вирусов, бактерий, простейших, а также для обнаружения приобретенных и врожденных генетических нарушений и идентификации личности [5].
Автоматизация этапов денатурации, отжига и элонгации с применением современного оборудования позволяет упростить проведение анализа и способствует его широкому применению в различных областях диагностики. Однако повсеместное внедрение данного метода ограничивается необходимостью ручной и трудоемкой подготовки проб идетекции результатов, а также необходимостью в оснащенной лаборатории со всеми необходимыми реактивами и оборудованием.
Сфера применения полимеразной цепной реакции в дальнейшем будет расширяться, т.к. все чаще в клинической практике имеют дело с очень небольшим количеством исследуемого материала, анализ которого возможен только этим методом.
Появление все новых видов ПЦР способствует охвату большего спектра возможностей для применения метода, упрощает и ускоряет его проведение, тем самым позволяя получить наиболее точный, верный и быстрый результат.
Читайте также:


