Микоплазменная инфекция у свиней
С . Н . Карташов ,
А . Г . Ключников ,
А . И . Бутенков ,
А . Н . Тазаян
ГНУ СКЗНИВИ Россельхозакадемии
Инфекционная патология свиней в Ростовской области представлена, в основном, бактериальными заболеваниями (52,8% от общей инфекционной патологии). По распространенности инфекций свиней микоплазмоз занимает 1-е место (20,9% соответственно). Комплекс исследований функционального состояния гуморального и клеточного иммунитета у 4-5 месячных поросят, больных энзоотической пневмонией, вызванной М. Нуорпеитогнае, выявил резкое снижение количества В-лимфоцитов, а также нарастающее снижение общего числа Т-лимфоцитов и отдельных популяций Р0К(р-Р0К и в-РОК), что, по всей видимости, отражают нарушение лимфопоэза, а также перераспределение клеток и изменение регуляторного потенциала лимфоидных тканей у заболевших животных.
Актуальность темы. Из заболеваний свиней, причиной которых являются микоплазмы, следует назвать энзоотическую пневмонию, полисерозиты, артриты, метриты и маститы. Хотя этиологическая роль микоплазм при некоторых заболеваниях, и том числе и при атрофическом рините свиней многими исследователями не подтверждена, тем не менее, большинство авторов считают, что микоплазмы при этих патологиях играют большую, если не ведущую роль [1, 3]. В последние годы в мировой литературе появляется все больше сообщений, свидетельствующих о том, что различные виды микоплазм могут вызывать самостоятельные заболевания свиней. В настоящее время от свиней выделено несколько различных видов микоплазм [2, 4, 6]. Энзоотическая пневмония у свиней, вызванная М. пуорпеитогпае, широко распространена и представляется как одна из экономически важных болезней свиней. Как указывает 1 Заггас!е11 (2003), у 75% убойных свиней находят очаги пневмонии, характерные для энзоотической пневмонии. Заболеваемость в отдельных хозяйствах может достигать 100%, однако смертность, которая наблюдается среди 3-6-недельных поросят, колеблется от 0,5 до 20%. Отмечается резкая задержка роста и развития поросят [3, 5]. В связи с отсутствием типичных симптомов болезни распознавание ее весьма затруднительно, в литературе мало данных по морфологическим особенностям этого заболевания и иммунный статус животных при этом заболевании не изучен, что и определило цель наших исследований.
Цели исследования. Выяснить эпизоотическую ситуацию по энзоотической пневмонии свиней в Ростовской области, изучить иммунологический статус при разной степени выраженности заболевания.
Материалы и методы. Работу выполняли с 2006 по 2008 гг. в лаборатории функциональной диагностики болезней сельскохозяйственных животных и лаборатории болезней свиней ГНУ СКЗНИВИ Россельхозакадемии, Ростовской областной ветеринарной лаборатории, а также в хозяйствах Ростовской области.
Для определения роли и места М. пуорпеитогпае в инфекционной патологии свиней в условиях Ростовской области нами изучен нозологический профиль, удельный вес, географическое распространение и годовая динамика инфекционных заболеваний свиней в Ростовской области.
Диагностику энзоотической пневмонии проводили ГУРО "Областная ветеринарная лаборатория" с помощью тест-системы для выявления ДНК возбудителя в патологическом материале методом полимеразно-цепной реакции (ПЦР) с электрофо-ретической детекцией продуктов амплификации в агарозном геле, а также определяли наличие специфических антител к возбудителю энзоотической пневмонии в сыворотке крови методом ИФА.
Статистическую обработку результатов исследований проводили по Н.А. Плохинскому (1970), Хитоси Кумэ (1990) с использованием компьютерной техники. Опыты по определению иммунологического статуса больных поросят проводили на 3-х группах поросят по 20 голов в каждой. Группы формировались по принципу пар-аналогов. Первая группа, контрольная, включала клинически здоровых животных без признаков заболевания. Во вторую опытную группу были включены животные с первой стадией заболевания заболевания, у которых отмечался кашель, но был сохранен аппетит. Третья опытная группа животных, включала поросят со второй стадией заболевания, характеризующейся кашлем, тяжелой одышкой, адинамией, анорексией. Определение концентрации сывороточных иммуноглобулинов проводили с помощью реакции Манчини. Определение количества Т - лимфоцитов и их субпопуляций проводили методом розеткообразования — Е-РОК, тимусзависимые Т-лимфоциты имеют рецепторы для эритроцитов барана, которые выступают, таким образом, специфическим маркером для их распознавания (Е-РОК: Егу1пгосут.е — розеткообразующие клетки). Выявляли 2 субпопуляции: теофиллинчувствительные Т-лимфоциты (Т-супрессоры), утратившие способность к ро-зеткообразованию под влиянием обработки теофиллином, и теофиллинустойчивые Т-клетки (Т-хелперы) лимфоциты, такую способность сохранившие.
Результаты исследований. За период с 2006 по 2008 гг. в хозяйствах Ростовской области осмотру подвергнуто 6481 свиней. Из них у 22% выявлена инфекционная патология. За подопытными животными было установлено постоянное клиническое наблюдение, при этом учитывали процент заболеваемости, выздоровления и падежа. Ежедневно проводили клиническое обследование поросят, а лабораторные исследования проводили при первичном и повторном осмотрах и при выздоровлении.
Для изучения эпизоотической ситуации по энзоотической пневмонии было проведено обследование поголовья свиней в 14 хозяйствах Ростовской области, проанализированы результаты лабораторных исследований ГУРО "Ростовская областная ветеринарная лаборатория" и лаборатории болезней свиней ГНУ СКЗНИВИ Россельхозакадемии.
Ростовская область представляет собой зону со сложной эпизоотической обстановкой по инфекционным болезням. В хозяйствах региона ежегодно переболевают инфекционными болезнями от 40 до 95% поросят. Из общего количества павших поросят в 2005-2008 годах гибель их от респираторных болезней составила 41,7%.
Мы провели ретроспективный анализ уровня заболеваемости свиней инфекционными болезнями в Ростовской области за период 2004-2008 г. Изучали удельный вес ми-коплазменной инфекции в сравнительном аспекте и в динамике. В результате выделены следующие нозологические единицы (рис. 1,2).


Пик заболеваемости свиней энзоотической пневмонией приходится на конец зимы - начало весны (рисунок 3), что, по-видимому, связано со снижением иммунного статуса свиней на фоне гиповитамонозов, снижения качества комбикормов в зимнее-весенний период.
в Ростовской области (по горизонтали - месяцы, по вертикали - количество животных).
Такую динамику можно объяснить и резкими изменениями климатических факторов, которые приводят к манифестации инфекции при наличии возбудителя в организме.
Кроме того, мы провели анализ распространения ассоциативных болезней у свиней при энзоотической пневмонии в Ростовской области в 2008 г (рисунок 4). Наряду с энзоотической пневмонией из 96 клинически больных поросят у 14 (14,6%) из них зарегистрирован репродуктив-но-респираторный синдром (РРСС), по 8 случаев (8,33%) приходилось на микоплазмоз и микоплазмоз с репродук-тивно-респираторным синдромом соответственно.
У 16 (16,7%) поросят цирковирусной инфекции сопутствовала бактериальная пневмония, а у 6 (6,3%) поросят мы наблюдали стрептококкоз. Выявлено только 5 случаев (5,21%), когда энзоотическая пневмония был обнаружен без присутствия других возбудителей.

Таким образом, наиболее часто респираторному микоплазмозу сопутствует пастереллез (28,1%), ЦВИС (16,7%) и РРСС (14,6%)
При анализе данных, полученных в результате бактериологического исследования поросят, у которых энзоотическая пневмония сопровождалась септицемией, было установлено, что в 2-х случаях выделен НеаторпИиз рагазцпз, по 3 случая приходилось на Е. СоП и За1топе11а зр. и в 5 случаях был выделен 31герт.ососсиз зцпз. Таким образом, бактериальная септицемия выявлена у 9% поросят с признаками микоп-лазмоза.
В результате анализа заболеваемости поросят энзоотической пневмонией в зависимости от возраста установлено, что из 360 поросят, у которых возбудитель был выделен методом ПЦР, 131 голов (36,4%) были 10-15 недельного возраста,
100 голов - в возрасте 15-20 недель (27,8%), 86 голов - в возрасте 5-10 недель (23,9%). Пик сероконверсии приходился на возраст 8-18 недель.
Динамика заболеваемости, смертности и летальности при
энзоотической пневмонии в Ростовской области была проанализирована за 2007-2008 годы (таблица 2).

В 2007 году смертность от энзоотической пневмонии составила 278,4 голов на 1000 восприимчивых свиней при летальности 35,77%. В 2008 году эти показатели существенно не изменились - смерность составила 347,7 голов на 1000 восприимчивых животных, а летальность - 39,28%.
Установлено, что у поросят первой опытной группы отмечается снижение общего числа лейкоцитов периферической крови, что, кроме того, сопровождается выраженной лимфопенией. У больных животных развивалась выраженная лейкопения и лимфопения, количество Т-лимфоцитов периферической крови снизилось до 29,1 ± 1,4% в первой стадии заболевания и увеличилось до 68,6 ± 1,2% во второй стадии заболевания. Однако, на фоне лимфопении абсолютное значение лимфоцитов снизилось до 0,69±0,038хЮ9/л в первой стадии заболевания и до 0,43±0,05*109/л во второй стадии заболевания. Соотношение Т-хелперов кТ-супрессорам также изменялось, и по мере развития заболевания снижалось с 2,17 до 1,58 (табл. 3).

Все эти изменения — снижение общего числа Т-лимфо-цитов и отдельных популяций РОК, снижение их соотношения (р-РОК и в-РОК) — по всей видимости, отражают нарушение лимфопоэза и перераспределение клеток, а также изменение регуляторного потенциала лимфоидных тканей по мере развития энзоотической пневмонии. Из теории общей иммунологии [3], выраженное снижение количества Т-лимфоцитов по отношению к здоровым животным сопровождается снижением клеточного иммунитета, что влечет за собой падение резистентнос-тии, в первую очередь, к вирусным инфекциям [2].
Результаты определения относительного и абсолютного содержания В-лимфоцитов у поросят в возрасте 3-6 недель, больных энзоотической пневмонией представлены в таблице 4.

Анализ показателей, характеризующих гуморальное звено иммунитета, выявил, что абсолютное содержание в крови В-лимфоцитов у здоровых поросят составило 0,69±0,04х109/л.
При энзоотической пневмонии свиней в первой стадии заболевания количество В-лимфоцитов периферической крови снизилось до 13,97 ± 1,89% и увеличилось до 33,46± 0,28% во второй стадии заболевания. Но на фоне лимфопении абсолютное значение лимфоцитов снизилось до 0,35±0,06хЮ9/л в первой стадии заболевания, до 0,20±0,06хЮ9/л во второй стадии заболевания. При изучении изменений количества иммуноглобулинов отмечено, что в первой стадии заболевания содержание иммуноглобулина-А, С и М не отличается от здоровых животных, но во второй стадии энзоотическом пневмонии происходит резкое снижение иммуноглобулинов А до 1,49±0,03 мг/мл, что на 30% ниже соответствующих показателей у здоровых животных и поросят во второй стадии заболевания. Уровень иммуноглобулина С и М статистически мало отличался от животных первой и второй опытных групп.
Выводы. Инфекционная патология свиней в Ростовской области представлена, в основном, бактериальными заболеваниями (52,8% от общей инфекционной патологии). По распространенности инфекций свиней микоплазмоз занимает 1-е место (20,9% соответственно). Кроме этого, наиболее часто регистрируют цирковирусную инфекцию - 14,3%, РРСС и колибактериоз - по 11,8%, ПВИС - 8,9%,
пастереллез - 7,5%, энзоотическая пневмония - 5,5%. На долю остальных заболеваний приходилось в сумме18,34%. За период с 2004 по 2008 гг. заболеваемость свиней энзоотической пневмонией составила в среднем 20,92% . При этом, за этот период заболеваемость свиней микоплазмозом занимала относительно стабильное значение и варьировала от 23,7% в 2005 году до 37,4%
в 2008 году.
Из 370 поросят, у которых возбудитель был выделен методом ПЦР, 135 голов (35,7%) были 10-15 недельного возраста, 100 голов - в возрасте 15-20 недель (27%), 88 голов - в возрасте 5-10 недель (23,8%). Пик сероконверсии приходился на возраст 8-18 недель.
Снижение общего числа В-лимфоцитов, Т-лимфоцитов, отдельных фракций иммуноглобулинов и отдельных популяций РОК, снижение их соотношения (р-РОК и в-РОК), по всей видимости, отражают нарушение лимфопоэза, а также изменение регуляторного потенциала лимфоидных тканей по мере развития заболевания. Из теории общей иммунологии известно, что, выраженное снижение количества Т-лимфоцитов по отношению к здоровым животным сопровождается снижением клеточного иммунитета и это влечет за собой падение резистентности, в первую очередь, к вирусным инфекциям [2].
Список использованной литературы:
1. УегсПп Е. 11зе от 1п1егпа1 соп1го1 1п а пезт.ес!-РСР аззау гог Мусор1азта пуорпеитогпае с!ет.ест.юп апс! ^иапт.^т^сат.^оп т 1гаспеоЬгопсЫа1 \л/азЫп§з тгот р|§з. / Е. УегсПп, М. КоЫзсп, 1М. Воуе, М. (Заггпег// Мо1. Се11. РгоЬез., 2000Ь. - уо1. 14. - р. 365-372.
2. Уюса 1 РаНегпз от Мусор1азта пуорпеитогпае 1птест.юпз 1п Ве1§1ап тагго\л/-т.о-т1гпзп р|§з пегс!з \л/Ип сПуеп|тё-соигзе./! Усса, О . Маез, 1_. Тпегтот.е, 1 Рее1егз, Р. НазезЬгоиск // >. Уе1. Мее. 2002. - уо1. 49. - р. 349-353.
3. Щербаков А. В. Этиологическая структура инфекционных болезней свиней в животноводческих хозяйствах России / А. В. Щербаков, В. Ф. Ковалишин, А. С. Яковлева, Е. В. Шабаева // Актуальные проблемы инфекционной патологии животных.
- Владимир, 2003. - с. 146-150.
4. Сорокин М.В. Энзоотическая пневмония свиней и ее специфическая профилактика/ М.В. Сорокину/Российский ветеринарный журнал. Сельскохозяйственные животные, 2006. - N° 3. - с. 35-37.
5. Романенко В.Ф. Этиология энзоотической пневмонии свиней/ В.Ф. Романенко, А.А. Бокун, Н.В. Бабич // Ветеринария, 1988. - Т. 2. - с. 35-37.
6. Пустоваров А.Я. Иммунологическое обоснование диагностики и профилактики энзоотической пневмонии, сальмонеллеза и некоторых смешанных инфекций свиней. - М, 1991. - 49 с.
Ключевые слова: энзоотическая пневмония свиней, В-лимфоциты, Т-лимфоциты иммунитет.
Ответственный за переписку с редакцией: Карташов Сергей Николаевич , доктор ветеринарных наук, заведующий лабораторией функциональной диагностики болезней сельскохозяйственных животных ГНУ Северо-Кавказский зональный научно-исследовательский ветеринарный институт, 16.00.02, 8-909-434-03-03, Ростовское шоссе О , г. Новочеркасск.
Ключников Александр Генадьевич, лаборатория функциональной диагностики болезней сельскохозяйственных животных ГНУ Северо-Кавказский зональный научно-исследовательский ветеринарный институт, соискатель, 16.00.03, 8-909-434-03-03, Ростовское шоссе О, г. Новочеркасск
Бутенков Александр Иванович, лаборатория функциональной диагностики болезней сельскохозяйственных животных ГНУ Северо-Кавказский зональный научно-исследовательский ветеринарный институт, кандидат ветеринарных наук, 16.00.03, 8-909-434-03-03, Ростовское шоссе 0, г. Новочеркасск
Тазаян Артур Ноярович , кафедра эпизоотологии Донского государственного аграрного университета, аспирант, 16.00.03, 8-909-434-03-03, Ростовская обл, п. Персиановский.
Энзоотическая пневмония свиней – микоплазменная пневмония, респираторный микоплазмоз, микоплазмоз свиней (pneumonia enzootica suum) – хроническое инфекционное заболевание, характеризующееся воспалением легких, серозных покровов и нарушением воспроизводительной функции у свиноматок.
Этиология. Возбудителем болезни являются микоплазмы. Наиболее часто она вызывается M. suipneumoniae – M. hyopneumoniae, реже – другими видами этих микроорганизмов. M.suipneumoniae по морфологическим и ферментативным свойствам имеет некоторое сходство с другими видами микоплазм, но отличается от них высокой требовательностью к питательным средам и медленной репликацией, которая длится до 30 дней.
На плотной питательной среде растут в виде мелких, размером до 10-25 нм, бесцветных колоний без центрального уплотнения, врастающие в агар всей поверхностью. M. hyopneumoniae ферментирует глюкозу, не гидролизует аргин, не продуцируют фосфатазу, слабо образуют пленки и пятна.
Эпизоотологические данные. Источником инфекции является больные и переболевшие животные, в организме которых микоплазмы могут сохраняться до 13-15 месяцев. Выделяется возбудитель с истечениями из носа, молоком, мочой и другими секретами. Заражение происходит воздушно-капельным путем и внутриутробно. К болезни восприимчивы свиньи всех возрастов, но более чувствителен молодняк. Заболевание протекает в виде энзоотии, поражая до 60-80% поросят. Летальность достигает до 10-15%. Зараженность стада сохраняется годами. У поросят сосунов симптомы болезни часто отсутствуют и наблюдаются они в 2-3-месячном возрасте.
На широту распространения, интенсивность энзоотии и тяжесть течения болезни существенно влияют микроклимат помещений, условия содержания и кормления. Выраженной сезонности не выявлено, но наиболее массово проявляется в осенне-зимний период.
Течение и симптомы. Инкубационный период длится от 7 до 30 дней. Болезнь проявляется в основном в респираторной форме. Температура тела может повышаться до 40,1-40,5 °С. Затем ухудшается общее состояние, аппетит. У поросят отмечается чихание, слизистое истечение из носа, кашель, вначале сухой и редкий, а затем в виде длительных приступов. Дыхание учащено до 70 -80 движений в минуту. Кашель особенно усиливается в утренние часы во время кормления или при перемещении животных.
При осложнении основного патологического процесса бактериальной микрофлорой у больных поросят болезнь протекает более тяжело. Дыхание становится затрудненным, аппетит понижен, отмечается истощение, слизистые оболочки цианотичны. На конечной стадии болезни поросята сидят на задней части тела с сильной одышкой и пытаются ударами живота выдохнуть воздух из хронически воспаленных легких.
Патологоанатомические изменения. При вскрытии отмечают катаральное воспаление верхушечных, сердечных и добавочной долей легких. Воспаленные участки уплотнены, серого цвета и имеют выраженную дольчатую структуру. С поверхности разреза стекает мутная сероватая жидкость. Средостенные лимфоузлы несколько увеличены, на разрезе сочные, серого цвета, местами покрасневшие.
Дыхательные пути обычно без видимых изменений. Обнаруживается лишь умеренная очаговая гиперемия слизистой оболочки трахеи и крупных бронхов. В их просветах содержится относительно небольшое количество вязкой, сероватой, реже кровянистой жидкости.
Почка, селезенка, печень и головной мозг без видимых изменений.
В хронических случаях, когда воспалительный процесс осложняется бактериальной микрофлорой, развивается перитонит, плеврит и гнойно-некротические процессы в легких.
Гистологически у поросят обнаруживается умеренный отек и инфильтрация клеточными элементами подслизистой оболочки трахеи и бронхов, распространяющаяся на перибронхиальную и периваскулярную ткань, образуя вокруг них инфильтраты в виде муфт.
Диагноз. Ставят с учетом эпизоотологических, клинических, патологоанатомических данных, результатов обнаружения антигена микоплазм МФА, выделения микоплазм и обнаружения к ним специфических антител. В лабораторию направляют кусочки пораженных легких, взятых на границе со здоровыми, средостенные и бронхиальные лимфатические узлы и сыворотку крови больных поросят. Изолят относят к виду M.suipneumoniae на основании определения антигенных свойств. Для ретроспективной диагностики используют РСК, РНГА, латекагглютинации и иммуноферментный анализ.
Энзоотическую пневмонию исключают от гриппа, хламидиоза, пастереллеза, сальмонеллеза, антинобациллярной плевропневмонии, пневмонии аскаридозной и метастронгилезной этиологии.
Лечение.Применяют линкомицин, спирамицин, тетрациклин, тиамугин, тилозин. Тиамулин применяют в дозе 50 мг/кг, тилозин (фрадизин, формазин) – 2-10 мг/кг, антибиотики тетрациклинового ряда – 10 тыс. ЕД./ кг живой массы. В виде аэрозолей можно назначать хлорную известь (1 г) и скипидар (0,75 г/1 м3 помещения), йодистый алюминий (на 1 м3 помещения – 0, 2 г йода, 0,02 алюмиевой пудры и 0, 06 хлористого аммония), 5%-ный раствор хлорамина Б в дозе 3 мл/м3, йодином – 2 мл/м3, йодтриэтиленглюколь из расчета 0,15-0,2 йода на 1 м 3 помещения.
Одновременно назначают препараты патогенетической терапии и иммуностимулирующие средства.
В качестве профилактики энзоотической пневмонии предложена схема применения антибактериальных средств, которая включает: в 1-ый день жизни и на 8-10-й день поросятам назначают по 50 мг основания тилансодержащего препарата или по 20-30 мг сульфонамид-триметоприма; на 16-й 100 мг тилозинового основания или по 40-60 мг сульфонамид-триметоприна на поросенка.
Профилактика и меры борьбы. Основаны на проведении комплекса ветеринарных, санитарных и зоотехнических мероприятий, направленных на недопущение заноса инфекции, обеспечение оптимальных условий содержания и кормления животных, повышение их естественной резистентности организма. Специфические средства профилактики окончательно не разработаны.
В наших опытах положительные результаты получены при применении сыворотки крови реконвалесцентов, которая в зависимости от вида микоплазм содержит специфические антитела в титре 1:8 – 1:128. Двух-, трехкратная обработка поросят сывороткой в дозе 2 мл/м3 помещения в первые дни после заполнения секции, с последующим применением в течение 5 дней йодинола в виде аэрозолей из расчета 2 мл/м3, предохраняет от заболеваемости 92% поросят, снижает вынужденный убой на 1,5, падеж – на 0,9% и повышает прирост массы тела животных на 2,9 – 3,6 кг.
Поливалентная сыворотка, полученная путем гипериммунизации свиней на откорме смесью инактивированных 4-х видов микоплазм и 2-х видов ахолеплазм, содержала специфические антитела в титре 1:128 – 1:1024. Применение ее в форме аэрозолей в первый день после заполнения сектора поросятами снижало заболеваемость до 19,3% вынужденный убой – до 1,9 и падеж до 2,0%. Средний прирост массы тела животных возрос на 2,4 кг.
Иммунизация поросят сконструированной нами поливалентной противомикоплазменной вакциной, которую вводили в 10 – 12-дневном возрасте в дозе 1 мл, а через 10 дней инъекцию повторяли в дозе 2 мл, снизила заболеваемость поросят на доращивании до 3,1%, вынужденный убой – 1,2 и падеж – до 1,5. Средняя масса тела одного животного у вакцинированных животных была на 4,2 кг выше, чем в контрольных животных.
В случае возникновения болезни меры борьбы с микоплазмозом свиней основываются на разрыве эпизоотической цепи, предотвращении контракта между больными и здоровыми животными, улучшении условий содержания, кормления и исключении стрессовых факторов, снижающих резистентность организма. Больных животных изолируют и лечат, а имевших контакт с ними обрабатывают антибактериальными средствами. При широком распространении болезни допускается замена маточного поголовья новым, завезенным из благополучного хозяйства.
Данное инфекционное заболевание относят к наиболее опасным и распространенным на территории РФ. Чаще всего диагностируют микоплазмоз КРС и свиней, однако также патология может поражать птиц. Особенность заболевания в том, что его возбудителями являются микроорганизмы, у которых отсутствует стенка клетки. Из-за этой особенности микоплазмоз плохо лечится традиционными антибиотиками предыдущих поколений, а потому требует применения новейших эффективных препаратов. Отсутствие своевременного ветеринарного вмешательства чревато развитием множества осложнений, приводящих хозяйства к крупным экономическим убыткам. Летальность может составлять 10-15% от общего числа больных особей.
Причины микоплазмоза животных
В природе существует более 10 видов микоплазм – микроорганизмов, схожих с бактериями, однако отличающихся по структуре.
К основным причинам, вызывающим заболевание, относят:
- нарушение гигиены в месте содержания животных;
- сырость, повышенная влажность воздуха в помещениях;
- снижение иммунитета отдельных особей из-за плохого микроклимата, питания;
- покупка в стадо зараженной особи со скрытыми клиническими проявлениями болезни (инкубационный период микроорганизмов достигает 27 дней).
Заражение происходит аэрогенным путем – при дыхании. Особенно чувствительны молодые особи. Чаще всего болеют поросята в возрасте от 3 до 10 недель. Микоплазмоз телят обычно развивается в 15-60-дневном возрасте.
Симптомы микоплазмоза
Среди общих проявлений патологии выделяют:
- воспаление, болезненность коленных и запястных суставов с образованием свищей;
- хромота;
- покраснение глаз;
- апатия, отсутствие аппетита;
- повышение температуры тела до 40,1-40,5°С;
- чихание, слизистые выделения из носа;
- кашель, затрудненное дыхание (чаще у поросят).
У взрослых коров болезнь поражает вымя, поэтому молоко приобретает желтый цвет, его консистенция становится неоднородной, а объем удоев падает.
Заражение приводит к многочисленным осложнениям:
- у коров – маститам, эндометритам, вульвовагинитам, преждевременному прерыванию беременности, рождению слаборазвитого потомства;
- у телят – артритам, пневмониям, менингитам, ринитам, конъюктивитам;
- у быков – эпидидимитам, орхитам;
- у свиней – воспалению легких, респираторным заболеваниям.
При отсутствии лечения у коров может развиться бесплодие. Поросята с респираторными осложнениями могут погибнуть от удушия.
Диагностика
Диагноз ставят на основе внешнего осмотра, клинических проявлений и лабораторных исследований тканей, выделений, абортированных или мертворожденных плодов. В лаборатории для обнаружения возбудителя используют метод ПЦР.
Лечение микоплазмоза
Единственным эффективным методом лечения является применение антибиотиков. При микоплазмозе используют препараты последнего поколения, так как к традиционным антибиотикам у микроорганизмов, вызывающих микоплазмоз, вырабатывается резистентность.
Компания NITA-FARM предлагает использовать при микоплазмозе препарат Лексофлон – антибиотик последнего поколения фторхинолонов.
- В основе – левофлоксацин, вещество, относящееся к фторхинолонам ІІІ поколения.
- Лечение широкого спектра инфекций, имеющих резистентность к антибиотикам предыдущего поколения.
- Биодоступность препарата составляет 99%.
- Уже через 2 часа после применения он достигает максимальной эффективности, хорошо проникая в ткани.
- 100% результативность в течение 24-48 часов.
- Одинаково эффективен при лечении микоплазмоза свиней и КРС.
- Достаточно одной ежедневной инъекции в течение 3-5-дневного курса.
- В течение 2 суток полностью выводится из организма, в основном, с мочой.
- Уже через 48 часов после применения препарата молоко можно использовать в пищевых целях.
Эффективность подтверждена клиническими исследованиями и соответствующими документами. Заказать Лексофлон можно непосредственно в компании NITA-FARM.
Профилактика
Ветеринарам и работникам хозяйств следует соблюдать следующие рекомендации:
- поддерживать чистоту в местах содержания животных;
- выпаивать телят молоком, проверенным на отсутствие микоплазм;
- особое внимание уделять случаям мастита, ринита и проверять животное на наличие инфекции;
- заботиться о полноценном рационе для повышения иммунитета;
- избегать стрессовых факторов в виде повышения влажности, перепадов температуры.
Хотя микоплазма (Mycoplasma hyorhinis) представляет собой комменсал, она может вызвать серьезные внутренние заболевания через механизмы, которые до сих пор не до конца изучены.
Полисерозит и артрит являются главными тяжелыми заболеваниями, поражающими свиней, выкормивших поросят. Как правило, гемофилёз и стрептококк считаются главной причиной таких случаев поражения животных. Однако за последние годы было замечено, что микоплазма (М. hyorhinis) также играет роль в развитии полисерозита и артрита, увеличивая процент заболеваемости и смертности. Эту бактерию часто обнаруживают на свинофермах, связывая ее с поражением верхней части респираторного тракта свиней. Считается, что поросята инфицируются от свиноматок или от старших поросят. Хотя микоплазма hyorhinis представляет собой комменсал, она может вызвать серьезные внутренние заболевания через механизмы, которые до сих пор не до конца изучены. Как полагают, различие между породами, сопутствующие инфекции и определенные условия содержания усугубляют болезнь, способствуя ее прогрессированию.


Рис. 1. Хромота после отъема поросят от свиноматки – частый клинический признак, наблюдаемый при внутреннем поражении микоплазмой hyorhinis.
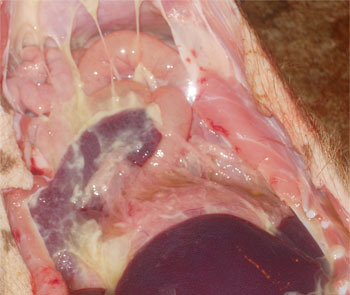
Клинически выявленные симптомы включают жар, одышку, хромоту, нежелание двигаться у поросят в возрасте от 3 до 15 недель (Рис. 1) Клинические симптомы и поражения были значительно выражены в результате экспериментальных прививок. Острые поражения характеризуются плевритом, фибринозным перикардитом и перитонитом (Рис.2). Хронические поражения характеризуются плевральными и перикардиальными спайками. В итоге микоплазма hyorhinis вызывает главным образом артрит, который зачастую поражает задние ноги поросят. Суставы могут содержать большее количество жидкости и фибрина, при этом синовиальная мембрана - утолщенная и красная. Грубые поражения и те, что наблюдались по гистопатологии, оказались идентичными поражениям, вызванным болезнью Глассера, поэтому требуется выполнить ПЦР-тест или попытку бактериальной изоляции, чтобы правильно диагностировать этиологию болезни и определить соответствующие антибиотики для лечения пострадавшего поголовья скота.
 |
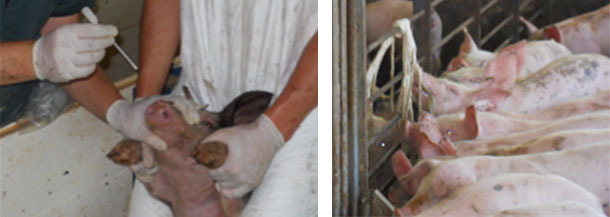
| Рис. 3. Сбор мазков из носовой полости у молочных поросят на выявление микоплазмы hyorhinis |