L-sil что это за инфекция
За последние 10-15 лет, уровень заболеваемости и смертности на фоне рака шейки матки значительно возрос и продолжает расти, поэтому так актуально знание алгоритмов диагностики и ведения женщин разного возраста с различной степенью поражения цервикального эпителия.
Комплексная профилактика и борьба с РШМ
Первичная:устранение факторов риска и вакцинация против ВПЧ (вируса папиломы человека).
Вторичная:цервикальный скрининг и лечение выявленных предраковых заболеваний ШМ (шейки матки).
Третичная: лечение РШМ (рака шейки матки) и паллиативная помощь.
Клинические проявления ВПЧ-ассоциированных заболеваний шейки матки
Морфологическая классификация изменений цервикального эпителия (ВОЗ, Bethesdasystem, 2002г.)
То ,что вы можете увидеть в заключении цитологического мазка с шейки матки.
Стадии прогрессирования заболевания:
-
инфицирование ВПЧ, койлоцитоз, или спустя месяцы — CIN I: плоскоклеточные и интраэпителиальные поражения низкой степени риска (ASCUS, LSIL);
-
спустя годы — CIN II и CIN III: плоскоклеточные и интраэпителиальные поражения высокой степени риска (HSIL);
-
спустя десятилетия — рак.Морфологическая классификация изменений цервикального эпителия (ВОЗ, Bethesdasystem, 2002г.)
I группая форма: бессимптомное вирусоносительство.
-
плоские кондиломы: типичная структура с множественными койлоцитами;
-
малые формы: поражение метапластического эпителия с единичными койлоцитами (небольшая пунктуация и легкая мозаика);
II группа
Интраэпителиальная неоплазия ШМ (LSIL, HSIL), вызванная онкогенными типами ВПЧ высокого риска и преинвазивный рак in situ.
При выборе метода цитологического исследования, предпочтение отдается жидкостному методу.
Преимущества жидкостной цитологии: улучшенное качество материала, длительный срок хранения биоматериала, можно приготовить несколько цитологических препаратов, приготовление стандартизированного монослойного мазка, стандартизированные методики окрашивания.
Диагностика ВПЧ:
мазок из цервикального канала на ВПЧ высокого онкогенного риска , скрининг 14 типов. ( причем типирование обязательно, потому что существую
Кольпоскопия
Желательно использовать этот метод как скрининг ежегодно .
Задачи: оценка состояния эпителия ШМ и влагалища, выявление очага поражения, дифференциация доброкачественных изменений от подозрительных, прицельная биопсия (в 25% случаев без контроля кольпоскопии не позволяет обнаружить интраэпителиальные поражения).
Тактика ведения ASCUS при ВПЧ+ у женщин 25+ лет
Нормальная кольпоскопическая картина → кольпоскопия + (ВПЧ + цитология) ежегодно.
Аномальная кольпоскопическая картина → биопсия и лечение.
Важно!! Необходимость лечения ИППП и восстановления микробиоценоза влагалища ( иследование микробиоценоза методом Фемофлор более информативно)
* У многих женщин с интраэпителиальными неоплазиями обнаруживается воспаление, которое способствует утяжелению процесса или маскирует имеющиеся изменения в сторону ложно+ или ложно- результатов.
* Выявлена взаимосвязь между тяжестью заболевания с распространенностью разнообразных микробиомов и низким уровнем lactobacillus spp.
* Роль других инфекций в развитии папилломавирусной инфекции
-
Вызывают иммунодефицит, снижая противовирусную защиту.
-
Способствуют персистенции ВПЧ в клетках эпителия.
- перед исследованием за 24 часа нельзя спринцеваться, вводить во влагалище медикаменты и тампоны. За сутки необходимо исключить половой акт;
- забор мазков производиться до бимануального обследования и проведения расширенной кольпоскопии.
- I — нормальный цервикальный эпителий здоровой женщины;
- II — элементы воспаления, легкая атипия;
- III — дисплазия;
- IV — подозрение на рак;
- V — рак.
- DELFI
- Woman
- Здоровье
- Здоровье
- начало половой жизни до 18 лет;
- роды до 16 лет;
- большое количество сексуальных партнеров;
- заболевания, связанные со снижением иммунитета (ВИЧ, сахарный диабет);
- использование лекарств, подавляющих иммунитет;
- отказ от презервативов. Этот способ предохранения не может полностью защитить от заражения вирусами, тем не менее, снижает риск инфицирования;
- курение.
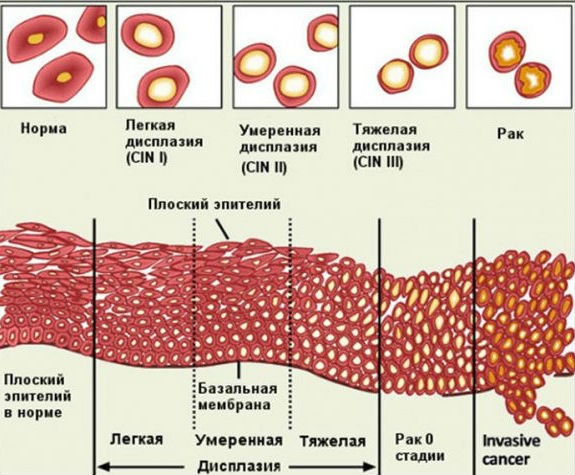
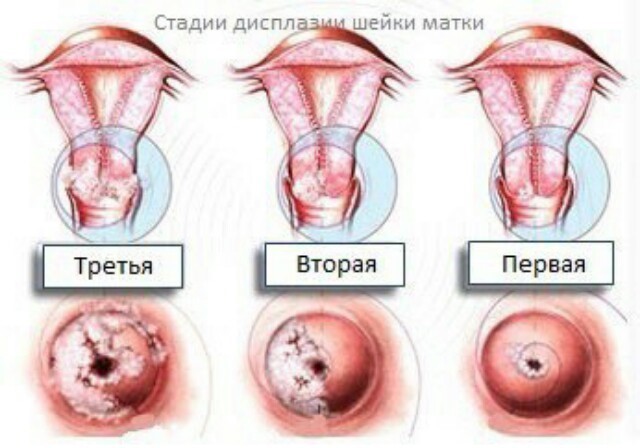
- Дисплазия шейки матки 1 степени (слабая).
- Легкая дисплазия. Изменения только нижнего слоя эпителия затрагивают не более ⅓ его толщины.
- Дисплазия шейки матки 2 степени (умеренная).
- Изменения выражены умеренно. Поражения занимают до ⅔ всего эпителиального слоя.
- Дисплазия шейки матки 3 степени (тяжелая).
- Значительно выраженные изменения вплоть до появления начальных признаков карциномы. Поражен эпителий во всех слоях, но выхода за пределы базальной мембраны нет.
- Выделения из половых путей. Изменение их обычной консистенции, цвета, запаха, как правило, побуждает женщину обратиться к врачу и пройти тщательное гинекологическое обследование. Чаще всего при дисплазии шейки матки выделения бывают обильными, окрашенными в белый цвет, имеют неприятный запах.
- Появление в выделениях прожилок крови после полового акта или использования тампонов.
- Болезненные ощущения во время полового контакта.
- Тянущие боли внизу живота. Возникают при тяжелой форме дисплазии шейки матки.
- КЛЮЧЕВЫЕ СЛОВА: папилломавирусная инфекция, шейка матки, беременность, ВИЧ, скрининг, дискариоз, кольпоскопия, Генферон
- возраст 18 – 50 лет, наличие интраэпителиального поражения шейки матки низкой степени (LSIL) по данным цитологического исследования цервикального мазка;
- наличие ВПЧ высокоонкогенного риска по данным Digene-теста; способность выполнять требования протокола;
- предоставление письменного информированного согласия.
- беременность;
- тяжелые нарушения функции сердца, легких, печени и почек в стадии декомпенсации; гиперчувствительность к интерферону или другим компонентам препарата, которая устанавливалась по данным анамнеза или в момент первого введения препарата;
- прием противовирусных или иммуномодулирующих препаратов в течение трех предшествующих месяцев;
- наличие более тяжелой патологии шейки матки;
- подтвержденная ВИЧ-инфекция;
- наличие психоневрологических заболеваний.
- регресс ВПЧ-ассоциированных изменений шейки матки по данным Пап-теста и кольпоскопии;
- достижение отрицательного результата Digene-теста на ВПЧ высокого онкогенного риска.
ВПЧ и иммунитет
Течение ВПЧ-инфекции (персистенция и развитие до клинически значимых форм или регресс) зависит от активности иммунной системы.
* Согласно данным исследований, очень ограниченное количество лекарственных средств имеют доказанный эффект в отношении CIN и ВПЧ.
* Пациентки с CIN 3 и карциномой должны быть консультированы онкогинекологом .
* Папилломавирусная инфекция у беременных женщин (поражения ШМ)
-
При наличии поражения ШМ LSIL у беременных женщин проводится кольпоскопия (предпочтительно, но допустимо отсрочить до 6 недель и провести после родов).
2. При отсутствии LSIL по данным кольпоскопии — обследование после родов.
3. При наличии LSIL — ведение согласно клиническим рекомендациям.

Изменения шейки матки при раке и предопухолевых состояниях часто протекают бессимптомно и обычный осмотр не всегда укажет на патологию. Скрининговые программы позволяют своевременно выявить изменения, определить причину и назначить лечение.
Предрасположенность к раку шейки матки определяется генетическими маркерами, но вклад в развитие патологии составляет не более 1% из всех случаев. Большое влияние оказывают внешние и внутренние факторы. Нарушения гормонального фона и питания ткани, локальное состояние иммунитета — определяют внутреннюю причину, по которой возникают предраковые изменения. Ранняя активная половая жизнь, частая смена половых партнеров и частые роды, применение гормонсодержащих контрацептивных препаратов, наличие ИППП в анамнезе являются внешними факторами риска развития рака шейки матки.
В 85% случаев рак шейки матки ассоциирован с ВПЧ.
ВПЧ и рак шейки матки
ВПЧ — ДНК-содержащий вирус. Вирус обладает родством к эпителиальным клеткам. После проникновения в клетки, вирус запускает синтез собственного генетического материала. Зараженные эпителиальные клетки начинают активно делится. Но из-за нарушений, клетки эпителия остаются незрелыми. Эпителиальный пласт не формируется должным образом. Возникает дисплазия.
В шейке матки в 90% случаев вирус может элиминироваться из организма благодаря внутренним резервам организма женщины. Но длительное нахождение вируса в клетках в 10% случаев провоцирует цервикальные интраэпителиальные неоплазии (CIN). Выделяют три гистологических класса CIN: легкой (CIN I), умеренной (CIN II) и высокой степени (CIN III), при переходе одной в другую вероятность формирования рака увеличивается. Дисплазии легкой степени (CIN I) в 90% случаев инволюционируют в нормальную ткань или остаются в неизменном виде, 10% прогрессируют в CIN II. CIN II трансформируются в CIN III в 1 случае из 10. При персистенции ВПЧ более 3-х лет на фоне дисплазии высокой степени развивается рак. Такая ситуация наблюдается у половины женщин с диагнозом инвазивный рак.
Существует около 200 видов ВПЧ, но не каждый тип способен вызвать поражения шейки матки. ВПЧ 16 и 18 типов обычно выявляются при цервикальной интраэпителиальной неоплазии CIN III и инвазивном раке, поэтому назван вирусом высокоонкогенного типа. ВПЧ 6 и 11 типа часто ассоциирован с CIN I и CIN II и обладает низким онкогенным потенциалом.
| Наличие дисплазии выявляется при проведении цитологического исследования по Папаниколау (ПАП-мазок). В ходе анализа изучаются особенности строения клеток, их морфология, расположения, после чего выдается заключение о наличии или об отсутствии атипии клеток.
Для выполнения анализа материал должен быть получен с трех участков: влагалищной части шейки матки, цервикального канала и зоны трансформации. Зона трансформации — зона перехода многослойного плоского эпителия шейки матки в железистый эпителий цервикального канала. В зоне трансформации обычно начинаются предраковые изменения. |  |
Полученный материал переносится на предметное стекло и окрашивается, после чего врач-цитолог исследует образец под микроскопом. Если мазок, не содержит цилиндрический эпителий, то образец считается неинформативным и исследованию не подлежит.
Процесс забора мазка не стандартизован, поэтому могут быть получены ложноотрицательные результаты. Для того, чтобы избежать ложных ответов, нужно соблюдать правила забора образца. Ответственность лежит на медицинском персонале, результат зависит от квалификации человека.
Ответственность за правильную подготовку к исследованию лежит на пациенте. Перед сдачей мазка на цитологию женщина должна придерживаться простых правил подготовки:
В таком случае образец не будет содержать посторонних элементов, и лаборатория сможет выдать достоверное заключение.
Результат цитологического анализа
Цитологическая интепретация клеточного состава должна быть представлена лечащему врачу в клинически значимых терминах и определениях. Существует несколько цитологических классификаций. Наиболее распространенные это классификация по Папаниколау и Бетдеста.
В соответствии с классификацией Папаниколау мазки делятся на 5 типов:
Классификация Бетесда является международной. Она создана в качестве унифицированного инструмента передачи информации между врачами-цитологами и врачами-клиницистами.
Образец, в котором клетки трудно поддаются дифференцировке, и врач не может определить связаны ли изменения с дисплазией или это реактивное состояние, выводятся в класс ASC-US. При постановке такого диагноза пациентка должна находится под динамическим наблюдением.
Если врач-цитолог видит, что в эпителии присутствуют изменения доброкачественные и нет никаких настораживающих морфологических признаков, выводит в заключении NILM. NILM также обозначает норму и реактивные изменения.
Соответствия цитологических заключений: корреляция между классификацией дисплазией/карциномой in situ/, Bethesda system 2001 года и классификацией по Папаниколау.

Хотите читать
DELFI без рекламы?
Подпишитесь на DELFI plus и получите доступ к уникальному контенту без коммерческой рекламы.
Для женщины риск соприкоснуться за время жизни с 16 и 18 типами высокого риска ВПЧ составляет в среднем 20%. Он может варьировать в зависимости от образа жизни. Для большинства женщин, то есть для 80% из них, кто за время своей жизни соприкоснулся с каким-либо из этих типов высокового риска ВПЧ, инфекция не вызывает никаких симптомов. Только у оставшихся 20% женщин наблюдаются клинические изменения, которые именуют цервикальной интраэпителиальной неоплазией или ЦИН или, как ее именовали раньше, дисплазией.
Эти повреждения подразделяются на три степени тяжести. Первая степень тяжести относится к повреждению невысокого риска и обозначается "LSIL" (по- английски — low grade squamous intraepithelial lesion), а последующие две степени — к повреждениям высокого риска, которые согласно новой классификации объединены в одну и обозначаются HSIL (по- английски — high grade squamous intraepithelial lesion). В случае повреждения невысокого риска в активном лечении нет необходимости, в этом случае как врачу, так и пациенту надлежит быть терпеливыми и надлежит проводить наблюдение за состоянием. В применении антибактериальных и противогрибковых средств в этих случаях нет необходимости, так как такое применение не повлияет на течение инфекции.
Повреждения легкой степени чаще всего спонтанно регрессируют, в свою очередь в случае повреждений высокого риска (ЦИН II и ЦИН III или HSIL) лечение требуется незамедлительно.
Где и как можно лечить вызванные вирусом ВПЧ изменения шейки матки?
Если при повторных визитах через 6 месяцев и 12 месяцев по-прежнему наблюдаются изменения легкой степени в эпителии шейки матки, необходимо произвести осмотр шейки матки при увеличении при помощи колпоскопа и взять небольшой кусочек тканей на гистологический анализ. Эта манипуляция не является болезненной, но после нее несколько дней могут быть кровянистые выделения.
Что касается повреждений высокого риска, то мнения в отношении того, кому этих пациенток надлежит лечить, разделяются. Клинически это очень серьезная ситуация, которая вскоре может перейти в рак шейки матки или нередко имеют место случаи, когда рак находится рядом с этими изменениями эпителия, просто злокачественные клетки предыдущим цитологическим исследованием не обнаружены.
Исторически лечение повреждений шейки матки высокого риска всегда проводилось в Отделении гинекологии Латвийского Онкологического центра, однако в последние годы лечение проводится и в других учреждениях. Существенным являлось бы, чтобы эти пациентки продолжали наблюдаться у врачей, лучше всего — у того врача, который проводил эти инвазивные манипуляции. Женщины, у которых развилась эта эпителиальная неоплазия, находятся в группе повышенного риска по образованию у них вновь этой патологии. В организме этих женщин, очевидно, не срабатывает какой-то защитный механизм, и она становится восприимчивой к этому вирусу. Очень важно сказать этим женщинам, что им в дальнейшем всю жизнь регулярно придется наблюдаться у гинеколога с взятием онкоцитологического мазка и в случае необходимости — колпоскопий и биопсий.
Существуют доказанные факторы риска, которые чаще всего провоцируют патологии ВПЧ. Одним из них является гормональная контрацепция. Если раньше это было связано с наиболее частым инфицированием от механического воздействия, так как пользовательницы гормональной контрацепции не используют барьерные методы, то есть презервативы, то в настоящее время известно, что причиной являются находящиеся в составе таблеток эстрогены и прогестины, которые активизируют экспрессию генома вируса ВПЧ в эпителий шейки матки.
Вторым фактором являются выношенные беременности. Каждая выношенная беременность увеличивает релятивный риск рака шейки матки на 10%. Также риск увеличивает курение и другие параллельно имеющиеся инфекции — хламидиоз, вирус герпеса и ВИЧ.
Однако все перечисленные причины не позволяют нам сказать, у какой женщины вызванные ВПЧ повреждения эпителия шейки матки будут прогрессировать, а у какой — нет. У одной женщины за время жизни может быть много половых партнеров, она может инфицироваться 16 и 18 типами ВПЧ, у нее параллельно может быть хламидиоз и, например, 3 выношенные беременности, и у нее никогда не будет рака шейки матки, в то же время может быть женщина, у которой не было ни одной беременности, которая имеет одного верного партнера, и у нее в возрасте 30 лет обнаруживают рак шейки матки. Это свидетельствует о том, что в ближайшем или в далеком будущем еще ожидаются значительные открытия именно в патогенезе вызванных ВПЧ повреждений, так как имеется еще какой-то или несколько факторов, определяющих, прогрессирует ли повреждение.
Рак шейки матки
Характерными симптомами рака шейки матки у женщин являются контактные кровотечения. Это кровотечение, которое появляется после половых отношений в виде небольших алых, пачкающих выделений. Женщины их обычно воспринимают как выделения в связи с менструальным кровотечением, однако такие выделения не являются характерными для нормального менструального цикла. При появлении таких выделений обязательно необходимо посетить своего доктора.
Еще существенным было бы, чтобы женщины не боялись обращаться за помощью. Мы живем в другую эпоху, когда с онкологическими заболеваниями можно бороться и, главное, успешно. Обнаруженный на самой ранней стадии рак можно успешно лечить так называемой электроэксцизией шейки матки. В органах женщины и в ее дальнейшей жизни совершенно ничего не меняется после такой манипуляции, и она считается здоровой примерно через 6-8 недель, пока заживает шейка матки. В это время могут быть неприятные выделения, но они исчезают. Также в это время можно употреблять улучшающие микрофлору влагалища бактерии, это не вредит лечению.
Женщинам после 40 лет на ранней стадии рака шейки матки, особенно в случаях, когда в семье больше не планируется пополнение, предлагается сравнительно простая и малотравматичная операция. Женщина после этой операции поправляется также в течение 6-8 недель.
В случаях, когда опухоль с более глубокой инвазией, но по-прежнему причисляемая к ранним стадиям, проводится травматическая операция с удалением лимфатических узлов таза и парааортальных лимфатических узлов. И хотя результаты лечения у оперативной и лучевой терапии являются равноценными, в этих случаях для молодых женщин преимущество отдается оперативной терапии, так как после этого наблюдается более хорошее последующее качество жизни.
Еще сравнительно новым подходом является удаление шейки матки, так называемая трахэлектомия, когда оперируются те же лимфатические узлы и шейка матки, но сохраняется матка с целью возможности дальнейших родов женщины. В Латвийском Онкологическом центре операции такого рода проводятся, но необходимо более длительное время для того, чтобы можно было судить об отдаленных результатах.
В случае запущенного рака шейки матки женщинам назначается лучевая терапия вместе с химиотерапией.
В заключение хотелось бы напомнить, что с января 2010 года начата национальная скрининг-программа рака шейки матки, предусматривающая взятие онкоцитологического мазка бесплатно. Поэтому, дорогие женщины, получившие пригласительные письма, не позволяйте им пылиться или быть забытыми среди журналов и листков рекламы.
Наслаждайтесь жизнью и берегите себя.
Гинекологи консультируют и проводят исследования:
Амбулаторные хирургические операции, включая лапароскопию, проводятся:
Вакцинация против рака шейки матки проводится:
Кабинет вакцинации Veselības centrs 4 (VC4) в т/ц SPICE
Рига, улица Лиелирбес 29
Время работы: каждый день (7 дней в неделю) с 10:00 до 21:00 час.
тел. 66051813
Кабинет вакцинации Клиники Юглы VC4
Бривибас гатве 410, Рига, 5 этаж
Время работы: каждую среду с 9.00 до 17.00 час.
тел. 29487902 , 67136282
Отделение диагностики VC4
Рига, улица Бривибас 180, 3 этаж
Время работы: По рабочим дням с 9:00 до 17:00 час.
Тел.67844246
Кабинет вакцинации VC4
Рига, улица Кр.Барона 117, 123 кабинет.
Время работы: По рабочим дням с 8:00 до 19:00 час.
По субботам: с 9:00 до 13:00 час.
Тел. 67847140
Я знаю себе цену! И с кем-нибудь не буду прыгать в постель!
Знал бы мой папа! Но он узнал через три месяца… Потому что я плакала в подушку, но видимо подушка не заглушала моих стиснутых рыданий… Очень болел живот… Несколько часов назад с НИМ был секс, было почему-то больно. В животе все пекло.
Все всполошились, вызвали скорую. Оказалось, что у меня лопнуло желтое тело. Это такое место в яичнике, которое образуется после того, как из фолликула выходит яйцеклетка. А выходит она тоже через микро разрыв, так что это место слабенькое и от сильных нагрузок может лопнуть или надорваться. Мне повезло, обошлось без операции. Но об этом как-нибудь потом расскажу. Настоящие мои злоключения начались позже.
После выписки мне нужно было прийти к гинекологу на плановый осмотр. Я раньше никогда к гинекологам не ходила, как-то повода не было. Теперь понимаю, что надо было. Мама то мне особо ничего не рассказывала, а в интернете только запутаешься.
Короче, яичник мой зажил, все бы ничего, но на осмотре зеркалами - блин, Алиса в Зазеркалье, ё-моё((((! – докторше что-то там не понравилось. Она взяла мазок и назначила повторный визит по результатам. Потому что в этих-то самых зеркалах увидела каким-то аппаратом какую-то дисплазию.
Окей, Док! Что делать будем? Что такое биопсия?
Час от часу не легче – от меня отщипнут кусочек… Там, внутри, от шейки. Больно будет? Немножко? Блииииин….
Половым путем передается, говорите? Партнер может не иметь никаких признаков заражения? Решила с ним поговорить об этом.
Перед биопсией почти не спала. Естественно, штурмовала интернет! Который безжалостно, не то что доктор с добрыми глазами, объявил мне, что у меня предрак! Ну, вроде легкой степени. Биопсия определит, нет ли там других степеней.
Процедуру перенесла нормально, чуть заныл низ живота. У доктора руки-бабочки, порхали быстро и уверенно, так что я даже подумала, что все позади и придет результат, что нет у меня никакой дисплазии, что все хорошо. А пошел на фиг Интернет и долбанная статистика, из-за которых у меня на глазном дне светятся 1-2% тех, у кого выявляется тяжелая дисплазия или начальный рак после подобных процедур с такими исходными данными, как у меня.
Дисплазия НИКАК не проявляется, ты ничего не чувствуешь.
Только если ты ВОВРЕМЯ попала к гинекологу и сдаешь регулярно РАР-тест или онкоцитологию, то по этому мазку и определяет лаборант – норма у тебя в клетках шейки матки или нет.
Существует цитологическая классификация – по клеткам. Это норма – NILM, дисплазия легкой степени – LSIL, дисплазия тяжелой степени – HSIL, дальше – рак. И как уже и ежику понятно, что при наличии причины (ВПЧ), развитие дисплазии – это лишь дело времени, активности вируса и сопротивляемости организма.
Когда при РАР-тесте находят дисплазию, то как правило дообследуют – на ВПЧ и другие инфекции, которые передаются половым путем, делают кольпоскопию (осмотр шейки матки в микроскоп с увеличением в 15-20 раз). Следующий этап – биопсия в тех местах, которые при кольпоскопии выглядят как диспластические. Это называется прицельная биопсия.
Все то, что отщипнули при биопсии, отправляют на гистологическое исследование. Это уже не просо клетки, это ткани со своими слоями и очередностью клеток. И вот по гистологической классификации тоже выделяют норму, легкую дисплазию CINI и тяжелую CINII-CINIII, дальше… да, правильно догадались – рак!
Я прошла через все это. Спасибо моему доктору, что направил меня к онкологу в частную клинику, где в хороших условиях, в отдельной палате, без очереди и встреч с истинно онкобольными, мне сделали все процедуры. Спасибо моим родителям, которые поддерживали и оплатили все это.
Мне посоветовали сделать вакцинацию от ВПЧ. Ту, что делают девочкам и мальчикам с 9 лет - ДО начала половой жизни. У них эффективность противостояния вирусу доказана. У таких, как я – пока только на нескольких сотнях человек. Но я согласилась на этот научный эксперимент.
Опять эта статистика! Я буду в той группе, которая покажет дулю вирусу и, даже если я с ним снова встречусь, он меня не тронет!
Мне 21 год. У меня был предрак. У меня нет полшейки. При беременности (согласно статистике) это может быть причиной невынашивания или, наоборот, невозможности открытия шейки матки во время родов, тогда только кесарево. Но я здорова, могу любить, могу иметь детей, могу дожить до старости. Я ведь не только про РАР-тест теперь знаю, но и про check-up в любом возрасте.
К чему это я все? Говорят, что все, что с нами случается, делает нас сильнее. Я бы не хотела знать то, что я знаю – о степенях дисплазии и рака шейки матки, про конизацию и синьку, которой красят края моей уже отрезанной шейки, чтоб гистолог видел, не распространяется ли предрак за эти края, про ужасы организации помощи онкобольным в нашей стране.
Но я хочу знать СТАТИСТИКУ распространенности рака шейки матки и СТАТИСТИКУ вакцинации от вируса папилломы человека! И я хочу видеть снижение первой и резкое повышений второй!
Дисплазия шейки матки - найти и вылечить! Иначе - рак…

Дисплазия шейки матки – это заболевание, характеризующееся нарушением клеточного строения поверхностного слоя шейки матки, самая частая форма предрака шейки матки, промежуточного состояния между раком и аномальным развитием клеток, пока еще не представляющих опасность. Это означает, что без правильного лечения возможна трансформация изменившихся клеток в злокачественную опухоль. В редких случаях дисплазия исчезает без лечения. Заболевание диагностируют в любом возрасте.
Причины дисплазии шейки матки
Основной причиной считают инфицирование вирусом папилломы человека, ВПЧ. Вирус имеет множество подтипов – около 200, часть из них обладает канцерогенными свойствами. 16 и 18 подтипы вызывают 70% предраковых и раковых заболеваний шейки матки, другие штаммы – генитальные бородавки или кондиломы. Заражение ВПЧ происходит только половым путем. Риск инфицирования повышен в следующих случаях:
Методы диагностики дисплазии шейки матки
Самым простым и информативным тестом считают Пап-мазок. Анализ имеет и другие названия: Пап-тест, мазок на цитологию, мазок на атипичные клетки, мазок Папаниколау. Врач-гинеколог берет мазок с поверхности шейки матки во время осмотра, это безболезненная процедура. Затем врач-лаборант исследует под микроскопом форму, размер, количество, расположение, состав клеток. Исследование нужно проводить ежегодно, начиная с 18 лет.
Т.к. некоторые штаммы ВПЧ считают канцерогенными, проводят исследование мазка из влагалища на обнаружение ДНК этих возбудителей. Исследование выполняют методом полимеразной цепной реакции (ПЦР), делают качественный анализ с типированием. Исследование на онкогенные вирусы обязательно у женщин старше 30 лет и в том случае, если есть невыраженные изменения в Пап-тесте. Определение уровня антител к вирусам в крови не информативно.
При обнаружении атипичных клеток в Пап-тесте проводят биопсию. Для этого во влагалище вводят оптическую систему – кольпоскоп. Она помогает врачу увидеть наиболее измененные участки и взять фрагмент ткани.
Степени дисплазии.
По результатам исследования биоптата дисплазии – ее еще называют цервикальной интраэпителиальной неоплазией (CIN) – может быть сгруппирована по категориям:
Симптомы дисплазии шейки матки

В подавляющем большинстве случаев никаких симптомов заболевания нет. Именно поэтому врачи настаивают на регулярном гинекологическом осмотре.
Вместе с тем, в качестве симптомов иногда появляются:
Лечение дисплазии шейки матки
Зависит от степени дисплазии, возраста женщины, репродуктивных планов. Без лечения возможна трансформация дисплазии в рак. Поэтому при обнаружении данного заболевания необходимо срочно обратиться к врачу акушеру-гинекологу.
Меры профилактики
Для того чтобы лечение дисплазии шейки было успешным и болезнь не повторилась, женщина через 3-4 месяца должна обязательно пройти контрольный профилактический осмотр, позволяющий проверить, как прошло заживление. Контроль проводится с помощью гистологического исследования мазка, взятого с поверхности шейки. Если анализ покажет, что все в порядке, то обследование достаточно повторять 1 раз в год.
Укрепление иммунитета, повышение сопротивляемости организма является одной из основных мер профилактики появления дисплазии. Для этого женщина должна правильно питаться, бороться с нехваткой витаминов. После 30-40 лет рекомендуется принимать комплексные препараты с витаминами С, А, группы В. В комплексах должен содержаться так называемый противораковый элемент селен.
Важно вовремя обращаться к врачу и лечиться при наличии заболеваний половых органов.
Множественные исследования, проведенные у пациентов с папилломавирусной инфекцией, фиксируют достоверные изменения в иммунной системе на системном и локальном уровнях. Это заставляет искать возможные консервативные средства, ускоряющие регресс данной патологии (27). Данные клинических испытаний различных иммуномодулирующих средств противоречивы (7). Опубликованные результаты мета-анализа не позволяют однозначно судить о возможности использования данных средств (10). Большие надежды возлагаются на потенциал экзогенных интерферонов, которые могли бы повысить локальный иммунитет и снизить активность вируса (2). Интерес представляет отечественный препарат Генферон® в форме суппозиториев, который успешно используется в лечении урогенитальных заболеваний вирусной и бактериальной этиологии. Его основными компонентами являются интерферон человеческий рекомбинантный α-2, таурин и анестезин (1).
Принимая во внимание широкий спектр терапевтических эффектов данного препарата (иммуномодулирующее, противомикробное, противовирусное, репаративное, противовоспалительное, мембрано- и гепатопротекторное, антиоксидантное, нормализующее метаболические процессы действие), он представляется перспективным для лечения LSIL, ассоциированных с высокоонкогенными типами ВПЧ (1, 2).
Изучение терапевтической эффективности и безопасности препарата Генферон® для лечения плоскоклеточных интраэпителиальных поражений шейки матки низкой степени, ассоциированных с вирусами папилломы человека (ВПЧ) высокоонкогенного риска по данным цитологического исследования цервикальных мазков и кольпоскопии, а также оценка возможности элиминации ВПЧ по данным Digene-теста.
Материалы и методы
Вариант исследования – сравнительное рандомизированное двойное слепое плацебо-контролируемое клиническое исследование. Исследование было выполнено на базе Научного центра акушерства, гинекологии и перинатологии Росмедтехнологий в течение 2007 года.
Материал – 40 женщин репродуктивного возраста, инфицированных ВПЧ высокоонкогенного риска по данным Digene-теста, результаты цитологического исследования у которых свидетельствовали о наличии LSIL (в соответствии с классификационной системой Бетесда).
ВПЧ Digene-тест – единственный метод, одобренный FDA для цервикального скрининга и лицензированный Федеральной службой РФ по надзору в сфере здравоохранения и социального развития, осуществлялся в лаборатории иммунологии Центра. Для проведения ПЦР-диагностики были использованы тест-системы, зарегистрированные в МЗ и СР РФ и/или получившие сертификаты производства ГИСК им. Л.А. Тарасевича. Забор материала для проведения исследований производился в одно и то же время суток (утром).
Пап-тест – микроскопическое исследование соскоба клеток цервикального эпителия, взятого с помощью специальных щеток – эндобрашей и шпателей, проводился в лаборатории патоморфологии Центра.
Кольпоскопия проводилась при помощи кольпоскопа фирмы Leisegang (Германия), с использованием традиционных сосудистых тестов и увеличением ×7,5, ×15, ×30.
Критериями включения в исследование были:
Критериями исключения были:
До начала исследования было получены одобрения Федеральной службы РФ по надзору в сфере здравоохранения и социального развития, национального и локального этических комитетов.
По результатам проводимой рандомизации (выбор одной из двух серий суппозиториев методом случайных чисел), включенным в исследование пациенткам назначались исследуемый препарат или плацебо. Введение суппозиториев Генферон®, содержащих 500000 МЕ интерферона α-2, или внешне неотличимых от них суппозиториев-плацебо, не содержащих ИФН-α и таурин, осуществлялось интравагинально 2 раза в сутки в течение 10 дней с последующим назначением 1 раз в сутки через день в течение трех месяцев. Кодировка суппозиториев осуществлялась в ФГУН ГИСК им. Л.А. Тарасевича.
На протяжении всего исследования женщины использовали барьерные методы контрацепции и вели дневник, в котором отмечались побочные эффекты терапии, их выраженность и продолжительность.
Через три месяца (визит 2) после первого введения суппозиториев проводились: Пап-тест, кольпоскопия, Digene-тест на ВПЧ высокого онкогенного риска, бактериоскопический анализ вагинального мазка, осуществлялась ПЦР-диагностика на другие инфекции в соскобе эпителия цервикального канала.
Через 6 месяцев (визит 3) женщинам, включенным в исследование, проводились: Пап-тест, Digene-тест и кольпоскопия, проверялись дневники, где были записаны все препараты, которые пациентки принимали на протяжении исследования с момента подписания информированного согласия до заключительного визита. Оценивались локальные и системные эффекты, которые могли бы быть связаны с использованием препарата. Переносимость и безопасность препарата оценивались по частоте и выраженности нежелательных явлений.
Возможность досрочного выбывания из исследования была предусмотрена на любом этапе клинических испытаний – как по инициативе пациентки, так и по инициативе исследователя. Причины выбывания указывались в истории болезни и индивидуальной регистрационной карте (ИРК). В случае проведения хирургического лечения плоскоклеточного интраэпителиального поражения шейки, а также применения противовирусных препаратов в процессе исследования, пациентка исключалась из исследования.
ИРК пациенток заполнялась на основании опроса и осмотра, данных клинического обследования и лабораторных исследований. По завершении исследования формировались два массива данных, которые подвергались анализу.
Критериями эффективности применения препарата являлись:
Показатели, полученные у обследованных пациенток, обрабатывали методами вариационной статистики – использовались описательная статистика и непараметрический анализ данных (Mann-Whitney U Test, Kolmogorov-Smirnov Test). Для статистического анализа частотных показателей использовался метод углового преобразования Фишера (вычисление ФИ* критерия) (30). Различие между сравниваемыми величинами признавалось достоверным при Р 0,05).
Основные исходные характеристики групп пациенток представлены в таблице 1.
У 9 из 40 испытуемых (у 5 женщин I группы и у 4 женщин II группы) в анамнезе зарегистрирована патология шейки матки (ШМ), по поводу которой они получали лечение. Предшествующая терапия шейки матки пациенток с LSIL включала: Ваготил – у 1 женщины, мазевые аппликации – у 2, криотерапия – у 3, лазеротерапия – у 1, диатермоэлектрокоагуляция – у 1, другие методы – у 1 пациентки.
Кольпоскопическая картина поражений шейки матки при LSIL характеризовалась наличием патологической зоны трансформации в 29 случаях из 40 (72%). Норма выявлена у 4 из 23 женщин I группы (17,4%) и у 7 из 17 женщин II группы (41,2%).
Обращала на себя внимание высокая специфичность признака ацетобелый эпителий (АБЭ) вне и в пределах зоны трансформации шейки матки (ЗТ ШМ) (отмечен у 24 из 40 женщин – 60%). Обнаруживались также йоднегативная и йодпозитивная мозаика, пунктация, гиперкератоз, йоднегативные участки. В двух случаях, наряду с плоскими поражениями, кольпоскопически были выявлены небольшие остроконечные кондиломы. Сильно выраженные аномальные признаки были у 7 из 23 и у 6 из 17 пациенток групп I и II, соответственно (отмечался густой АБЭ и высокоатипическая ЗТ ШМ). У остальных пациенток кольпоскопическая картина носила характер низкой атипии или нормы, т. е. процесс, по-видимому, был локализован внутри цервикального канала. Таким образом, кольпоскопическая картина пришла в норму через три месяца наблюдения у 3 и 2 женщин I и II групп, соответственно (13,0% и 11,8%), и у 6 и 4 женщин (28,6% и 26,7%) соответственно через 6 месяцев (Р > 0,05). Таким образом, статистически значимых различий между группами выявлено не было.
ШМ проводили всем женщинам обеих групп (n=40) трижды с перерывом в 3 месяца. Материал был представлен соскобом клеток с экзоцервикса и эндоцервикса, взятых с помощью шпателя и щетки-эндобраша, который наносили на предметное стекло. Выявлялись койлоциты, дискератоциты, дискариоциты, дистрофически измененные клетки, псевдодискариоз, нейтрофильные лейкоциты, лимфоциты, плазматические клетки, базальные/парабазальные клетки, двухядерные клетки, голые ядра (таблица 3).
Основным цитологическим признаком LSIL считается: наличие клеток с койлоцитозом, которые были обнаружены в мазках с ШМ у 34 из 40 женщин (85%); клеток с дискератоцитозом (обнаружены у 21 из 40 женщин – 52,5%), клеток с дискариозом (у 12 из 40 женщин – 30%); клеток с многоядерностью (у 6 из 40 женщин – 15 %).
В зависимости от локализации материала мазка и наличия эктопии с ЗТ, в мазки также попадали неизмененные клетки многослойного плоского эпителия, метапластические клетки, базальные/парабазальные клетки и клетки цилиндрического эпителия, клетки, свидетельствующие о хроническом воспалении.
Полученные результаты представлены в виде 4 основных групп, согласно классификации Бетесда: LSIL, HSIL, ASCUS, норма (таблица 4).
Digene-тест на выявление 13 онкогенных типов ВПЧ в клинически значимой концентрации был положителен у всех 40 женщин в начале исследования.
Данные цитологического, кольпоскопического исследования и Digene-теста на ВПЧ у женщин с LSIL шейки матки в динамике наблюдения (n=40) представлены в таблице 4.
Через 3 месяца после начала терапии у 9 из 23 пациенток (39,1%), получавших Генферон®, был достигнут отрицательный результат Digene-теста (менее 0,8 ЕД), через 6 месяцев отрицательный результат Digene-теста был достигнут у 15 пациенток из 22 (68,2%). В группе пациенток, получавших плацебо, отрицательный результат Digene-теста через 3 месяца был достигнут у 2 из 17 пациенток (11,8%), через 6 месяцев – у 4 пациенток из 15 (26,7%). У 4 из 17 наблюдалось увеличение содержания ВПЧ по данным количественного теста.
Проведение Пап-теста через 3 месяца после начала лечения выявило регресс ВПЧ-ассоциированных изменений шейки матки у 13 из 23 пациенток, получавших Генферон® (56,5%), через 6 месяцев – у 18 пациенток из 22 (81,8%). При этом регресс ВПЧ-ассоциированных изменений шейки матки у пациенток, получавших плацебо, через 3 месяца наблюдался только у 6 пациенток из 17 (35,3%), через 6 месяцев – у 6 из 15 (40%). У одной женщины I группы через 6 месяцев наблюдения было выявлено прогрессирование процесса в более высокую стадию (HSIL), по поводу чего ей была проведена эксцизия и диагноз CIN II был подтвержден гистологически.
Как видно из таблицы 4, в результате проведения кольпоскопии у трех пациенток из 23 (13,0%), получавших Генферон®, выявлен регресс патологических изменений эпителия шейки матки через 3 месяца и у 6 из 21 (28,6%) – через 6 месяцев. У пациенток, получавших плацебо, через три месяца регресс патологических изменений отмечен у 2 пациенток из 17 (11,8%), через 6 месяцев – у 4 из 15 (26,5%).
У 3 из 23 (13,0%) пациенток, получавших Генферон®, проведенная в начале исследования бактериоскопия вагинального мазка выявила II-III степень чистоты влагалища. У всех пациенток бактериоскопическая картина нормализовалась к 3 месяцу исследования без дополнительной терапии. У 1 пациентки данной группы было выявлено присутствие грибов Candida albicans без клинических проявлений, которые через 3 месяца приема препарата отсутствовали. У 1 пациентки при нормальной картине бактериоскопии вагинального мазка в начале исследования было обнаружено повышенное содержание лейкоцитов через 3 месяца наблюдения. Достоверной разницы с группой плацебо по данным показателям не отмечено.
ПЦР-диагностика выявила наличие у 1 пациентки первой группы вирусов простого герпеса (ВПГ) I и II типов в начале исследования и их отсутствие через 3 месяца. У 1 пациентки с отрицательным тестом на ВПГ в начале исследования, через 3 месяца был обнаружен ВПГ I типа. Проведение ПЦР в начале исследования выявило наличие ВПГ I типа и цитомегаловируса (ЦМВ) у 1 из 17 пациенток, получавших плацебо, через 3 месяца у этой пациентки был выявлен только ВПГ I типа. Кроме того, у одной пациентки II группы через 3 месяца был выявлен ВПГ I типа, не обнаруженный в начале исследования. Таким образом, достоверной разницы между группами по указанным параметрам обнаружено не было. Нежелательные явления наблюдались как у пациенток, получавших Генферон®, так и у пациенток, получавших плацебо. Эти нежелательные явления классифицировались как легкие, носили преходящий характер, не требовали медикаментозной коррекции и не привели к выбыванию пациенток из исследования. Серьезных побочных эффектов не было отмечено ни в одной из групп. У одной женщины первой группы были гриппоподобные симптомы, по одной пациентке из каждой группы жаловались на кратковременный зуд вульвы.
Таким образом, вагинальное применение препарата Генферон® в дозе 500000 МЕ по указанной выше схеме безопасно. Эффективность лечения по двум основным критериям (регресс ВПЧ-ассоциированных изменений шейки матки и отрицательный результат Digene-теста) была достоверно выше у пациенток, использовавших Генферон® в сравнении с группой пациенток, получавших плацебо.
К сожалению, специфических лекарственных средств, полностью элиминирующих ВПЧ, на сегодняшний день не создано. Однако при изучении состояния иммунной системы у женщин, страдающих ПВИ и другими урогенитальными инфекциями, были выявлены нарушения различных ее звеньев на локальном и системном уровне. В частности, было показано присутствие ингибиторов синтеза интерферона альфа и гамма типов. Это свидетельствует о целесообразности поиска средств иммунокоррекции, способствующих нормализации нарушенных при ПВИ звеньев иммунной системы (2). Так, в литературе широко представлен опыт применения при ПВИ Цидофовира, Имиквимода, индол-3-карбинола, а также препаратов интерферона для местного и системного применения (21).
Клинические исследования доказали, что препараты интерферона не только дают интерферонозамещающий эффект, но и стимулируют синтез эндогенного интерферона альфа и гамма типов (23). Именно поэтому они все интенсивнее внедряются в практику здравоохранения не только в нашей стране, но и за рубежом. Клиническая эффективность препаратов интерферона показана при ВПЧ-ассоциированной патологии коньюктивы глаза, респираторном папилломатозе, экзофитных кондиломах, плоскоклеточных интраэпителиальных поражениях шейки матки и т.п. (2). Однако данные об эффективности системного применения препаратов интерферона остаются противоречивыми (7). Кроме того, системное применение препаратов интерферона ограничивается их высокой стоимостью и значительными побочными эффектами (17). Принимая во внимание тот факт, что ВПЧ является эпителиотропным вирусом, предпринимаются попытки использования лекарственных форм интерферонов для местного применения (24, 25).
Препараты для местного применения (мази, суппозитории, капли и т.д.) являются более эффективными при ряде форм ПВИ. Они способны обеспечить более высокие концентрации действующего вещества непосредственно в очаге поражения при отсутствии побочных эффектов (7). Особый интерес представляют суппозиторные формы, показавшие эффективность при лечении целого ряда урогенитальных инфекций (7).
В нашем исследовании мы изучили терапевтическую эффективность и безопасность суппозиториев Генферон® для лечения LSIL, ассоциированных с ВПЧ высокоонкогенного риска.
Основными компонентами препарата Генферон® являются интерферон человеческий рекомбинантный α-2 типа, таурин и анестезин, комбинация которых обеспечивает усиление и расширение спектра действия препарата (1). Таурин широко применяется при целом ряде заболеваний и способствует нормализации метаболических процессов, обладает регенерирующими, репаративными, антиоксидантными, мембрано- и гепатопротекторными свойствами (26). Анестезин – местноанестезирующее вещество, наличие которого существенно повышает качество жизни пациентов, поскольку ПВИ нередко сопровождается локальным дискомфортом.
Несмотря на то что для местного применения препаратов интерферона не характерно наличие побочных эффектов, в отличие от системного применения (9), в данном исследовании важно было определить переносимость Генферона®, поскольку по рекомендуемой нами схеме он должен применяться длительно – на протяжении 3 месяцев. Показано, что нежелательные явления в данном исследовании были минимальными, они наблюдались как у пациенток, получавших Генферон®, так и у получавших плацебо. Они классифицировались как легкие, носили преходящий характер, не требовали медикаментозной коррекции и не привели к выбыванию пациенток из исследования. Серьезных побочных эффектов не было отмечено ни в одной из групп. У одной женщины первой группы были гриппоподобные симптомы, по одной пациентке из первой и второй групп жаловались на кратковременный зуд вульвы. Выявленная нами чрезвычайно низкая частота побочных эффектов Генферона® согласуется с данными других авторов (1) и объясняется, по-видимому, низкими концентрациями действующих веществ в системном кровотоке.
Основными критериями оценки эффективности исследуемого препарата были данные Пап-теста и Digene-теста на ВПЧ. Данные кольпоскопии, учитывая недостаточную специфичность этого метода (40-60%), учитывались, но не использовались в качестве основного критерия эффективности терапии.
Мы показали, что интравагинальное использование суппозиториев Генферон® привело к регрессии LSIL, по результатам Пап-теста до нормы в 61,9% случаев в группе лечения по сравнению с 33,3% в группе плацебо (P ® безопасен и хорошо переносится при лечении в дозе 500000 МЕ интравагинально 2 раза в сутки в течение 10 дней с последующим назначением 1 раз в сутки через день в течение 3 месяцев.
По данным цитологического исследования, применение препарата Генферон® способствует регрессу плоскоклеточных интраэпителиальных поражений шейки матки низкой степени до нормы через 6 месяцев наблюдения в 59,1% случаев по сравнению с 33,3% в группе плацебо. Более того, Генферон® способствует элиминации высокоонкогенных типов ВПЧ при LSIL в 68,2% случаев по сравнению с 26,7% в группе плацебо. Таким образом, Генферон® эффективен для лечения плоскоклеточных интраэпителиальных поражений шейки матки низкой степени, ассоциированных с вирусами папилломы человека (ВПЧ) высокоонкогенного риска.
Читайте также:


