Клинико лабораторные признаки активности инфекционного эндокардита
Аннотация научной статьи по клинической медицине, автор научной работы — Цеханович В. Н., Мильченко М. В., Ярославская Е. И., Федоров В. А., Тюканов М. Н.
Представлены и оценены результаты клинического, микробиологического, ультразвукового обследования у 37 больных с инфекционным эндокардитом протезированного клапана (ИЭПК). Установлено, что ранний ИЭПК протекал остро, с высокой клинико-лабораторной активностью, а для позднего ИЭПК была характерна минимальная активность инфекционного процесса и стертость клинической симптоматики. Выделенные возбудители отличались при раннем и позднем ИЭПК, выявлена значимость микробных ассоциаций и грибковой флоры при раннем ИЭПК. Трансторакальная эхокардиография недостаточно информативна для диагностики морфологического субстрата болезни, чреспищеводное исследование повышало информативность метода. Диагноз ИЭПК на дооперационном этапе, как правило, подтверждался при грубой дисфункции протеза (значимой фистулы или обструкции), которая требовала реоперации, однако не у всех больных такие изменения выявлялась при ЭхоКГ. Тем не менее, у всех пациентов имелись какие-либо, в том числе гемодинамически незначимые изменения функции протеза по эхокардиографическим данным. Однако любые изменения функции протеза не должны оставаться без внимания у пациентов с прогрессирующей сердечной недостаточностью, лихорадкой, воспалительными изменениями и требуют неоднократного проведения ЭхоКГ в динамике с обязательным использованием чреспищеводного метода.
Похожие темы научных работ по клинической медицине , автор научной работы — Цеханович В. Н., Мильченко М. В., Ярославская Е. И., Федоров В. А., Тюканов М. Н.
ИНФЕКЦИОННЫЙ ЭНДОКАРДИТ ПРОТЕЗИРОВАННОГО КЛАПАНА: КЛИНИКО-ЛАБОРАТОРНЫЕ И МОРФОЛОГИЧЕСКИЕ ОСОБЕННОСТИ, ЗНАЧЕНИЕ КОМПЛЕКСНОЙ ЭХОКАРДИОГРАФИИ В ДИАГНОСТИКЕ
В.Н. Цеханович, М.В. Мильченко, Е.И. Ярославская, В.А. Федоров, М.Н. Тюканов, A.B. Тимошенко, С.Ф. Иванова, Л.В. Шохина
Представлены и оценены результаты клинического, микробиологического, ультразвукового обследования у 37 больных с инфекционным эндокардитом протезированного клапана (ИЭПК). Установлено, что ранний ИЭПК протекал остро, с высокой клинико-лабораторной активностью, а для позднего ИЭПК была характерна минимальная активность инфекционного процесса и стертость клинической симптоматики. Выделенные возбудители отличались при раннем и позднем ИЭПК, выявлена значимость микробных ассоциаций и грибковой флоры при раннем ИЭПК. Трансторакальная эхокардиография недостаточно информативна для диагностики морфологического субстрата болезни, чреспищеводное исследование повышало информативность метода. Диагноз ИЭПК на дооперационном этапе, как правило, подтверждался при грубой дисфункции протеза (значимой фистулы или обструкции), которая требовала реоперации, однако не у всех больных такие изменения выявлялась при ЭхоКГ. Тем не менее, у всех пациентов имелись какие-либо, в том числе гемодинамически незначимые изменения функции протеза по эхокардиографическим данным. Однако любые изменения функции протеза не должны оставаться без внимания у пациентов с прогрессирующей сердечной недостаточностью, лихорадкой, воспалительными изменениями и требуют неоднократного проведения ЭхоКГ в динамике с обязательным использованием чреспищеводного метода.
Одна из составляющих прогноза у пациентов с ИЭПК - своевременная диагностика заболевания, при которой важнейшее значение придается бактериологическим и эхокардиогра-фическим методам [8, 9]. Ранняя диагностика определяет начало проведения лечебных мероприятий в более ранние сроки. Большинством хирургов признано, что, несмотря на высокий операционный риск, альтернативы хирургическому лечению раннего ИЭПК нет [9]. Успех лечения зависит от ранней диагностики и ранней
операции [2]. Своевременную постановку диагноза осложняет высокий процент негативных гемокультур, по данным отечественных исследователей, 56,6-67,2% [3, 4]. Визуализация при ИЭПК затруднена из-за акустической тени, которую отбрасывают элементы механического протеза. Кроме того, интерпретация ультразвуковых данных субъективна, зависит от многих факторов, в частности от квалификации специалистов и лечебного учреждения, в котором проводилось исследование [5].
Изучение всего комплекса клинико-лабора-торных и инструментальных признаков, характерных для ИЭПК, представляется нам своевременным, позволяет улучшить диагностику и повысить эффективность лечения этого заболевания. Цель исследования - выявление основных клинико-лабораторных симптомов, структуры возбудителей в зависимости от сроков возникновения ИЭПК, изучение информативности эхокардиографического метода в диагностике.
МАТЕРИАЛ И МЕТОДЫ
С 2000 по 2006 г. в кардиохирургическом отделении (КХО) Областной клинической больницы находились на лечении 37 больных с ИЭПК. Из них были реоперированы - 27
(73%), не были реоперированы по разным причинам - 10 (27%).
Все пациенты имели достоверный инфекционный эндокардит на основании DUKE-кри-териев [14]. Мужчин - 17 (46%), женщин - 20 (54%). Средний возраст - 46 лет. Все больные были разделены на 2 группы: с ранним ИЭПК, развившимся в первые 3 мес. после протезирования - 21 пациент (57%), и с поздним ИЭПК, развившимся через 3 мес. и более после операции - 16 (43%) [9]. Для оценки степени активности ИЭ использовали клинико-лабораторные критерии Ю.Л. Шевченко (1995). Предшествующее инфекционное поражение клапанов сердца было у пациентов с ранним ИЭПК в 66,7%, с поздним ИЭПК - в 44,8%. Поражение митрального протеза отмечалось у 49%, аортального - у 41%, трикуспи-дального - у 5%; сочетанное поражение митрального и аортального протезов - у 3%, митрального и трикуспидального - у 3%. Преобладало поражение клапана в митральной позиции над аортальной как при раннем, так и позднем ИЭПК.
Помимо сбора анамнеза и общеклинического обследования, всем больным выполнялась комплексная ЭхоКГ, ультразвуковое исследование органов брюшной полости, плевральных полостей, R-графия органов грудной клетки, ЭКГ и холтеровское мониторирование ЭКГ, микробиологическое исследование крови. У реопери-рованных больных проводилось микробиологическое исследование интраоперационного материала (иссеченные клапаны, вегетации, содержимое абсцессов).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Инфекционный эндокардит ПК в 64,9% случаев развивался в течение 1 года после первичного протезирования, затем частота возникновения уменьшалась и становилась в 4,8 раза меньше к 3 годам и в 6 раз меньше к 10 годам наблюдения. Это связано, по-видимому, с тем, что в течение первого года после операции имеются благоприятные условия для развития инфекции: сохраняются участки нерезорбцирован-ных нежизнеспособных тканей, наблюдается иммунодепрессия после операционного стресса, перенесенного ИК и у части больных после микробной интоксикации на фоне сепсиса [2].
Больные с ИЭПК представляли тяжелую клиническую группу. У 57% была ХСН 2Б-3 стадии, 62% пациентов относились к IV ФК, у 24% были признаки легочной гипертензии. Причинами сердечной недостаточности были как длительно существующие или остро сформировавшиеся нарушения внутрисердечной гемодинамики, так и сопутствующий миокардит и инфаркт миокарда (в 70 и 3%, соответственно). У большинства пациентов, 33 (89%), при поступлении в КХО наблюдался активный инфекционный процесс по клиническим и лабораторным критериям, ремиссия была только у 4 (11%).
При сравнении клинических и лабораторных проявлений у больных с ранним и поздним ИЭПК выявлены отличия. При раннем ИЭПК все больные были с активным процессом и у половины из них определялась максимальная (III) ст. активности. При позднем ИЭПК, наоборот, большинство (63%) имело минимальную (!)ст. активности или были в ремиссии. Высокая активность инфекционного процесса при раннем ИЭПК объясняла повторное поступление пациентов в КХО в более короткие сроки с момента появления первых симптомов (через 1,5-2 мес.) по сравнению с поздним ИЭПК (через 5-7 мес.).
Мы проанализировали наиболее часто встречающиеся клинические симптомы при ИЭПК. Самым распространенным, но не специфичным симптомом, была одышка разной степени выраженности, которая отмечалась у всех и была обусловлена, в первую очередь, сердечной недостаточностью. У ряда пациентов, помимо сердечной недостаточности, одышка объяснялась еще и дыхательной недостаточностью на фоне плеврита (32%), пневмонии (11%), обструктивного бронхита (19%).
Вторым по частоте и самым ранним симптомом была лихорадка различного типа, кото-
рая в дебюте регистрировалась у 92%, а при поступлении - у 73% пациентов. Характер лихорадки был разнообразным: от периодического субфебрилитета до постоянной гектической. При поступлении примерно у половины пациентов (49%) регистрировалась фебрильная лихорадка и у четверти (24%) - субфебрильная. Лихорадка сопровождалась ознобами и потами у половины больных. При раннем ИЭПК лихорадка при поступлении в КХО была у 95%, а при позднем только у 46%. В группе раннего ИЭК фебрильная лихорадка встречалась в 62%, а в группе позднего - только у 31%. Несмотря на проводимую АБ-терапию, лихорадка у больных с ранним ИЭПК отличалась стойкостью и регистрировалась с высокой частотой как в дебюте, так и при госпитализации в КХО (в 100 и 95%, соответственно). У больных с поздним ИЭПК лихорадка снижалась на фоне АБ-терапии и регистрировалась при госпитализации в 2 раза реже, чем в дебюте (в 44 и 81%, соответственно).
С высокой частотой у больных с ИЭПК регистрировалась спленомегалия (73%), которая объясняется гиперплазией пульпы селезенки на фоне генерализованной инфекции. Только у одного пациента с ИЭПК мы встретились с пи-емическим отсевом в селезенку и у троих больных - с ишемическим инфарктом селезенки вследствие эмболии, причем данные изменения были диагностированы только на аутопсии. Спленомегалия чаще регистрировалась в группе раннего ИЭПК, что объясняется более высокой активностью раннего эндокардита, при котором клиника сепсиса отмечалась у 52% больных.
У 73% клинически отмечались проявления нефрита, у 14% пациентов - почечная недостаточность 1-11 стадии. Нефротического синдрома в наших наблюдениях не было. В большинстве случаев отмечался умеренный мочевой синдром (умеренная протеинурия, лейкоцитурия, гематурия, цилиндрурия). Проявления нефрита встречались часто как в группе раннего (76%), так и в группе позднего ИЭНК (69%). На аутопсии (17 случаев) диффузный гломерулонефрит выявлен у троих, гнойный пиелонефрит - у одного пациента.
У 26 (70%) пациентов отмечался миокардит. У 12 из них миокардит был диагностирован при жизни по клиническим данным, данным ЭКГ и ЭхоКГ. Мерцание-трепетание предсердий, резистентное к проводимой антиаритмической терапии, было у пятерых пациентов, частая по-литопная желудочковая ЭС - у четверых, АВ-блокада I степени - у двоих, несоответствие
выраженности сердечной недостаточности нарушениям внутрисердечной гемодинамики - у одного пациента. Еще у 14 пациентов диффузный продуктивный миокардит был выявлен только на аутопсии. Наши данные подтверждают мнение ряда исследователей, что миокардит при ИЭ реально встречается чаще, чем диагностируется с помощью клинических и инструментальных методов диагностики [6]. У пациентов с ранним ИЭПК миокардит встречался в 2 раза чаще, что, вероятно, связано с токсическим поражением миокарда у пациентов на фоне высокой активности эндокардита, выраженности септических проявлений.
У 65% пациентов отмечалось снижение массы тела на 5-18 кг с момента появления первых симптомов до поступления в КХО, что объясняется выраженностью процессов катаболизма на фоне лихорадки и инфекционно-токси-ческих проявлений, а у ряда пациентов и на фоне терминальной сердечной недостаточности.
Только у 23 (63%) пациентов аускультативно отмечали появление нового шума регургитации, характерного для парапротезных фистул (систолического на протезе в митральной позизи-ции и диастолического в аортальной). У остальных 14 (37%) шума регургитации в динамике не было. Отсутствие шумовой картины в этой группе объяснялось морфологическими проявлениями эндокардита: у пациентов наблюдался тромбэндокардит и/или разрастание вегетаций на протезе, а парапротезные фистулы не формировались или они были незначимыми и регистрировались только при допплерографии.
У 15 (41%) пациентов с ИЭПК наблюдали полисерозиты, как изолированные, так и комбинированные. Плеврит был более распространен и отмечался у 12 (32%) больных с ИЭПК. Экссудативный плеврит отметили у 11 пациентов, гнойный - у одного. В группе раннего ИЭПК данный симптом встречался в 3,5 раза чаще. Асцит как проявление выраженной декомпенсации кровообращения и /или на фоне цирроза печени наблюдали у 5 (14%) пациентов, все они были с поздним ИЭПК. С такой же частотой встретился перикардит.
У 13 (35%) пациентов клинически и/или на аутопсии мы выявили эмболии в сосуды большого круга кровообращения, у пятерых из них были множественные тромбоэмболические осложнения. В исследуемых группах эмболии регистрировались примерно с одинаковой частотой: 38% при раннем и 31% при позднем ИЭПК и встречались в 1,6 раза чаще при локализации ИЭПК в аортальной позиции. В структуре
всех эмболических осложнений преобладали эмболии в ЦНС (37%), за ними следовали эмболии в почки (22%) и артерии конечностей (22%), а реже всего регистрировались эмболии в селезенку (11%) и кишечник (8%). Эмболии в ЦНС и артерии конечностей в 100% были диагностированы при жизни пациента, эмболии в почки - в 33%. У всех больных с эмболиями в селезенку и кишечник диагностика была только на аутопсии. У двоих пациентов церебральные эмболии привели к обширному инсульту с последующим отеком головного мозга и смертельному исходу.
Кожные проявления ИЭ (васкулит периферических сосудов) наблюдались только у троих (8%) пациентов, что подтверждает мнение многих современных авторов о том, что кожные проявления ИЭ стали редкостью [6]. У двоих пациентов наблюдали петехальную сыпь, у одного - пятна Жаневье.
Инфаркт миокарда развился в одном случае (3%). Причиной обширного передне-перегородочного инфаркта у больного с ранним ИЭПК был рубцовый стеноз ствола левой коронарной артерии в ложе абсцесса, который был дренирован при первичной операции. В табл. 1 представлена частота различных клинических проявлений ИЭПК при поступлении в КХО.
При анализе лабораторных данных у 86% пациентов выявили повышение СОЭ, причем у 43% преобладало значительное повышение (свыше 40 мм/ч). С учетом того, что в раннем послеоперационном периоде у больных, оперированных в условиях ИК, СОЭ исходно повышена, у больных с ранним ИЭПК отмечалось увеличение показателя по мере развития болезни. У 81% больных выявлена нормо- и гипохромная анемия легкой и средней степени тяжести, лейкоцитоз встретили у 65%, лейкопению - у 14%, лимфопению - у 62% больных.
Клинические проявления ИЭПК при поступлении в кардиохирургический стационар (п=37)
Клинические проявления ранний (п=21) поздний (п=16)
Одышка 21 100 16 100 37 100
Лихорадка 20 95 7 46 27 73
Увеличение селезенки 16 76 11 69 27 73
Нефрит 16 76 11 69 27 73
Миокардит 18 86 8 50 26 70
Похудание 16 76 8 50 24 65
Поты 15 71 4 25 19 51
Ознобы 15 71 4 25 19 51
Увеличение печени 8 38 8 50 16 43
Полисерозит 9 43 6 38 15 41
Отеки при поступлении 7 33 7 44 14 38
Эмболические осложнения 8 38 5 31 13 35
Плеврит 10 48 2 13 12 32
Поражение ЦНС 5 24 5 31 10 27
Перикардит 2 10 3 19 5 14
Асцит 2 10 3 19 5 14
Пневмония 4 19 0 0 4 11
Кожный васкулит 1 5 3 19 4 11
Суставной синдром 2 10 1 6 3 8
Боли в поясничной области 1 5 1 6 2 5
Инфаркт миокарда 1 5 0 0 1 3
При сравнительном анализе лабораторных данных также имелись отличия, отражающие гораздо более острое течение раннего ИЭПК по сравнению с поздним. Лейкоцитоз чаще встречался у больных с ранним (80%), чем у больных с поздним (44%) ИЭПК. Выраженный лейкоцитоз (выше 15 тыс/л) в группе раннего ИЭПК встретился в 38%, в группе позднего - только в 13%. Лейкопения, напротив, чаще встречалась при позднем ИЭПК (19%), чем при раннем (10%) ИЭПК.
У 60% отмечалась гипопротеинемия менее 65 г/л, у 62% пациентов выявили изменения показателей функции печени, связанные как с декомпенсацией кровообращения, так и с септическим процессом. Чаще регистрировалась умеренная гипербилирубинемия и умеренное повышение трансаминаз, реже - положительные белковооосадочные пробы.
Положительная гемокультура отмечалась у 57% пациентов с ИЭПК. При анализе возбудителей ИЭПК, помимо результатов гемокульту-ры, учитывали результаты посева интраопера-ционного материала. Для ИЭПК характерны микробные ассоциации (бактериальные и бактериально-грибковые), которые выявлены у 12 (32%) больных. В структуре возбудителей ИЭПК среди всех выделенных штаммов преобладали грамположительные кокки (63,6%), отмечалась высокая частота грибковой флоры (24,2%), грам-отрицательные бактерии встретились в 9,1%, анаэробные бактерии - в 0,3%. Среди грам+ кокков лидировали золотистый стафилококк, эпидермальный стафилококк и энтерококки. 43% штаммов стафилококков обладали метициллинрезистентностью, сохраняя высокую чувствительность к рифампицину и ванкомицину. 94% штаммов грибков были чувствительны к флюконазолу. Резистентность энтерококков к аминогликозидам встретили в
I случае (25%), все штаммы энтерококков были чувствительны к ванкомицину.
При раздельном анализе возбудителей раннего и позднего ИЭПК выявлены различия. В структуре возбудителей раннего ИЭПК превалировала грибковая инфекция (33%), на
II месте был золотистый стафилококк (19%), на III - другие коагулазонегативные штаммы стафилококков (14%), на IV месте - энтерококки (10%). У 10 (48%) больных с ранним ИЭПК выявлена mixt-инфекция: у 4 (19%) в виде бактериальных и у 6 (29%) в виде бактериально-грибковых ассоциаций. Следует отметить значимость грибковой флоры при развитии раннего ИЭПК.
При позднем ИЭПК преобладали коагулазонегативные стафилококки (55%), грибковая флора встретилась только в 9% и в 9% - золотистый стафилококк. Среди возбудителей позднего ИЭПК не выявили грам-отрицательных бактерий и анаэробов. Только у двоих (12%) пациентов с поздним ИЭПК были бактериальные ассоциации, бактериально-грибковых ассоциации в этой группе больных не встретили. Структура возбудителей раннего и позднего ИЭПК представлена в таблице (табл. 2).
Визуализировать морфологический субстрат ИЭ при жизни пациента, выявить характер нарушений внутрисердечной гемодинамики помогает ЭхоКГ [8, 9]. Сопоставив эхокардиографи-ческие данные с интраоперационными находками или данными аутопсий, мы проанализировали чувствительность метода для диагностики ИЭПК
Структура возбудителей раннего и позднего ИЭПК

Инфекционный эндокардит (ИЭ) – грозное заболевание, характеризующееся крайне неблагоприятным прогнозом при естественном его течении. Анализируя литературные данные, можно отметить, что частота ИЭ в Российской Федерации имеет сравнительно высокие показатели распространенности по отношению к другим странам; так, в расчете на 1 млн населения заболеваемость ИЭ составляет: в США 38-92,9 человека, в Канаде – 20-25, в Швеции – 59, Англии – 23-25, Франции – 18-23, Германии и Италии – 16. В России заболеваемость ИЭ достигает 46,3 человека на 1 млн населения [1]. Особую активность проблема данного заболевания приобретает в связи с неуклонным ростом ИЭ интактных клапанов в течение последних десятилетий на фоне общего роста заболеваемости инфекционным эндокардитом в 3-4 раза 4.
Диагностика ИЭ представляет значительные затруднения в связи с ярко выраженным полиморфизмом клиники, широким спектром возбудителей и ростом доли полимикробной инфекции в генезе ИЭ [5]. На ранних этапах заболевание не имеет специфических диагностических признаков. Так, клиническая картина подострого ИЭ характеризуется преобладанием и нарастанием общей астеновегетативной симптоматики на фоне лихорадки и в некоторых случаях миалгии, а острая форма инфекционного эндокардита может манифестировать уже с осложнений в виде отрыва вегетаций и эмболии органов. Результаты лабораторной диагностики также не позволяют врачу-клиницисту заподозрить данное заболевание, так как у пациента будут отмечаться анемия, лейкоцитоз и ускорение скорости оседания эритроцитов (СОЭ), в общем анализе мочи может быть микрогематурия и протеинурия [6; 7]. Доказана чувствительность С-реактивного белка (СРБ) при диагностике ИЭ, но данный воспалительный маркер специфичен для целого ряда воспалительных заболеваний [8].
Даже несмотря на технические достижения современной медицины, постановка диагноза ИЭ во многих случаях значительно растягивается во времени, что, вероятно, связано с небольшим числом работ, описывающих клинико-эпидемиологические характеристики инфекционного эндокардита на современном этапе [9].
Целью нашей работы явилось изучение структуры заболеваемости, основных особенностей клинической и лабораторно-инструментальной картины, вариантов поражения клапанного аппарата, а также осложнений ИЭ.
Результаты и их обсуждение. За исследуемый период времени наблюдается увеличение числа пациентов с ИЭ (рис. 1), что хорошо согласуется с данными общемировой статистики [1].
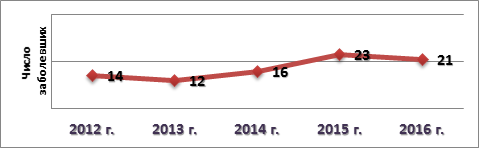
Рис. 1. Случаи выявления ИЭ в период за 2012-2016 гг.
Анализ половой структуры заболеваемости показывает, что мужчины болеют в 3 раза чаще, чем женщины (Z=2,137880, p-level=0,032527), составляя при этом 64% от общего числа.
Результаты анализа возрастной структуры ИЭ позволяют утверждать, что большинство страдающих инфекционным эндокардитом пациентов - это больные молодого и среднего возраста, при этом отмечается отчетливая тенденция к увеличению абсолютного числа пациентов молодого и среднего возраста среди всех пациентов с ИЭ (рис. 2, 3).
Далее нами были проанализированы особенности течения ИЭ по клиническим вариантам: острая форма наблюдалась лишь в 7 клинических случаях (8,14%), подострая – у 91,86% пациентов с ИЭ.
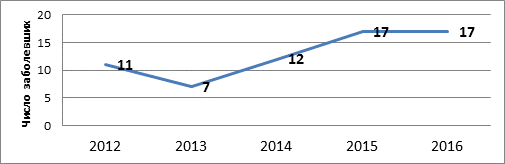
Рис. 2. Динамика заболеваемости ИЭ пациентов молодого и среднего возраста
в период с 2012 по 2016 г.
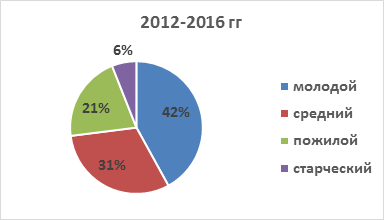
Рис. 3. Возрастная структура пациентов с ИЭ
Анализ поражений клапанного аппарата выявил следующие морфологические варианты инфекционного эндокардита: первичный ИЭ естественных клапанов – 66,27%, вторичный ИЭ естественных клапанов – 15,12%, ранний ИЭ протеза клапанов – 11,63% и поздний ИЭ протеза клапанов в 6,98% случаев.
Среди случаев ИЭ естественных клапанов преобладает эндокардит левых отделов – 65,11%. Сочетанное поражение трикуспидального клапана (ТК) и митрального клапана (МК) наблюдалось в 4,65% случаев в результате сообщения правой и левой полостей сердца вследствие образования абсцессов. Эндокардит правых отделов сердца был выявлен у 33,24% пациентов.
Анализируя случаи эндокардита правых отделов сердца, можно отметить неуклонный рост числа больных с данным видом поражения клапанного аппарата в период с 2013 по 2016 год (рис. 4).
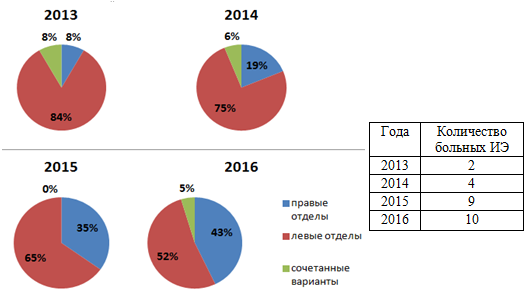
Рис. 4. Рост абсолютного числа больных с эндокардитом правых отделов сердца
Среди наиболее распространенных осложнений ИЭ у пациентов с эндокардитом правых отделов сердца можно отметить: пневмонию, экссудативный перикардит, абсцесс легкого, асцит, гидроторакс, нефритический синдром с явлениями почечной недостаточности.
При этом тяжелая почечная недостаточность с максимальным повышением креатинина до 671 мкмоль/л отмечалась лишь у пациентов с поражением митрального и аортального клапанов.
Среди эндокардита левых отделов характерны осложнения в виде левожелудочковой сердечной недостаточности, нефритического синдрома с развитием почечной недостаточности, экссудативного перикардита, гидроторакса.
Анемия была типичным осложнением как при поражении правых, так и левых отделов, встречаясь в 16,3% случаев.
Эмболические осложнения наблюдались у 8 пациентов, что составило 9% от общего числа. При ИЭ левых отделов сердца у больных развился эмболический инфаркт селезенки в одном случае, а в другом – эмболизация сосудов головного мозга, почек и сердца. При поражении трикуспидального и легочного клапанов в 6 случаях (7% от общего количества больных ИЭ) закономерно развилась тромбоэмболия мелких ветвей легочной артерии.
Проанализировав клиническую симптоматику, можно выявить следующие ведущие симптомы инфекционного эндокардита: одышка в 73% случаев, лихорадка – 72%, астения – 64%, отеки нижних конечностей – 31%, кардиалгия – 30%, миалгия – 10%.
Изучив результаты диагностических методов выявления ИЭ, можно отметить низкую выявляемость положительной гемокультуры среди всех пациентов вне зависимости от формы, сроков возникновения, половозрастной группы (таблица). Положительная гемокультура встречалась только у 23% больных от общего числа, что, вероятно, свидетельствует как о необходимости совершенствования лабораторной диагностики сепсиса, так и о высокой распространенности назначения антибактериальной терапии до проведения бактериологического посева крови.
Структура бактериологически подтвержденных возбудителей ИЭ
*Enterococcus faecium, Klebsiella pneumoniae, Stenotrophomonas maltophilia
Варианты положительной гемокультуры
Анализируя данные лабораторной диагностики, отмечаем повышение СОЭ свыше 20 мм/ч у 57 больных – 67% от общего количества больных, и свыше 40 мм/ч в 27% случаев. Вместе с тем 21% больных имели уровень СОЭ в пределах нормальных значений. В работе [5] Тюрина В.П. и Гогина Е.Е. в качестве одного из патогномоничных симптомов отмечено ускорение СОЭ в 97% случаев у пациентов с ИЭ, что противоречит полученным нами данным. Таким образом, ИЭ не всегда сопровождается увеличением СОЭ (рис. 5).
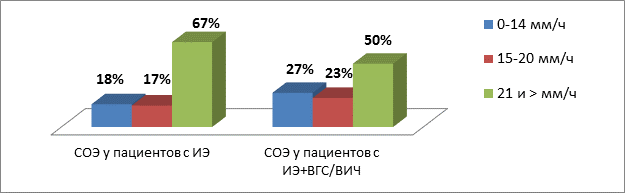
Рис. 5. Показатели СОЭ у пациентов с ИЭ
Примечание к рисунку: СОЭ – скорость оседания эритроцитов, ИЭ – инфекционный эндокардит, ВГС – вирус гепатита С, ВИЧ – вирус иммунодефицита человека
Среднее значение СРБ среди всех пациентов составило 47,99 ±10,49 мг/л. СРБ оставался в пределах нормальных значений (за норму принимали диапазон от 0 до 5 мг/л) у 17,65% пациентов, для большинства пациентов характерно повышение СРБ свыше 10 и более мг/л (76,47%). Подавляющее большинство больных имели значение СРБ свыше 30 мг/л.
Наличие нормальных значений СРБ при ИЭ, очевидно, свидетельствует о крайне низкой реактивности организма. Среди всех пациентов с нормальными значениями СРБ нам встретился лишь 1 пациент в возрасте 46 лет с ИЭ левых отделов сердца. При этом нормальные значения СРБ наблюдались у двух пациентов старческого возраста и 3 больных с ИЭ правых отделов сердца. В первом случае низкая реактивность обусловлена снижением иммунного ответа, связанным с возрастом. Во втором случае – нормальные значения СРБ обусловлены угнетением иммунитета, вероятнее всего, вследствие внутривенной наркомании, определенный вклад в снижение реактивности иммунитета, несомненно, вносит вирусный гепатит С (ВГС). Два из трех пациентов с эндокардитом правых отделов сердца, имевших нормальный уровень СРБ, страдали вирусным гепатитом С.
В целом проанализировать вклад вирусного гепатита С и ВИЧ в ареактивность пациентов с ИЭ практически невозможно, так как значения СРБ у таких больных варьируют в крайне широком диапазоне: от нормальных до крайне экстремальных значений (166, 177 и даже 298 мг/л). Однако при анализе значения СОЭ у пациентов с ИЭ выявляется отчетливая тенденция к более низким значениям СОЭ (рис. 5) у пациентов, страдающих ВГС/ВИЧ, приближающаяся к статистической достоверности (Z=1,676; P=0,09). Вышеописанные изменения СОЭ, вероятно, подтверждают мысль о роли ВГС и ВИЧ в снижении иммунной реактивности организма пациентов с ИЭ.
Необходимо отметить, что в исследовании ряда авторов под руководством Hogevik H., Olaison L. было также установлено, что СОЭ является менее чувствительным показателем по отношению к СРБ, так как нормальные значения СОЭ наблюдались в 28% случаев, в то время когда уровень СРБ был в норме лишь у 4%. В работе также отмечено, что ИЭ стафилококкового происхождения с коротким периодом клинической симптоматики коррелируют с более высокими уровнями СРБ [8].
Таким образом, полученные результаты позволяют отметить, что наблюдающийся рост заболеваемости ИЭ в период за 2012-2016 годы связан с увеличением поражения числа лиц молодого и среднего возраста.
Значительная доля и увеличение числа больных с поражением правых отделов сердца свидетельствуют о том, что вышеуказанные изменения заболеваемости связаны с вероятным распространением внутривенной наркомании.
Таким образом, к 2015-2016 году сформировалось характерное клиническое лицо пациента с ИЭ: молодой больной, чаще мужского пола, с длительным лихорадочным синдромом, проявлениями общей интоксикации, симптомами правожелудочковой сердечной недостаточности в сочетании с инфаркт-пневмонией легкого или деструктивными поражениями легочной ткани.
Согласно анамнестическим данным, проведение посевов крови в большинстве случаев предшествовало проведению антибиотикотерапии, что закономерно привело к значительному снижению лиц с положительной гемокультурой. Выявлен крайне низкий процент высевания микроорганизмов возбудителей ИЭ. Полученные данные убедительно свидетельствуют о первостепенности клинической и инструментальной диагностики (ЭхоКГ, ЧПЭхоКГ). Методы бактериальной диагностики в большинстве случаев имеют вторичное значение в подтверждении диагноза, но играют определяющую роль при выборе антибиотикотерапии в случае выявления положительной гемокультуры у пациента. Отсутствие воспалительной активности в анализах крови при яркой клинической картине ИЭ и положительного результата посева гемокультуры не должно вводить в заблуждение лечащего врача.
Неврологические осложнения инфекционного эндокардита
Шевченко Ю.Л., Кузнецов А.Н., Тюрин В.П. Национальный медико-хирургический центр имени Н.И.Пирогова, Москва
Ни одно заболевание сердца не может сравниться с инфекционным эндокардитом по частоте, разнообразию и тяжести неврологических осложнений. Не случайно, что более ста лет назад Ослер описал инфекционный эндокардит как триаду, состоящую из лихорадки, сердечного шума и гемиплегии [1]. Инфекционный эндокардит является чрезвычайно тяжелым заболеванием с летальностью, достигающей при консервативном лечении 80% (общая летальность составляет [2, 3]. В настоящее время инфекционный эндокардит вышел на четвертое место по уровню смертности среди инфекционных синдромов после уросепсиса, пневмонии и перитонита и занял нишу социально обусловленных заболеваний [4]. Несмотря на успехи в диагностике и лечении инфекционного эндокардита частота неврологических осложнений заболевания остается в последние три десятилетия на уровне (по нашим данным — около 25%) [5, 6, 7, 8, 9, 10, 11]. Присоединение неврологических осложнений значительно увеличивает летальность. При мозговой эмболии на фоне инфекционного эндокардита она колеблется между 20% и 80% (по нашим данным — около 60%), а в доантибиотическую эру она составляла 100% [5, 11, 12, 13, 14]. Основными этиопатогенетическими факторами при инфекционном эндокардите являются: травма эндокарда, бактериемия и ослабление резистентности организма. Спектр наиболее частых возбудителей и предрасполагающих кардиальных повреждений к настоящему времени претерпел некоторые изменения. Ревматическое заболевание сердца было одним из наиболее распространенных заболеваний сердца, предрасполагающих к эндокардиту (вторичный инфекционный эндокардит), но сейчас чаще развивается первичный инфекционный эндокардит, то есть поражение условно неизмененных клапанов сердца. Вместе с изменениями предрасполагающих условий изменились и возбудители эндокардита. Наиболее частыми остаются стрептококки и стафилококки, однако, частота стрептококковой этиологии снижается, а стафилококковой — растет, кроме того, в последние годы продолжает расти доля энтерококка, а также грамотрицательной флоры, микоплазм, вирусов, грибов, риккетсий, вероятно, вследствие иммуносупрессии, изменения клапанного субстрата и использования антимикробных средств. Неврологические осложнения у больных инфекционным эндокардитом чаще развиваются при поражении золотистым стафилококком [3, 11, 12, 15, 16]. Характерный патологический признак инфекционного эндокардита — это наличие вегетаций на створках клапанов. Вегетации состоят из аморфного фибрина и тромбоцитов вместе с возбудителями и лейкоцитами, являясь, таким образом, инфицированными белыми фибрин-тромбоцитарными тромбами. Возбудители, как правило, локализуются глубоко внутри вегетации и, таким образом, надежно защищены от антибактериальных факторов крови. Для обнаружения вегетаций используют эхокардиографию. Трансэзофагеальная эхокардиография значительно превосходит трансторакальное исследование — чувствительность достигает специфичность — [3]. У обследованных нами пациентов вегетации имели существенные различия: по размеру — от очень мелких до массивных (24 мм); по форме — шаровидные, булавовидные, лентовидные, дольчатые; по характеру прикрепления к клапану — на узком основании, на широком основании; по подвижности — флотирующие, фиксированные; по структуре — рыхлые, организованные. Очень важной является последняя характеристика, поскольку она отражает активность инфекционного процесса в сердце и эмбологенный потенциал вегетаций. Шестидесятиминутный транскраниальный допплеровский мониторинг кровотока по средней мозговой артерии позволяет детектировать микроэмболические сигналы (МЭС) у больных инфекционным эндокардитом. В нашем исследовании все пациенты с МЭС имели свежий инфекционный эндокардит (давность не более 2 месяцев) и рыхлые вегетации по данным эхокардиографии. При давности эндокардита более 2 месяцев МЭС не обнаруживались. Появление МЭС связано с пассажем мелких фрагментов рыхлых клапанный вегетаций, а также агрегатов тромбоцитов, образующихся в турбулентном потоке вблизи пораженного клапана. Неврологические осложнения наиболее часто возникают до начала антибактериальной терапии и в первую неделю ее проведения. В подавляющем большинстве случаев церебральная эмболия развивается в течение первого месяца от момента появления симптомов эндокардита. В этот период вегетации являются рыхлыми и могут легко фрагментироваться, вызывая эмболизацию. Затем в процессе адекватной антибактериальной терапии происходит уплотнение вегетаций. По данным эхокардиографии, выполненной в динамике, вегетации становятся плотными и прочными, они организуются, покрываются эндотелием и уже реже вызывают эмболии. Неврологические осложнения инфекционного эндокардита связаны с количеством, размером, локализацией и инфицированностью эмболов. Пациенты с инфекционным эндокардитом могут переносить инфаркт головного мозга, интрацеребральную и субарахноидальную геморрагию, микотическую аневризму, энцефалопатию, внутримозговой абсцесс, менингит и менингоэнцефалит. Ишемический инсульт является наиболее частой неврологической манифестацией инфекционного эндокардита (по данным литературы — у пациентов с инфекционным эндокардитом, по нашим данным — у 20%). Методы нейровизуализации демонстрируют в большинстве случаев множественные ишемические очаги, из которых примерно половина — корковые, локализующиеся в бассейнах концевых ветвей мозговых артерий, а другая половина представляет собой лакунарные очаги, располагающиеся в глубине полушарий мозга на границе серого и белого вещества. При небольших размерах очагов течение инсульта является достаточно доброкачественным. МРТ является более информативным методом исследования, чем КТ, в выявлении очагового поражения головного мозга у больных инфекционным эндокардитом. Наиболее часто поражается бассейн левой средней мозговой артерии. Церебральная геморрагия имеет место приблизительно у пациентов с инфекционным эндокардитом (по нашим данным — у 5%), чаще при поражении Staphylococcus aureus, и происходит вследствие трех отдельных патофизиологических механизмов. Церебральная септическая эмболия с последующим эрозивным артериитом является причиной и ранней геморрагии, и образования микотических аневризм с их последующим разрывом. Геморрагическая трансформация ишемического инфаркта дополняет данную триаду. Экспериментальные исследования церебральной септической эмболии документируют появление септического артериита в течение 1 дня после эмболии. Считается, что сосудистая деструкция возникает вследствие проникновения микроорганизмов из просвета сосуда в пространства Вирхова-Робена через vasa vasorum окклюзированного сосудистого сегмента. Микроорганизмы затем проникают в адвентицию сосуда, разрушая более медиальные слои до тех пор, пока не достигнут внутренней эластической пластинки. Микотические аневризмы по данным литературы имеют место у 5%-12% пациентов с эндокардитом (по нашим данным — около 1%). Примерно половина микотических аневризм разрывается с развитием интрацеребральной геморрагии или субарахноидального кровоизлияния. Иногда разрыв аневризм происходит спустя месяцы после излечения эндокардита. Летальность при разрыве достигает 80%. У 30% больных при антибиотикотерапии аневризмы подвергаются обратному развитию, а также менее вероятен разрыв аневризмы. Острая энцефалопатия — второе по частоте неврологическое осложнение эндокардита (по данным литературы и нашим данным ее переносят около 20% пациентов с инфекционным эндокардитом). Патофизиологическими механизмами являются мультифокальная септическая микроэмболия с последующим образованием микроинфарктов и микроабсцессов, изменения интракраниальных артерий (периваскулярная пролиферация), мозговая дисциркуляция и интоксикация. Аутопсические исследования пациентов с неврологическими осложнениями эндокардита показывают множественные микроинфаркты у 23%, микроабсцессы — у 26%. Большие абсцессы головного мозга редки. Они имеют место менее чем в 1% случаев при эндокардите. Менингит и менингоэнцефалит развиваются примерно у 4% пациентов с инфекционным эндокардитом, являются, как правило, дебютом заболевания, и поражение клапанов сердца выявляется уже после постановки неврологического диагноза. Таким образом, неврологические осложнения при инфекционном эндокардите представляют собой довольно пеструю картину. Инфекционный эндокардит до сегодняшнего дня остается одним из наиболее трудно диагностируемых заболеваний, несмотря на хорошо известные клинические и лабораторные признаки. Особенно затруднена постановка правильного диагноза в случае дебюта заболевания неврологическими осложнениями. По нашим данным примерно у 10% больных инфекционный эндокардит дебютировал развитием неврологических осложнений в виде ишемического, геморрагического инсультов или субарахноидального кровоизлияния. В этом случае имеются некоторые отличительные особенности течения неврологической патологии, которые позволяют заподозрить инфекционный эндокардит в качестве причинного фактора.
- Начало развития неврологической симптоматики является острым, с захватом нескольких бассейнов кровоснабжения головного мозга. Очаговые симптомы поражения нервной системы часто не достигают выраженной степени. Более часто, чем при инсультах иного генеза, встречается общемозговая симптоматика (головная боль, оглушение и др.).
- При нейровизуализации выявляются множественные инфаркты мозга.
- Часто наблюдается повышение температуры тела еще до развития симптомов поражения нервной системы.
- При лабораторных исследованиях выявляется: снижение уровня гемоглобина, снижение количества эритроцитов, лейкоцитоз, увеличение СОЭ.
- При УЗИ часто обнаруживается увеличение селезенки.
- При эхокардиографии выявляются клапанные вегетации.
Читайте также:


