Какие антибиотики принимать при инфекции ноги
Статья посвящена пиогенному стрептококку и вызываемым им тонзилофарингиту, ревматической лихорадке как его осложнению и рожистому воспалению.
Среди 18 видов и 8 родственных групп бактерий, причисленных к важнейшим патогенам человека, особую роль играют стрептококки. По медицинской значимости они занимают второе место после стафилококков. Из числа стрептококков, патогенных для человека, с середины 80-х гг. ХХ столетия во многих странах мира наблюдается рост заболеваемости, обусловленной β-гемолитическими стрептококками группы А (БГСА, S.pyogenes).
β-гемолитический стрептококк группы А (пиогенный стрептококк, БГСА S.pyogenes) - грамположительный, неспорообразующий, неподвижный микроорганизм. Растёт на кровяном агаре, обладает выраженной гемолитической активностью, каталазанегативный, чувствителен к бацитрацину. Встречается повсеместно, часто колонизирует кожные покровы и слизистые оболочки человека. Главными путями передачи являются воздушно-капельный, контактный и пищевой. Патогенез заболеваний связан с продукцией токсинов: гемолизин, стрептолизин, стрептокиназы А и В, дезоксирибонуклеаза, гиалуронидаза. Основные нозоформы представлены поверхностными (ангины, фарингит, импетиго, рожа), инвазивными (некротизирующий фасциит, миозит, менингит, эндокардит, пневмония, послеродовой сепсис) и токсин-опосредованными инфекциями (скарлатина, синдром токсического шока). Со стрептококковой инфекцией связано также возникновение неврологических расстройств у детей, проявляющихся обсессивно-компульсивными расстройствами (PANDAS-синдром).
Streptococcus pyogenes сохраняет 100% чувствительность к β-лактамным антибиотикам (пенициллинам, цефалоспоринам, карбапенемам). Они остаются единственным классом антибиотиков, к которым у S.pyogenes не развилась резистентность. Актуальной проблемой является устойчивость к макролидам, которая в некоторых регионах мира превышает 30%. Многоцентровое исследование резистентности клинических штаммов S.pyogenes, проведённое в 2000-2001 гг., позволило изучить распространенность устойчивости, прежде всего к макролидам, в различных регионах России. Частота резистентности к эритромицину варьировала и достигала 11,4%, при этом не было обнаружено штаммов, устойчивых к телитромицину, представителю нового класса антибиотиков - кетолидов. Почти в 90% случаев резистентность к макролидам была обусловлена метилированием рибосом, в остальных случаях она была связана с активным выведением (эффлюксом) антибиотика из клетки.
Стрептококковый тонзиллофарингит
Стрептококковый тонзиллофарингит (ангина) - острое общее инфекционное заболевание с преимущественным поражением лимфоидного аппарата и слизистой оболочки глотки, вызванное БГСА. Под рецидивирующим стрептококковым тонзиллофарингитом следует понимать множественные эпизоды заболевания в течение нескольких месяцев с положительными результатами бактериологических и/или экспресс-методов диагностики БГСА, отрицательными результатами исследований между эпизодами заболевания, повышением титров противострептококковых антител после каждого случая болезни.
Этиология: среди бактериальных возбудителей острого тонзиллофарингита наибольшее значение имеет БГСА.
Эпидемиология. В США ежегодно диагностируется 1-1,4 млн. случаев тонзиллофарингита БГСА-этиологии. Передача осуществляется воздушно-капельным, контактным и пищевым путями. Источниками инфекции являются больные, реже - бессимптомные носители. Вероятность заражения увеличивается при высокой обсемененности и тесном контакте. БГСА может вызывать крупные вспышки тонзиллофарингита в организованных коллективах. Чаще болеют дети в возрасте 5-15 лет. Наибольшая заболеваемость - в зимне-весенний период.
Клиническая картина: Инкубационный период составляет от нескольких часов до 2-4 дней. Характерно острое начало с повышения температуры тела до 37,5-39°С, выражена общая интоксикация. Боль в горле бывает так сильно выражена, что у больного нарушается глотание. При осмотре выявляется покраснение нёбных дужек, язычка и задней стенки глотки. Миндалины гиперемированы, отёчны, часто с гнойным налётом желтовато-белого цвета. Налёт рыхлый, пористый, легко удаляется шпателем с поверхности миндалин без кровоточащего дефекта. У всех больных отмечается регионарный лимфаденит.
Кровь: лейкоцитоз, сдвиг лейкоцитарной формулы влево, увеличение СОЭ, появление С-реактивного белка.
Длительность периода разгара (без лечения) составляет 5-7 дней. В дальнейшем, при отсутствии осложнений, основные клинические проявления болезни быстро исчезают.
Осложнения. Особую опасность представляют осложнения стрептококкового тонзиллофарингита, которые делятся на:
- ранние (гнойные), развивающиеся на 4-6-й день от начала заболевания,- отит, синусит, мастоидит, паратонзиллярный абсцесс, шейный лимфаденит, менингит, бактериемия, эндокардит, пневмония;
- поздние (негнойные): постстрептококковый гломерулонефрит, токсический шок, развивающиеся в стадии реконвалесценции (на 8-10-й день от начала болезни) и острая ревматическая лихорадка, развивающаяся через 2-3 нед после купирования симптомов заболевания - опасные, часто приводящие к инвалидизации заболевания.
Диагностика. Чрезвычайно важно своевременно установить этиологию тонзиллофарингита, поскольку, за редким исключением, только ангина стрептококковой этиологии требует антибактериальной терапии. Диагностика включает микробиологическое исследование мазка с поверхности миндалин и/или задней стенки глотки. За рубежом широкое распространение получили методы экспресс-диагностики, основанные на прямом выявлении стрептококкового антигена в мазках с поверхности миндалин и/или задней стенки глотки. Современные тестовые системы позволяют получать результат через 15-20 мин с высокой специфичностью (95-100%), но меньшей, чем при культуральном исследовании, чувствительностью (60-95%), в связи с чем отрицательный результат экспресс-теста всегда должен подтверждаться культуральным исследованием.
Целью антибиотикотерапии острых стрептококковых ангин является эрадикация БГСА, что ведёт не только к ликвидации симптомов инфекции, но и предупреждает ранние и поздние осложнения, а также предотвращает распространение инфекции.
Выбор антибиотиков. Препаратами I ряда для лечения острого стрептококкового тонзиллита являются пенициллин (феноксиметилпенициллин), аминопенициллины и оральные цефалоспорины. У пациентов с доказанной аллергией на β-лактамные антибиотики следует применять макролиды, а при непереносимости последних - линкозамиды.
Носительство БГСА. В среднем около 20% детей школьного возраста являются носителями БГСА в весенне-зимнее время. Учитывая низкий риск развития гнойных и негнойных осложнений, а также незначительную роль в распространении БГСА, хронические носители, как правило, не нуждаются в антибактериальной терапии.
Острая ревматическая лихорадка
Острая ревматическая лихорадка (ОРЛ) может возникать как после тонзиллофарингита с типичной клинической картиной, так и после перенесённой бессимптомной или малосимптомной инфекции. ОРЛ возникает только после инфекций глотки, и никогда после инфекций кожи и мягких тканей. Предположительное объяснение этого феномена состоит в различии иммунного ответа на кожную и глоточную инфекцию и в отсутствии ревматогенного потенциала у штаммов, вызывающих кожные инфекции. Риск развития ОРЛ после нелеченного тонзиллофарингита составляет 1%. К ревматогенным М-серотипам стрептококка относятся 1, 3, 5, 6, 18, 19, 24.
В настоящее время в развитых странах острая ревматическая лихорадка встречается с частотой 0,5 на 100000 детей школьного возраста. В развивающихся странах заболеваемость составляет от 100 до 200 на 100000 детей школьного возраста, ежегодно регистрируется от 10 до 15 млн. новых случаев ОРЛ, которая является основной причиной смерти от сердечно-сосудистой патологии.
Следует отметить, что немотивированная задержка восстановления трудоспособности, слабость, нестойкий субфебрилитет, артралгии, сердцебиение и нерезко повышенная СОЭ, сохраняющиеся после перенесенной ангины, в сочетании с ростом титров противострептококковых антител (антистрептолизин О, антистрептокиназа, антистрептогиалуронидаза, анти-ДНКаза В) могут свидетельствовать о дебюте острой ревматической лихорадки.
В соответствии с рекомендациями ВОЗ для диагностики острой ревматической лихорадки в качестве международных применяются критерии Джонса, пересмотренные Американской кардиологической ассоциацией в 1992 г. (см. табл.). Наличие двух больших критериев или одного большого и двух малых в сочетании с данными, документированно подтверждающими предшествующую БГСА-инфекцию, свидетельствует о высокой вероятности ОРЛ. Однако ни один диагностический критерий не является строго специфичным для ОРЛ, поэтому трудности в раннем распознавании заболевания и дифференциальной диагностике с другими нозологиями сохраняются по-прежнему.
Критерии Джонса, применяемые для диагностики первой атаки ревматической лихорадки (по состоянию на 1992 г.)

Лечение инфекции костей и суставов является одной из сложных проблем в травматологии и ортопедии. Имплант-ассоциированная инфекция костей и суставов приводит к неэффективности антибактериальной терапии в связи с наличием биопленок [8]. С целью купирования воспаления проводятся неоднократные хирургические вмешательства с использованием материалов, способных доставлять и создавать локальную концентрацию антибиотика непосредственно в очаге инфекции [9].
В современной клинической медицине достигнуты значительные успехи в лечении периимплантной костной и суставной инфекции с применением различных материалов [4,6,7].
Остается много вопросов, которые необходимо решить при лечении данной патологии: как доставить антибиотик к месту назначения в необходимой концентрации для купирования воспаления; какой группы антибиотик использовать; какова его фармакокинетика; есть ли возможность использовать антибиотик совместно со средствами, усиливающими остеообразование и/или ослабляющими остеолиз; как удалить местную форму препарата из тканей, если это будет необходимо [5].
Все системы транспорта антибиотика к очагу инфекции можно разделить на нерассасывающиеся и рассасывающиеся (биодеградируемые)[10].
Цель исследования: улучшение результатов хирургического лечения периимплантной инфекции костей и суставов.
Материалы и методы исследования: в ОТО МОНИКИ с 2004 г. – по сентябрь 2015 г., при сочетании инфицирования с дестабилизацией компонентов эндопротеза у пациентов с перипротезным воспалением тазобедренного сустава в 34 случаях и с глубоким перипротезным нагноением коленного сустава в 8 случаях использован нерассасывающийся метод. Применяются временные спейсеры, импрегнированные антибиотиками с целью заполнения остаточной полости, воздействия на микрофлору очага воспаления и создание благоприятных условий для выполнения повторного тотального эндопротезирования на фоне стойкого купирования воспалительного процесса. Мужчин среди них – 24, женщин – 18, в возрасте от 31 до 75 лет.
При лечении имплант-ассоциированной костной инфекции с наличием костной деструкции в ОТО МОНИКИ с января 2015 г. – по сентябрь 2015 г. применен рассасывающий метод с использованием аутотрансплантата без фиксации и с фиксацией его биодеградируемым винтом с антибиотиком у 7-и пациентов, в возрасте от 36 до 60 лет. Мужчин – 6, женщин – 1.
Результаты и обсуждение:
Критерии для проведения двухэтапного эндопротезирования:
- Наличие местных проявлений перипротезного инфицирования;
- Стабильные компоненты эндопротеза при наличии положительной полирезистентной микрофлоры;
- Хроническое продуктивное воспаление с преобладанием сегментоядерных нейтрофилов [3].
- Гистопатологическое исследование: отсутствие при цитологическом исследовании остеокластов, наличие более 5 нейтрофилов в поле зрения при гистологическом исследовании свежезамороженных параартикулярных тканях;
- Неэффективность проведенных ранее хирургических санаций;
- Возможность проведения супрессивной антибиотикотерапии;
- Согласие больного на проведение двухэтапного метода лечения;
- Отсутствие тяжелых соматических заболеваний;
- Отсутствие критической потери костной ткани;
Первым этапом осуществляется хирургическая санация с широкой ревизией возможных путей распространения инфекции и удалением вертлужного, бедренного компонентов эндопротеза и фиксирующих материалов.
После завершения санации проводится интраоперационное формирование цементного спейсера в соответствии с формой и размерами вертлужной впадины с последующим укреплением его к проксимальному отделу бедренной кости (рис. 1)
а)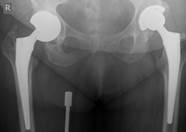
б)
в) 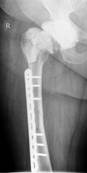
Рис. 1. Рентгенограмма таза больной К-ой, 1951 г.р., и/б 21813/18278
Нестабильность вертлужного компонента эндопротеза справа с комбинированным дефектом тазовой кости и повреждением бедренного компонента. а) – при поступлении в клинику; б) – удаленные компоненты эндопротеза с повреждением бедренного компонента; в) – рентгенограмма после первого этапа хирургического лечения – удаление компонентов эндопротеза справа, установка цементного спейсера, остеосинтез бедренной кости.
Фиксированный к бедренной кости цементный спейсер погружается в вертлужную впадину, заполняя пространство для последующего установления вертлужного компонента ревизионного эндопротеза (2-й этап).
Для изготовления цементного спейсера используется рентгеноконтрастный цементоподобный материал, обеспечивающий установку и крепление протезов к костям. Варианты антибиотиков, которые добавляют в спейсер: аминогликозиды (тобрамицин, гентамицин); Цефалоспорины 1-ого поколения (цефазолин), 2-ого поколения (цефуроксим), 3-его поколения (цефтазидим), 4-ого поколения (цефотаксим), 5-ого поколения (цефтаролин); фторхинолоны (ципрофлоксацин); гликопептиды (ванкомицин); оксазолидиноны (линезолид); противогрипковые (вориконазол).
Для формирования цементного спейсера достаточно полутора – двух доз, хотя требуемое количество зависит от характера хирургического вмешательства и применяемого метода. После окончания полимеризации приготовленный спейсер фиксируется к проксимальному отделу бедренной кости с помощью дополнительной дозы цемента. Перед установкой спейсера следует обеспечить тщательную санацию и высушивание проксимальной части костномозгового канала бедренной кости непосредственно перед погружением временного имплантата.
В случаях, когда нестабильность обоих компонентов эндопротеза сочетается с глубокой перипротезной инфекцией возможно применение преформированных (фабричных) спейсеров.
После тщательной хирургической санации очага воспаления выполняется удаление обоих компонентов эндопротеза тазобедренного сустава и фиксирующего материала. В канал бедренной кости устанавливается артикулирующий преформированный спейсер, импрегнированный антибиотиками (гентамицин, ванкомицин), а затем вправляются в вертлужную впадину, рана дренируется в течение двух дней (рис. 2).
а)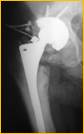
б)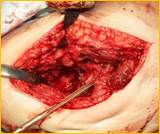
в) 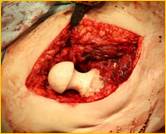
г)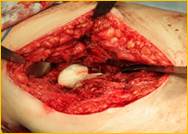
д) 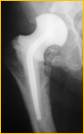
е) 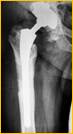
Рис. 2. Рентгенограмма правого тазобедренного сустава больного Г-на, 1963 г.р., и/б 16697/8454
Глубокое перипротезное инфицирование правого тазобедренного сустава. Комбинированный дефект правой вертлужной впадины и проксимального отдела бедренной кости. а) – при поступлении в клинику фистулограмма правого тазобедренного сустава; б) – внешний вид мягких тканей после удаления компонентов эндопротеза; в) – первый этап – санирующая операция на правом тазобедренном суставе с установкой спейсера в канал бедренной кости; г) – вправление спейсера; д) – рентгенограмма правого тазобедренного сустава после установки спейсера; е) – рентгенограмма правого тазобедренного сустава после второго этапа – удаление спейсера, повторное тотальное эндопротезирование правого тазобедренного сустава с установкой ревизионной конструкции и костной аутопластикой дефекта бедренной кости.
Среди 34 пациентов с перипротезным инфицированием тазобедренного сустава рецидив воспаления отмечен у 2 пациентов, что составило – 5,8%, которым выполнено удаление спейсера, формированием опорного неоартроза тазобедренного сустава. Три пациента отказываются от реэндопротезирования, что составляет – 8,8%. Купирование воспаления достигнуто в 94,2% случаев.
Среди 8 пациентов с глубоким нагноением эндопротеза коленного сустава рецидивов воспаления не отмечено. Двум пациентам планируется выполнить повторное эндопротезирование коленного сустава.
Необходимость проводить повторную операцию по замене спейсера на ревизионный эндопротез остается главным недостатком нерассасывающихся материалов [1].
С целью профилактики рецидивов перипротезного инфицирования суставов применен рассасывающийся биополимерный биодеградируемый материал на основе коллагеновой губки, содержащий антибиотик гентамицин. При имплантации 1 губки в полостях и тканях создается высокая локальная концентрация (666,66 мг/мл) гентамицина. Перед применением коллагеновой губки с гентамицином необходимо максимально просушить область аппликации.
а) 
б) 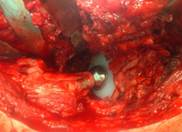
Рис. 3. а) – биополимерный биодеградируемый материал на основе коллагеной губки с гентамицином (collatampEG); б) – коллагеновая губка с гентамицином покрывает металлические участки эндопротеза тазобедренного сустава
Преимущества биополимерного биодеградируемого материала на основе коллагеновой губки с антибиотиком: создает высокую концентрацию антибиотика в областях с низкой перфузией крови в тканях; профилактики ранних и поздних инфекционных осложнений у пациентов из группы риска благодаря высокой концентрации антибиотика; обладает местным гемостатическим действием; является биодеградируемым материалом (не требует дальнейших манипуляций по удалению).
Критерии для лечения имплант-ассоциированной инфекции рассасывающимся методом с использованием аутотрансплантата без фиксации и с фиксацией его биодеградируемым винтом с антибиотиком.
- Наличие местных проявлений перииплантной костной и суставной инфекции;
- Возможность использовать аутотрансплантат для замещения костных дефектов;
- Отсутствие аллергической реакции на компоненты биодеградируемого винта;
- Чувствительность микрофлоры к антибиотику[2].
У 4-х пациентов с наличием дестрекции костей и суставов проводилась тщательная хирургическая санация очага воспаления, секвестрэктомия, замещение костного дефекта аутотрансплантатом из гребня подвздошной кости, дренирование послеоперационной раны (рис.4)
а) 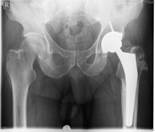
б)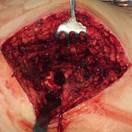
в) 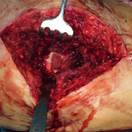
г) 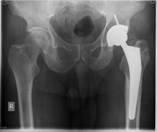
Рис. 4. Пациент К-н, 1957 г.р., и/б 14426
Глубокое перипротезное инфицирование левого тазобедренного сустава с наличием дефекта большого вертела, без дестабилизации комопнентовэндопротеза. а) – рентгенограмма левого тазобедренного сустава при поступлении в клинику; б) – внешний вид костного дефекта большого вертела после хирургической санации; в) – замещение костного дефекта трансплантатом из гребня подвздошной кости; г) – рентгенограмма левого тазобедренного сустава после оперативного лечения.
У одного пациента через четыре месяца после операции замещения костного дефекта большеберцовой кости по данным рентгенограмм отмечено рассасывания аутотрансплантата. У одного пациента после костной пластики костей стопы рецидив воспаления с формированием свищевого хода.
Трем пациентам с длительным вялотекущим процессом с наличием костной деструкции костей и суставов проведена хирургическая санация с замещением костного дефекта аутотрансплантатом и фиксация его биодеградируемым винтом с антибиотиком.
а)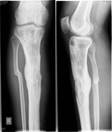
б)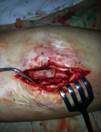
в) 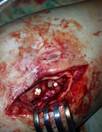
г) 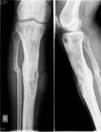
Рис. 5. Пациент Г., и/б 2485. Хронический остеомиелит большеберцовой кости справа с наличием секвестра, состояние после удаления погружного металлофиксатора большеберцовой кости, свищевая форма. а) – рентгенограмма правой голени с наличием очага деструкции большеберцовой кости, размером 9х2 см, б) – аутотрансплантат из гребня подвздошной кости, в) – фиксация аутотрансплантата винтами с антибиотиком,
г) – рентгенограмма правой голени после оперативного лечения
Послеоперационное ведение проводилось в соответствии со стандартным ведением пациентов с высоким риском инфекции.
У одного пациента в послеоперационном периоде отмечено длительное заживление послеоперационной раны. На контрольных рентгенограммах – рассасывания трансплантата ни в одном случае не произошло. Рецидива воспаления не отмечено ни в одном случае.
Заключение: использование спейсера с антибиотиком является золотым стандартом при лечении перипротезной инфекции крупных суставов и позволяет добиться стойкого купирования воспалительного процесса в 95,3% случаях. С целью профилактики перипротезного инфицирования у пациентов с высоким риском послеоперационного нагноения рекомендовано использовать биополимерный биодеградируемый материал на основе коллагеновой губки, содержащий антибиотик гентамицин.
При лечении имплант-ассоциированной костной инфекции с наличием костной деструкции использование биодеградируемого винта с антибиотиком позволяет воздействовать на микрофлору непосредственной в очаге инфекции, фиксация аутотрансплантата способствует его остеоинтеграции, повторной операции для удаления винта не требуется.
Рецензенты:
Оноприенко Г.А., д.м.н., профессор, ГБУЗ МО МОНИКИ им. М.Ф. Владимирского, г. Москва;
Дорожко И.Г., д.м.н., профессор, ГБУЗ МО МОНИКИ им. М.Ф. Владимирского, г. Москва.
М.Н. ЗУБКОВ, доктор медицинских наук, профессор, вице-президент Межрегиональной ассоциации клинической микробиологии и антимикробной химиотерапии (МАКМАХ). ПРОФИЛАКТИКА И ТЕРАПИЯ ХИРУРГИЧЕСКОЙ ИНФЕКЦИИ
Основная роль антибиотикопрофилактики в хирургии заключается в предупреждении инфекций, возникающих вследствие операции или других инвазивных вмешательств либо имеющих прямую связь с ними, а побочная цель - в уменьшении продолжительности и стоимости пребывания больного в стационаре.
Ее суть состоит в достижении эффективных концентраций антибиотика в операционной зоне во время ее микробного загрязнения и поддержании бактерицидного уровня препарата в течение всей операции и первых 3-4 часов после оперативного вмешательства, поскольку этот отрезок времени является решающим для размножения и адгезии на клетках хозяина попавших в рану микробов, что служит пусковым механизмом для начала инфекционно-воспалительного процесса в ране. Антибиотикопрофилактика, начатая по истечении этого периода, является запоздалой, а ее продолжение после окончания операции в большинстве случаев излишним, поскольку профилактическая роль антибиотика в основном заключается в уменьшении пороговой концентрации бактерий в ране и препятствии адгезии возбудителя.
Антибиотикопрофилактика показана там, где особенно высок риск развития послеоперационной инфекции (например, при "условно чистых" операциях на органах брюшной, грудной полости и малого таза, затрагивающих слизистые оболочки, населенные микрофлорой) или если ее последствия могут представлять угрозу здоровью и жизни больного (при некоторых "чистых" операциях, связанных с имплантацией сосудистых шунтов или искусственных протезов, когда немногочисленные и малопатогенные микроорганизмы с поверхности кожи могут проникнуть глубоко в рану и вызвать ее нагноение). Если хирург заранее уверен, что встретится с инфекцией в процессе операции (например, при "условно чистых" или "загрязненных" вмешательствах), в качестве антибактериальной защиты проводят превентивную антибиотикотерапию, которая должна быть ограничена самыми жесткими показаниями: патофизиологическими предпосылками (например, перфорация органов желудочно-кишечного тракта в результате проникающего ранения или имеющая эндогенное происхождение, сопровождающаяся загрязнением кишечной микрофлорой брюшной полости и прилегающих к ней структур); наличием входных ворот инфекции (например, открытые переломы); биологией потенциального возбудителя. Раннее назначение антибиотиков, обычно в течение 12 часов с момента перфорации или травмы, расценивается как профилактика, более позднее, когда развились признаки серьезной инфекции, - как лечение.
В большинстве случаев для профилактики послеоперационной инфекции достаточно одной дозы антибиотика (во время премедикации; вторая доза вводится при 3-часовых и более длительных операциях) либо проводят сверхкраткий курс антибиотикопрофилактики, ограниченный двумя-тремя дозами препарата. Такая тактика, основанная на многочисленных клинических и экспериментальных наблюдениях, вполне эффективна, снижает вероятность побочных действий антибиотика, ограничивает возможность развития устойчивости бактерий к химиопрепаратам, обеспечивает меньшую стоимость лечения. Профилактическое применение антибиотиков задолго до операции или более 48 часов в послеоперационном периоде ведет к нарушению биоценоза желудочно-кишечного тракта и колонизации верхних его отделов микрофлорой толстой кишки с возможным развитием эндогенной инфекции путем бактериальной транслокации условных патогенов через лимфатическую систему тонкого кишечника. Кроме того, возрастает опасность суперинфекции у оперированных больных за счет селекции антибиотикорезистентных штаммов. Поэтому антибиотик следует вводить больному в соответствующей дозе непосредственно перед операцией (за 10-15 мин. внутривенно во время наркоза либо за 40-60 мин. до операции внутримышечно) с последующими повторными инъекциями по показаниям, но не более 24-48 часов.
Для профилактики раневой инфекции чаще всего назначают цефалоспорины 1-го и 2-го поколения (препараты 3-го поколения существенно дороже и используются в основном для лечения), так как они имеют достаточный спектр бактерицидной активности против наиболее распространенных возбудителей послеоперационных осложнений, и прежде всего стафилококков; при парентеральном введении создают высокие концентрации в операционной зоне; отличаются малой токсичностью и частотой побочных действий. К числу недостатков всех цефалоспоринов следует отнести неэффективность при энтерококковой инфекции; плохое проникновение через гематоэнцефалический барьер (кроме цефтазидима и некоторых других препаратов 3-го поколения); возможное увеличение нефротоксичности в комбинации с аминогликозидами.
Помимо цефалоспоринов при высоком риске стафилококковой хирургической инфекции у ортопедических и некоторых других категорий больных применяют ванкомицин. При колоректальных операциях наряду с пероральным промыванием кишечника изотоническим раствором за сутки до операции больному назначают внутрь неомицин, 1 г + эритромицин, 1 г в 13, 14 и 22 ч., а в день операции - цефалоспорины 1-2-го поколения в/в дважды с интервалом 8 ч. При катаральном и флегмонозном аппендиците достаточно однократного применения в/в цефазолина (1 г) или цефуроксима (1,5 г) либо проведения короткого курса (2-3 дозы). При гангренозном аппендиците дополнительно вводят метронидазол, 0,5 г в/в. Если в послеоперационном периоде возникает подозрение на перитонит и/или абсцедирование, продолжают применение антибиотиков в течение 3-5 суток. Схемы профилактики при других видах операций приведены в таблице 1.
Таблица 1
ВАРИАНТЫ АНТИБИОТИКОПРОФИЛАКТИКИ (АП) РАНЕВОЙ ИНФЕКЦИИ ПРИ НЕКОТОРЫХ ВИДАХ ХИРУРГИЧЕСКИХ ВМЕШАТЕЛЬСТВ*
| Операции | Схемы профилактики 1 |
| Протезирование тазобедренного сустава, спондилодез | ЦЕФАЗОЛИН, 1 г в/в каждые 8 ч 2-3 дня ИЛИ ЦЕФУРОКСИМ, 1,5 г в/в, затем по 750 мг каждые 8 ч 1-2 дня 2 . |
| Тотальная замена сустава (кроме тазобедренного) | ВАНКОМИЦИН, 1 г в/в перед операцией 3 , затем ОКСАЦИЛЛИН, 0,5 г в/м каждые 6 ч 2 сут. |
| Открытое вправление закрытого перелома кости с внутренней фиксацией | ЦЕФАЛОСПОРИНЫ 1-2-го поколения 2-3 дозы с интервалом 8 ч. |
| Тотальная артропластика бедра | ЦЕФУРОКСИМ, 1,5 г в/в + 750 мг каждые 8 ч (либо ЦЕФАЗОЛИН по 1 г) в течение 48-72 ч. |
| Открытый перелом любого типа, произошедший в сроки более 6 ч (без признаков нагноения раны) | БЕНЗИЛПЕНИЦИЛЛИН, 4 г/сут (либо ЛИНКОМИЦИН/КЛИНДАМИЦИН, 1,2-1,8 г/сут) 4-5дней 4 . |
| Протезирование клапанов сердца 5 , реконструктивные операции на сосудах брюшной полости и нижних конечностей | ЦЕФАЗОЛИН, 1 г в/в каждые 8 ч 1-2 дня, ИЛИ ЦЕФУРОКСИМ, 1,5 г в/в, затем по 750 мг каждые 8 ч 1-2 дня, ИЛИ ВАНКОМИЦИН 1 г в/в, затем через 12 ч 2 дня. |
| На грудной полости, ушивание грыжевых ворот | ЦЕФАЗОЛИН, 1 г в/в, затем через 8 ч ИЛИ ЦЕФУРОКСИМ, 1,5 г в/в однократно. |
| При ущемленной грыже | ЦЕФОКСИТИН, 2 г в/в, затем 1 г каждые 8 ч > 5 дней (с учетом клиники), или КЛИНДАМИЦИН (ЛИНКОМИЦИН) 600 мг в/в каждые 6 ч + ГЕНТАМИЦИН (НЕТИЛМИЦИН 6 ) 1,5 мг/кг в/в каждые 8 ч > 5 дн. |
| Кесарево сечение, экстирпация матки из брюшного или влагалищного доступа | ЦЕФАЗОЛИН, 1 г в/в, затем 0,5-1 г через 8 ч 2 раза., ИЛИ ЦЕФОКСИТИН 7 (или ЦЕФОТЕТАН 7 , ЦЕФМЕТАЗОЛ 7 ), 2 г в/в однократно 8 , или ЦЕФУРОКСИМ, 1,5 г в/в однократно. |
| На желудке и 12-перстной кишке, включая чрескожную эндоскопическую гастростомию | ЦЕФАЗОЛИН, ЦЕФОКСИТИН, ЦЕФОТЕТАН, ЦЕФМЕТАЗОЛ, ЦЕФТИЗОКСИМ 7 , ИЛИ ЦЕФУРОКСИМ, 1,5 г в/в через 12 ч 2-3 дня. |
| На желчных путях, включая лапароскопическую холецистэктомию | ЦЕФАЗОЛИН (или ЦЕФМЕТАЗОЛ), 1 г в/в, затем 1 г через 8 ч и16 ч, или ЦЕФТИЗОКСИМ, 1 г в/в, затем через 12 ч, или ЦЕФУРОКСИМ, 1,5 г в/в 1 раз. |
| Эндоскопическая ретроградная холангиопанкреатография | ЦИПРОФЛОКСАЦИН, 500 мг - 1 г внутрь за 2 ч до процедуры, или за 1 ч ЦЕФТИЗОКСИМ, 1 г в/в, или за 1 ч ПИПЕРАЦИЛЛИН, 4 г в/в. |
| На толстой и прямой кишке, включая аппендэктомию | См. в тексте |
1 Первую дозу цефалоспорина вводят в/в во время вводного наркоза (за 10-15 мин. до разреза); при операциях > 3 ч антибиотик вводят повторно; при реконструктивных операциях на сосудах и нервных окончаниях АП продлевают до 2-3 сут.
2 До 3 дней, по показаниям.
3 В/в капельно в течение 1 часа.
4 Профилактика газовой гангрены.
5 АП не показана при катетеризации сердца.
6 О преимуществах нетилмицино см. в тексте.
7 Цефалоспорины 2-го поколения, активные против анаэробов.
8 При брюшном доступе повторяют по 1 г в/в через 8 ч и 16 ч.
Антибиотикопрофилактику считают неэффективной, если в области первичного операционного разреза возникла послеоперационная инфекция; если появилась необходимость дренирования операционной зоны; если в течение 4-недельного периода после первичной операции понадобилось не находящее объяснений применение антимикробных препаратов.
При уже развившейся хирургической инфекции на начальном этапе лечения назначение антибиотиков носит эмпирический характер до получения результатов бактериологического исследования материалов из раны. При этом выбор тактики химиотерапии зависит от характера хирургической патологии и локализации гнойно-воспалительного процесса, определяющих специфику раневой инфекции. Вполне естественно, что при перитонитах, где превалирует анаэробная флора в ассоциации с энтеробактериями, и при инфекциях костей и мягких тканей, где ведущую роль играют стафилококки, алгоритмы эмпирической антибиотикотерапии будут различными.
При травматических ранах с признаками нагноения назначают комбинированную терапию, учитывая лидирующее положение стафилококков и высокий удельный вес микробных ассоциаций (до 70%) при посттравматических инфекциях. Обычно используют гентамицин (4,5 мг/кг/сут) в сочетании с оксациллином (4-6 г/сут), цефазолином (3 г/сут) или линкомицином (1200-1800 мг/сут) при высоком риске развития анаэробной инфекции.
Современная терапия острых инфекций органов малого таза (эндометрит, тазовый целлюлит, параметрит, абсцессы, флегмоны) должна быть прямо направлена против аэробного и анаэробного компонентов полимикробной флоры, где комбинация гентамицина с клиндамицином достигает 88% эффективности. Из других препаратов следует выделить пенициллины широкого спектра действия, и прежде всего пиперациллин (характеризующийся достаточно высокой активностью против Enterobacteriaceae и грамположительных анаэробов) и его комбинированную форму пиперациллин/тазобактам (тазоцин). Последний особенно активен против продуцирующих бета-лактамазу штаммов энтеробактерий и Bacteroides spp. - ведущих представителей микрофлоры кишечника и генитального тракта, что существенно повышает возможности тазоцина не только в терапии гинекологических инфекций (78-95% клинической эффективности), но и в лечении интраабдоминальных инфекций, а также септических состояний, где клиническое выздоровление при монотерапии отмечалось у 82% больных (Intensive Care Med., 1994, 20, Suppl.3, 43-48). Заслуживают внимания данные, свидетельствующие о высокой результативности (95-100%) лечения тазоцином инфекций костей и суставов (Complications Surg., 1993, 12, Suppl A, 50-60)
Состав микрофлоры при перитонитах
Стрептококки - 11%
Энтеробактерии - 24%
Стафилококки - 5%
Псевдомонады - 12%
Анаэробы - 48%
Состав микрофлоры при инфекциях костей и мягких тканей
Стрептококки - 7%
Энтеробактерии - 15%
Стафилококки - 60%
Псевдомонады - 8%
Анаэробы - 10%
Но особенно следует выделить антисинегнойную активность пиперациллина и тазоцина, что позволяет использовать их для лечения внутрибольничных инфекций в виде монотерапии (4 г/0,5 г тазоцина) или в комбинации с нетилмицином (4,5 г/кг/сут).
При острых интраабдоминальных инфекциях (80% из них возникает вне стационара), когда точная локализация неизвестна, лечение направляют против смешанной флоры кишечника, включающей факультативные грамотрицательные бактерии и часто встречающиеся анаэробы (Clostridium spp. и Bacteroides spp.). Одна из применяемых в настоящее время схем противоинфекционной терапии предусматривает комбинацию аминогликозида с антианаэробным препаратом (метронидазол или клиндамицин). Многие хирурги предпочитают добавлять ампициллин для воздействия на энтерококки. Назначение тазоцина по эффективности не уступает комбинированному препарату имипенем-циластатин. Широко используются также комбинации цефалоспоринов 3-го поколения с клиндамицином или метронидазолом. Парентеральную терапию продолжают до исчезновения лихорадки, снижения числа лейкоцитов крови (
Читайте также:


