Как избавиться от гнойных инфекций
Гемофильная инфекция – группа острых инфекционных болезней, вызванных гемофильной палочкой.
Повышение заболеваемости отмечается в конце зимы и весной.
Гемофильная инфекция характеризуется поражением:
- органов дыхания (развитие тяжелейших пневмоний);
- центральной нервной системы;
- развитием гнойных очагов в различных органах.
Возбудитель инфекции – Haemophilus influenzaе (палочка Пфайффера).

Возбудитель инфекции локализуется на слизистой оболочке верхних дыхательных путей.
Гемофильную палочку можно выделить из носоглотки 90% здоровых людей, 5% всех выделенных штаммов способны заразить организм. Наиболее патогенный тип бактерии - Haemophilus influenzaе b.
В связи с высокой устойчивостью возбудителя гемофильная инфекция плохо поддается антибиотикотерапии.
Здоровое носительство может продолжаться от нескольких дней до нескольких месяцев. Носительство может сохраняться даже при назначении антибактериальных препаратов. Возбудитель начинает поражать организм в момент его ослабленного состояния.
Источник и резервуар инфекции – только человек.
Путь распространения инфекции – воздушно-капельный (от зараженного человека здоровому), также передача инфекции возможна при контакте с инфицированным материалом, как от бессимптомных носителей, так и от больных.
Кто наиболее подвержен заражению данной инфекцией?
- дети в возрасте от 4 месяцев до 4 лет;
- дети, посещающие организованные дошкольные коллективы;
- младенцы, находящиеся на искусственном вскармливании;
- дети с иммунодефицитными состояниями или анатомическими дефектами, приводящими к повышенной опасности заболевания гемофильной инфекцией;
- дети, рожденные от матерей с ВИЧ-инфекцией;
- дети, находящиеся в детских домах, домах ребенка;
- взрослые, старше 65 лет;
- люди с ослабленным иммунитетом;
- люди с хроническими заболеваниями легких, с тяжелыми заболеваниями крови;
- пациенты, перенесшие удаление селезенки;
- люди с низким социальным статусом;
- люди, страдающие алкогольной, никотиновой зависимостью
- ослабленный иммунитет;
- онкологические заболевания крови, СПИД;
- прием антибиотиков;
- стрессы
Поражает гемофильная инфекция любые органы. Первым делом она поражает дыхательную систему.
Заболевания органов дыхания:
- трахеит;
- синусит;
- бронхит;
- отит;
- эпиглоттит (острое воспаление надгортанника);
- тяжелая пневмония.
Заболевания, развивающиеся в следствие поражения других органов:
- гнойный бактериальный менингит (воспаление мягкой мозговой оболочки) – самая тяжелая форма инфекции;
- целлюлит (воспаление подкожной клетчатки);
- поражение слизистой глаз (конъюнктивит);

- септический артрит;
- остеомиелит;
- септицемия (заражение крови);
- перикардит (заражение перикарда – наружной оболочки сердца).
Заражение гемофильной инфекцией беременной женщины приводит к развитию патологи плода или к его смерти.
В детском возрасте гемофильная инфекция протекает часто с поражением верхних дыхательных путей, нервной системы, во взрослом чаще встречается пневмония, вызванная гемофильной палочкой.
Некоторые симптомы гемофильной инфекции:
Симптомы при поражении нервной системы – гемофильная инфекция в виде менингита.

По данным Всемирной организации здравоохранения (ВОЗ), менингит составляет около 50% среди всех случаев инвазивных форм гемофильной инфекции типа b.
слабость, повышение температуры тела, боль в горле, насморк

многократная рвота, спутанность сознания, бред, судороги, бессознательное состояние, сыпь, положение тела характерно для менингита (голова запрокинута назад, ноги приведены к животу)
Пневмония, вызванная гемофильной палочкой:

- симптомы интоксикации (слабость, отсутствие аппетита, апатия, нарушение сна).
- повышение температуры тела, боль в области грудной клетки. Сухой кашель.
Артрит, вызванный гемофильной палочкой:

Набухание суставов, покраснение, болезненные движения.
Осложнения после перенесенной гемофильной инфекции.
Осложнения менингита, вызванного гемофильной палочкой:
- Летальность вследствие гнойного менингита достигает 16-20% (даже при своевременной диагностике и правильном лечении!)
- Судороги, задержка нервно-психического развития
- Расстройства речи, задержка речи
- Тугоухость
- Слепота
- Сердечная недостаточность;
- Дыхательная недостаточность.
Гемофильный сепсис приводит к летальному исходу.
Гнойные артриты часто сопровождаются остеомиелитом.
Осложнением эпиглоттита является обструкция дыхательных путей, вызывающая в 5-10% летальный исход.
Профилактика гемофильной инфекции.
Единственным надежным средством профилактики группы заболеваний, вызванных гемофильной инфекцией типа b, является вакцинация.
Первая вакцинация детей групп риска проводится в возрасте 3 месяцев, вторая в 4,5 месяцев, третья – 6 месяцев. Ревакцинация проводится детям в возрасте 18 месяцев.
Оказание медицинской помощи больным с раневой инфекцией начинается в консультативном кабинете поликлиники. Попасть на прием может любой желающий без направления с места первичного лечения. На приеме осуществляется обследование пациентов, назначается амбулаторное лечение, решаются вопросы госпитализации в специализированное отделение гнойной хирургии для дальнейшего комплексного хирургического лечения.
Попав в стационар, пациент проходит комплексное лабораторно-инструментальное обследование для установления точного диагноза и исключения риска периоперационных осложнений. Применяя специальные методы исследования (УЗИ, УЗДГ, РВГ, ЭНМГ, ЭМГ, ТВ, КТ и рентгенографию) наши специалисты разрабатывают вопросы характера, объема и этапности комплексного лечения. Оснащение лабораторий позволяет контролировать состояние органов и систем организма и адекватно проводить лекарственную терапию в пред- и послеоперационном периодах.
Реконструктивно-восстановительные операции у больных с хирургической инфекцией - это трудоемкий и многоэтапный технологический процесс. Комплексное лечение включает хирургическое вмешательство, гравитационную хирургию (экстракорпоральную детоксикацию и гемокоррекцию), гипербарическую, антибактериальную, инфузионно-трансфузионную, медикаментозную терапии, современные методы местного лечения. Все тактические и технические вопросы решаются коллегиально с участием хирургов-ортопедов, врачей гравитационной хирургии и ГБО-терапии, микробиологов, анестезиологов, терапевтов, эндокринологов, неврологов, психологов, реабилитологов, физиотерапевтов, ортопедов-протезистов. При необходимости мы привлекаем на консультацию любого специалиста узкого профиля.
Сразу после операции наши пациенты попадают в палату интенсивной терапии, где врачи-реаниматологи осуществляют постоянное и круглосуточное наблюдение за всеми жизненными функциями оперированного, а также производят лекарственную коррекцию. Здесь больные находятся ровно столько времени, сколько потребуется на восстановление сил, с последующим переводом в общие или индивидуальные палаты с необходимыми бытовыми удобствами.
До и после оперативного вмешательства осуществляется реабилитационное лечение по разработанным нами методикам. Главной задачей реабилитологов является подготовка наших пациентов к активной бытовой и трудовой деятельности.
Кто же является нашими пациентами? Во-первых, это пострадавшие с одиночными или множественными осложненными травмами конечностей, получившие первичное хирургическое лечение в поликлиниках или стационарах по месту жительства. Мы считаем, что существует единая общая стратегическая ошибка – позднее обращение к нам за помощью при развитии гнойных осложнений. Иногда пациенты переводятся в наше специализированное отделение в поздние сроки - от 2 до 8 и более месяцев после развития гнойно-некротических посттравматических или послеоперационных осложнений. Показателен пример пациентки Б., 28 лет. Она получила тяжелую травму с открытыми переломами бедра и голени, повреждением мягких тканей нижней конечности. По месту жительства в центральной районной больнице проводилось консервативное лечение. Течение заболевания осложнилось присоединением нагноения области перелома бедренной и большеберцовой костей. Четыре месяца проводилось лечение по месту жительства в соседнем регионе России. По истечении этого срока больная была переведена в ФГБУ "ПФМИЦ" Минздрава России, где был выполнен ряд реконструктивно-восстановительных операций с применением аппаратов внешней фиксации. Через 1,5 месяца с момента госпитализации пациентка была выписана на амбулаторное лечение.
К сожалению, к нам обращается ряд пациентов с гнойными осложнениями после выполненного остеосинтеза, эндопротезирования. Продолжительное и малоэффективное лечение на местах первичной госпитализации приводит в неоправданно высокой инвалидизации пострадавших.
Пациент Т., 43 лет. Полтора года назад получил открытый перелом нижней трети большеберцовой кости. В городской больнице произведен накостный остеосинтез. После операции развилось нагноение. Около 8 месяцев лечился в поликлинике по месту жительства. Образовался свищ в нижней трети голени. После консультации в поликлинике ФГБУ "ПФМИЦ" Минздрава России госпитализирован в отделение гнойной хирургии. Произведены ряд пластических операций для восстановления функции конечности. Контрольный осмотр через 1 год. Приступил к работе. Конечность опороспособная, жалоб нет.
Пациент М., 37 лет. Переведен из городской больницы, куда был госпитализирован после закрытого перелома бедренной кости и открытого перелома костей голени. По месту первичной госпитализации произведены ряд оперативных вмешательств. Течение заболевания осложнилось глубоким нагноением с последующим развитием остеомиелита большеберцовой кости. Переведен в специализированное отделение ФГБУ "ПФМИЦ" Минздрава России . Продолжительное реконтруктивно-восстановительное лечение с применением костных и кожных пластик позволило устранить воспаление, сохранить конечность. Работает по специальности.
Следующая группа пациентов – это больные с трофическим язвами различного происхождения, обширными дефектами тканей. Мы обладаем огромным опытом замещения образовавшихся дефектов с хорошими функциональными результатами. В нашем арсенале – дерматомы для выполнения пластики расщепленными кожными аутотрансплантатами, при необходимости можем выполнить операции с применением микрохирургической техники. Пациентка М., 58 лет. На протяжении многих лет страдала венозной недостаточностью нижних конечностей. За 4 месяца до обращения ударилась ногой. В месте удара образовалась язва, которая постоянно увеличивалась в размерах, появились боли. Сосудистые хирурги, имея прямые показания к хирургической коррекции сосудистой недостаточности у пациентки, отказались от оперативного вмешательства, так как имелась обширная гнойная рана конечности. После местной и общей медикаментозной терапии выполнена успешная пластика язвенного дефекта, после которой больная смогла выполнить операцию на сосудистом русле.
Разработанные методики реконструктивно-восстановительных операций, на которые получены патенты, позволили зачастую сохранить конечности при том, что по месту жительства пациентам были предложены ампутации. Пациент К., 74 лет. Болен сахарным диабетом около 15 лет. После ношения тесной обуви на подошвенной поверхности стопы образовалась язва, которая прогрессивно увеличивалась в размерах. Появились выраженные боли, ухудшилось самочувствие. Лечился в поликлинике, больнице по месту жительства на протяжении 4-х месяцев, была предложена ампутация нижней конечности на уровне голени. Больной от радикального лечения отказался, обратился в отделение гнойной хирургии ФГБУ "ПФМИЦ" Минздрава России . После полного клинико-лабораторного обследования, на фоне интенсивной медикаментозной терапии, выполнен ряд реконструктивно-восстановительных операций на стопе. Раны зажили, опороспособность стопы восстановлена.
После проведенного лечения наши пациенты в обязательном порядке наблюдаются в поликлинике ФГБУ "ПФМИЦ" Минздрава России (кабинет № 5) до 5-6 раз в год, а иногда, по необходимости, и чаще. Прием ведут врачи, которые осуществляли лечение больного в стационаре.
Таким образом, мы обладаем опытом, ресурсами, огромным желанием помочь нашим пациентам и с удовольствием поможем всем нуждающимся восстановить здоровье и вернуться к полноценной жизни.
Для консультации необходимо позвонить по телефонам:
432-01-45 - заведующий отделением Митрофанов Вячеслав Николаевич






В настоящее время в европейских странах регистрируется 26-43 случаев заболеваний Хиб-инфекцией на 100.000 детей, смертность составляет 1-3 %, высок уровень неврологических осложнений.
ХИБ-инфекция плохо поддается лечению, поскольку гемофильная палочка рекордно устойчива к антибиотикам. По этой причине даже своевременное лечение современными антибиотиками зачастую оказывается безрезультатным.
В России, у детей до 6 лет до трети всех случаев гнойных менингитов вызвано гемофильной палочкой типа Б. Гемофильные менингиты плохо поддаются лечению, поскольку их возбудитель вырабатывает ферменты, которые делают его устойчивым к антибиотикам, поэтому результаты лечения не всегда удачны, и смертность при тяжелых формах заболевания может достигать 16–20%.
Пневмония, вызванная гемофильной палочкой типа Б, возникает преимущественно у детей с 2 до 8 лет, и ее течение в 60% случаев также имеет различные осложнения, в том числе со стороны сердца и легких.
В 2000 году до широкого внедрения Hib-вакцины в странах с ограниченными ресурсами Hib-инфекция была причиной 8,13 миллионов случаев возникновения серьезного заболевания у детей в возрасте 1-59 месяцев (амплитуда колебаний 7,33-13,2 миллионов случаев) и 371 000 случаев смерти (амплитуда колебаний 247 000 – 527 000). К 2008 году, когда 136 государств - членов ВОЗ внедрили вакцину, по оценкам, было 203 000 случаев смерти, обусловленных Hib-инфекцией, среди детей в возрасте младше 60 месяцев (амплитуда колебаний 136 000 – 281 000).
Заболеваемость Хиб-менингитом в России оценивается как 16,9 на 100 тыс. детей 0–5 лет, летальность при нем 15–20%, у 35% развиваются стойкие дефекты.

Общие сведения
Гемофильная инфекция (ХИБ-инфекция) вызывается гемофильной палочкой типа b – Haemophilus influenzae type b. Она может стать причиной острых инфекционных болезней – гнойного менингита, пневмонии (воспаления легких), эпиглоттита (воспаления надгортанника), артрита (воспаления суставов), а также гнойного поражения всего организма – сепсиса. Гемофильная инфекция характеризуется преимущественным поражением органов дыхания, центральной нервной системы и развитием гнойных очагов в различных органах. Бактерия H. influenzae локализуется в носоглотке, откуда может передаваться другим людям воздушно-капельным путем. Только у очень небольшого числа из тех, у кого в носоглотке локализуется возбудитель, развивается заболевание с клиническими проявлениями. Однако носители H. influenzae в носоглотке являются важным источником распространения возбудителя.
Вероятность заболеть
Выделяют несколько групп риска для данного заболевания. Во-первых, наиболее часто страдают от этой инфекции дети. По данным разных исследований, носительство гемофильной палочки в детском коллективе достигает 50%. У детей 6-12 мес., находящихся на искусственном вскармливании и не получающих небольших дополнительных количеств материнских антител с грудным молоком, особенно высок риск развития самых тяжелых форм инфекции – воспаления легких и менингита. По этой причине искусственное вскармливание является дополнительным показанием к прививке против ХИБ-инфекции, начиная с 3-месячного возраста.
Люди экстремальных возрастов (дети до 2-х лет, пожилые люди) и лица с низким социально-экономическим статусом также подвержены гемофильной инфекции. Кроме того, заболеванию подвержены лица с низким социально-экономическим статусом, крайне ослабленные и страдающие алкоголизмом, больные лимфогранулематозом (болезнь Ходжкина), серповидно-клеточной анемией; лица, подвергшиеся спленэктомии (удалению селезёнки).
Заболеваемость повышается в конце зимы и весной. За последние годы заметно увеличилась заболеваемость взрослых.
Симптомы
Длительность инкубационного периода установить трудно, так как заболевание нередко является следствием перехода латентной инфекции в манифестную. Может развиться как местный воспалительный процесс слизистой оболочки верхних дыхательных путей, так и заболевания, обусловленные гематогенной диссеминацией.
Часто гемофильная инфекция протекает у детей в виде обычной респираторной инфекции с соответствующими симптомами. Однако нередки случаи и более тяжелых форм инфекции. Наиболее тяжелой формой гемофильной инфекции является гнойный менингит. По некоторым данным в России у детей до 6 лет до трети всех случаев гнойных менингитов вызвано Haemophilus influenzae type b. Гемофильные менингиты плохо поддаются лечению, поскольку их возбудитель вырабатывает ферменты, которые делают его устойчивым к антибиотикам (около 20-30% гемофильных палочек, выделенных от больных, не чувствительны ко многим антибиотикам). Поэтому результаты лечения не всегда удачны, и смертность при тяжелых формах заболевания может достигать 16–20%.
У трети больных, перенесших гемофильный менингит, развиваются необратимые неврологические осложнения – судороги, задержка нервно-психического развития, глухота, слепота и др.
Пневмония, вызванная гемофильной палочкой типа b, возникает преимущественно у детей с 2 до 8 лет, и ее течение в 60% случаев также имеет различные осложнения, в том числе со стороны сердца и легких.
С гемофильной инфекцией связывают до половины всех гнойных инфекций уха, горла, носа, в частности, рецидивирующих гнойных отитов (воспаление среднего уха) и синуситов (воспаление придаточных пазух носа).
Гемофильный сепсис чаще развивается у детей 6-12 мес., предрасположенных к этому заболеванию. Протекает бурно, нередко как молниеносный, с септическим шоком и быстрой гибелью больного.
Гнойные артриты являются следствием гематогенного заноса гемофильной палочки, нередко сопровождаются остеомиелитом.
Смертность
В настоящее время в европейских странах регистрируется 26-43 случаев заболеваний, вызванных гемофильной палочкой, на 100 000 детей, смертность составляет 1-3%, высок уровень неврологических осложнений.
Лечение
Гемофильная ХИБ-инфекция плохо поддается лечению, поскольку гемофильная палочка рекордно устойчива к антибиотикам. По этой причине даже своевременное лечение современными антибиотиками зачастую оказывается безрезультатным. Пенициллиновые антибиотики, эритромицин, левомицетин, тетрациклин – процент устойчивости гемофильной палочки к ним составляет 80-100% (от числа выделенных образцов бактерий). Без этиотропной терапии некоторые формы гемофильной инфекции (менингит, эпиглоттит) почти всегда заканчиваются смертью больного. Необходимо как можно раньше начать лечение от гемофильной инфекции.
Эффективность вакцинации
В 2000 году, до широкого внедрения ХИБ-вакцины в странах с ограниченными ресурсами, ХИБ-инфекция была причиной 8,13 миллионов случаев возникновения серьезного заболевания у детей в возрасте 1-59 месяцев (амплитуда колебаний – 7,33-13,2 миллионов случаев) и 371 000 случаев смерти (амплитуда колебаний – 247 000=527 000). К 2008 году, когда 136 государств - членов ВОЗ внедрили вакцину против гемофильной палочки, по оценкам, произошло 203 000 случаев смерти, обусловленных ХИБ-инфекцией, среди детей в возрасте младше 60 месяцев (амплитуда колебаний – 136 000-281 000).
Эффективность ХИБ-вакцин — 95-100%, защитный титр антител сохраняется не менее 4-х лет.
Среди вакцинированных в 10 странах Европы, Израиле и Австралии ХИБ-инфекция развилась с частотой всего 2 случая на 1 млн; у 18% этих детей имелись проблемы, в т. ч. недоношенность; у 33% отмечались низкие уровни иммуноглобулинов.
Вакцины
В настоящее время единственное средство для профилактики этой инфекции – вакцинация. По рекомендациям ВОЗ, прививка против гемофильной инфекции показана всем детям. Эффективность вакцинации сегодня оценивается на уровне 95-100%. Проводились многочисленные испытания полисахаридных конъюгированных ХИБ-вакцин в Европе и Северной Америке. В частности, клиническое испытание в Великобритании (1991-1993) показало снижение на 87% заболеваемости менингитом гемофильной этиологии. В Голландии, при проведении аналогичного исследования, было зафиксировано полное отсутствие случаев менингита гемофильной этиологии в течение 2-х лет после начала иммунизации.
Современные вакцины представляют собой химически связанные антиген капсулы гемофильной палочки и столбнячного анатоксина, который нужен для того, чтобы основной антиген вырабатывал иммунитет у детей в возрасте до 18 месяцев.
Рекомендованные календари. ВОЗ рекомендует какой-либо один из следующих календарей прививок против ХИБ-инфекции:
- 3 дозы в рамках первичного курса вакцинации без бустерной дозы (3р+0);
- 2 дозы в рамках первичного курса вакцинации и бустерная доза (2р+1);
- 3 дозы в рамках первичного курса вакцинации и бустерная доза (3р+1).
В странах, где пик бремени тяжёлого заболевания гемофильной инфекцией типа b ложится на младенцев младшего возраста, введение 3-х доз вакцины в раннем возрасте может принести пользу.
Приказом Министерства здравоохранения российской Федерации №125 от 21.03.14 г. вакцинация против гемофильной инфекции тип b введена и в Национальный календарь профилактических прививок РФ для детей из групп риска.
Последние эпидемии
Заболеваемость ХИБ-менингитом в России оценивается как 16,9 на 100 тыс. детей 0-5 лет, летальность при этой болезни составляет 15-20%, у 35% развиваются стойкие дефекты. В России инфекция регистрируется с 2007 г. (единичные сообщения). В Москве в 2005-2007 гг. из расшифрованных 83 случаев гнойного менингита 47 (57%) были вызваны гемофильной инфекцией.
Исторические сведения и интересные факты
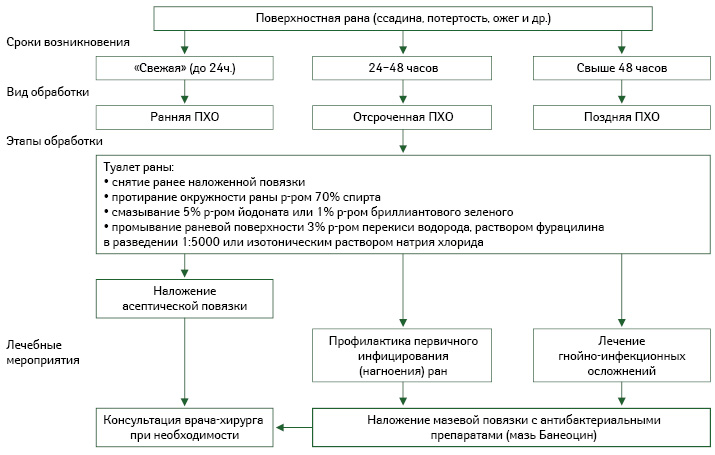
Расширение ассортимента лекарственных препаратов для локальной консервативной фармакотерапии раневого процесса позволяет проводить дифференцированное лечение ран и ожогов, которое осуществляется путем последовательного применения различных лекарственных средств с разнообразным механизмом их действия (Ляпунов Н.А. и соавт., 1995), влияющих на определенные фазы раневого процесса. Активный поиск эффективных лекарственных веществ в разных лекарственных формах является актуальным и в настоящее время.
Нанесение лекарственных препаратов для наружного применения на рану определяют как местное медикаментозное лечение. Для успешной терапии ран необходимо комплексное воздействие на раневой процесс (Кузнецов Н.А., 2006) с учетом не только степени тяжести его течения, но и уровня его распространения в глубину, количества вовлеченных в воспалительный процесс анатомических структур и т.д. (таблица; алгоритм обработки поверхностных ран).
| Таблица | Классификация хирургической инфекции мягких тканей (Ahrenholz D., 1991; Блатун Л.А., 2007) |
| Уровень | Поражение | Заболевания |
| I | Собственно кожи | Фурункул |
| Фурункулез | ||
| Рожа | ||
| Эризипелоид | ||
| II | Подкожной клетчатки | Карбункул |
| Гидраденит | ||
| Абсцесс | ||
| Целлюлит | ||
| III | Поверхностной фасции | Некротизирующий фасциит |
| IV | Мышц и глубоких фасциальных структур | Пиомиозит |
| Инфекции мышечных футляров | ||
| Клостридиальный мионекроз | ||
| Неклостридиальный мионекроз |
Терапия включает локальное назначение широкого спектра лекарственных веществ в форме мазей, гелей, порошков, масел и раневых покрытий (Кузин М.И., 1999; Блатун Л.А., 2007).
Поверхностные инфицированные раны лечат дренирующими сорбентами и протеолитическими ферментами. При лечении гнойных глубоких ран в первой фазе проводят терапию мазями под повязками (Блатун Л.А., 2009), причем успех профилактики и лечения ран в данной фазе определяется своевременным назначением различных лекарственных средств с антимикробным действием. А вот во второй фазе — регенерации, образования и созревания грануляционной ткани применяют мази, раневые покрытия, гелевые повязки и масла с активными компонентами, уже способствующими стимуляции этих процессов (алгоритм обработки поверхностных ран).
Неомицин — представитель антибиотиков-аминогликозидов, оказывает бактерицидное действие путем подавления синтеза бактериального белка и угнетения генетического кода бактерий. Для него характерен широкий спектр противомикробного действия (рис. 1).
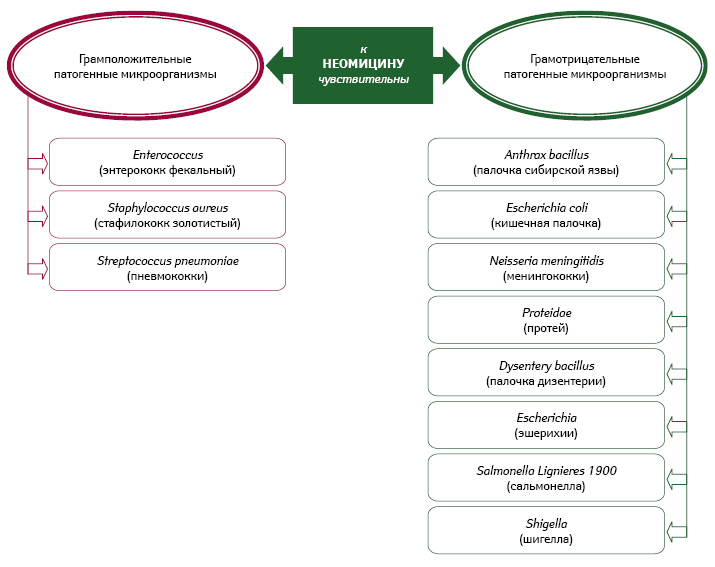
Очевидно, что неомицин проявляет широкий спектр антибактериальной активности, оказывая бактерицидное действие на чувствительную к нему микрофлору (Даценко Б.М. и соавт., 1989). Характерно медленное формирование устойчивости микроорганизмов к неомицину. Наружное применение неомицина в форме порошка или мази не позволяет развиться его токсическим проявлениям, которые могут возникать при парентеральном применении (ото-, нефротоксичность, блокада нейромышечной передачи). Неомицин не применяют перорально ввиду возможности его кумулирования в плазме крови, отмечающееся при нарушенной функции почек (Коваленко В.Н., 2012).
Бацитрацин — полипептидный антибиотик. Он угнетает синтез клеточной стенки путем подавления кругооборота липидных переносчиков субъединиц пептидогликанов (блокада синтеза пептидогликанов), что также реализуется в виде бактерицидного действия. Спектр антибактериального действия бацитрацина представлен на рис. 2.
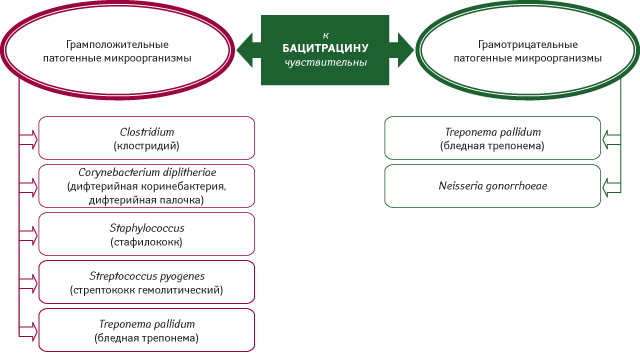
К бацитрацину устойчивость развивается крайне редко, механизмы ее развития не установлены. Он хорошо переносится тканями организма человека и не инактивируется кровью, тканевыми компонентами, биологическими продуктами (Паршина В.Л., 2007). Особенно актуально то, что при локальном его применении снижается риск проявлений повышенной чувствительности к составляющим Банеоцина .
Таким образом, фармацевтическая композиция неомицина и бацитрацина ( Банеоцин ) приводит к синергическому фармакологическому взаимодействию двух лекарственных средств. Такое объединенное действие в итоге превышает сумму действий этих действующих веществ (усиление действия друг друга) по сравнению с их раздельным использованием.
Эта комбинация антибактериальных средств выпускается в виде двух лекарственных форм — порошка и мази.
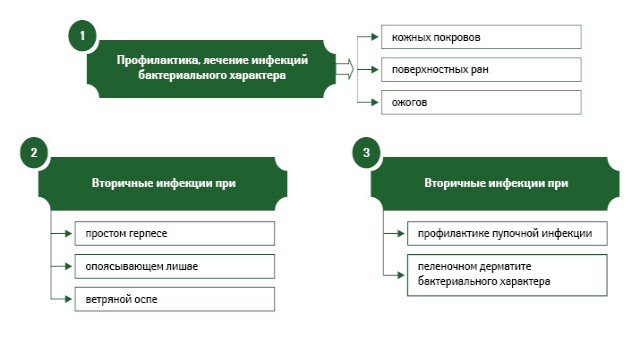
Показания к применению Банеоцина в форме мази и порошка представлены на рис. 3 и 4.

В качестве вспомогательного вещества в состав порошка Банеоцин входит крахмал кукурузный, содержащий не более 2% магния оксида (основа порошковая стерилизованная) (Коваленко В.Н., 2012). Ранее уже были отмечены высокие абсорбционные свойства порошковой основы, которые как раз и проявляются за счет легковесных аморфных порошков — магния оксида и крахмала кукурузного.
Порошок Банеоцин в короткие сроки купирует проявления воспалительного процесса, упреждает возможное возникновение нагноения (Зорин А.Н. и соавт., 2005). При нанесении на кожу порошок Банеоцин обусловливает активное поглощение раневого экссудата, осушение раны и на протяжении нескольких часов обеспечивает дренаж из раны с одновременным образованием защитного антибактериального слоя (Буслаев О.А. и соавт., 2006).
Также порошок Банеоцин обладает замечательными дополнительными действиями: охлаждающим и успокаивающим. Это особенно важно для лечения ран у пациентов детского возраста ввиду их высокой чувствительности к боли и страха перед спиртосодержащими средствами, традиционно используемыми для обработки ран.
Эффективность Банеоцина подтверждена комплексным изучением клинико-лабораторных показателей в лечении пациентов с гнойным поражением кожи и мягких тканей (бактериологическая эффективность составляла 92,5%, а клиническая — 95%) (Блатун Л.А., 2009). Это обусловлено длительным осмотическим действием порошка Банеоцин , что особенно эффективно в лечении гнойных ран в первой фазе раневого процесса, когда происходит активное впитывание раневого отделяемого. Ценным качеством Банеоцина является быстрое разрешение кожных проявлений инфекционных поражений кожи, таких как атопический дерматит, импетиго, фолликулит и т.д., которое отмечается в течение 1 или 2 сут от начала лечения (Шерстобитов А.С., 2008). Банеоцин успешно применяется в лечении пациентов с трофическими язвами и у больных с аллергологическим анамнезом, когда они не могут применять традиционные локальные препараты (Буслаев и соавт., 2006; Блатун Л.А., 2007; 2009). Кроме того, обработка ран, возникших вследствие лазерной деструкции (Соколовский Е.В. и соавт., 2004), порошком Банеоцин с дальнейшим переходом на мазь Банеоцин оказывается более щадящим методом по сравнению с традиционной обработкой (Хорук С.А., 2008).
В свою очередь, мазь Банеоцин представляет собой комбинированный мягкий лекарственный препарат с антибиотиками, введенными в дифильную абсорбционную основу, состоящую из гидрофобного компонента — вазелина, и вещества с дифильными свойствами — ланолина, обладающего эмульгирующей способностью (Хишова О.М., 2009).
Вазелин можно отнести к веществам, которые давно и успешно используют в качестве средства для смягчения кожных покровов, защиты кожи после некоторых косметических процедур и т.д. Это связано с тем, что вазелин способен удерживать влагу в клетках кожи, что, в свою очередь, позволяет смягчить загрубевшие участки кожи, устранить раздражение, защитить слизистую оболочку и саму кожу от агрессивного и вредного воздействия лекарственных препаратов или окружающей среды. При этом вазелин и введенные в него вещества, не проникают в глубокие слои кожи и, тем более, под кожу. Последнее особенно актуально, если рассматривать его в аспекте безопасности применения Банеоцина . Как уже было отмечено выше, использование как неомицина, так и бацитрацина предполагает их исключительно локальное применение с целью предотвращения побочного действия на организм.
Ланолин, относящийся к натуральным вспомогательным веществам, кроме прочего обладает увлажняющими и смягчающими свойствами, позволяющими защищать кожу от неблагоприятных внешних факторов, а также связывать и удерживать в коже влагу. Именно эти позитивные качества ланолина успешно используются в медицине и косметологии с целью обеспечения уменьшения потери влаги и восстановления натуральной мягкости и эластичности кожи. В качестве одного из свойств чистого ланолина отмечают положительное местное его применение у кормящих грудью, помогающее заживлению трещин на сосках и предотвращающее их появление.
Так, учитывая вышеизложенные свойства вспомогательных веществ, входящих в состав мази Банеоцин , можно резюмировать: мазевая основа обладает умеренными абсорбционными свойствами на фоне низких показателей осмотической активности; не нарушает аэрацию кожи и не всасывается в глубокие слои; гидрофобные компоненты, покрывая кожу, препятствуют сухости кожи вследствие исключения излишней потери влаги.
С точки зрения биофармацевтических аспектов создания мягких лекарственных средств, мазевая основа сегодня является не только носителем действующих веществ, поэтому основа мази Банеоцин , отвечая медико-биологическим требованиям к мазям определенного назначения, активно участвует в терапевтическом процессе.
Банеоцин в форме мази эффективен в лечении поверхностных ран, во второй фазе раневого процесса (где может быть использован наряду с порошком) (Буслаев и соавт., 2006). Банеоцин в высоких концентрациях скапливается в гнойном очаге, оказывая бактерицидное действие, не оказывая системного эффекта. При его нанесении образуется тонкая пленка, защищающая молодой эпителий от деструктирующих факторов. Нанесение Банеоцина под повязки приводит к полной эридикации болезнетворных микроорганизмов в короткие сроки и обеспечивает профилактику повторного инфицирования поверхности раны госпитальной инфекцией (Оболенский В.Н., 2013). Уместно использовать мазь Банеоцин в третьей фазе раневого процесса для организации рубца и эпителизации, когда пленка, образуемая мазью, защищает эпителий от повреждения и способствует ускорению эпителизации. Неоспоримые достоинства фармакологического действия Банеоцина объясняют его активное назначение и на этапе стационарного комплексного лечения больных, и в поликлинических условиях.
Доказана высокая клиническая эффективность Банеоцина при распространенной форме акне средней и тяжелой степени (Кунгуров Н.В., 2009; Шабардина О.В., 2010). При локальном применении Банеоцина снижен риск возникновения гиперчувствительности к его компонентам (Ширшов О.Н., 2008). Характерна достаточно хорошая переносимость Банеоцина . Отмечается успешное использование Банеоцина в педиатрии при топическом дерматите, осложненном вторичной инфекцией (Ahrenholz D.H., 1991; Зорин А.Н. и соавт., 2005), а также при сочетании топического дерматита с пиодермией, и даже в неонатологической практике применение порошка Банеоцина позволяет сокращать сроки эпителизации пупочной ранки новорожденных. Назначение Банеоцина предупреждает развитие серьезных гнойно-септических осложнений у новорожденных, позволяет эффективно купировать клинические проявления инфицированного пеленочного дерматита и эксфолиативного дерматита Риттера (Паршина В.Л., 2007).
Таким образом, благодаря комбинации двух антибактериальных компонентов достигается широкий спектр действия препарата и синергизм в отношении широкого ряда микроорганизмов, в который не попадают лишь псевдомонады, нокардии, грибы и вирусы. При местном нанесении на кожные покровы, раневые поверхности Банеоцин переносится хорошо, не вызывая раздражения; через интактную кожу препарат не всасывается, а через поврежденные кожные покровы всасывание незначительно, что позволяет создать максимальную концентрацию препарата непосредственно в месте применения. А две лекарственные формы Банеоцина ориентированы на последовательное его применение на различных стадиях раневого процесса (Буслаев О.А. и соавт., 2006).
Особые указания при применении Банеоцина
- Нельзя допускать попадания мази и порошка Банеоцин в глаза.
- С осторожностью наносить препарат на участки кожных покровов со значительными повреждениями.
- Нельзя применять Банеоцин в наружный слуховой проход в случае, если у пациента нарушена целостность барабанной перепонки и имеется сквозной дефект.
- Кратность нанесения порошка составляет 2–4 раза в сутки.
- Мазь Банеоцин наносится 2–3 раза в сутки.
- Суточная доза не должна превышать 1 г Банеоцина .
- Курс лечения обычно составляет 7 дней.
- При назначении повторного курса максимально допустимая доза снижается в 2 раза.
- Банеоцину присуща фотосенсибилизация. Поэтому рекомендуется предотвращать доступ прямых солнечных лучей к месту нанесения препарата.
Фармацевтическая опека при применении Банеоцина
- Не применять Банеоцин у пациентов с повышенной чувствительностью к бацитрацину, неомицину и другим антибиотикам аминогликозидного ряда.
- Не допускать сочетанного применения антибиотиков аминогликозидного ряда местного и системного действия из-за возможной их кумуляции и, как следствие, — риска развития токсичности.
- С осторожностью применять при миастении и других заболеваниях нервно-мышечной системы, а также при аллергических реакциях в анамнезе.
- При обширных поражениях кожи возникает риск абсорбции бацитрацина и неомицина, что может привести к развитию токсических проявлений у пациентов с нарушенной функцией печени или почек.
- Дисфункция вестибулярной и кохлеарной систем, патология почек с нарушением их выделительной функции является противопоказанием для приема Банеоцина , особенно при возможности его всасывания в системный кровоток.
- При ожоговых поражениях кожи площадью более 20% поверхности тела больного порошок Банеоцин наносится только 1 раз в сутки.
- При развитии аллергии или суперинфекции Банеоцин следует отменить.
- Избегать инсоляции из-за возможности возникновения фотосенсибилизации и фототоксических реакций.
- При лечении в период беременности и кормления грудью фармакотерапию Банеоцином следует проводить с осторожностью.
- Применение мази Банеоцин в педиатрии проводится по показаниям, аналогичным таковым у взрослых.
- Порошок Банеоцин применяется у детей с первых дней жизни при преобладании пользы от применения Банеоцина над риском развития его побочных эффектов.
- Нет сведений о способности Банеоцина изменять скорость реакций при управлении транспортными средствами и работе с другими механизмами.
Список использованной литературы
Информация для профессиональной деятельности медицинских и фармацевтических специалистов
БАНЕОЦИН (BANEOCIN) . Код АТС : D06A X54**. Состав и форма выпуска: мазь, туба 20 г, № 1 (бацитрацин цинк — 250 МЕ/г, неомицина сульфат — 5000 МЕ/г) — р.с. № UA/3951/01/01 от 28.04.2011 г. до 28.04.2016 г.; порошок накожный, контейнер 10 г, № 1 (бацитрацин цинк — 250 МЕ/г, неомицина сульфат — 5000 МЕ/г) — р.с. № UA/3951/02/01 от 11.05.2011 г. до 11.05.2016 г.). Показания . Порошок — бактериальное инфицирование ограниченных участков кожи при герпетических инфекциях, в том числе при ветряной оспе; инфицированные варикозные язвы; экзема; бактериальный пеленочный дерматит; профилактика пупочной инфекции у новорожденных; после хирургических манипуляций: как вспомогательная терапия в послеоперационный период (в том числе лечение разрывов промежности и эпизиотомии, мастита при дренировании, посттравматических инфекций); инфекции при ожогах. Мазь — местное лечение и профилактика бактериальных инфекций кожи, вызванных чувствительными к препарату микроорганизмами: фурункулы, карбункулы (после хирургического вмешательства), абсцессы (после разреза), сикоз, в том числе глубокий, на участке подбородка, гнойный гидраденит, псевдофурункулез, паронихии; бактериальные инфекции кожи ограниченной степени, в том числе контагиозное импетиго, инфицированные варикозные язвы, вторичные инфекции при экземе, инфекции при ожогах, после косметической хирургии и пересадки кожи (также с профилактической целью и при применении повязок); как вспомогательная терапия при лечении послеоперационных инфицированных ран (например при наружном отите, вторичном инфицировании хирургических рубцов). Побочные эффекты . Обычно препарат переносится хорошо. При продолжительном лечении возможно развитие аллергических реакций (гиперемия, сухость и шелушение кожи, сыпь, зуд). Если поражения распространяются или раны не заживают, это может быть следствием аллергической реакции (очень редко — в виде контактной экземы). Для пациентов со значительным поражением кожи следует учитывать возможную абсорбцию препарата и развитие таких побочных эффектов, как нарушения вестибулярной и кохлеарной функции, слуха, нервно-мышечной проводимости. Более детальная информация изложена в инструкции по медицинскому применению.
Читайте также:


