К инфекционным относят заболевания которые могут быть вызваны бактериофагами

Инфекционные болезни ("infectio" - заражение) - это группа заболеваний, которые вызываются проникновением в организм болезнетворных (патогенных) микроорганизмов. Чтобы патогенный микроб, попавший в организм, мог вызвать инфекционные болезни, он должен быть способен преодолевать сопротивляемость человеческого организма и оказывать на него токсическое действие. Эти качества специалисты называют вирулентностью (ядовитостью). Некоторые патогенные микроорганизмы высвобождают токсины (эндотоксины), в процессе саморазрушения (брюшной тиф, холера). Другие возбудители инфекционных заболеваний выделяют токсины (экзотоксины) в процессе своей жизнедеятельности (дифтерия, столбняк).
На сегодняшний день число известных науке инфекционных заболеваний превышает 1200, и эта цифра постоянно увеличивается. Человек на протяжении всей своей жизни контактирует с несчетным количеством микроорганизмов. Тем не менее, лишь 1/30000 часть микробов является возбудителями инфекционных заболеваний. Это грибки, бактерии, риккетсии и вирусы, обладающие патогенными свойствами. Интенсивность распространения инфекционных болезней зависит, в основном, от социально-бытовых факторов: условий труда, питания, жилищных условий, культурного и экономического уровня населения.
Процесс протекания инфекционных заболеваний

Инфекционные заболевания отличаются от неинфекционных тем, что болезнетворный агент и организм при инфекционных болезнях обладают определённой биологической активностью. Патогенный микроорганизм является мощным раздражителем, в результате воздействия которого на организм возникает сложный процесс. С самого начала этого процесса в нем выделяется два основных звена - физиологическое состояние организма и возбудитель инфекционного заболевания. Соотношения между этими звеньями в каждом конкретном случае могут быть различными в зависимости от этапа, фазы, периода развития инфекционного процесса. Необходимо учитывать, что не только больные, но и выздоравливающие после инфекционных болезней люди могут служить источниками возбудителей (при кишечных инфекциях, дифтерии и некоторых других). Некоторые люди могут являться носителями инфекции, не заболевая сами.
В развитии патологического процесса выделяют несколько основных стадий:
- момент заражения - происходит проникновение болезнетворных микробов в организм;
- инкубационный (скрытый, латентный) период - длится с момента инфицирования до проявления первых симптомов заболевания;
- продромальный период (предвестник заболевания) - сопровождается небольшим повышением температуры, головной болью, чувством разбитости, общим недомоганием;
- период нарастания заболевания - происходит последовательное появление признаков, характерных для определенной болезни;
- разгар болезни - время ярко выраженного проявления всех специфических для заболевания симптомов;
- период угасания заболевания - сопровождается исчезновением клинических признаков заболевания с быстрым (кризис) или медленным (лизис) падением температуры;
- период выздоровления - продолжительность зависит от общего состояния организма, условий, в которых находится пациент, тяжести перенесенного заболевания.
Для многих инфекционных болезней человека (оспа, тиф, грипп, скарлатина, дифтерия и др.) характерно развитие осложнений в период болезни. После перенесенной инфекционной болезни человек на некоторое время или навсегда становится невосприимчивым к воздействию ее возбудителей (приобретает иммунитет).
Классификация инфекционных болезней
Инфекционные заболевания человека, в зависимости от определенного механизма передачи и места преимущественной локализации процесса делятся на следующие группы:
- кишечные - сальмонеллез, холера, дизентерия, паратифы А и В, пищевые токсикоинфекции, эшерихиоз, брюшной тиф;
- инфекции дыхательных путей - ветряная оспа, ОРВИ, корь, грипп, микоплазменная респираторная инфекция;
- трансмиссовые, или кровяные, инфекции - малярия, чума, возвратный и сыпной тиф, ВИЧ-инфекция;
- инфекционные заболевания наружных покровов - столбняк, сибирская язва;
- инфекции с множественными путями передачи - инфекционный мононуклеоз, энтеровирусные инфекции.
По природе возбудителей инфекционные заболевания подразделяются на:
- вирусные - корь, грипп, парагрипп, ВИЧ-инфекция, вирусные гепатиты, менингит, цитомегаловирусная инфекция;
- прионные - фатальная семейная бессонница, куру, болезнь Крейтцфельда-Якоба;
- протозойные - критоспоридиоз, амебиаз, изоспориаз, бабезиоз, токсоплазмоз, бластоцистоз, малярия, балантидиаз;
- бактериальные - холера, чума, дизентерия, стафилококковая и стрептококковая инфекции, сальмонеллез, менингит;
- микозы (грибковые инфекции) - эпидермофития, аспергиллёз, кандидоз, мукормикоз, криптококкоз, хромомикоз.
Инфекционные заболевания подразделяются также на зоонозные и антропонозные. К зоонозам относятся болезни животных, возбудители которых могут попадать в организм человека и заражать его (бешенство, сибирская язва, туляремия, ящур, бруцеллез, лептоспироз, листериоз). Антропонозы являются исключительно человеческими болезнями и передаются между людьми (корь, тиф, холера, дизентерия, натуральная оспа, брюшной тиф, дифтерия). Вызываемые паразитами (возбудителями животного происхождения - насекомыми, простейшими, клещами) заболевания называют паразитарными, или инвазионными.
Среди всех инфекционных болезней выделяют ряд особо опасных инфекций, называемых карантинными. Они характеризуются склонностью к быстрому распространению, высокой степенью заразности, тяжелым эпидемическим течением и большим риском быстрого летального исхода. Всемирной организацией здравоохранения к этой группе отнесены натуральная оспа (считается искорененной в мире с 1980 года), чума, желтая лихорадка (и сходные с ней по эпидемиологии лихорадки Марбург и Эбола), холера. В России особо опасными инфекционными заболеваниями считаются также сибирская язва и туляремия.
Способы инфицирования, лечения и профилактики инфекционных заболеваний

Лечение инфекционных заболеваний обычно проводится в специализированных отделениях стационаров, в легких случаях возможно лечение в домашних условиях. Строгое соблюдение противоэпидемического режима является обязательным условием. Современная медицина создала и успешно использует большое число эффективных лекарственных средств. Это антибиотики, вакцины (применяются для профилактики инфекционных заболеваний), иммуноглобулины различного рода, бактериофаги и т.д.
Профилактика инфекционных болезней не менее важна, чем лечение инфекционных заболеваний. Большое значение придается воспитанию чистоплотности у людей. Обыкновенное мытье рук после посещения уборной, выполнения грязной работы, перед едой уже может уберечь от многих кишечных инфекций. Кроме того, источником инфекции могут быть не только места общего пользования, но и деньги, поручни в транспорте, поверхность прилавков и многое другое. Купленные фрукты и овощи могут быть источником гельминтов и других опасных микробов, поэтому их обязательно нужно тщательно вымывать перед употреблением. Инфекционными носителями являются тараканы и грызуны, для борьбы с которыми промышленность производит разнообразные средства, которыми необходимо обрабатывать места их скопления и распространения. Нельзя сбрасывать со счетов комаров и клещей. Эти насекомые особенно опасны, так как переносят не только энцефалит и малярию, но и СПИД вместе с кровью инфицированного человека. Для защиты от клещей и комаров существует множество кремов и аэрозолей для нанесения на одежду, а также фумигаторов и отпугивателей.
Адрес: 364038, Чеченская Республика, г. Грозный, ул. Урицкого, 2а

Терминология
Общие для инфекционных заболеваний характеристики
О начале инфекционной болезни можно говорить, если после встречи возбудителя и макроорганизма, в частности человека, происходит нарушение функций жизнедеятельности последнего, появляются симптомы заболевания, а в крови происходит нарастание титра антител. Встречаются и другие формы инфекционных процессов: здоровое носительство вируса при наличии иммунитета или природной невосприимчивости к данному заболеванию, хронические инфекции, медленные инфекции.
Помимо того, что начинаются все инфекционные болезни с патогенных микроорганизмов-возбудителей, есть и другие общие для них характеристики. Такие заболевания заразительны, то есть способны передаваться от заболевшего человека или животного к здоровому. При определенных условиях возможно возникновение эпидемий и пандемий, то есть массовое распространение болезни, а это уже весьма серьезная угроза для общества. Помимо этого, инфекционные заболевания, список которых можно посмотреть в любом медицинском справочнике, всегда протекают циклично. Это означает, что в процессе болезни по очереди сменяют друг друга определенные временные промежутки: инкубационный период, этап предвестников заболевания, период разгара болезни, период спада и, наконец, период выздоровления.
Инкубационный период никаких клинических проявлений еще не имеет. Он тем короче, чем выше патогенность возбудителя и больше его доза, и может составлять как несколько часов, так и несколько месяцев и даже лет. Предвестники заболевания – это самые общие и достаточно неопределенные симптомы, на основе которых заподозрить конкретную инфекционную болезнь сложно. Типичные для нее клинические проявления максимальны на этапе разгара заболевания. Далее болезнь начинает угасать, но для некоторых инфекционных заболеваний характерны рецидивы. Еще одной специфической характеристикой инфекционных заболеваний является формирование в процессе заболевания иммунитета.
Возбудители инфекционных заболеваний
Возбудителями инфекционных болезней являются вирусы, бактерии и грибы. Чтобы внедрение прошло для патогенного микроорганизма успешно, одной встречи макро- и микроорганизма недостаточно. Требуется выполнение определенных условий. Большое значение имеет собственно состояние макроорганизма и его защитных систем. Много зависит и от патогенности самого возбудителя. Она определяется степенью вирулентности (ядовитости) микроорганизма, его токсигенностью (иначе – способностью вырабатывать токсины) и агрессивностью. Условия внешней среды также играют большую роль. бактериальная пневмония
Классификация инфекционных заболеваний
Прежде всего, инфекционные заболевания можно систематизировать в зависимости от возбудителя. В общем случае, выделяют вирусные, бактериальные и грибковые инфекции. Отдельно выделяют хламидийные, микоплазменные, риккетсиозные, спирохетозные инфекции, хотя и хламидии, и микоплазмы, и риккетсии, и спирохеты относятся к царству бактерий. Вирусы – это, пожалуй, самые распространенные возбудители заболеваний. Однако и бактерии способны вызвать множество недугов. Среди самых известных – такие как ангина, менингит, холера, чума, бактериальная пневмония, туберкулез, столбняк. К грибковым инфекционным заболеваниям, или микозам, относят кандидоз, дерматофитию, онихомикоз, лишай.
Наиболее часто инфекционные заболевания классифицируют соответственно месту локализации возбудителей с учетом механизма их передачи, но это касается тех заболеваний, которые распространяются от человека к человеку. Соответственно, выделяют кишечные инфекционные болезни, передающиеся фекально-оральным путем (астровирусная инфекция, полиомиелит, холера, брюшной тиф). Существуют инфекционные заболевания верхних дыхательных путей. Способ заражения ими именуется воздушно-капельным (ОРВИ, дифтерия, скарлатина, грипп).
Инфекционные болезни еще способны локализоваться в крови и передаваться посредством укусов насекомых и медицинских манипуляций. Речь идет об инъекциях и переливаниях крови. К ним относятся гепатит Б, чума, сыпной тиф. Существуют еще наружные инфекции, поражающие кожные покровы и слизистую оболочку и передающиеся контактным путем. болезнь бруцеллез
В процессе эволюции за каждым видом возбудителя инфекционного заболевания закрепились свои входные ворота инфекции. Так, ряд микроорганизмов проникает через слизистые оболочки дыхательных путей, другие – через пищеварительный тракт, половые пути. Бывает, впрочем, что один и тот же возбудитель способен попасть в организм человека одновременно разными путями. Например, гепатит Б передается через кровь, от матери к ребенку и контактным путем.
Что касается источников инфекции, то различают антропонозы, если заболевание исходит от человека, и зоонозы, если носителями заразы являются животные. Надо сказать, что возбудители зоонозов при попадании в организм человека в дальнейшем в окружающую среду уже не выделяются, поэтому интенсивность распространения зоонозов на порядок ниже, нежели антропонозов. К зоонозам относят болезнь бруцеллез, ботулизм, чуму, туляремию, бешенство, сибирскую язву, ящур, столбняк. Для зоонозов характерно, как правило, несколько механизмов передачи инфекции.
Существуют три основных среды обитания возбудителей инфекционных заболеваний. Это организм человека, организм животных и неживая среда – почва и водоемы.
Симптомы инфекционных заболеваний
Общие симптомы инфекционных заболеваний включают в себя недомогание, головную боль, бледность, озноб, ломоту в мышцах, повышение температуры, иногда – тошноту и рвоту, понос. Помимо общих, бывают такие симптомы, которые характерны только для одного заболевания. Например, сыпь при менингококковой инфекции весьма специфична. грипп инфекционные болезни
Диагностика
Что касается диагностики, то она должна основываться на всестороннем и комплексном изучении больного. Изучение включает в себя подробный и обстоятельный опрос, обследование органов и систем, и обязательно анализ результатов лабораторных исследований. Ранняя диагностика инфекционных заболеваний представляет определенные трудности, но имеет серьезное значение как для своевременного адекватного лечения больного, так и для организации профилактических мероприятий.
Лечение
В лечении таких недугов, как инфекционные заболевания, список которых так пугающе обширен, выделяют несколько направлений. Прежде всего, это меры, направленные на снижение активности патогенного микроорганизма и нейтрализацию его токсинов. Для этого применяются антибактериальные препараты, бактериофаги, интерфероны и другие средства. Во-вторых, необходимо активизировать защитные силы организма, применяя иммуномодулирующие препараты и витамины. Лечение обязательно должно быть комплексным. Важно нормализовать нарушенные болезнью функции органов и систем. В любом случае, подход к лечению должен учитывать все индивидуальные особенности пациента и течения его заболевания. сыпь при менингококковой инфекции
Профилактика
Чтобы максимально обезопасить себя и своих близких от такой угрозы, как инфекционные заболевания, список которых включает болезни вирусной, бактериальной и грибковой природы, необходимо помнить о карантинных мерах, вакцинации, укреплении иммунитета. А иногда, чтобы спастись от инфекции, достаточно соблюдения элементарных правил личной гигиены.
Первые клинические эксперименты с бактериофагами начались сто лет назад, и казалось, что этот новый метод терапии обречен на успех: с научной точки зрения он выглядел безупречным, и результаты применения выглядели многообещающими.
Почему же в последующие десятилетия интерес к терапевтическому применению бактериофагов в мире упал? Почему он возник вновь, и почему эта замечательная идея до сих пор не реализована в полной мере? И практические врачи, и их пациенты сегодня должны четко представлять не только суть, но и все сильные и слабые стороны этого перспективного вида терапии
Бактериофаги – это не обычные лекарства. Они не являются простыми химическими веществами, как антибиотики и большинство других препаратов, но их вряд ли можно считать и полноценными живыми организмами, так как они, как и все остальные вирусы, могут размножаться только в клетке-хозяине. По сути, это нанороботы с генетической программой, способные проникнуть внутрь бактериальной клетки и там размножиться, разрушив ее.
Поэтому к бактериофагам не всегда применимы стандартные для фармакологии нормы и подходы. И хотя фаговые препараты сегодня производятся и используются в медицине, наши знания о многообразии этих вирусов, механизмах их взаимодействия с бактериями и конкуренции с себе подобными пока недостаточны, чтобы в полной мере использовать их мощный терапевтический потенциал.
Безопасно и эффективно
Фаготерапия родилась едва ли не сразу после открытия самих бактериофагов, однако широкие испытания этих противобактериальных средств начали проводиться в СССР только в конце 1930-х гг. В результате была доказана эффективность препаратов бактериофагов как профилактического средства при борьбе с эпидемиями дизентерии и холеры, а использование их при лечении ран и гнойно-воспалительных процессов показало их потенциал как альтернативы антибиотикам.
Однако результаты исследований тех времен были зачастую противоречивы: иногда фаги сразу подавляли развитие инфекционных процессов, но иногда оказывались бесполезными. Специалисты сразу поняли, в чем причина: лечение было успешным лишь тогда, когда использовались фаги, способные инфицировать именно тот бактериальный штамм, который и вызвал заболевание. Поэтому при возникновении эпидемии требовалось выделить инфекционный агент, проверить на нем имеющиеся фаговые препараты и запустить в производство в качестве препарата наиболее эффективный бактериофаг.
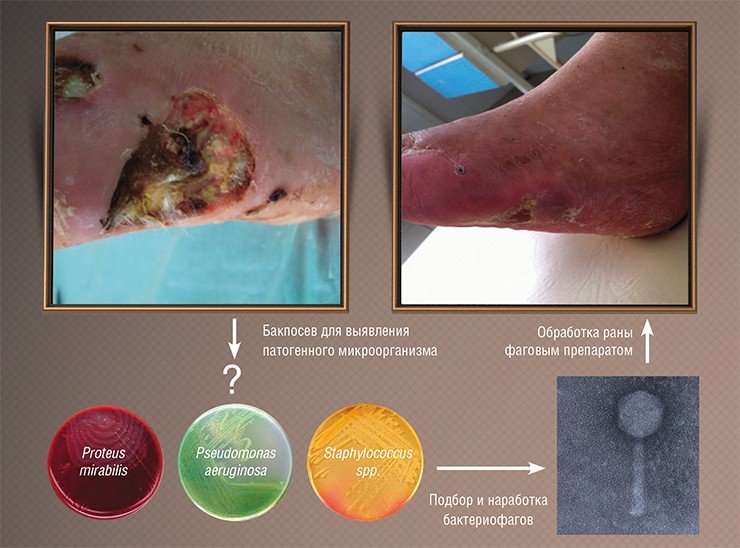
К сожалению, результаты подобных исследований, проводившихся в СССР, не были должным образом документированы и описаны в научной литературе, к тому же они проводились по схемам, не соответствующим принятым на сегодня протоколам клинических испытаний. Тем не менее главные результаты этой работы были бесспорны: фаги доказали свою безопасность и высокую эффективность в реальных условиях и с тех пор используются в нашей стране в клинической практике наряду с обычными лекарственными средствами.

С появлением антибиотиков интерес к фагам на Западе был утрачен, но после появления антибиотикоустойчивых штаммов бактерий в разных странах начали разрабатывать фаговые препараты и проводить испытания, которые, по сути, повторяли исследования, уже проведенные в СССР. Результаты этих работ вновь подтвердили безопасность препаратов бактериофагов, что, в частности, отметило и Управление по контролю за качеством пищевых продуктов и лекарственных препаратов США (FDA).
В Великобритании успешно проведены эксперименты по лечению бактериофагами хронического отита, вызванного нечувствительной к антибиотикам синегнойной палочкой Pseudomonas aeruginosa, а в рамках проекта Phagoburn семь медицинских центров Франции, Бельгии и Швейцарии проводят клинические испытания коктейля фагов для предотвращения инфекций при ожогах. Об испытаниях собственных оригинальных коктейлей фагов для лечения широкого спектра заболеваний сообщает и ряд американских фирм (Intralytix, Enbiotix, AmpliPhi). Правда ни одно из этих масштабных клинических испытаний пока не доведено до конца.
В России препараты бактериофагов можно приобрести в обычной аптеке. Но при этом нужно понимать, что в отличие от других лекарств с точной химической формулой и концентрацией действующих компонентов препарат бактериофага представляет собой нестандартный раствор, содержащий живые вирусные частицы. Даже препарат с одним и тем же названием, но произведенный на разных предприятиях или в разное время, может содержать отличающиеся комбинации и (или) пропорции фагов.
Поэтому покупать препарат бактериофага, чтобы лечиться самостоятельно, не стоит. Назначить лечение и выбрать лекарство должен специалист. Спектр заболеваний, которые можно лечить бактериофагами широк: трофические язвы, ожоговые и раневые инфекции, инфекции органов дыхания, мочеполовой системы и желудочно-кишечного тракта, остеомиелит и т. п. Возбудителями болезней во всех этих случаях служат такие печально известные бактерии, как золотистый стафилококк, включая лекарственно устойчивые штаммы, синегнойная палочка, патогенные формы кишечной палочки, сальмонеллы, протеи, стрептококки и др. В принципе в природе можно найти бактериофаг против любой бактерии, включая возбудителей чумы и сибирской язвы. Можно применять бактериофаги и для профилактики бактериальных инфекционных болезней, например, они были успешно использованы в детских садах и школах для предотвращения эпидемии дизентерии.

Основная же и главная причина неудач – неумелый подбор фагов для лечения конкретных пациентов. Каждый конкретный фаг эффективен против одного или максимум нескольких штаммов бактерий, а у разных пациентов схожая по внешнему проявлению инфекция, например, ангина может быть вызвана разными штаммами стрептококка. Чтобы вылечить больного, необходимо выделить культуру патогена и протестировать ее на чувствительность к конкретным фагам. То есть терапия бактериофагами должна проводиться с использованием принципов персонализированной медицины, к чему современная медицина практически не готова.

На пути к персонализированной Фаготерапии
Опыт СССР, Грузии и Польши показал, что для успешного применения бактериофагов нужны не только клиника, но и производственно-лабораторный участок, располагающий коллекцией фагов и специалистами, способными идентифицировать бактерии, подбирать и выделять бактериофаги для конкретного пациента.
Но в таком случае имеет ли смысл масштабное производство фаговых препаратов? Ответ – да, потому что проблема узкой специфичности фагов частично решается производством фаговых коктейлей из нескольких (иногда десятков) разных фагов, поражающих разные штаммы целевого возбудителя. Ведь подобрать для больного нужный фаговый коктейль быстрее и проще, чем тестировать отдельные фаги из большой коллекции.
И все же не надо думать, что бактериофаги полностью заменят антибиотики – эти препараты дополняют друг друга, и применяться они должны в разных ситуациях. Когда больной находится в тяжелом состоянии, и есть уверенность, что причиной служит бактериальная инфекция, времени на эксперименты и подбор препаратов нет. Единственно правильное решение в этой ситуации – антибиотик широкого спектра действия.
Но в ситуации хронической инфекции или инфекции, вызванной бактериями со множественной устойчивостью к антибиотикам, предпочтение следует отдавать бактериофагу. В случае таких затяжных болезней, как отит, у врача есть время, чтобы использовать фаговый коктейль или специально подобрать фаг. Или же, когда после операции больной поражается антибиотикоустойчивым бактериальным штаммом, и его состояние быстро ухудшается, фаготерапия может стать единственным спасением.
Богатый опыт применения бактериофагов в клинической практике, накопленный за последние сто лет, свидетельствует о перспективности фаговых медицинских технологий. Дальнейшая работа специалистов из множества компаний, работающих сегодня в этой области, и применение методов синтетической биологии обязательно приведут к созданию препаратов с несравненно большей эффективностью по сравнению с современными фаговыми коктейлями.
Тем не менее, биотехнологи, также как ученые и медики, надеются, что безвредные и эффективные препараты все же займут свое законное место в арсенале терапии инфекционных заболеваний.
Алешкин А. В. Бактериофаги в инфекционной патологии: прошлое, настоящее и будущее // Лекции по исследованию и применению бактериофагов. 2016. Ульяновск. С. 11—51.
Козлова Ю. Н., Репин В.Е., Анищенко В.В., Власов В.В. и др. Штамм бактериофага Pseudomonas aeruginosa, используемый в качестве основы для приготовления асептического средства против синегнойной палочки. // Патент РФ №2455355. 2012.
Козлова Ю. Н., Морозова В. В., Тикунова Н. В. и др. Штамм бактериофага Staphylococcus aureus SA20, обеспечивающий разрушение биопленок, образуемых бактериями рода Staphylococcus // Патент РФ № 2565824. 2015.
Морозова В. В., Козлова Ю. Н., Тикунова Н. В. и др. Штамм бактериофага Citrobacter freundii CF17, способный лизировать патогенные штаммы Citrobacter freundii // Патент РФ № 2565559. 2015.
Тикунова Н. В., Морозова В. В. Фаговый дисплей на основе нитчатых бактериофагов: применение для отбора рекомбинантных антител // Аcta Naturae. 2009. № 3. С. 6—15.
Тикунова Н. В. и Власов В. В. Бактериофаги – враги наших врагов // Наука из первых рук. 2013. № 2(50). С. 58—69.
Покровская М. П. Каганова Л. С., Морозенко М. А. и др. Лечение ран бактериофагом. М.: НАРКОМЗДРАВ СССР, МЕДГИЗ. 1941. 57 с
Górski A. et al. Phages targeting infected tissues: novel approach to phage therapy. // Future Microbiol. 2015. V. 10. P. 199—204.
Międzybrodzki R. et al. Clinical aspects of phage therapy // Adv. Virus. Res. 2012. V. 83. P. 73—121.
В публикации использованы иллюстрации из книги Лечение ран бактериофагом. М.: НАРКОМЗДРАВ СССР, МЕДГИЗ. 1941. 57 с.
, MD, FACP, Charles E. Schmidt College of Medicine, Florida Atlantic University;
, MD, Wellington Regional Medical Center, West Palm Beach
Last full review/revision September 2017 by Larry M. Bush, MD, FACP; Maria T. Perez, MD





Способность к тромбообразованию путем продуцирования коагулазы отличает вирулентный патоген, Staphylococcus aureus, от менее вирулентных коагулазонегативных штаммов стафилококка. Коагулазопозитивный S. aureus - один из самых распространенных и опасных для человека болезнетворных микроорганизмов из-за его высокой вирулентности и способности к формированию резистентности к антибиотикам.
Коагулазонегативные виды, такие как S. epidermidis все чаще ассоциируются с внутрибольничной инфекцией; S. saprophyticus является причиной инфекции мочевых путей. Коагулазонегативный S. lugdunensis может вызывать инвазивное заболевание с вирулентностью, аналогичной S. aureus. В отличие от большинства коагулазонегативных стафилококков, S. lugdunensis часто остается чувствительным к пенициллиназа-резистентным бета-лактамным антибиотикам (например, к метициллину).
Патогенные стафилококки распространены повсеместно. Около 30% здоровых взрослых, обычно временно, являются носителями стрептококков в носовых проходах и около 20% – на коже; отсюда стрептококки могут инфицировать самого носителя и других людей. Обсемененность пациентов стационаров и медперсонала значительно выше. Инфекция, вызванная S. aureus, чаще встречается среди бактерионосителей, чем среди лиц, которые таковыми не являются, и обычно вызвана колонизирующим штаммом.
Факторы риска
Людьми, предрасположенными к стафилококковой инфекции, являются:
Новорожденные младенцы и кормящие матери
Пациенты с гриппом, хроническими бронхолегочными заболеваниями (например, муковисцидоз, эмфизема), лейкемией, опухолями, хроническими кожными заболеваниями или сахарным диабетом
Пациенты с трансплантатами, имплантированными протезами, другими инородными телами или имплантированными внутрисосудистыми пластмассовыми катетерами
Пациенты, получающие глюкокортикоиды, иммуносупрессанты, лучевую терапию, или противоопухолевую химиотерапию
Пациенты с хронической болезнью почек и находятся на диализе
Пациенты с хирургическими разрезами, открытыми ранами или ожогами
Предрасположенным пациентам могут передаваться антибиотикорезистентные штаммы стафилококков от других пациентов, медперсонала или контактно-бытовым путем через предметы ухода за пациентами. Передача через руки персонала – наиболее распространенный способ заражения, воздушно-капельная передача также актуальна.
Болезни, вызываемые стафилококками
Стафилококки вызывают заболевание путем
Прямого проникновения в ткань
Иногда продукцией экзотоксина
Прямое проникновение в ткань является наиболее распространенным механизмом возникновения стафилококковых заболеваний, включая следующее:
Иногда стафилококками продуцируются множественные экзотоксины. Некоторые имеют локальные проявления; другие вызывают выработку цитокина из определенных Т-клеток, что ведет к серьезным системным поражениям (например, поражения кожи, шок, недостаточность органа, смерть). Лейкоцидин Пантона-Валентайна (PVL) является токсином, продуцируемым штаммами, инфицированными определенным бактериофагом. Лейкоцидин Пантон-Валентайна, как правило, присутствует в штаммах бытового метициллин резистентного стафилококка S. aureus (БМРЗС) и считается, что он опосредует способность к формированию некрозов; однако этот эффект не был доказан.
Токсин-опосредованные стафилококковые заболевания включают следующие:
Синдром токсического шока
Стафилококковый синдром ошпаренной кожи
Стафилококковое пищевое отравление
Упомянутые болезни обсуждаются далее в Р у к оводстве .
S. aureus вызываетбактериемию, которая часто приводит к появлению метастатических очагов инфекции, может возникнуть от инфекции S. aureus любой локализации, но особенно часто – от инфекции, связанной с присутствием внутрисосудистых катетеров или других инородных тел. Может также проявляться без какой-либо четко выявленной первичной локализации. S. epidermidis и другие коагулазонегативные стафилококки чаще вызывают внутрибольничную бактериемию, связанную с наличием внутрисосудистых катетеров и других инородных тел, так как они могут образовывать биопленки на этих материалах. Стафилококковая бактериемия является основной причиной заболеваемости (особенно удлинения периода госпитализации) и смертности среди ослабленных пациентов.
Инфекция кожи – наиболее распространенная форма стафилококкового заболевания. Поверхностные инфекции могут быть диффузными, с везикулярными пустулами, покрытыми коркой (импетиго), иногда в виде флегмоны или очаговыми с узловыми абсцессами (фурункулы и карбункулы). Более глубокие кожные абсцессы также широко распространены. Могут встречаться тяжелые некротизирующие инфекции кожи.




Стафилококки обычно являются причиной раневых и ожоговых инфекций, послеоперационных раневых инфекций и мастита или абсцесса груди у кормящих матерей.
Неонатальные инфекции обычно появляются у детей в течение 6 нед после рождения и включают:
Повреждения кожи с шелушением или без него
Пневмония, которая возникает в амбулаторных условиях, не является распространенной, однако может развиваться у пациентов
Пациенты, получающие кортикостероиды или иммуносупрессанты
Имеют хронические бронхолегочные или другие заболевания с высоким уровнем риска
Стафилококковая пневмония может быть первичной инфекцией, а также следствием гематогенного распространения инфекции S. aureus из других частей тела (например инфицирование внутривенного катетера, эндокардит, инфекция мягких тканей) или инъекционной наркомании. Однако S. aureus является частой причиной развития внутрибольничной пневмонии, включая вентиляторную пневмонию при ИВЛ
Стафилококковая пневмония иногда характеризуется формированием абсцессов легких, сопровождаемых быстрым развитием пневматоцеле и эмпиемы. Внебольничный MRSA часто является причиной развития тяжелой некротизирующей пневмонии.
Эндокардит может развиться у инъекционных наркоманов и пациентов с протезами клапанов сердца. Поскольку частота использования внутрисосудистых катетеров и имплантаций сердечных устройств увеличилась, S. aureus стал ведущей причиной бактериального эндокардита.
Эндокардит, вызванный S. aureus, является острым фебрильным заболеванием, которое часто сопровождается формированием висцеральных абсцессов, эмболий, перикардита, подногтевых петехий, кровоизлияний в конъюнктиву глаза, пурпуры, шумов в сердце и сердечной недостаточности, как следствие вторичного повреждения клапанов сердца.
Остеомиелит встречается наиболее часто у детей, вызывая озноб, лихорадку и боль поражённой кости. Впоследствии и мягкие ткани над зоной поражения становятся красными и отечными. Может наблюдаться суставная инфекция, что часто приводит к суставному выпоту, предполагая септический артрит, а не остеомиелит. Большинство инфекций позвонков и межпозвоночных дисков у взрослых связаны с S. aureus.
Стафилококковый синдром токсического шока может быть следствием применения вагинальных тампонов или осложнением любого типа инфекции S. aureus (например послеоперационная раневая инфекция, ожоговые инфекции, инфекции кожи). Хотя большинство случаев связано с метициллин-чувствительным S. aureus (MSSA), случаи, связанные с MRSA, становятся все более частыми.

Стафилококковый синдром ошпаренной кожи вызывается несколькими токсинами, так называемыми эксфолиатинами, и проявляется как детский эксфолиативный дерматит, характеризующийся крупными волдырями и шелушением верхнего слоя кожи. В конечном счёте происходит эксфолиация. Синдром "ошпаренной кожи" наиболее часто встречается у младенцев и детей
Стафилококковое пищевое отравление вызывается употреблением в пищу инфицированных стафилококками продуктов питания (устойчивый к высокой температуре стафилококковый энтеротоксин). Пища может быть заражена стафилококковыми носителями или людьми с выраженными заболеваниями кожи. В пище, недостаточно термически обработанной или оставленной при комнатной температуре, стафилококки активно размножаются и вырабатывают энтеротоксин. Многие продукты могут служить питательной средой, не изменяя при этом своих органолептических свойств (вкус и запах). Тяжелая тошнота и рвота начинаются спустя 2–8 ч после приема пищи, как правило, сопровождаемыми спазмами брюшной полости и диареей. Приступ непродолжительный, часто составляет 12 ч.
Диагностика
Цитобактерископия мазков, окрашенных по Граму, и посев на обогащенные питательные среды
Диагноз стафилококковой инфекции устанавливается после бактериоскопии мазков, окрашенных по Граму, и посевов инфицированного материала на питательные среды.
Необходимо провести тесты на восприимчивость, поскольку метициллин-резистентные микроорганизмы теперь повсеместно распространены и требуют альтернативной терапии.
Если подозревается стафилококковый синдром ошпаренной кожи, то следует провести посевы крови, мочи, носоглотки, отделяемого пупочного кольца, пораженной кожи или любого подозреваемого очага инфекции; интактные волдыри являются асептическими. Хотя диагноз обычно ставится клинически, биопсия зараженной кожи может помочь подтвердить диагноз.
Стафилококковое пищевое отравление обычно предполагают из-за регистрации однотипных случаев инфекции (например, в пределах семьи, среди посетителей массовых социальных учреждений или ресторанов). Подтверждение (как правило, отделом здравоохранения) подразумевает выделение стафилококков в подозрительной пище и иногда анализ на наличие энтеротоксинов.
При остеомиелите рентгенологические изменения могут не проявиться до 10–14 дней болезни, и размягчение кости, и периостальная реакция могут не выявляться и дольше. Отклонения по МРТ, КТ или сканирование радионуклида кости часто становятся очевидными раньше. Биопсия кости (открытая или перкутатная) должна быть проведена для идентификации патогена и анализа антибиотикорезистентности.
В некоторых учреждениях с высокой распространённостью метициллин - резистентных штаммов S. аureus обычно проверяют пациентов на стафилококковое носительство (активное наблюдение), используя лабораторные методы быстрой диагностики, чтобы оценить образцы мазков из носа. Некоторые учреждения проводят скрининг только у пациентов группы риска (например тех, кто поступает в отделение интенсивной терапии, у кого ранее была инфекция MRSA, кому планируются сосудистые, ортопедические оперативные вмешательства или операция на сердце).
Быстрая идентификация MRSA:
позволяет произвести изоляцию контактных носителей и, в случае необходимости предоперационной антибиотикопрофилактики против кожных микроорганизмов, назначить ванкомицин как часть их курса лечения
уменьшает распространение MRSA
может снизить частоту внутрибольничных инфекций MRSA
Однако лечение, направленное на деколонизацию (например, местное применение назального мупироцина), хотя иногда и проводится, но еще окончательно не доказало своей эффективности, так как выявлена резистентность к мупироцину. Ежедневное обмывание с хлоргексидином пациентов отделения интенсивной терапии снижает частоту инфекций, вызванных MRSA.
Лечение
Местные меры (например, санация раны, удаление катетеров)
Антибиотики выбираются с учетом тяжести заболевания и результатов антибиотикограммы
Контроль стафилококковых инфекций включает дренирование абсцесса, санацию некротической ткани, удаление инородных тел (включая внутрисосудистые катетеры) и назначение антибиотиков ( Лечение антибиотиками стафилококковых инфекций у взрослых).
Первоначальный выбор и дозировка антибиотиков зависят от
вероятности того, что задействованы резистентные штаммы
Таким образом, необходимо иметь данные о циркуляции антибиотикорезистентных штаммов в определенном регионе для стартовой терапии (и в конечном счете знать фактическую антибиотикочувствительность выделенного микроорганизма).
Лечение токсин-опосредованного стафилококкового заболевания (самым тяжелым из которых является синдром токсического шока) подразумевает деконтаминацию токсин-продуцирующих областей (ревизия хирургических ран, некрэктомия, промывание), интенсивную терапию (включая внутривенное введение жидкостей, вазопрессоры и респираторную поддержку), коррекцию водно-электролитного баланса и антибактериальные препараты. Доказательства in vitro свидетельствуют о предпочтительном назначении ингибиторов синтеза белка (например, клиндамицин по 900 мг внутривенно каждые 8 ч, линезолид 600 мг внутривенно каждые 12 ч) по сравнению с другими классами антибиотиков. В тяжелых случаях оправдано применение внутривенного иммуноглобулина.
Многие стафилококковые штаммы продуцируют пенициллиназу, фермент, который инактивирует некоторые бета-лактамные антибиотики; эти штаммы являются резистентными к пенициллину G, ампициллину и противопсевдомонадному пенициллину.
Внебольничные штаммы часто чувствительны к пенициллиназа-резистентным пенициллинам (например, метициллину, оксациллину, нафциллину, клоксациллину, диклоксациллину), цефалоспоринам, карбапенемам (например, имипенему, меропенему, эртапенему, дорипенему), тетрациклинам, макролидам, фторхинолонам, триметоприму/сульфаметоксазолу (TMP/SMX), гентамицину, ванкомицину и тейкопланину.
Изоляты MRSAстали повсеместно распространены, особенно в стационарах. Кроме того, внебольничный МRSA появился за последние несколько лет в большинстве географических регионов. Как правило, внебольничные MRSA обладают меньшей резистентностью ко многим антибиотикам, в отличие от внутрибольничных. Эти штаммы, хотя и резистентные к большинству бета-лактамов, обычно чувствительны к TMP/SMX, тетрациклинам (миноциклину, доксициклину) и часто чувствительны к клиндамицину, однако есть возможность развития резистентности к клиндамицину у штаммов с индуцируемой устойчивостью к эритромицину (эти штаммы могут быть выявлены с помощью D-теста). Ванкомицин эффективен против большинства MRSA, иногда в сочетании с рифампином и аминогликозидами при тяжелых инфекциях (таких как остеомиелит, инфекции протезированных суставов, эндокардит протезированного клапана). Назначение альтернативного препарата (даптомицин, линезолид, тедизолид, далбаванцин, оритаванцин, тигециклин, хинупристин/дальфопристин, TMP-SMX, возможно цефтаролин) следует рассматривать при лечении метициллин-резистентных штаммов S. аureus с МИК (минимальная ингибирующая концентрация) ванкомицина > 1,5 мкг/мл.
В США появились штаммы ванкомицин-резистентного S. aureus (VRSA; МИК > 16 мкг/мл) и штаммы S. aureus с умеренной чувствительностью к ванкомицину (VISA, МИК 4–8 мкг/мл). Для терапии инфекций, вызванных этими штаммами стафилококка, требуется назначение линезолида, тедизолида, хинупристина/дальфопристина, даптомицина, TMP/SMX или цефтаролина.
Поскольку распространённость метициллин - резистентных штаммов S. аureus увеличилась, стартовое лечение тяжелых стафилококковых инфекций (особенно тех, которые возникают в стенах учреждений здравоохранения) должно включать препарат с высокой активностью против метициллин-резистентного S. аureus. Таким образом, адекватными лекарственными средствами являются:
Для доказанных или подозреваемых инфекций кровотока– ванкомицин или даптомицин
Для пневмонии – ванкомицин, телаванцин или линезолид (т к даптомицин не проявляет должной активности в легких)
Читайте также:


