Инфекции вызванные чувствительными штаммами микроорганизмов
Пенициллин стали широко применять для лечения инфекционных заболеваний и осложнений с 1942 г. В 1944 г. подавляющее большинство штаммов стафилококков были чувствительны к этому препарату. Однако уже в 1948 г. 65-85% штаммов стафилококков в больницах оказались резистентными к пенициллину.
Внедрение в практику в 1950-1960-х гг. пенициллинов, устойчивых к действию стафилококковой пенициллиназы (метициллин, оксациллин), привело к снижению частоты стафилококковых инфекций.
Одновременно отмечен рост числа заболеваний, вызванных грамотрицательными возбудителями. Кроме того, озабоченность врачей стали вызывать метициллин-резистентные стафилококки (MRSA).
С середины 1970-х гг. в арсенале врачей появились цефалоспорины 2-й, 3-й генераций, высокоактивные против грамотрицательных патогенов.
В начале 80- х гг. в разных странах мира зарегистрированы вспышки внутрибольничных инфекций, вызванных полирезистентными грамотрицательными микроорганизмами. Основным механизмом формирования устойчивости грамотрицательных бактерий к цефалоспоринам стала продукция бактериальных ферментов, разрушающих бета-лактамное кольцо антибиотиков (бета-лактамазы расширенного спектра — БЛРС).
Внедрение в практику в 1985 г. имипенема, первого антибиотика из класса карбапенемов, позволило почти два десятилетия держать под контролем инфекции, вызванные грамотрицательными возбудителями.
Первые устойчивые к ванкомицину клинические штаммы энтерококков — ванкомицин-резистентные энтерококки (VRE) были описаны в конце 80-х г. В настоящее время в Европейских странах выделяется от 1,1 до 11,5% ванкомицин-резистентных энтерококков, а в некоторых американских госпиталях доля таких штаммов достигает 75%.
С начала 1990-х гг. отмечается широкое распространение в стационарах всего мира MRSA (метициллин-резистентные стафилококки). Доля таких штаммов в некоторых учреждениях превышает 70%. Вместе с тем, в последние годы появились сообщения о снижении заболеваемости инвазивными MRSA инфекциями, что связывают с активным внедрением образовательных программ для медицинских работников и более строгим соблюдением принципов инфекционного контроля в стационарах.
С конца 1990-х гг. стали поступать сообщения о выделении штаммов стафилококков со сниженной чувствительностью к ванкомицину. Сначала такие штаммы выделяли в США и Японии, а затем и по всему миру. При заболеваниях, вызываемых такими стафилококками, терапия ванкомицином очень часто неэффективна.
Увеличение числа заболеваний, вызванных полирезистентными грамположительными возбудителями, способствовало поиску и внедрению в клиническую практику новых противомикробных препаратов.
Так, с конца 1990-х гг. разрешены к применению эффективные при жизнеугрожающих грамположительных инфекциях антибиотики новых классов: линезолид (класс оксазолидинов) и даптомицин (класс липопептидов).
Был открыт тигециклин — антибиотик из группы глицилциклинов, активный против MRSA, ванкомицин-резистентных энтерококков, пенициллин-резистентных пневмококков и энтеробактерий, продуцирующих БЛРС.
Разработаны и внедрены в практику цефалоспорины с анти -MRSA-активностью (цефтобипрол и цефтаролин). В настоящее время в клинике есть выбор препаратов, позволяющих эффективно лечить инфекционные заболевания, вызванные грамположительными возбудителями, в том числе и полирезистентными.
Единичные сообщения о выделении клинических штаммов грамотрицательных бактерий, устойчивых к карбапенемам, стали появляться с 1994 г. Карбапенемы по-прежнему рассматривались как препараты высокоэффективной терапии в случае инфекций, вызванных грамотрицательными возбудителями.
В этот период активно рекомендовалась политика деэскалационной терапии. Согласно такому подходу, пациенту с подозрением на грамотрицательную инфекцию предлагалось эмпирически назначать на несколько дней карбапенемы. Затем, согласно результатам микробиологического исследования, переходить на антибиотики с более узким спектром действия, например, цефалоспорины 3-й генерации.
Обосновывалась такая тактика тем, что раннее назначение антибиотика с максимально широким спектром активности позволит гарантировать высокую клиническую эффективность и обеспечит экономию средств за счет сокращения сроков госпитализации, уменьшения затрат на неэффективные препараты и коррекцию осложнений.
В результате пациенты с жизнеугрожающими заболеваниями, такими как медиастинит, перитонит, менингит, вентилятор- ассоциированная пневмония, сепсис, но вызванными антибиотико-чувствительными штаммами микроорганизмов, получали полный курс терапии карбапенемами.
Лечение отдельного пациента, конечно же, было успешным. Однако селективное давление карбапенемов постепенно способствовало изменению структуры возбудителей внутрибольничных инфекций (ВБИ) и значительному распространению полирезистентных штаммов микроорганизмов.
В ряде публикаций доказано, что увеличение использования карбапенемов в стационаре способствует быстрому распространению в данном учреждении устойчивых штаммов бактерий. По данным многочисленных работ, фактором риска развития инфекций, вызванных карбапенем- резистентными штаммами, является предшествующая терапия антибиотиками широкого спектра действия и, в частности, карбапенемами.
Микроорганизмы с приобретенной резистентностью к карбапенемам устойчивы ко всем бета-лактамным антибиотикам и часто — к препаратам других классов противомикробных средств.
В научной литературе встречается несколько терминов, характеризующих резистентность грамотрицательных патогенов к антибиотикам:
- возбудители с множественной лекарственной устойчивостью (MDR) — резистентные к трем классам антибиотиков и более;
- со значительной (extensively) лекарственной устойчивостью (XDR) — резистентные ко всем, кроме одного или двух классов антибиотиков;
- панрезистентные (PDR) — устойчивые ко всем известным классам препаратов.
Резистентность к карбапенемам грамотрицательных бактерий, за исключением видов с природной устойчивостью к этим препаратам, является маркером XDR или PDR.
Основной механизм формирования устойчивости грамотрицательных бактерий к карбапенемам такой же, как и к другим бета-лактамным антибиотикам — продукция бактериями ферментов, разрушающих бета-лактамное кольцо антибиотиков.
В настоящее время описано более 10 групп карбапенемаз, входящих в разные молекулярные классы бета-лактамаз. Продукция бета-лактамаз бактериями кодируется на генетическом уровне. Большинство генов, кодирующих продукцию карбапенемаз, входит в состав так называемых интегронов, распространяющихся с помощью плазмид между разными видами грамотрицательных бактерий.
В состав таких интегронов входят генные кассеты, несущие детерминанты устойчивости к антибиотикам разных классов. Поэтому происходит одномоментная передача фенотипа множественной лекарственной устойчивости. В последние годы во всех странах мира число штаммов карбапенем-устойчивых грамотрицательных бактерий возрастает в геометрической прогрессии.
S. maltophilia — неферментирующая грамотрицательная бактерия (НГОБ). В настоящее время все чаще выделяется как возбудитель внутрибольничных инфекций и представляет серьезную проблему в лечении пациентов в связи с множественной природной устойчивостью к противомикробным препаратам.
В. cepacia — условно-патогенный микроорганизм из группы НГОБ. Может вызывать вспышки ВБИ (раневые и катетер-ассоциированные инфекции, пневмонии). Особую опасность бактерии В. cepacia представляют для лиц с иммунодефицитами различного генеза.
В последнее время участились случаи госпитальных пневмоний и сепсиса, связанные с этим патогеном, у больных, находящихся длительно на искусственной вентиляции легких. При инфекциях, возбудителем которых является В. cepacia, смертность достигает 83%.
Заболевания, вызванные В. cepacia, с трудом поддаются лечению, так как этот микроорганизм обладает природной устойчивостью к большинству классов антибиотиков.
В настоящее время распространенность устойчивости к карбапенемам среди Р. аeruginosa, по данным различных исследований, составляет от 22 до 95,9%.
В последние годы в структуре возбудителей ВБИ, особенно у пациентов в критических состояниях, все чаще встречается Acinetobacter spp. В некоторых медицинских центрах Acinetobacter spp. является ведущим возбудителем ВБИ.
Препаратами выбора для лечения заболеваний, вызванных этим микроорганизмом, долгое время считались карбапенемы. Однако в настоящее время в разных странах мира устойчивость Acinetobacter spp. к карбапенемам стремительно нарастает.
По данным D.W. Wareham et al., за 8 лет доля устойчивых к карбапенемам штаммов Acinetobacter spp. увеличилась с 0 до 55%. В одном из китайских госпиталей за период с 2008 по 2011 гг. количество резистентных к имипенему штаммов Acinetobacter spp. возросло с 14,8 до 90,8%. По данным H.G. Lee et al., количество карбапенем-резистентных штаммов Acinetobacter spp. составляет 95,3%.
Первый клинический штамм Klebsiella pneumonia, устойчивый к карбапенемам, был описан в 1996 г. в Северной Каролине (США). В течение нескольких последующих лет единичные подобные возбудители выделялись в разных клиниках США.
Начиная с 2000- х гг. случаи ВБИ, вызванные карбапенем-резистентными штаммами Klebsiella pneumonia, стали фиксировать и в Европейских странах. После 2011 г. устойчивые к карбапенемам клебсиеллы были обнаружены во многих странах мира с заметными вспышками ВБИ в Израиле и США.
Наиболее часто эти возбудители вызывают заболевания у пациентов в критических состояниях, находящихся на лечении в отделении реанимации и интенсивной терапии (ОРИТ). В отдельных клиниках доля устойчивых к карбапенемам штаммов клебсиелл может достигать 40-50%. В случае развития заболеваний, вызванных такими штаммами, значительно увеличивается длительность пребывания больного в ОРИТ и потребность в искусственной вентиляции легких.
По данным многочисленных публикаций, ВБИ, вызванные устойчивыми штаммами бактерий, сопровождаются более высокой частотой смертельных исходов по сравнению с заболеваниями, вызванными чувствительными микроорганизмами. Эксперты придают особое значение проблеме карбапенем- резистентных возбудителей в связи с отсутствием на сегодняшний день альтернативных антибиотиков для лечения пациентов при таких инфекциях.
Американское общество инфекционных болезней (Infectious Diseases Society of America — IDSA) констатирует стагнацию в поисках новых антибиотиков против полирезистентных бактерий (Bad Bugs). Число новых антибиотиков, появляющихся на фармакологическом рынке, снижается: с 17 в 1980-1984 гг. до 2 в 2008-2011.
За период с 2010 г. по настоящее время только 7 новых препаратов, потенциально активных против MDR-патогенов, находятся на 2-3-й стадиях клинических испытаний. Причем все они принадлежат к уже длительно применяемым классам антибиотиков, к которым у бактерий выработались механизмы развития резистентности.
В условиях повсеместного распространения штаммов бактерий с множественной устойчивостью к противомикробным средствам ведется поиск эффективной альтернативы антибиотикам в профилактике и лечении инфекционно-воспалительных заболеваний.
В настоящее время активно проводятся исследования по изучению антибактериального действия ионов и наночастиц различных металлов и полупроводников. Их вводят в покрытия катетеров, хирургические повязки, антисептическую одежду, ортопедические устройства. Оцениваются перспективы более широкого использования наночастиц металлов в медицине.
В последние годы возобновился интерес к препаратам бактериофагов и лизатов бактерий. В качестве противомикробных средств их стали применять вскоре после открытия, начиная с 1920-х гг. Для фаготерапии того периода характерны нестабильные результаты лечения, что связано с недостаточным уровнем знаний о биологических свойствах фагов, способах применения, условиях их производства и хранения.
Появившиеся в клинической практике антибиотики быстро вытеснили фаги из арсенала противомикробной терапии. Изучение свойств бактериофагов и их клиническое применение продолжались в Грузии, России, Польше. Современные технологии позволили стандартизировать производство лечебных препаратов бактериофагов и расширить возможности их терапевтического применения.
В настоящее время лечебно-профилактические бактериофаги зарегистрированы для перорального, наружного, местного, ректального и интраназального использования.
По мнению экспертов, решить проблему полирезистентных возбудителей только путем разработки новых лекарств не получится. Признается тот факт, что возникновение устойчивости микроорганизмов является естественным биологическим ответом на использование антибиотиков, которые создают селективное давление, способствующее отбору, выживанию и размножению резистентных штаммов бактерий.
В связи с этим значительное место в организации борьбы с XDR- и PDR-бактериями отводят внедрению в стационарах систем инфекционного контроля и оптимизации политики применения антибиотиков.
Для стабилизации ситуации с распространением полирезистентных штаммов микроорганизмов необходимы комплексные, постоянно действующие мероприятия, включающие:
- микробиологический мониторинг структуры возбудителей и их устойчивости к антибиотикам для выявления зон наиболее высокого риска развития ВБИ;
- мониторинг использования антибиотиков (выбор препаратов, дозы, кратность введения, количество курсов);
- оптимизацию политики применения антибиотиков в стационаре;
- строгое соблюдение принципов инфекционного контроля.

Особое опасение и тревогу вызывает распространение резистентных штаммов микроорганизмов [19]. На рисунке 1 приведен график на основании информации Американского общества специалистов по инфекционным болезням (IDSA), отражающий распространенность наиболее важных видов резистентных к антибиотикам микроорганизмов.На графике видно, что количество резистентных к антибиотикам штаммов, выявляемых в клиническом материале, растет год от года.
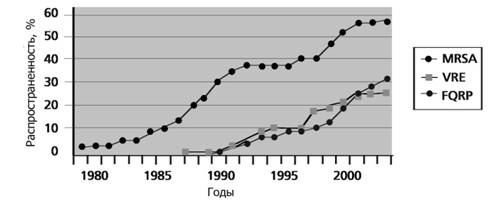
Рис. 1. Динамика распространения наиболее важных резистентных бактериальных штаммов. MRSA – метициллин резистентный Staphilococcusaureus, VRE–ванкомицин резистентные бактерии семейства Enterobacteriaceae, FQRP – резистентные к фторхинолонамPseudomonasaeruginosa [13]
Общую статистику по всем случаям инфекционных заболеваний, вызванных резистентными микроорганизмами, привести достаточно сложно. Считается, что порядка 70% внутригоспитальных инфекций вызваны штаммами, которые устойчивы к одному или нескольким антибиотикам. По последней доступной статистике за 2006 год в России ежегодно регистрируется около 60 тысяч случаев внутрибольничных инфекций [3], хотя, по оценкам экспертов, эта цифра выше в 40-50 раз [4].
Уже через 7 лет после введения в практику пенициллина, 50% штаммов Staphylococcusaureusбыли невосприимчивы к действию этого антибиотика по причине распространения штаммов бактерий, вырабатывающих пенициллиназу [23]. В дальнейшем, после введения в практику метициллина, устойчивого к воздействию указанного фермента, появились устойчивые бактериальные штаммы, объединенные в дальнейшем в группу MRSA (methicillinresistantStaphylococcusaureus), резистентность которых обусловлена другим механизмом – бактериальная клетка изменяла белок-мишень, предотвращая, таким образом, его блокирование. Кроме того, помимо снижения чувствительности к антибиотикам, штаммы MRSA более вирулентны – в частности, смертность при бактериемии, вызванной штаммами MRSA, значительно выше по сравнению с уровнем смертности при бактериемии, вызванной штаммами Staphylococcusaureus, чувствительными кметициллину [12].
Наибольшее внимание обращает на себя факт увеличения количества зарегистрированных случаев появления устойчивых к резервным антибиотикам штаммов, например, количество сообщений о появлении штаммов S. aureus, резистентных к ванкомицину,увеличилось с 2 в 2002 году до 12 в 2010 [21].
Более того, проблема инфекций, вызванных резистентными штаммами бактерий, начала выходить за рамки лечебных учреждений – сообщалось о случаях заболеваний, вызванных MRSA, полученных при использовании одного комплекта спортивного оборудования несколькими людьми [21].
На рисунке 2 приведена схема, отражающая время внедрения в практику антибиотика и время появления первых сообщений о появлении резистентных штаммов чувствительных ранее видов микроорганизмов. Как видно на схеме, скорость появления резистентных штаммов микроорганизмов к вновь введенным в практику антибактериальным препаратам варьирует от 1 до 10 лет.
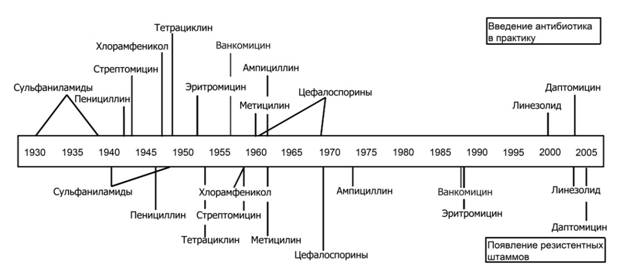
Рис. 2. Внедрение в практику антибиотиков и появление резистентных штаммов [21]
Таким образом, очевидно, что на сегодняшний день, имеется острая необходимость в новыхантибактериальных препаратах. Однако, несмотря на это, ситуация с введением в практику препаратов этой группы год от года ухудшается – количество вводимых в практику антибиотиков падает.
Проанализировав информацию из литературных источников и отчетов FDA (Foodanddrugadministration), мы получили следующую закономерность (рис. 3). Из диаграммы видно, что ежегодно в среднем регистрируется порядка 1-2 антибиотиков преимущественно с известным ранее механизмом действия. Из 184 препаратов, зарегистрированных за последние пять лет ведомством FDA, только 12% были антимикробными препаратами.
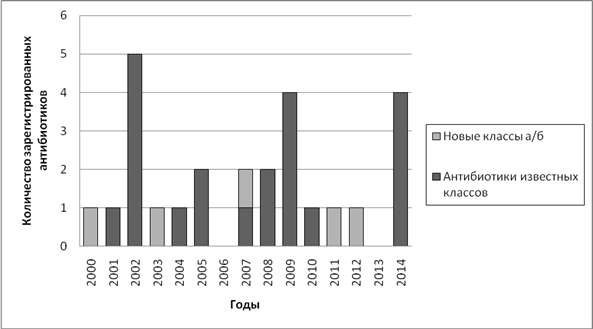
Рис. 3. Количество зарегистрированных FDA антибиотиков с 2000 по 2014 год
В таблице 1 приведены зарегистрированные FDA с 2000 года антибиотики (на основании информации из [9] и отчетов FDA за 2013 и 2014 года), а также информация об их регистрации в России (на основании информации государственного реестра лекарственных средств по состоянию на 6 июля 2015 года). Из таблицы видно, что большая часть антибиотиков, зарегистрированных в западных странах, с некоторой задержкой, но регистрируется также и в России.
Год регистрации в РФ
Цефалоспорин+ ингибитор β-лактамаз
* Гр+ – грамположительные, ** Гр- – грамотрицательные, *** Синт – синтетического происхождения, ****Прир – природного происхождения
Снижение количества вновь регистрируемых антибиотиков вызвано низкой инвестиционной привлекательностью данной группы препаратов у производителей. Помимо уже упомянутой высокой скорости распространения резистентных штаммов, данной ситуации способствуют еще несколько факторов:
1. Высокая стоимость разработки и вывода на рынок нового препарата
С 2003 года стоимость работ, проведенных до получения компанией-разработчиком регистрационного удостоверения от FDA, увеличилась более чем в два раза и в настоящее время составляет в среднем 2,6 миллиарда долларов [6], [14].
К сожалению, нам не удалось найти исследований, посвященных стоимости исследовательских работ, проводимых российскими фармацевтическими компаниями до вывода препарата на рынок. Приведем лишь размеры выплат государственным органам за процедуры, необходимые для регистрации препарата. В случае регистрации препарата, который не был в обращении на территории РФ в течение более чем 20 лет, размер государственной пошлины составит 350 000 рублей, а в случае отсутствия проведенных клинических исследований, сумма увеличится еще на 100 000 рублей (на основании требований Налогового кодекса РФ и ФЗ № 61). Таким образом, сумма только государственных пошлин при регистрации препарата в РФ, составляет около полумиллиона рублей.
Ситуацию усугубляет короткий срок действия патентной защиты – 20 лет. За это время необходимо провести доклинические и клинические испытания, зарегистрировать препарат, что занимает, в среднем, около 10 лет. Таким образом, фармацевтические компаниирасполагают сроком около10 лет,чтобы вернуть затраченные средства и получить прибыль.
2. Короткий курс приема антибактериальных препаратов
В отличие от препаратов, применяемых для лечения сердечнососудистых, пульмонологических, онкологических и других заболеваний, курс приема антибиотиков редко превышает 4 недели, даже в самых серьезных случаях. В среднем прием антибиотиков длится 7 – 14 дней. Этот факт также способствует отказу фармацевтических компаний от дальнейшей разработки антибактериальных препаратов, по причине недостаточно большого объема средств, получаемых от реализации антибиотиков.
3. Введение антибиотиков в резерв
После регистрации новых антибактериальных препаратов, регуляторные органы, как правило, в целях предотвращения быстрого развития резистентности, ограничивают обращение этих препаратов [11]. Данный факт еще более ухудшает положение антибиотиков в качестве объекта для инвестиций.
Все вышеперечисленные причины приводят к тому, что крупные фармацевтические компании все чаще отказываются от работ в области разработки новых антибиотиков.
Подходы к получению новых антибактериальных препаратов
Несмотря на все вышеперечисленные причины, новые антибиотики регистрируются. В настоящее время разработкой новых антибактериальных препаратов занимаются небольшие биотехнологические компании, которые, как правило, расположены в США (например, Achaogen, AiCuris, Basilea, Cempra, и др.)[17]. Рассмотрим основные тенденции в области поиска новых биологически активных веществ с антибактериальными свойствами.
Сплошной и направленный скрининг вновь синтезированных или выделенных из природных источников веществ
Скрининг вновь синтезированных соединений – это ранний подход в поиске новых веществ с антибактериальной активностью. Данное направление широко используется российскими учеными[1], [5]. Сплошной скрининг вновь полученных веществ имеет ряд неоспоримых преимуществ –возможность изучения широкого круга соединений, простота используемых методик, возможность быстрого получения практического результата анализа.Тем не менее, этот подход не обладает должной продуктивностью и вытесняется современными методиками, которые учитывают биологические особенности микроорганизмов и человека и, как следствие, позволяют получать более активные и безопасные вещества быстрее и с меньшими усилиями.
Анализ генома патогенных бактерий на предмет выявления потенциальных мишеней
Отличительной чертой большинства используемых в настоящее время методов поиска антибиотиков является широкое использование информации, получаемой в ходе анализа генома микроорганизмов – как патогенных болезнетворных, являющихся мишенью антибиотиков, так и генома основных известных продуцентов антибиотиков (например, актиномицетов).
В 1995 году был полностью секвенирован геном Haemophilusinfluenzae[15]. Сразу после публикации результатов секвенирования генома Haemophilusinfluenzaeкомпанией GlaxoSmithKline были начаты работы по выявлению генов наиболее важных белков упомянутой бактерии, которые впоследствии могли бы стать мишенями для новых антибиотиков. Используя антисмысловыемикроРНК и плазмиды с индуцибельными промоторами (более подробно использованные методы описаны в статьях –[18], [10], [22]), регулируя экспрессию генов, анализировали физиологические проявления пониженной экспрессии тех или иных генов бактерии, после чего анализируемый ген вырезали, получая нокаутные штаммы. При культивировании подобного рода нокаутных штаммов не должно было наблюдаться роста, что подтверждало критическую важность тех или иных белков бактерии.
Через некоторое время после начала описанных выше работ, были опубликованы результаты полного секвенирования генома Moraxellacatarrhalis, Streptococcuspneumoniae, Staphylococcusaureus и Enterococcusfaecalis. Для выбора общих, универсальных для бактерий белков, в целях определения мишеней для антибактериальных веществ широкого спектра действия, был проведен анализ геномов на выявление белков с наиболее консервативной аминокислотной последовательностью среди перечисленных бактерий и Haemophilusinfluenzae. Таким образом было выделено более 300 консервативных белков, которые в дальнейшем были также проанализированы на значимость для каждого из видов бактерий с использованием описанной выше методики. По результатам анализа из 300 белков были выделены 160 наиболее важных белков, блокирование которых вызывает гибель бактериальной клетки [18], [20].
Таким образом, на сегодняшний день доступна вся требуемая информация для проведения направленного синтеза веществ с антибактериальным действием – белки-мишени определены, информация о белках имеется в открытом доступе.
Анализ вторичных метаболитов продуцентов антибиотиков
Другим важным направлением поиска антибиотиков является анализ генома микроорганизмов-продуцентов. Наибольшее количество имеющихся на рынке антибиотиков являются продуктами жизнедеятельности актиномицетов. Эти вещества используются не только в качестве антибактериальных препаратов, но и играют большую роль при лечении онкологических заболеваний [7], [21].После анализа данных, полученных при полном секвенировании генома актиномицетов, выяснилось, что размер генома актиномицетов несколько больше по сравнению с геномом других групп бактерий. В ходе дальнейших исследований выяснилось, что избыток генетического материала кодирует белки, вовлеченные в процессы, связанные с вторичными метаболитами. По этой причине, в настоящее время пристальное внимание уделяется этой группе веществ.
Помимо актиномицетов, второй группой организмов, являющихся традиционно источником новых антибактериальных препаратов, являются грибы. Около 42% всех антибиотиков имеют грибковое происхождение [8]. По этой причине, данная группа организмов также является объектом пристального внимания со стороны исследователей, занимающихся поиском новых антибиотиков.
Для изучения вторичных метаболитов упомянутых двух групп микроорганизмов, в большинстве случаев используют следующий подход – анализируют геном микроорганизма на предмет наличия генов с неизвестной функцией. Вырезают искомый ген рестриктазами и получают нокаутный по данному гену микроорганизм. Культивируют нокаутный штамм параллельно с обычным штаммом микроорганизма. После этого анализируют культуральную жидкость хроматографическими методами с чувствительным детектором и выявляют наличие дополнительных пиков на хроматограммекультуральной жидкости, полученной при культивировании микроорганизма обычного штамма. Эти дополнительные пики соответствуют тем веществам, биосинтез которых был заблокирован у нокаутных штаммов по причине удаления гена. Затем генно-инженерным способом получают вещества и описывают их свойства. Более подробно методы описаны в работах [8], [16].
В заключении стоит отметить, что в настоящее время накоплено достаточно большое количество знаний об особенностях жизнедеятельности микроорганизмов, имеется большой выбор стратегий и методов поиска новых антибактериальных препаратов.
Тем не менее, к сожалению, подавляющее большинство публикаций, посвященных синтезу антимикробных препаратов, в российских журналах по медицинской и фармацевтической химии, описывают, как правило, химическую часть и общую противомикробную активность веществ, оставляя в тени механизмы, обеспечивающие антимикробную активность нового вещества. Однако, очевидно, что в научном поиске новых веществ с антибактериальной активностью необходимо использовать методы не только медицинской химии, но и молекулярной биологии, генетики и других биологических дисциплин, основные направления, применения которых мы описали. И поскольку крупные фармацевтические компании отказываются от разработок антибиотиков, на сегодняшний день большая надежда в области поиска новых антибиотиков сегодня возлагается на небольшие некоммерческие научные группы, которые имеют частичное государственное финансирование.
Рецензенты:
Читайте также:


