Грамположительные аэробные бактерии возбудители гнойных и раневых инфекций

Попков В. М., Чеснокова Н. П., Ледванов М. Ю.,
Воспаление – это типовой патологический процесс, возникающий в ответ на действие разнообразных патогенных факторов экзогенной или эндогенной природы, характеризующийся развитием стандартного комплекса сосудистых и тканевых изменений.
Описание внешних признаков воспаления относится к I веку до н.э., когда Цельс обратил внимание на закономерность возникновения при воспалении таких признаков, как краснота (rubor), жар (calor), припухлость (tumor), боль (dolor). Гален указал на неизбежность нарушения функций при воспалении (functio laesa).
Этиологические факторы, вызывающие воспаление, могут иметь инфекционную и неинфекционную природу. Индукторами воспаления являются механические, физические, химические альтерирующие агенты [11].
Развитие воспалительного процесса может быть следствием инфицирования организма патогенной микрофлорой, вирусами, простейшими, а также возникать на фоне активации условно патогенной микрофлоры при снижении специфических иммунологических механизмов защиты и резистентности организма.
В настоящее время важно учитывать значительные изменения в структуре возбудителей воспалительных гнойных процессов, осложняющих хирургические вмешательства, в частности, тот факт, что на первое место выдвинулась проблема условно патогенных возбудителей.
В развитии острого и хронического воспалительного процесса большую роль играет группа неклостридиальных анаэробных бактерий (грамотрицательные палочки рода Bacteroiides, грамположительные кокки рода Peptococcus и Peptostreptococcus, грамположительные палочки), которые не образуют спор и являются представителями нормальной аутофлоры человека. Они обитают в полости рта, в кишечнике, на коже и слизистых. Неклостридиальные анаэробы играют важную роль в развитии острой и хронической инфекции.
Частота выделения анаэробов при острых гнойных заболеваниях колеблется от 40 до 95 % в зависимости от локализации и характера патологического процесса [29].
Основные возбудители гнойных хирургических инфекций – стафилококки и грамотрицательные бактерии, принадлежащие к семейству Enterobaсteriaceae и к обширной малоизученной группе так называемых неферментирующих грамотрицательных бактерий.
Существенная роль в этиологии хирургических инфекций отводится облигатным неспорообразующим анаэробным бактериям.
В ряде случаев этиологическими факторами инфекционного воспалительного процесса могут быть возбудители, вызывающие развитие особых видов раневой инфекции – клостридиальной (газовая гангрена), неклостридиальной анаэробной и гнилостной инфекции, сибирской язвы, столбняка, рожистого воспаления, актиномикоза, дифтерии, туберкулеза, сифилиса. Указанные возбудители резко изменяют течение раневого процесса, придают особую специфику местным и общим проявлениям воспаления.
В хирургической практике следует учитывать возможность первичного и вторичного микробного загрязнения раны. Первичное загрязнение наступает в момент нанесения раны и характерно для травматических и огнестрельных ран. Вторичное загрязнение раны, как правило, связано с нарушением правил асептики во время перевязок и операций и часто бывает следствием внутригоспитальной инфекции.
Наличие в ране возбудителя является необходимым, но не решающим фактором в развитии заболевания. Так, в 60–70 %, а по некоторым данным в 90 % случаев, в ранах обнаруживаются анаэробные возбудители, однако инфекция развивается примерно у 2 % больных [29].
Определяющее значение в развитии инфекции имеют реактивность организма и степень местных нарушений в ране. Особенно важное значение имеют повреждение магистральных сосудов (риск развития инфекции возрастает в 15–20 раз), поражение костей и наличие в ране некротизированных тканей и инородных тел.
Для острых гнойных ран характерно то, что на всех этапах обследования основными представителями раневой микрофлоры являются стафилококки, которые выделяются как в монокультурах, так и в различных микробных ассоциациях. Кроме стафилококков, с большой частотой высеваются различные грамотрицательные бактерии, особенно синегнойные палочки, а также грамположительные стрептококки.
У больных, оперированных по поводу хронических гнойных заболеваний, раневая микрофлора носит полимикробный характер и представлена ассоциациями стафилококков, стрептококков и синегнойных палочек.
Необходимо отметить, что уровень обсемененности операционных ран служит информативным показателем качества хирургической обработки раны и коррелирует с местными и общими признаками воспаления, а также с процессом заживления раны.
В повседневной практике врач может встретиться с таким течением раневого процесса, которое резко отличается от описанных вариантов местными изменениями в ране и общим проявлением, обусловленным видом возбудителя раневой инфекции.
К таким особым видам раневой инфекции относится клостридиальная раневая инфекция (газовая гангрена).
Наибольшее распространение клостридиальная инфекция имеет во время боевых действий, однако и в мирное время она встречается у больных с обширными размозженными ранами, сопровождающимися повреждением сосудов и костей, а также в хирургических и гинекологических отделениях у больных, перенесших операции на органах брюшной полости или имеющих пролежни.
Причиной клостридиальной инфекции в мирное время может быть нарушение правил асептики и антисептики при проведении хирургических манипуляций.
Раневой воспалительный процесс может быть вызван неспоробразующими анаэробами, при этом инфекция может локализоваться в подкожно-жировой клетчатке, фасциях, мышцах или поражать одновременно все эти образования, что и наблюдается наиболее часто.
Летальность при неклостридиальной инфекции согласно литературным данным составляет 48–60 %.
Тяжелое инфекционное поражение раневых поверхностей представляет собой гнилостная инфекция. Чаще всего гнилостной инфекцией осложняются травматические раны с большим количеством размозженных тканей, мочевые флегмоны, диабетические гангрены, раны с повреждением толстой кишки, раны от укусов.
Возбудители гнилостной инфекции: В.coli, petrificum, B.pyocyaneus, B.sporogenes, Str.fecalis, Pr.vulgaris,emphysematicus и др.
Диагностика гнилостной инфекции затруднена ее значительным сходством с анаэробной неклостридиальной инфекцией. Общие клинические признаки этих инфекций: поражения кожи и клетчатки, характер экссудата, выраженная интоксикация и решающий эффект радикального хирургического вмешательства.
В ряде случаев возможно инфицирование поврежденной ткани возбудителем столбняка – Cl. tetani – строго анаэробным, спорообразующим грамположительным подвижным микробом. Особенно высока степень инфицированности ран в условиях военного времени, однако и в мирное время летальность от столбняка составляет 25–50 % среди больных молодого возраста и 70–80 % – среди лиц пожилого возраста [12, 13].
К особому виду возбудителей инфекции относится ?-гемолитический стрептококк группы А, вызывающий развитие рожистого воспаления кожи и слизистых, часто принимающего рецидивирующий характер. Хронический специфический воспалительный процесс, сопровождающийся образованием множественных плотных инфильтратов, может быть вызван возбудителем актиномикоза – широко распространенного в природе лучистого грибка Actinomyces bovis. В зависимости от механизма заражения актиномикоз развивается в различных органах и тканях (лицевая область, шея, легкие, кишечник и др.).
Спорообразующий микроб B.antracis является возбудителем особого вида инфекции – сибирской язвы. В последнее время заболевание наблюдается, в основном, в сельской местности в виде спорадических случаев.
У человека поражение кожи при сибирской язве встречается в 93–99 % случаев, хотя могут быть и другие формы патологии (легочная, кишечная).
Для хирургов наибольший интерес представляет карбункул, так как именно его чаще всего приходится дифференцировать от фурункулеза или карбункула при банальной инфекции.
При попадании возбудителя Cоrynebacterium diphtheriae на имеющуюся раневую или язвенную поверхность развивается дифтерия раны. Наиболее часто такое осложнение воспалительного процесса возникает в детском возрасте. Клинически распознать дифтерию ран трудно, поэтому для уточнения диагноза проводят микроскопическое исследование патологического материала с приготовлением препаратов, окрашенных по Нейссеру, Леффлеру.
Довольно редкой формой поражения раневой поверхности является туберкулез ран. Различают экзогенный и эндогенный пути попадания возбудителя в рану. Раневой процесс приобретает затяжной, вялотекущий характер, с частыми рецидивами.
В развитии хронического воспалительного процесса инфекционной природы нередко важная роль принадлежит сенсибилизации организма, образованию аллергических антител, активации Т-системы лимфоцитов [11, 60].
Воспалительный процесс может носить первичный характер и возникать в месте действия альтерирующего фактора.
В ряде случаев возможно вторичное развитие воспаления при аутоинтоксикациях (почечная недостаточность, печеночная недостаточность, кетоацидоз) и при различных экзоинтоксикациях бактериальной и небактериальной природы.
Септические инфекции характеризуются быстрой диссеминацией патогенных инфекционных факторов и развитием воспалительного процесса далеко за пределами первичной инокуляции возбудителя.
Вторичные воспалительные процессы различной локализации могут сопутствовать анемиям различной этиологии, сердечной недостаточности, дыхательной недостаточности, сопровождающимся развитием гипоксических состояний, нарушением трофики и регенерации тканей.
В ряде случаев воспаление имеет ятрогенную природу и может быть обусловлено применением лекарственных препаратов. Так, воспаление слизистой оболочки желудочно-кишечного тракта нередко возникает на фоне применения аспирина, резерпина, бутадиона и стероидных гормонов.
ВОЗБУДИТЕЛИ ГНОЙНО-ВОСПАЛИТЕЛЬНЫХ И РАНЕВЫХ ИНФЕКЦИЙ
Раневые и гнойные инфекции часто встречаются в хирургической, акушерско-гинекологической, терапевтической, педиатрической практике, а также других отраслях медицины. Нередко они носят характер внутрибольничной (госпитальной) инфекции. Возбудителями раневой и гнойной инфекции являются бактерии, которые относятся к разным семействам, родам и видам. Среди них известны аэробные и анаэробные, грам-положительные и грамотрицательные бактерии.
БАКТЕРИИ - ВОЗБУДИТЕЛИ РАНЕВОЙ И ГНОЙНОЙ ИНФЕКЦИИ
Chryseobacterium indologenes Chryseobacterium meningosepticum Enterococcus faecalis и другие виды Enterococcus Erysipelothrix rhusiopathiae Staphylococcus aureus Staphylococcus epidermidis Staphylococcus saprophiticus и другие виды Staphylococcus Streptococcus pyogenes Streptococcus agalactiae
Burkholderia cepacia Citrobacter koseri Edwardsiella tarda Eikenella corrodens Enterobacter spp. Escherichia coli Haemophilus influence Klebsiella spp. Listeria monocytogenes Moraxella catarrhalis Proteus vulgaris Proteus mirabilis Pseudomonas aeruginosa Pseudomonas putida Pseudomonas fluorescens Salmonella enterica
подвид enterica биовар typhimurium Serratia spp. Spirillum minus Streptobacillus moniliformis Vibrio vulnificus
Неспорообразующие грамотрицательные анаэробы
и другие виды рода Bacteroides
и другие виды рода Prevotella
Неспорообразующие грамположи-тельные анаэробы
Peptostreptococcus spp. Propionibacterium acnes
Спорообразующие грамположи-тельные анаэробы
Clostridium Clostridium Clostridium Clostridium Clostridium Clostridium Clostridium
Бактерии, перечисленные выше, вызывают гнойно-воспалительные процессы различной локализации, в том числе ангины, фурункулы, циститы и пиелиты, плевриты, перикардиты, сепсис и др. Многие из этих возбудителей встречаются в нормальной микрофлоре человека и проявляют свою патогенность только при нарушении нормальной экологии.
Стафилококки, стрептококки, протей, эшерихии и анаэробные бактерии нередко вызывают смешанную инфекцию как в разнообразных сочетаниях между собой, так и с другими микроорганизмами — вирусами, грибами.
Тема 12.1. Аэробные бактерии -возбудители гнойно-воспалительных заболеваний и раневых инфекций
Биологические свойства возбудителей гнойно-воспалительной и раневой инфекции, их патогенность, экология, особенности инфекции и эпидемиология вызываемых заболеваний.
Диагностические препараты, профилактические и лечебные препараты.
Рост а- и р-гемолитических стрептококков на кровяном агаре.
Рост и образование пигмента P.aeruginosa на агаре.
Диагностические и лечебно-профилактические препараты.
а Задание студентам
Микроскопировать и зарисовать мазки из чистых культур возбудителей гнойных инфекций: S.aureus, S.pyogenes, P.aeruginosa, E.coli, P.vulgaris. Окраска по методу Грама.
Микроскопировать и зарисовать мазки из гноя, содержащие возбудителей: стафилококков, стрептококков. Окраска по методу Грама.
Ознакомиться с питательными средами, применяемыми при микробиологической диагностике гнойных и раневых инфекций. Указать назначение отдельных питательных сред.
Микробиологическое исследование при раневых и гнойных инфекциях:
а) указать материал, подлежащий исследованию;
б) микроскопический метод: микроскопировать мазок из гноя, окраска по методу Грама. Сделать вывод;
в) наметить план дальнейшего исследования.
1. Микробиологическое исследование гноя:
а) учесть результат посева гноя на кровяной агар в чашке Петри, описать подозрительные колонии, отметить наличие гемолиза, составить план дальнейшего исследования;
б) учесть результаты определения лецитиназы и плазмокоагулазы у выделенной культуры стафилококка. Сделать вывод;
в) учесть результаты определения чувствительности культуры стафилококка к антибиотикам. Сделать вывод.
Микробиологическое исследование мочи. Определить количество бактерий в 1 мл мочи по результатам метода секторных посевов. Дать заключение.
Серодиагностика ревматизма. Ознакомиться с описанием стрептолизиновой реакции. Внести в протокол результаты определения анти-0-стрептолизина в сыворотке крови больного. Сделать вывод.
Дать краткую характеристику демонстрируемым антимикробным, диагностическим и лечебно-профилактическим препаратам.
Материал для исследования: раневое отделяемое, гной, экссудат, моча, мазки со слизистых оболочек (носоглотки, зева и др.), кровь при подозрении на сепсис.
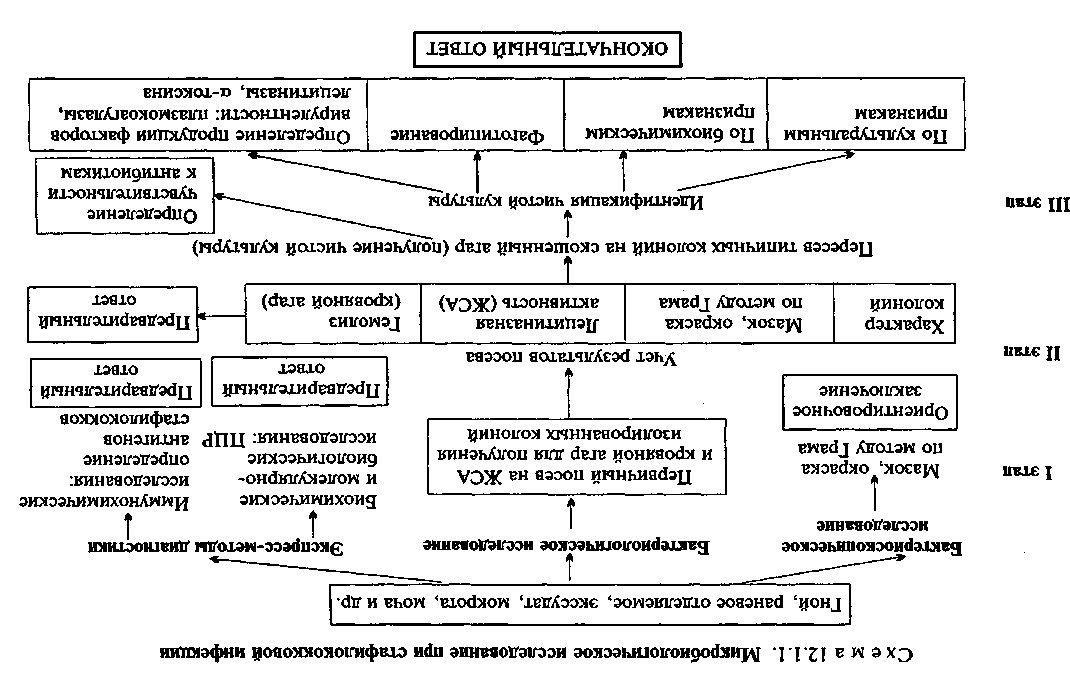
• Микробиологическая диагностика стафилококковых инфекций
Бактериоскопическое исследование (схема 12.1.1). Из исследуемого материала (за исключением крови) готовят мазки для первичной бактериоскопии, окрашивают по методу Грама и микроскопируют. Наличие в препаратах грамположителькых кокков, располагающихся в виде гроздевидных скоплений (рис. 12.1.1; на вклейке), позволяет поставить предварительный диагноз стафилококковой инфекции. Следует иметь в виду, что в патологическом материале стрептококки редко образуют типичные скопления, чаще располагаются поодиночке или небольшими группами по 2—3 бактерии.
Бактериологическое исследование. Испытуемый материал засевают петлей на чашки с кровяным и желточно-солевым агаром
S.aureus S.epider- S.sapro-midis phyticus
Образование: плазмокоагулазы + — — лецитиназы + — — альфа-токсина + — — Ферментация: глюкозы + + — маннита в анаэробных условиях + — + Чувствительность к новобиоцину S S R
Определение чувствительности стафилококка к антибиотикам — см. тему 7.2.
Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования.
Иммунохимические исследования. Основаны на обнаружении антигенов (токсинов и ферментов) возбудителя в материале от больного с помощью чувствительных серологических реакций.
Биохимические и молекулярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР. В случае обнаружения соответствующих молекул можно поставить предварительный диагноз.
• Микробиологическая диагностика стрептококковых инфекций (схема 12.1.2)
Бактериоскопическое исследование. Мазки для первичной бактериоскопии готовят из патологического материала (за исключением крови), окрашивают по методу Грама и микроско-пируют. При положительном результате обнаруживают цепочки грамположительных кокков (см. рис. 12.1.1). Следует иметь в виду, что в патологическом материале стрептококки редко образуют типичные скопления, чаще располагаются поодиночке или небольшими группами по 2—3 бактерии.
Бактериологическое исследование. Исследуемый материал засевают на кровяной агар в чашку Петри. После инкубации при 37 "С в течение 24 ч отмечают характер колоний и наличие вокруг них зон гемолиза. Из части материала, взятого из колоний, готовят мазок, окрашивают по методу Грама и микро-скопируют. Для получения чистой культуры 1—3 подозрительные колонии пересевают в пробирки со скошенным кровяным агаром и сахарным бульоном. На кровяном агаре Streptococcus pyogenes образует мелкие, величиной с булавочную головку, мутноватые круглые колонии. В бульоне стрептококк в отличие от стафилококка дает придонно-пристеночный рост в виде хлопьев или зерен, оставляя среду прозрачной.
По характеру гемолиза на кровяном агаре стрептококки делятся на три группы: 1) негемолитические; 2) ссргемолити-ческие, или зеленящие, образующие зеленоватую зону частичного гемолиза; 3) р-гемолитические, образующие вокруг колонии полностью прозрачную зону гемолиза.
Заключительным этапом бактериологического исследования является идентификация выделенной культуры по антигенным свойствам (табл. 12.1.2). Серогруппу стрептококков определяют в реакции преципитации с экстрактом из исследуемой культуры (полисахаридным преципитиногеном С) и группоспецифи-
Вид Рост при Рост на средах, содержащих желчь (40%)
10 °С 45 "С метиленовый хлорид натрия синий (0,1%) (6,5%)
S.pyogenes — — — — — S.pneumoniae — + ± — — S.sanguis — ± — — + S.salivarius — + — — —
Вид Рост Термоустойчи- Образование раствори- Антиген- при вость при 60 "С мого гемолизина ная груп- рН в течение 1 па (серо- 9,6 30 мин О S группа)
S.pyogenes — — -f + A S.pneumoniae — — + — — S.sanguis ± H(— ) S.salivarius — — — — —(К)

1:50, 1:250, 1:1000. Диагностический препарат О-стрептолизина также разводят буфером и применяют в количестве 0,3 мл, в котором содержится 1 рабочая доза О-стрептолизина. Рабочая доза — количество О-стрептолизина, которое почти полностью нейтрализуется половиной международной единицы анти-О-стрептолизина стандарта ГИСК. О-стрептолизин в рабочей дозе должен вызывать полный лизис 0,2 мл 5 % взвеси эритроцитов. Разведенную сыворотку и другие ингредиенты разливают по пробиркам так, как указано в табл. 12.1.3, и инкубируют. После инкубации отмечают последнюю пробирку, в которой сыворотка еще нейтрализует рабочую дозу О-стрептолизина (гемолиз отсутствует). Титр сыворотки выражают числом единиц анти-О-стрептолизина в 1 мл (АЕ St-O в 1 мл). В табл. 12.1.3 приведено число АЕ St-O в 1 мл сыворотки при нейтрализации О-стрептолизина различными разведениями сыворотки. Титр анти-О-стрептолизина до 250 АЕ St-O обнаруживается у практически здоровых людей. При ревматизме с первых дней болезни антитела к О-стрептолизину выявляются в высоких титрах — 500 АЕ St-O и выше.
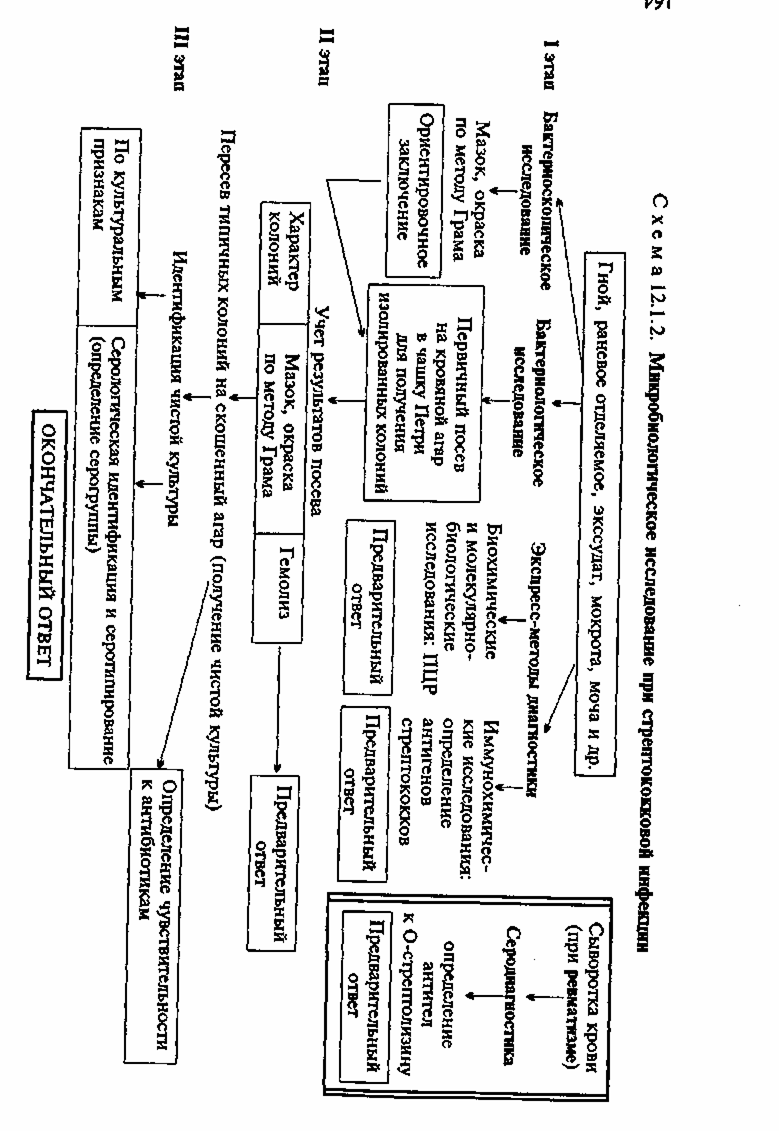
• Микробиологическая диагностика гнойно-воспалительных заболеваний, вызванных грамотрицательными аэробными бактериями
Бактериоскопическое исследование. Из исследуемого материала (гной, раневое отделяемое, участки ожоговой ткани и др.) готовят мазки, окрашивают по методу Грама и микроско-пируют. Обнаружение в мазках грамотрицательных бактерий позволяет сделать предварительное заключение.
Бактериологическое исследование. Для выделения культуры Pseudomonas aeruginosa исследуемый материал засевают в чашки Петри на основные (МПА) или селективные питательные среды (агар, содержащий цитилпиридиний хлорид, который угнетает рост сопутствующей микрофлоры — ЦПХ-агар). Посевы инкубируют при 37 °С в течение суток. P.aeruginosa образуют круглые плоские слизистые колонии, окрашивая среду характерным сине-зеленым пигментом. При бактериоскопии темнопольным методом нативных препаратов, приготовленных из колоний, в "раздавленной" или "висячей" капле обнаруживают подвижные и слегка изогнутые палочки; в мазках, окрашенных по методу Грама, — грамотрицательные палочки. Чистые культуры P. aeruginosa идентифицируют по биохимическим признакам и образованию пигмента.
Для эпидемиологического анализа госпитальных инфекций определяют серовары в реакции агглютинации, пиоциновары и фаговары.
Для выделения энтеробактерий исследуемый материал засевают на одну из дифференциально-диагностических сред, например на среду Эндо (см. тему 3.1). Для выделения бактерий рода Proteus используют метод Шукевича (см. тему 3.1).
Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования. Иммунохимические исследования. Патогенные штаммы P.aerugi-nosa выделяют различные растворимые белковые (экзотоксины и экзоферменты) и небелковые (экстрацеллюлярная слизь) антигены, которые могут быть обнаружены в материале от пациента (из очага, в крови или моче) с помощью чувствительных серологических реакций (ИФА и др.).
Биохимические и молекулярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР. В случае обнаружения соответствующих молекул можно поставить предварительный диагноз.
• Микробиологическая диагностика сепсиса
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: кровь; при септико-пиемиях исследуют также материал из первичных и вторичных местных очагов инфекции. Кровь берут в период подъема температуры до начала антибиотикотерапии из локтевой вены в количестве не менее 10 мл у взрослых и 5 мл у детей, так как микроорганизмы находятся в крови в сравнительно небольших количествах. Посевы делают у постели больного в колбы с 50—100 мл питательной среды. Сравнительно большие объемы питательной среды (в 10 раз превышающие количество крови) необходимы для устранения бактерицидного действия сывороточных белков.
В случае необходимости транспортировки крови к ней добавляют антикоагулянты: цитрат или оксалат натрия, декстран сульфат, гепарин. В качестве добавки к среде для выделения бактерий из крови используют полианетолсульфонат натрия, являющийся антикоагулянтом и одновременно угнетающий бактерицидную активность сыворотки, фагоцитоз, инактиви-рующий комплемент и нейтрализующий лизоцим.
Бактериологическое исследование. Является ведущим при лабораторной диагностике сепсиса. Посевы производят на жидкие среды обогащения: сахарный бульон и др.; при подозрении на анаэробную флору — на тиогликолевую среду, среду Китта—-Тароцци или другие элективные среды для анаэробов (см. тему 3.1) и инкубируют их при 37 °С в течение 10 дней при ежедневном контроле. В случае отсутствия роста микроорганизмов дают отрицательный ответ. При наличии роста делают мазки, которые окрашивают по методу Грама. Выделенную чистую
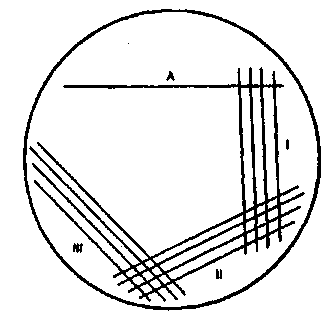
Число колоний в секторах Количество 1 1 1 бактерий А I II III в 1 мл мочи
1—6 — — — Менее 10 3 8-20 - - - 3-Ю 3 20-30 - - - 5-Ю 3 30-60 - - - 10 4 70-80 - - - 5-1 0 4 100-150 5-10 - - 10 5 Несосчитываемое 20—30 — — 5-Ю 5 Несосчитываемое 40—60 — — 10 6 ^сосчитываемое 100—140 10—20 — 5-1 0 6 Несосчитываемое Несосчи- 30—40 — 10 7 тываемое
Несосчитываемое То же 60—80 Единичные 10 8 колонии
Иммуноглобулин человеческий противостафилококковый.
Гамма-глобулиновая фракция сыворотки крови, содержащая стафилококковый антитоксин. Готовят из крови животных или людей, иммунизированных стафилококковым адсорбированным анатоксином. Применяют для специфического лечения при стафилококковых заболеваниях.
Стафилококковый бактериофаг (жидкий). Фильтрат фаголи-зата стафилококков. Применяют наружно, внутрикожно, внутримышечно для лечения при стафилококковых заболеваниях.
Диагностические стафилококковые фаги. Набор типоспеци-фических фагов для фаготипирования стафилококков.
О-стрептолизин сухой. Лиофильно высушенный фильтрат бульонной культуры стрептококка — активного продуцента О-стрептолизина. Применяют для серодиагностики — определения антител к О-стрептолизину в сыворотках крови больных стрептококковыми инфекциями (чаще ревматизмом).
Антибиотики. Грамположительные бактерии — р-лак-тамные антибиотики, ванкомицин, тетрациклины, аминогли-козиды, макролиды, линкомицины, сульфаниламиды, фторхи-нолоны и др.
Грамотрицательные бактерии — р-лактамы, спектр действия которых сдвинут в сторону грамотрицательных микроорганизмов, хлорамфеникол, аминогликозиды, тетрациклины, сульфаниламиды, фторхинолоны и др.
Биоматериал: Мазок-верхние дыхательные пути
Срок выполнения (в лаборатории): 2-4 р.д. *
Описание
Анаэробные бактерии - микроорганизмы, использующие кислород в минимальных количествах для своей жизнедеятельности.
Выделяют эндогенные и экзогенные анаэробные микроорганизмы. Эндогенные анаэробы являются составной частью нормальной микрофлоры человека и обнаруживаются главным образом в кишечнике, органах мочеполовой системы. Их можно также выявить на поверхности кожи, слизистых оболочек, в отделяемом из дыхательных путей. Экзогенные анаэробы обнаруживаются в почве, разлагающихся органических соединениях, на одежде человека.
Анаэробная инфекция - заболевание (осложнение), вызываемое анаэробными возбудителями. Характеризуется быстро возникающим и прогрессирующим некрозом тканей с образованием в них газов и отсутствием выраженных воспалительных явлений, тяжелой общей интоксикацией. Традиционно под А. и. понимают раневую инфекцию, однако анаэробы могут вызывать также поражение различных органов.
Различают две группы микроорганизмов - возбудителей анаэробной инфекции. К первой группе относят спорообразующие анаэробы, или клостридии (Clostridium perfringens, Cl. septicum, Cl. oedematiens и Cl. histolyticum). Раневая инфекция, вызванная этими микроорганизмами, часто обозначается как газовая гангрена либо газовая флегмона. Вторая группа - неспорообразующие, или неклостридиальные, анаэробы, среди которых наиболее часто встречаются следующие анаэробные микробы: грамотрицательные палочки рода Bacteroides и Fusobacterium, грамположительные кокки рода Peptococcus и Peptostreptococcus, грамположительные неспорообразующие палочки. Неспорообразующие анаэробные бактерии входят в состав нормальной микрофлоры слизистых оболочек у человека и животных. Основные резервуары этих бактерий находятся в ротовой полости, в желудочно-кишечном тракте, на коже и в женских половых путях.
К наиболее частым анаэробным инфекциям центральной нервной системы относятся абсцесс мозга и субдуральная эмпиема. Анаэробы вызывают плевролегочные заболевания, например аспирационную и некротизирующую пневмонию, абсцессы или эмпиемы. Точно также анаэробы играют важную роль в развитии внутрибрюшных процессов, таких как перитонит, абсцессы, печеночные абсцессы. Их часто обнаруживают при инфекционных заболеваниях женских половых органов: сальпингитах, пельвиоперитонитах, тубоовариальных (трубно-яичниковые) и вульвовагинальных абсцессах, септических абортах и эндометритах. Анаэробные бактерии часто выделяют при инфекциях кожи, мягких тканей, костей, а также бактериемии.
Традиционно анаэробную инфекцию ассоциируют с клостридиальными (спорообразующими) микроорганизмами. Однако удельный вес этих микроорганизмов в общем спектре возбудителей анаэробной инфекции невелик и составляет около 5 % среди патогенных анаэробов. Неклостридиальные анаэробы встречаются значительно чаще.
Раневая инфекция, вызываемая клостридиями, имеет, как правило, экзогенное происхождение. Неклостридиальные анаэробы в большинстве случаев имеют эндогенную природу, являясь возбудителями гнойно-воспалительных процессов в организме.
Интерпретация результатов/Информация для специалистов
При подозрении на анаэробную инфекцию из всех проб биологического материала готовят мазки, окрашивают по Граму, и исследуют с целью определения микроорганизмов с типичной для анаэробов морфологией.
По отношению к окраске по Грамму все анаэробные бактерии разделяют на грамположительные и грамотрицательные. Среди грамположительных бактерий к наиболее частым возбудителям заболеваний у человека относятся: 1. спорообразующие бактерии рода Ciostridium - Cl. perfringens, Cl. septicum, Cl. oedematiens и Cl. histolyticum, Cl. chavoei, Cl. sporogenes, Cl. sordelii, Cl. fallax, Cl. difficile; 2. бактерии рода Peptostreptococcus (типовые представители P. magnus, P. asacchorolyticus) и Peptococcus (P. niger). Из грамотрицательных анаэробных бактерий основную роль играют представители рода Bacteroides (типовые представители B. fragilis, B. urealiticus), Porphyromjnas (типовой представитель P. asaccharolytica), Prevotella (типовой представитель P. melaninogenica), Fusobacterium (типовой представитель F. nucleatum), Mobiluncus (типовой представитель M. curtisii), Veillonella (типовой представитель V. parvula).
Из анаэробных грамположительных кокков, чаще всего вызывающих заболевания, следует отметить пептострептококки. Из грамотрицательных анаэробных бактерий основную роль играют представители семейства бактероидов, в том числе бактероиды, фузобактерии и пигментированные бактероиды. При наличии ассоциации анаэробов и анаэробов для установления ведущей роли микроорганизмов, важнейшее значение имеет получение чистой культуры с определением количества каждого вида микроорганизмов в пробах. В отношении выявления грамотрицательных анаэробов совпадение результатов микроскопии нативного мазка с результатами бактериологического посева составляет около 70 %.
Чувствительность к антибиотикам определяется при обнаружении этиологически значимого возбудителя. Идентификация микроорганизмов при бактериологических посевах осуществляется до вида. Количество препаратов, к которым определяется чувствительность, зависит от вида выделенного микроорганизма.
Обращаем ваше внимание на то что, день взятия биоматериалла в расчет продолжительности выполнения исследования не принимается. Остчет сроков выполнения исследования начинается следующим днем после забора биоматериала. Праздничные дни, воскресенье и суббота не считаются рабочими днями.
* На сайте указан максимально возможный срок выполнения исследования. Он отражает время выполнения исследования в лаборатории и не включает время на доставку биоматериала до лаборатории.
Приведенная информация носит справочный характер и не является публичной офертой. Для получения актуальной информации обратитесь в медицинский центр Исполнителя или call-центр.
Читайте также:


