Генерализованная вирусно-бактериальная инфекция что это
В настоящее время ясно, что первичный иммунодефицит — не столь уж редкое состояние. Однако, несмотря на достижения в области диагностики, более чем у 70% больных иммунодефицитные состояния (ИДС) не диагностируются, а их
В настоящее время ясно, что первичный иммунодефицит — не столь уж редкое состояние. Однако, несмотря на достижения в области диагностики, более чем у 70% больных иммунодефицитные состояния (ИДС) не диагностируются, а их типичными проявлениями являются тяжело протекающие бактериальные, вирусные и грибковые инфекции, аутоиммунные заболевания.
Ольга М., 4 года, жительница Сибирского ФО, находилась в отделении кишечных инфекций НИИ детских инфекций с 13.11.2000 по 01.12.2000, поступила по переводу из СПбНИИ фтизиопульмонологии с диагнозом сальмонеллезный сепсис с развитием синдрома диссеминированного внутрисосудистого свертывания крови (ДВС-синдрома) в тяжелом состоянии, но при неплохом самочувствии. Лихорадила в течение суток до 38,5 °С. Менингеальные симптомы отрицательные, грубой очаговой симптоматики нет. На коже нижних конечностей, ягодиц, промежности сливные геморрагические элементы. Лимфатические узлы задне- и переднешейные 1,5–2,0 см каменистой плотности неспаянные с кожей, пакеты лимфоузлов 5,0´3,5 см больше справа, подчелюстные 3,0´1,5 см, кожа не изменена, флюктуации нет. Границы относительной сердечной тупости не расширены. Частота сердечных сокращений 84–92 в минуту, тоны сердца приглушены, дыхательная аритмия, на верхушке и в точке Боткина мезосистолический шум, акцент II тона на легочной артерии, артериальное давление 90/50 мм рт. ст. Живот увеличен в объеме, мягкий, печень до 3,5 см из-под края реберной дуги, селезенка плотная до 2,5 см из-под края реберной дуги. Периферических отеков нет. Стул оформленный. Диурез адекватный.
Из анамнеза жизни известно, что родители девочки являются двоюродными братом и сестрой. Старший мальчик в этой семье родился здоровым, но перенес БЦЖ-сепсис на первом году жизни, на втором году — Candida-сепсис и погиб в 4 года от сепсиса, вызванного Salmonella dublin. При жизни у него подозревалось ИДС, но диагноз не установлен. Через два года родилась Оля М. от второй нормально протекавшей беременности, вторых срочных родов, с массой тела 3300 г. В родильном доме БЦЖ-вакцинация не проводилась, росла и развивалась в соответствии с возрастом, не болела, прививки не делались. В 1 год 10 месяцев девочке сделана БЦЖ-М-вакцинация в левое плечо, через 2 месяца развилось увеличение подмышечных лимфоузлов слева с абсцедированием. В НИИ фтизиопульмонологии произведено дренирование абсцесса и выделен вакцинный штамм Micobacterium bovis, диагностирована БЦЖ-инфекция регионарный лимфаденит, назначены туберкулостатические препараты, которые через 4 месяца привели к нормализации размеров лимфоузлов. Однако через 9 месяцев у девочки стали увеличиваться подчелюстные лимфоузлы слева. В 3 года вновь проведено обследование — рецидив туберкулезного процесса исключен, из крови выделена Salmonella dublin, проведен курс терапии Кефзолом, и ребенок с уменьшением в размерах лимфоузлов и отрицательным бактериологическим исследованием крови выписан с рекомендацией продолжить туберкулостатические препараты. Через 6 месяцев вновь значительно увеличились передне- и заднешейные лимфоузлы, отмечено появление петехиальных элементов на голенях, затем высыпания приняли сливной характер и распространились выше, присоединилась фебрильная лихорадка. В 3 года 10 месяцев девочка госпитализирована в НИИ фтизиопульмонологии, проведено оперативное вмешательство (26.10.2000) — удален переднешейный лимфоузел слева. При гистологическом исследовании обнаружена гиперплазия лимфоидной ткани, очаговый склероз и признаки хронического воспаления без черт специфичности, изменения по типу аллергического васкулита, предполагаемые диагнозы БЦЖ-ита, лимфогранулематоза и гистиоцитоза были отвергнуты. При бактериологическом исследовании лимфоузла выделена Salmonella dublin, чувствительная к левомицетину, гентамицину, ципрофлоксацину, амикацину, цефазолину, ципрофлоксацину. В посеве крови 01.11.2000 рост Salmonella dublin. Получила Клафоран, амикацин, свежезамороженную плазму, эритроцитарную массу, кардиотрофики. На фоне проводимой терапии положительной динамики не достигнуто, и ребенок переведен в НИИ детских инфекций.
При поступлении в НИИ детских инфекций выраженная параклиническая активность — лейкоцитоз 12,5´109/л, нейтрофилез 66%, палочек 10%, тромбоцитопения 133´106/л, гипоальбуминемия 42%, гипергаммаглобулинемия 40%, гипопротромбинемия 60%, гипофибриногенемия 1,8 г/л, время свертывания крови по Ли-Уайту 18 минут, СОЭ 45 мм/час. Из фекалий выделена Salmonella dublin, посевы крови и мочи отрицательные. В РНГА (реакции непрямой гемагглютинации) с комплексным сальмонеллезным диагностикумом АВСДЕ титр антител 1/640, с группой D -1/1280. По данным ультразвукового исследования брюшной полости и забрюшинного пространства абсцессов и объемных образований в печени и селезенке не обнаружено, лоцировались увеличенные мезентериальные лимфоузлы.
При иммунологическом обследовании выявлено повышение показателей гуморального звена иммунного ответа (CD20+-лимфоцитов, циркулирующих иммунных комплексов (ЦИК)); высокий уровень CD8+-клеток и выраженная активация иммунной системы (увеличено число лимфоцитов, несущих маркеры CD25+, CD71+, CD95+). Данные изменения свидетельствовали об отсутствии ИДС по клеточному или гуморальному звену (табл. 1).
Таким образом, на основании анамнеза, лабораторных и гистологических данных (гранулематозный процесс без черт специфичности, гипергаммаглобулинемия), клинических данных и при отсутствии лабораторного подтверждения ИДС по гуморальному и/или клеточному типу был заподозрен первичный ИДС с дефектом фагоцитоза. Проведены тесты, характеризующие функциональную активность фагоцитирующих клеток (табл. 2), но к этому времени уже была начата иммуномодулирующая терапия, что не позволило выявить значимые нарушения в бактерицидной активности нейтрофилов.
Известно, что первичные дефекты фагоцитоза являются результатом дефицита нейтрофильных ферментов, к ним относят хроническую гранулематозную болезнь (ХГБ), миелопероксидазную недостаточность, недостаточность адгезии лейкоцитов, синдром Чедиака–Хигаси, недостаточность специфических гранул полиморфно-ядерных гранулоцитов. По клинической картине у ребенка складывалось впечатление о ХГБ, вероятно, с аутосомно-рецессивным типом наследования. ХГБ объединяет наследственные дефекты бактерицидности фагоцитирующих клеток, приводящие к гнойным инфекциям кожи, подкожной клетчатки, легких, лимфоузлов, печени, поражениям желудочно-кишечного тракта, с формированием обтурирующих гранулем, реже возникают септицемия, менингит, абсцессы мозга, инфекции мочеполового тракта. Существуют четыре генетических варианта ХГБ: Х-сцепленный, развивающийся вследствие мутаций гена GP91PHOX цитохрома b и три аутосомно-рецессивных (дефект GP22PHOX цитохрома b, дефект GP67PHOX цитозольного компонента NADPH-оксидазы и дефект GP47PHOX цитозольного компонента NADPH-оксидазы). Иммунопатогенез ХГБ связан с недостаточностью гексозомонофосфатного шунта в нейтрофилах и моноцитах. Все вышеуказанные молекулярные дефекты приводят к нарушению продукции перекисных радикалов в нейтрофилах и блокаде клеточного киллинга. Больные с ХГБ высоко восприимчивы к инфекциям, вызванным микроорганизмами, продуцирующими каталазу: стафилококку, эшерихиям, сальмонеллам, серрациям, грибам рода аспергилл, нокардий и кандида. Известно, что инфекции, обусловленные Salmonella dublin, встречаются исключительно у лиц с ИДС. После БЦЖ-вакцинации развивается регионарный БЦЖ-ит, а в тяжелых случаях БЦЖ-сепсис. Известно, что на первых этапах инфекции у больных могут протекать подостро и сопровождаться небольшим недомоганием. Формы с аутосомно-рецессивным типом наследования протекают несколько легче. Критериями диагноза ХГБ является значительное снижение продукции перекисных радикалов, при оценке с помощью люмино-зависимой хемилюминисценции и НСТ-теста (реакции восстановления растворимого желтого тетразолия в нерастворимый синий формазан при активации форболмиристат-ацетатом).
Таким образом, мы сформулировали клинический диагноз: первичный иммунодефицит: хроническая гранулематозная болезнь.
Осложнения:
Прогноз для жизни при ХГБ неблагоприятный, дети редко доживают до 10 лет. Антибиотики являются не только средством терапии, но и профилактики инфекций при ХГБ. Стандартом терапии является трансплантация костного мозга, но это проблематично, учитывая полную сохранность гуморального и клеточно-опосредованного иммунного ответа. Учитывая вышеперечисленное, ребенку были даны рекомендации по введению Полиоксидония в течение месяца в дозе 0,15 мг/кг каждые 72 часа, а далее 1 раз в 5–7 дней в сочетании с триметопримом-сульфаметоксазолом 3 раза в неделю постоянно. На фоне проводимой терапии у девочки в течение одного года не отмечалось инфекционных заболеваний. Затем Полиоксидоний был отменен, и вновь развилась генерализованная сальмонеллезная инфекция, которую удалось купировать массивной антимикробной терапией и Полиоксидонием парентерально. Во время этого эпизода диагноз хронической гранулематозной болезни был подтвержден лабораторно, и в последующие 5 лет дистанционного наблюдения ребенок находился на постоянном введении Полиоксидония.
Таким образом, отечественный иммуномодулятор и детоксикант Полиоксидоний может являться препаратом выбора для терапии ХГБ. Разработка схем назначения препарата требует проведения дальнейших исследований.
М. К. Бехтерева, О. В. Тихомирова, О. В. Волохова, Г. Ф. Железникова, О. И. Ныркова СПбГМПА, Санкт-Петербург
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.

Читайте в новом номере
Ежегодно в России регистрируется 27,3–41,2 млн случаев острых респираторных заболеваний (ОРЗ), при этом доля вируса гриппа как возбудителя ОРЗ составляла в первом XXI в. около 6,2–12,6%. Расходы на лечение гриппа и его осложнений в мире ежегодно составляют около 14,6 млрд долларов. В России экономические потери от гриппа в год оцениваются в 10 млрд руб. [1]. ОРЗ являются причиной смерти в 19% случаев у детей младше 5 лет, особенно в странах Африки, Латинской Америки. 20% медицинских консультаций у детей связаны с ОРЗ, в 30% случаев ОРЗ является причиной нетрудоспособности [10].
При респираторного тракта чаще высеваются Streptococcus (S.) pneumoniae, Staphylococcus (Staph.) aureus, Haemophilus (H.) influenzae, Moraxella (М.) catarrhalis или Neisseria catarrhalis [3, 4].
Природным резервуаром S. pneumoniae является носоглотка человека, возбудитель передается путем. Каждый ребенок инфицирован одним или несколькими штаммами S. pneumoniae и может быть переносчиком инфекции, особенно в первые годы жизни, в промышленно развитых странах — и в возрасте 6 мес. Чаще всего инфицирование не приводит к развитию клинических проявлений, а проходит бессимптомно. Клинические проявления начинаются при распространении инфекции из носоглотки в другие органы. Большинство инфекционных заболеваний возникает не после длительного носительства, а после инфицирования новыми серотипами, чувствительность организма зависит от состояния иммунной системы и вирулентности штамма возбудителя. Высокий уровень пневмококковых инфекций наблюдается у детей и пожилых людей, относящихся к группе риска по развитию иммунодефицита. Пневмококковая инфекция, по данным ВОЗ, приводит к смертельным исходам у 1,6 млн человек в год, при этом около 50% случаев составляют дети в возрасте от 0 до 5 лет. У 76% взрослых (0,5 млн случаев в год) и у 90% детей (70 тыс. случаев) пневмония вызывается пневмококковой инфекцией [2]. Особой тяжестью отличается пневмококковый менингит, частота которого составляет 8 на 100 тыс. детей до 5 лет. 30–40% острых средних отитов у детей вызывается пневмококком [2].
Большинство штаммов H. influenzae являются микроорганизмами. У новорожденных и маленьких детей H. influenzae типа В () вызывает бактериемию, пневмонию и острый бактериальный менингит. В ряде случаев развиваются воспаление подкожной клетчатки, остеомиелит, инфекционный артрит.
M. catarrhalis (или Neisseria catarrhalis) — грамотрицательная бактерия, вызывает инфекционные заболевания респираторного тракта, среднего уха, глаз, центральной нервной системы и суставов. M. catarrhalis относится к микроорганизмам, представляет угрозу для человека и персистирует в респираторном тракте. M. catarrhalis в 15–20% случаев вызывает острый средний отит у детей.
- до года — 4 и более эпизодов ОРЗ в год;
- до лет — 6 и более эпизодов ОРЗ в год;
- 4–5 лет — 5 и более эпизодов ОРЗ в год;
- старше 5 лет — 4 и более эпизодов ОРЗ в год.
Нами среди ЧБД выделена группа ЧБД с хроническими заболеваниями () [3].
- с заболеваниями рото- и носоглотки;
- с заболеваниями верхних дыхательных путей;
- с заболеваниями нижних дыхательных путей.
По данным , у ЧБД на слизистых происходит вытеснение сапрофитной флоры микроорганизмами, включая S. pneumoniae, Staph. аureus, H. influenzae. В контрольной группе в основном из носо- и ротоглотки высевались S. viridens — у 26%, S. mutans — у 23,3%, S. salivaricus — у 20% детей. У ЧБД эти возбудители высевались в 15,3; 16,6; 9,7% случаев. Доминирующими микроорганизмами являются Staph. aureus — 52,7%; S. pyogenes — 23,6%; Candida albicans — до 50% ЧБД. Повышается плотность заселения слизистых микроорганизмами: S. pneumoniaе — lg=3,5±0,97 КОЕ; H. influenzaе — lg=2,4±0,48 КОЕ; Staph. aureus — lg=3,5±0,87 КОЕ. Лишь 36,5% штаммов M. catarrhalis чувствительны к ампициллину. H. influenzaе была резистентна к ампициллину в 36,5% случаев. Разница представленных показателей была статистически достоверна. Смена сапрофитной флоры на , высевание Candida albicans, резистентность флоры к антибактериальной терапии затрудняют лечение и реабилитацию ЧБД [4, 5].
Микрофлора, высеваемая из зева ЧБД, представлена в таблице 1.
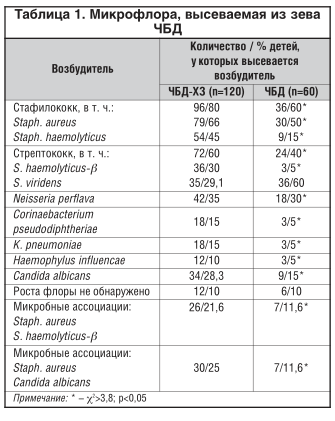
Обследовано и отобрано 60 ЧБД, согласно классификации , (1986) на основании частоты ОРЗ [13], и 120 с частотой ОРЗ 6 и более раз в год и хроническими заболеваниями носо- и ротоглотки. Было проведено сравнение персистенции флоры у ЧБД и . В мазках из зева монокультура выделена у 40% , 2 и более возбудителя — у 46,6%, Candida albicans — у 28,3%, сочетанная бактериальная и грибковая флора — у 25%. Количество возбудителей колебалось от 105хКОЕ до 108хКОЕ/мл. С уменьшением числа эпизодов ОРЗ уменьшаются частота и спектр высеваемых микроорганизмов. Сравнение частоты высеваемости Staph. haemolyticus и Staph. aureus, S. haemolyticus-β, Neisseria perflava в группах статистически достоверно (χ2>3,8; p 3,8; p Литература
- Зайцев А.А., Синопальников А.И. Грипп: диагностика и лечение // РМЖ. 2008. Т. 16. № 22. С. 1494–1502.
- Таточенко В.К., Озерецковский Н.А., Федоров А.М. Иммунопрофилактика – 2014. М.: ПедиатрЪ, 2014. 199 с.
- Маркова Т.П. Применение изопринозина для профилактики повторных респираторных инфекций у часто болеющих детей // Фарматека. 2009. № 6. С. 46–50.
- Хлынина Ю.О. Часто болеющие дети: микроэкологическое обоснование подходов к лечению и реабилитации: Автореф. дисс. … канд. мед. наук. Волгоград, 2012. 25 с.
- Хлынина Ю.О. Резидентное стафилококковое бактерионосительство в популяции человека, живущего в крупных промышленных городах // Вестник новых медицинских технологий. 2009. № 1. С. 43–45.
- Альбицкий В.Ю., Баранов А.А. Часто болеющие дети. Клинико-социальные аспекты, пути оздоровления. Саратов: Медицина, 1986.
- Mellioli J. Deciders in pulmonology (Принятие решений в пульмонологии) // Giorn. It. Mal. tor. 2002. Vol. 56 (4). Р. 245–268.
- Маркова Т. П., Чувиров Д. Г., Гаращенко Т.И. Механизм действия и эффективность бронхо-мунала в группе длительно и часто болеющих детей // Иммунология. 1999. № 6. С. 49–52.
- Maul J. Stimulation of immunoprotective mechanisms by OM-85 BV // Respiration. 1994. Vol. 61 (Suppl. 1). Р. 15.
- Del-Rio Navarro B.E., Espinosa-Rosales F.J., Flenady V., Sienra-Monge J.J.L. Immunostimulants for preventing respiratory tract infection in children (Review) // The Cochrane Collaboration. The Cochrane Library. 2011. Issue 6.
- Evans S.E., Tuvin M.J., Dickey B.F. Induciblе innate resistance of lung epithelium to infection // Ann. Rev. Physiol. 2010. Vol. 72. P. 413–435.
- Levy O. Innate immunity of the newborn: basic mechanisms and clinical correlates // Nat. Rev. Immunol. 2007. Vol. 7. P. 379–390.
- Заплатников А.Л., Гирина А.А., Бурцева Е.И. и соавт. Иммунопрофилактика гриппа и других острых респираторных вирусных инфекций в достижении контроля над течением бронхиальной астмы у детей // Педиатрия. 2013. Т. 92. № 1. С. 51–56.
- Olivieri D., Fiocchi A., Pregliasco F. et al. Safety and tolerability of ribosome-component immune modulator in adults and children // Allergy Asthma Proc. 2009. Vol. 30. Р. 33–36. doi: 10.2500/aap.2009.30.3247.
- Mora R., Dellepiane M., Crippa B. et al. Ribosomal therapy in the treatment acute adenoiditis // Eur.Arch.Otorhinolaryngol. 2010. Vol. 267. P. 1313–1318.
- Akikusa J.D., Kemps A.S. Clinical correlates of response to pneumococcal immunization // J.Paediatr. Child Health. 2001. Vol. 37 (4). Р. 382.
- Геппе Н.А. Рибосомальный комплекс в профилактике частых респираторных заболеваний у детей // Фарматека. 2013. № 1. С. 65–70.
- Fiocchi A., Omboni S., Mora R. et al. Efficacy and safety of ribosome-component immune modulator for preventing of recurrent respiratory infections in socialized children // Allergy Asthma Proc. 2012. Vol. 33 (2). P. 197–204.
- Сорока Н.Д. Особенности иммунотерапии затяжных и рецидивирующих болезней у детей // Педиатр. фармакология. 2008. Т. 5. № 5. С. 38–41.
- Алексеева А.А., Намазова-Баранова Л.С., Торшхоева Р.М. Рибосомальный комплекс в профилактике и лечении острых респираторных инфекций у детей // Вопр. совр. педиатрии. 2010. Т. 9. № 6. С. 127–130.
Только для зарегистрированных пользователей
Герпес-вирусная инфекция у женщин репродуктивного возраста и новорождённых остаётся актуальной проблемой. В США ежегодно 1,6 млн молодых женщин приобретают генитальный герпес, вызванный ВПГ II типа и более 2 % беременных отметили сероконверсию к этому же типу вируса в течение беременности. Именно будущая мать является основным источником инфекции у плода и новорождённого [6, 9].
Нами проводились систематические многолетние исследования герпетической инфекции у новорождённых, часть из которых можно было расценить как диссеминированную форму с одновременным наличием висцеральных и церебральных повреждений.
При отсутствии специфической терапии генерализованная герпетическая инфекция или тяжёлая нейроинфекция у новорождённых может привести в 80 % случаях к смерти, а при выживании последних у 50 % младенцев могут быть тяжёлые последствия: гемипарезы, судороги и др. [2, 8, 13, 15].
До ацикловиротерапии генитального герпеса у женщин частота этой формы инфекции была до 18-20 %; в последние 10 лет на фоне ацикловиротерапии она существенно снизилась и составила 1-3 % от всех больных с ВПГ инфекцией.
Проводился анализ состояния здоровья матерей, родивших новорождённых с герпес-вирусной инфекцией. В анамнезе матерей больных младенцев часто (в 85 % случаев) встречаются гинекологические заболевания: эндоцервицит, аднексит, реже сальпингоофорит. Акушерский анамнез этих матерей также был отягощён: наличие плацентита, кальцификаты в плаценте и плацентарная недостаточность (у 66 % матерей), ОРВИ, гипоксия, затяжные роды (у 60 %). Несомненно способствовали инфицированию и реализации инфекции у новорождённых у матерей наблюдаемых больных; в 38 % случаях имел место длительный безводный промежуток и в 12 % отмечена преждевременная отслойка плаценты. 56 % больных родились путём операции кесарева сечения, остальные – естественным путем. От преждевременных родов родилось лишь 23 % ребёнка; морфофункциональная незрелость, гипотрофия отмечены у 44 %.
Диагноз у матерей акушерами-гинекологами устанавливался на основании учёта эпиданамнеза, наличия активных проявлений (пузырьковых высыпаний на половых органах, на коже бёдер) и других клинических данных, наличие генитального герпеса в прошлом, наличие рецидивов во время данной беременности. Система диагностики соответствует Европейскому стандарту. Она основана на клинических критериях и результатах выявления специфических иммуноглобулиов IgG, IgM, наличия вирус-специфических антигенов в крови, ликворе, моче ребёнка и в крови и молоке матери (PCR).
Для дифференциации церебральных повреждений энцефалитов вирусной этиологии проводилась детекция противовирусных антигенов и противовирусных иммуноглобулинов в ликворе, при этом учитывался процесс накопления антител при повторных исследованиях. В качестве референс-антител исследовались антитела к антигенам ЦМВ 6.
Диагностические аспекты диссеминированных форм. В виду тяжести течения, быстрого и частого развития энцефалита к диагностике и лечению этой формы инфекции следует подходить как к выявлению острой нейроинфекции. В связи с тяжёлым течением и плохим прогнозом (в 50 % случаях) возникла необходимость быстрой диагностики и терапии. Появилось много сообщений в США о технологии диагностики [6, 12-14, 16]. Обобщая результаты этих исследований, следует остановиться на некоторых аспектах этой технологии, применяемой врачами в США:
Литература
1. Александровский А.В. Клинико-иммунологическая характеристика новорожденных с герпес-вирусной инфекцией. Автореф. дисс… канд. мед. наук. М.: 1996.
2. Володин Н.Н., Дементьева Г.М. Никонов А.П. и др. Профилактика, диагностика и лечение неонатального герпеса. Методические рекомендации // Ж. Российский вестник перинатологии и педиатрии. 2001; 3: 17-19.
3. Кудашов Н.И. Герпес-вирусная инфекция у новорожденных детей // Ж. Вопросы охраны материнства и детства. 1991. Т. 36. № 5. С. 3-8.
4. Кудашов Н.И., Озерова О.Е., Львов Н.Д. и др. Тяжёлые формы герпес-вирусной инфекции у новорожденных // Ж. Педиатрия. 1992; 1: 24-28.
5. Кудашов Н.И., Озерова О.Е., Орловская И.В. Неврологические проявления при герпес-вирусной инфекции у новорождённых // Ж. Педиатрия. 1997; 5: 42-45.
6. Кудашов Н.И., Орловская И.В. О клинике и диагностике герпетических повреждений мозга у новорождённых детей // Ж. Нейродиагностика и высокие медицинские технологии. 2006; 2: 43-46.
7. Орловская И.В. Диагностика внутриутробной герпес-вирусной инфекции с церебральными изменениями. Автореф. дисс… канд. мед. наук. М.: 1995.
8. Чандра В.Ш. Клинико-иммунологическая характеристика генерализованных (диссеминированных) форм герпетической инфекции у новорождённых. Автореф. дисс… канд. мед. наук, М.: 1994.
9. Brown L.A., Gardeella C., Wald A. et al. Genital Herpes Complicating Pregnancy // Obstet. Gynecol. 2005; 106: 845-856.
10. Chandra S.V., Kydashow N.I. Neonatal Herpetic infections: an update j. Singapore pediatrics society // 1994; 1-2: 29-35.
11. Diamond C., Mohan K., Hobson A. Viremia in neonatal herpes simples virus infections // Pediatr. Infect. Dis. J. 1999; 18: 487-489.
12. Gressens P., Langston C., Martin J.R. Insity PCR Localization of herpes DNA seguences in disseminated neonatal herpes encephalitis // J. Neuropathol. Exp. Neurol. 1994; 53: 469-482.
13. Kimberlin D.W. Herpes simplex virus, meningitis and encephalitis neonates // Herpes. 2004; 11: 65A-76A.
14. Kimberlin D.W. Neonatal herpes simplex infection // Clin. Microbiol. Rev. 2004; 17: 1-13.
15. Kimberlin D.W., Chin In.L., Jacob R.F. et al. Safety and efficacy of high-dose intravenous acyclovir in the management herpes implex virus infections // Pediatrics. 2001; 108: 230-238.
16. Kimberlin D.W., Lakeman F.D., Arvin A.M. et al. Application of the polymerase chain reaction to the diagnosis and management of neonatal herpes simplex virus disease // J. Infect. Dia. 1996; 174: 1162-1167.
17. Kohl S., Loo L.S., Rench M.S. et al. Effect of inravenously administered immune globulin on functional antibody to herpes simplex virus in low weight neonates // J. Pediatr. 1989; 115: 135-139.
18. Arvin A.M., Prober C.G. Herpes simplex virus type 2 a persistent problem // N. Engl. J. Med. 1997; 337: 1158-1159.
19. Langlet, Gaugler C., Gastaing M. et al. An uncommon case of disseminated neonatal herpes simplex infection presenting with pneumonia and pleural effusions // Eur. J. Pediatr. 2003; 162: 532-533.
20. Lee W.S., Kelly D.A., Tanner M.S. et al. Neonatal livertransplentation for fulminant hepatitis caused by herpes simplex virus typ 2 // J. Pediatr. Gastocnterol. Nutr. 2002; 35: 220-223.
21. Levin M.J., Weinberg A. Development of acyclovir-resistant staut herpes simplex virus early during the treatment of herpes neonatorum // Pediatr. Infect. Dis. J. 2001; 20: 1097-2001.
22. Malm G., Forsgren M. Neonatal herpes simplex virus infections. HSV DNA in cerospinal fluid and serum // Arch. Dis. Child Fetal Neonatal Ed. 1999; 81: F. 24. F. 29.
23. Prober C.G. et al. Neonatal antibody-dependent cellular cytotoxic antibody levels are associated with the clinical presentation of neonatal herpes simplex virus infection // J. Infect. Dis. 1989; 160: 770-776.
24. Prober C.G., Sullender W.M., Yasukawa L.L. Low risk of herpes simplex infections in neonates to the time of vaginal delivery to mother with recurrent genital herpes simplex virus infections // W. Engl. J. Med. 1987; 316: 240-244.
25. Troendle-Atksin J., Demmler G.J., Buffone G.J. Rapid diagnosis of herpes simplex virus encephalitis by using the polymerase chain reaction // J. Pediatrics. 1993; 123: 376-380.
26. Weil A.A., Glaser C.F., Amad L., Torghani D. Patients with suspected herpes simplex encephalitis rethinking an inicial negative polymerase chain reaction result // Clin. Infect. Dis. 2002; 34: 1154-1157.
27. Sullender W.M., Muller J.L., Yasukawa L.L. et al. Humoral and Cell-mediated immutity in neonates with herpes simplex virus infection // J. Inpest. Dis. 1987; 155: 28-37.
28. Whitley R., Arvin A., Prober C. et al. Predictors of morbidity and mortality in neonates with herpes simplex infections // N. Engl. J. Med. 1991; 324: 450-454.
29. Whitley R.J. Neonatal herpes simplex virus infections is there a role for immunoglobin in disease prevention and therapy? // Pediatr. Infect. Dis. J. 1994; 13: 432-438.
30. Whitley R.J., Kimberlin D. Infections in perinatology: antiviral therapy of neonatal herpes simplex virus infections // Clin. perinatol. 1997; 24: 267-283.
31. Whitley R.J., Kimberlin D.W. Infections in perinatology antiviral therapy of neonatal herpes simplex virus infections // Clin. perinatolo. 1997; 24: 267-283.
32. Whitley R.J., Lakeman F.D. Herpes simplex virus infections of the central nervous system: therapeutic and diagnostic considerations // Clin. Infect. Dis. 1995; 20: 414-420.
* Z. Broun – зав. кафедрой акушерства Вашингтонского университета, США
| Фарм. группы | Действующее вещество | Торговые названия |
| Ансамицины | Рифампицин* | Эремфат |
| БАДы витамины, витаминоподобные вещества и коферменты | Иммуно-Шилд ® | |
| Коэнзим Q10 с Гинкго | ||
| БАДы пробиотики и пребиотики | Бифидум-Мульти ® -1 | |
| Бифидум-Мульти ® -2 | ||
| Бифидум-Мульти ® -3 | ||
| Максилак ® | ||
| БАДы продукты растительного, животного или минерального происхождения | Бетула-Шарм | |
| Кэтс-Кло | ||
| Вакцины, сыворотки, фаги и анатоксины | Пиобактериофаг | Пиобактериофаг комплексный |
| Секстафаг ® Пиобактериофаг поливалентный | ||
| Витамины и витаминоподобные средства в комбинациях | Кокарбоксилаза + Рибофлавин + Тиоктовая кислота | Корилип-Нео |
| Глюкокортикостероиды | Гидрокортизон* | Гидрокортизон |
| Другие иммуномодуляторы | Анаферон | |
| Анаферон детский | ||
| Альфа-глутамил-триптофан | Тимоген ® | |
| Дезоксирибонуклеат натрия | Деринат ® | |
| Другие синтетические антибактериальные средства | Орнидазол* | Квинизол |
| Иммуноглобулины | Иммуноглобулин человека нормальный | Интраглобин |
| Привиджен | ||
| Иммуноглобулин человека нормальный [IgG+IgA+IgM] | Пентаглобин | |
| Индукторы интерферонов | Меглюмина акридонацетат | Циклоферон ® |
| Карбапенемы в комбинациях | Имипенем + Циластатин | Имипенем и Циластатин Спенсер |
| Линкозамиды | Линкомицин* | Линкомицина гидрохлорид в капсулах 0,25 г |
| Макролиды и азалиды | Рокситромицин* | ЭСПАРОКСИ ® |
| Общетонизирующие средства и адаптогены | Оксиэтиламмония метилфеноксиацетат | Трекрезан |
| Пенициллины в комбинациях | Амоксициллин + Клавулановая кислота | Амоксиклав ® |
| Амоксиклав ® Квиктаб | ||
| Средства, нормализующие микрофлору кишечника | Бифидобактерии бифидум | Бифидумбактерин сухой |
| Бифидумбактерин форте ® | ||
| Пробифор ® | ||
| Хинолоны/фторхинолоны | Ципрофлоксацин* | Ципродокс |
| Ципролет ® | ||
| Цефалоспорины | Цефтриаксон* | Цефтриаксон |
Все права защищены. Не разрешается коммерческое использование материалов. Информация предназначена для медицинских специалистов.
Читайте также:


