Что такое экспериментальная инфекция





2. Методы индикации при заражении лабораторных животных.
3. Методы идентификации вирусов при заражении лабораторных животных.
4. Список литературы.
и экспериментальная инфекция
Методы исследования, связанные с применением животных, называются биологическими, или экспериментальными, а используемые для этой цели животные – экспериментальными, или лабораторными. Наиболее широко в микробиологических лабораториях используют кроликов, морских свинок, белых мышей и крыс.
Лабораторные животные являются донорами, у которых систематически берут кровь для получения сыворотки, плазмы, эритроцитов, лейкоцитов, необходимых при постановке многих серологических реакций и для приготовления кровяных питательных сред. Лабораторные животные служат также для диагностики некоторых инфекционных заболеваний, моделирования экспериментальных острых и хронических инфекционных процессов, установления вирулентности и токсигенности изучаемых штаммов микробов, определения активности приготовленных вакцин и исследования их на безвредность.
Способы заражения лабораторных животных
В зависимости от цели исследования пользуются различными способами заражения: внутрикожным, подкожным, внутримышечным, внутрибрюшинным, внутривенным, пероральным или интраназальным. При перечисленных способах, за исключением перорального и интраназанального, заражение осуществляется с помощью шприца.
Техника взятия у лабораторных животных крови
и получение из нее отдельных ингредиентов
Небольшое количество крови получают у кроликов, морских свинок из вен уха, у мышей и крыс – из вен хвоста, а большие количества – из сердца. В особых случаях прибегают к полному или тотальному, обескровливанию, после которого животное погибает.
Выделение вирусов на лабораторных животных
В настоящее время лабораторные животные применяются сравнительно редко для выделения вирусов из инфекционного материала. Этот метод почти полностью заменен выделением вирусов в культурах клеток и развивающихся куриных эмбрионах, поскольку это более экономично, менее трудоемко и позволяет быстро учитывать результаты исследования.
МЕТОДЫ ИДЕНТИФИКАЦИИ ВИРУСОВ
Для индикации вирусов в инфекционном материале могут быть использованы следующие методы.
- Микроскопические: а) вирусоскопия; б) обнаружение внутриклеточных включений; в) метод иммунофлюорисценции.
- Биологические, включающие выделение вирусов: а) в культурах клеток;
б) в развивающихся куриных эмбрионах; в) на лабораторных животных.
- Методы гемагглютинации и гемадсорбции: а) реакция гемагглютинации;
б) реакция гемадсорбции.
Идентификация вирусов осуществляется с помощью серологических методов, включающих: а) реакцию торможения гемагглютинации; б) реакцию задержки гемадсорбции и нейтрализации с учетом результатов по гемадсорбции; в) реакцию связывания комплемента; г) реакцию нейтрализации; д) реакцию преципитации в теле; е) метод иммунофлюоресценции.
Микроскопические методы. Вирусоскопия. С помощью светового микроскопа могут быть обнаружены только крупные вирусы, размеры которых превышают 150 нм. Распознавание вирусов, имеющих меньшие размеры, возможно лишь в электронном микроскопе.
Для выявления крупных вирусов может применяться световая, фазово-контрастная и люминесцентная микроскопия. Наиболее часто используют световую микроскопию окрашенных мазков и отпечатков. Наилучшим методом окраски для выявления вирусов является серебрение по Морозову. Метод основан на осаждении частиц серебра, что приводит к увеличению размеров вирусов. Для окраски по Морозову готовят мазки и отпечатки из инфекционного материала, источником которого чаще всего служит содержимое кожных высыпаний, мокрота, носоглоточная слизь. Вирусы окрашиваются в темно-коричневый цвет и имеют вид однородных округлых образований, расположенных по одиночке или в виде скоплений на светло-коричневом фоне препарата.
Вирусоскопия является быстрым ориентировочным методом лабораторной диагностики вирусных заболеваний. Однако она не позволяет установить точную природу возбудителя, и для его идентификации необходимы другие методы исследования.
Введение
Микробные популяции отличаются своей многочисленностью, когда в одном биотопе находится одновременно миллиарды особей, составляющих генотипически и фенотипически неоднородную популяцию. В литературе неоднократно высказывалось мнение о том, что исходная гетерогенность популяций возбудителей по биологическим признакам оказывает существенное влияние на возникновение, течение и исход инфекционных заболеваний [4, 7, 9 и др.]. Работами ряда исследователей установлено, что микроорганизмы чувствительны к геомагнитному полю, очень тонко реагируют на любые изменения как магнитного поля в целом, так и его составляющих, что свидетельствует об их высокой и неодинаковой магниточувствительности [3, 6, 10]. В работах по изучению длительного воздействия магнитного поля повышенной напряженности, моделирующего аномальное геомагнитное поле региона Курской магнитной аномалии (уровень напряженности поля в 4-5 раз превышает фоновые значения для других регионов), было продемонстрировано, что характер изменения биологических свойств сальмонелл зависит от уровня напряженности магнитного поля [1]. В опубликованных нами результатах исследований показано, что развитие инфекционного процесса у лабораторных животных в условиях длительного непрерывного влияния магнитного поля повышенной напряженности сопровождается отбором клеток кишечной палочки, обладающих повышенной вирулентностью [5]. Поскольку инфекционный процесс представляет собой взаимодействие микроорганизма с макроорганизмом, то можно предположить, что воздействие на иммунную систему хозяина способно изменить направленность и характер отбора клеток в составе популяции возбудителя.
Цель исследования
Изучить изменения структуры популяции кишечной палочки при внутрибрюшинном заражении мышей, подвергнутых длительному воздействию магнитного поля повышенной напряженности, в условиях применения ликопида.
Материал и методы исследования
Для моделирования воздействия аномального геомагнитного поля региона Курской магнитной аномалии использовалась установка, состоящая из высокостабилизированного источника постоянного тока и колец Гельмгольца с радиусом 1,5 м. Внутри колец создавалось постоянное магнитное поле с индукцией 3х10 -4 Тл, вектор которого находился в суперпозиции с вертикальной составляющей вектора геомагнитного поля. Лабораторные животные (мыши CBAхC57BL6) помещались в магнитное поле за 2 недели до начала эксперимента с целью адаптации к условиям среды обитания. Экспериментальная инфекция воспроизводилась путем внутрибрюшинного введения животным взвеси суточной агаровой культуры Escherichiacoli в объеме 0,5 мл. С целью изучения влияния ликопида на биологические свойства кишечной палочки экспериментальным животным с 1-го дня заражения ежедневно внутрижелудочно через зонд 1 раз в день в первой половине дня вводили препарат в жидкой форме. Доза препарата рассчитывалась по стандартным схемам, описанным в рекомендациях, на единицу массы тела животного.
Вскрытие мышей производили спустя 1, 3, 7 и 14 суток после заражения после вывода из эксперимента путем дислокации шейных позвонков. После этого извлекали селезенку, которую взвешивали и гомогенизировали в асептических условиях с добавлением 1 мл изотонического раствора NaCl. Полученную суспензию и ее разведения 1:10 и 1:100 в количестве 0,1 мл высевали на чашки Петри со средой Эндо для выделения популяций кишечной палочки и определения обсемененности ткани почки. В дальнейшем у выросших культур E.coli определяли структуру популяций (100-150 клонов) по выраженности биологических свойств, связанных с вирулентностью и персистенцией. Для этого изучали гемолитическую, фибринолитическую, лизоцимную, антилизоцимную и антикомплементарную активности клонов популяции. Определение гемолитической активности проводилось на чашках с мясо-пептоннымагаром, содержащих 3 % взвеси эритроцитов барана. Изучение фибринолитической активности проводили по усовершенствованному методу Кристи [8]. Определение лизоцимной, антилизоцимной и антикомплементарной активностей проводили по О. В. Бухарину [2].
В качестве контроля использовали данные, полученные на животных, пребывавших при аномальных значениях магнитного поля и не получавших ликопид.
Статистическую обработку и анализ данных проводили с помощью пакета программ MicrosoftOfficeExcel 2007 для Windows 7.
Результаты исследования и их обсуждение
Изучение биологических свойств популяций кишечной палочки, выделенных от экспериментальных животных, показало, что в условиях воздействия аномального магнитного поля с развитием патологического процесса популяция возбудителя становилась более однородной по гемолитической активности - процент гемолитически активных клеток возрастал с 58,0±2,1 % в исходной культуре до 77,6±1,7 - 78,8±1,2 % на 7-14 сутки эксперимента (рис. 1). Достоверная разница в структуре популяций по фибринолитической активности по отношению к исходной культуре отмечалась уже на 7-е сутки инфекционного процесса. Что касается лизоцимной и антилизоцимной активности, то в динамике инфекционного процесса статистически значимых изменений их значений не зарегистрировано.
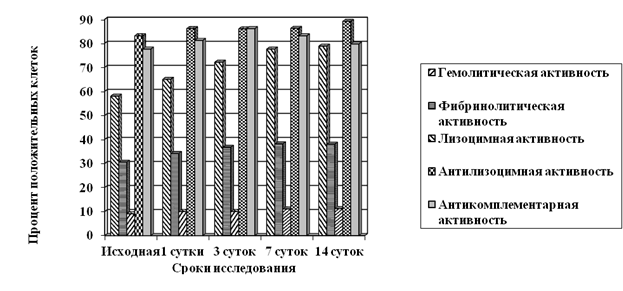
Рисунок 1. Структура популяций E. coli, выделенных от инфицированных мышей, находившихся в условиях аномального магнитного поля
Изучение микробной обсемененности ткани селезенки показало, что развитие инфекционного процесса в организме мышей в условиях воздействия аномального магнитного поля сопровождалось увеличением показателя к 7-м суткам и в дальнейшем статистически не изменялось (табл. 1).
Обсемененность селезенки мышей в динамике инфекционного процесса, вызванного кишечной палочкой
Условия проведения эксперимента
Обсемененность по срокам исследования, м.т./мг
Биологический метод (экспериментальный или биопроба) заключается в заражении исследуемым материалом чувствительных лабораторных животных или других биологических объектов (куриные эмбрионы, культуры клеток). Его используют для выделения чистой культуры возбудителя, определения типа токсина, активности антимикробных химиотерапевтических препа.
При проведении микробиологической диагностики инфекционных болезней в бактериологических и вирусологических лабораториях часто прибегают к заражению подопытных животных (биологический способ). Заражение животных проводят с целью выделения чистых культур патогенных микроорганизмов, которые медленно или совсем не растут на питательных средах. Часто этим способом пользуются для выделения возбудителя из исследуемого материала, который сильно загрязнен другими микробами (например, при выделении палочек чумы из трупов людей и животных). Так выделяют стрептококки с мокроты, туберкулезные палочки из осадка мочи и др.
Экспериментальное заражение животных используют также для воссоздания инфекционного заболевания на биологической модели тогда, когда возбудитель заболевания неизвестен, для изучения факторов вирулентности, действия токсинов, определения минимальных смертельных доз выделенных чистых культур. При его помощи изучают эффективность лечебного действия антибиотиков и других химиотерапевтическиех препаратов. Воссоздание экспериментальной инфекции имеет важное значение для оценки качества живых вакцин, эффективности иммунологических препаратов.
С этой целью чаще всего используют таких лабораторных животных, как кроликов, гвинейских свинок, белых крыс и мышей, реже - котов, собак, голубей, хомяков, мартышек. Заражение животных проводится или естественным путем через дыхательные пути и рот или искусственным способом через инъекции.
В медико-биологических исследованиях используется до 250 видов животных. Одни виды постоянно разводят в лабораториях и питомниках (лабораторные животные - белые мыши, белые крысы, морские свинки, кролики, хомяки, кошки, собаки, обезьяны, минисвиньи и др.); других периодически отлавливают для эксперимента (полевки, песчанки, суслики, хорьки, сурки, лемминги и др.). От общего числа лабораторных животных на долю белых мышей приходиться около 70% , белых крыс - 15% , морских свинок - 9% , кроликов - 2% . Эти животные чаще всего используются в целях диагностики заболевания, моделирования различных патологических состояний, изучения вопросов иммунологии, изготовления лечебно-профилактических препаратов, производства биологических препаратов - диагностических сывороток, вакцин, культур тканей и др. Лабораторные животные служат также донорами, от которых можно систематически брать кровь для приготовления кровяных питательных сред и проведения специальных исследований, связанных с использованием крови и ее ингредиентов: сыворотки, плазмы, эритроцитов, гранулоцитов, агранулоцитов и т.д. Кроме того, животные используются как доноры клеточных элементов выпотевающих в серозные полости.
К выполнению экспериментальных исследований на животных допускаются лица, имеющие высшее медицинское, медико-биологическое, фармацевтическое, ветеринарное, зоотехническое или биологическое образование, после того как они освоили правила обращения с лабораторными животными и приобрели практические навыки.
В настоящее время усилиями исследователей многих стран мира методом тесного инбридинга (внутри родственного скрещивания) удалось вывести более 200 линий мышей, свыше 20 линий крыс, 7 линий морских свинок, несколько линий кроликов. Среди диких животных чистых линий не существует. На выведение линий затрачивается не мене 8-10 лет тщательно выполняемой работы. Каждой линии присущи свои передающиеся по наследству особенности и свойства (повышенная или пониженная чувствительность к возбудителям инфекционных заболеваний, опухолям и т.д.). Линейные ( инбредные ) животные, подобно однояйцевым близнецам гомозиготны . Они ценны тем, что являются генетически однородными и отличаются от нелинейных животных постоянными реакциями на воздействие физиологических, химических и патогенных факторов.
Линейных животных получают методом непрерывного тесного инбридинга, то есть при спаривании близких родственников. С целью выведения определенной линии лабораторных мышей, крыс или других животных осуществляют братско-сестринское скрещивание на протяжении более 20 последовательных поколений и лишь тогда достигают 100% гомозиготности . Такие линейные животные являются генетически контролируемыми.
По рекомендации международного комитета по стандартизации генетической номенклатуры названия линий пишутся заглавными латинскими буквами. В заглавии линии заложено ее происхождение, год создания какой-либо особенности животных данной линии. Так среди белых мышей наиболее распространены A, CBA , BALB , BAJJ , C57BL , C57BR , C58, C3H .
Линейные лабораторные животные очень чувствительны к неблагоприятным факторам окружающей среды поэтому условия содержания их должны быть лучше, чем нелинейных животных.
Потомство линейных животных у которых в силу различных причин прекращено разведение методом инбридинга теряет линию, так как у них накапливаются мутации, а гомозиготность понижается. Уменьшение гомозиготоности при этом прогрессирует от поколения к поколению, а признаки, специфические для данной линии, могут быть потеряны, ослаблены или извращены.
Как линейные, так и нелинейные животные являются носителями возбудителей многих вирусных, бактериальных, грибковых заболеваний, которые затрудняют выполнение точных исследований. В процессе эксперимента, особенно длительного, присутствующие в организме животного возбудители могут активироваться и извратить характер реакции на испытуемый агент. В связи с этим возникла потребность получения лабораторных животных, лишенных микроорганизмов или имеющих в организме контролируемую микрофлору. Современная технология позволяет получать, выращивать и содержать в стерильных условиях в течение всей их жизни лабораторных животных, совершенно лишенных микроорганизмов, называемых гнотобиотами . Их получают от беременных самок, которым проводят кесарево сечение в определенный период перед родами. Новорожденных помещают на утепленные подстилки в клетки. Корм, воду, подстилку и другие материалы, необходимые для обеспечения жизнедеятельности безмикробных животных, подвергают стерилизации в автоклавах. В настоящее время в стерильных условиях в гнотобиотических изоляторах получены безмикробные мыши, крысы, морские свинки, хомячки, кролики, кошки, собаки, ягнята, козлята, поросята, обезьяны.
Подопытных животных следует подбирать однородными по возрасту, полу, массе и генетическим характеристикам. Отобранных животных необходимо тщательно осмотреть и выбраковать подозрительных или больных. Выбор вида, линии, возраста и пола животных диктуется целями исследований. Существует целый ряд маркировки лабораторных животных, основными из которых являются следующие:
-Татуировка ушей у животных, имеющие большие непигментированные ушные раковины (кролики, свинки, крысы, мыши). Для татуировки применяют тушь и специальные татуировочные щипцы.
-Мечение мышей и крыс нанесением краски, лучшими из которых считаются насыщенный раствор пикриновой кислоты, 0,5% раствор генцианвиолета , фуксин, эозин.
-Можно метить лабораторных животных, в том числе и новорожденных, с помощью колец, жетонов из мягкой белой жести, которые закрепляют на ушах или лапках.
Методы заражения лабораторных животных.
Наиболее широко лабораторные животные используются в бактериологической и вирусологической практике, как в целях диагностики, так и для воспроизведения экспериментальных инфекций. Применяют следующие методы заражения животных: накожный, внутрикожный, подкожный, внутримышечный, внутривенный, внутриполостной (брюшная полость, грудная, передняя камера глаза), внутриорганный (мозг, легкие), введение микроорганизмов в пищеварительный или дыхательный тракт.
Участок кожи, где происходит та или иная манипуляция, непосредственно перед ее выполнением или заранее, обрабатывают в такой последовательности:
-выщипывают или выстригают (выбривают) шерсть;
-удаляют остатки шерсти депилятором;
-дезинфицируют участок одним из способов (спиртом, спиртом в смеси с -эфиром 1:1, 10% настойкой йода).
1.Накожный метод. На кожу спины или живота, освобожденную от шерсти, наносят царапины скарификационной иглой. Материал берут стеклянной палочкой и втирают досуха.
2.Внутрикожный метод. Местом введения обычно выбирают кожу спины или живота. Шерсть на этом месте за два дня до опыта удаляют депилятором, сухой порошок которого разводят водой, накладывают образовавшуюся кашицу на кожу на время, указанное в наставлении к его применению. Используют очень тонкие и острые иглы с пологим скосом. Иглу вводят в кожу под очень острым углом скосом вверх. Инъецируют до 0,1 мл раствора. Образовавшееся вздутие не исчезает 3-5 минут.
6.Подкожный метод. Иглу шприца вводят в основание кожной складки предполагаемого места инъекции. После прокола кожи направление иглы меняют и медленно вводят жидкость - мышам не более 1,0 мл, морским свинкам и крысам - 1,5 мл, кроликам - 3,0 мл место введения обрабатывают. Следят за тем, чтобы введенный материал не вытекал наружу.
3.Внутримышечный метод. Лучшим местом введения считается участок с развитым мышечным слоем в области верхней трети задней лапы животного. острие иглы направляют почти перпендикулярно участку.
4.Внутривенный метод. Инъекцию производят в краевую вену уха кроликов, яремную вену морских свинок, хвостовую вену крыс или мышей. Обрабатывают кожу над веной. Для лучшего наполнения вены ее пережимают ниже будущего введения или кожу обогревают теплой (55 ° С) водой. Материал вводят медленно.
5.Внутрибрюшинный метод. Инъекцию производят в задней трети живота. Место введения обрабатывают до и после инъекции. Животное располагают вниз головой или в наклонном положении. Несколько отступив от средней линии, брюшную стенку прокалывают, вводят иглу под тупым углом к стенке. Игла должна быть с притупленным концом во избежание повреждения внутренних органов.
7.Оральный метод. Материал вводят принудительно с помощью тонкого эластичного зонда. Кроликов и морских свинок пеленают и располагают в положении, близком к вертикальному. Перед введением зонда животному вставляют роторасширитель с отверстием в середине; продвижение зонда по пищеводу обычно не вызывает затруднений, если его конец смазан вазелином, а у животного вызывают глотательные движения закапыванием в рот нескольких капель воды. Через воронку или шприц жидкость вливают в желудок.
Крыс или мышей помощник фиксирует в вертикальном положении. Жидкость можно вводить двумя способами: а) шприцем со специальной изогнутой иглой, конец которой утолщен в виде шарика с боковым отверстием; б) шприцем с обычной иглой, на которую насажен тонкий эластичный зонд. Животным открывают рот браншами пинцета. Процесс введения зонда требует навыков. Объем жидкости зависит от вида и возраста животного.
8.Интраназальный метод. Животное фиксируют. С помощью эфира или хло
Вскрытие трупа лабораторного животного.
Животные, которые подвергались в эксперименте воздействиям, поведшим за собой понижение жизнеспособности, подлежат умерщвлению гуманным методом ( эвтаназии ). Эвтаназия не должна выполняться в помещении, в котором находятся другие лабораторные животные. Умерщвление часто осуществляется путем декапитации с использованием специальных гильотин, путем передозировки наркотических веществ (эфира, хлороформа, барбитуратов ), электрическим током, воздушной эмболией - внутривенным введением воздуха, полным обескровливанием при использовании различных методов обезболивания.
Между смертью и вскрытием трупа животного должно проходить как можно меньше времени. Более целесообразно умерщвлять животное в агональный период. Труп кролика фиксируют на специальной доске за вытянутые лапы. Трупы морских свинок, крыс, мышей можно прикалывать старыми инъекционными иглами к парафиновой пластине в эмалированном лотке. Всю шерсть животного смачивают дезинфектантом (спирт, 5% карболовая кислота, 5% хлорамин). Кожу разрезают по средней линии живота от симфиза до подбородка. На уровне передних и задних лап делают боковые разрезы. Кожу отсепаровывают , отворачивают в стороны и прикалывают к пластине. Вскрытие начинают с грудной полости, вырезая грудину. Если в грудной полости есть экссудат, из него делают мазки и посев. Кровь из сердца забирают проколом пастеровской пипеткой с оттянутым капиллярным концом. Проводят осмотр органов грудной полости и при необходимости забирают из них кусочки ткани. Далее вскрывают брюшную полость. При наличии экссудата его засевают в питательную среду. Затем тщательно осматривают и исследуют органы полости. Взятие материала из паренхиматозных органов проводят следующим образом: поверхность органа прижигают нагретым в пламени спиртовки скальпелем соответствующего размера; прижженный участок органа прокалывают стерильной пастеровской пипеткой с оттянутым концом или стерильной петлей; взятый материал засевают.
Все этапы работы с лабораторными животными должны быть зарегистрированы в соответствующем журнале с графами:
Вид лабораторного животного.
Материал, примененный для заражения.
Изменение поведенческих реакций животного после заражения.

В общей структуре травматизма по данным ВОЗ ожоги занимают третье место в мире. Ежегодно в развитых странах регистрируется 290–300 ожогов на 100 тыс. населения. В Российской Федерации ежегодно около 500 тыс. населения получают ожоги, в том числе 29–46 % из них нуждаются в госпитализации [1, 2, 3], в 5–7 % случаев причиной гибели пациентов является патология головного мозга [4, 5]. Удельный вес детей, пострадавших от термической травмы, составляет 13,8–75,3 % с высоким процентом летальности [6, 7, 8, 9, 10, 11]. Одной из основных причин высокой летальности при ожоговой болезни является возникновение генерализованной инфекции с последующим развитием полиорганной недостаточности [12, 13, 14, 15].
В связи с развитием полиорганного патологического процесса, отсутствием единой тактики лечения инфекционных осложнений, возникающих при ожоговой болезни, возникает необходимость более детального изучения влияния патогенной и условно патогенной микрофлоры на развитие патологического процесса при ожоговой болезни и совершенствования методов лечения пациентов с тяжелой термической травмой.
1. В опытах на кроликах породы шиншилла выявить особенности течения инфекционного процесса, вызванного культивируемыми и некультивируемыми бактериями P. aeruginosa и S. aureus, на фоне ожоговой травмы, на основании клинических, микробиологических и гистологических исследований.
2. На модели экспериментальных животных, кроликов породы шиншилла, изучить влияние динамики транслокации культивируемых и некультивируемых бактерий на развитие инфекционного процесса.
3. Выявить особенности патологических изменений в организме лабораторных животных, вызванных культивируемыми и некультивируемыми бактериями на фоне ожоговой травмы.
Материалы и методы исследований
Динамику транслокации микробных популяций изучали в организме кроликов породы шиншилла. Под наблюдением находилось 2 группы животных по 16 кроликов в каждой группе. Одной группе животных на фоне ожоговой травмы вводили подкожно смесь культивируемых бактерий P. aeruginosa и S. aureus в концентрации 105 степени микробных клеток, а другой – некультивируемые бактерий P. aeruginosa и S.aureus в такой же концентрации. После предварительного наркоза по методике, предложенной А.В. Разиной [16], животным наносили термическую травму. Поверхность спины и боковые поверхности туловища кроликов погружали в водяную баню на 10 с при температуре 90 °С. Кролики получали ожоговую травму со степенью поражения IIIАБ. На ожоговой поверхности кроликов фиксировали перевязочный материал [17]. Средняя масса тела кроликов в исследуемых группах животных составила 2262,5 ± 28,4 и 2386,7 ± 48,5 грамм, а ожоговая поверхность – 15,98 ± 0,53 и 17,29 ± 0,4 % площади поверхности тела соответственно.
Для выявления преморбидного фона за кроликами до проведения опыта наблюдали в течение 21 дня. После карантина кроликов помещали в экспериментальные клетки собственной конструкции [21] и в течение 3 дней наблюдали за животными (процесс адаптации животных к новым клеткам). В виварии поддерживали температуру воздуха 24–26 °С в соответствии с приказом МЗ РФ № 267 от 19.06.2003 и требованиями Европейской конвенции (Страсбург, 1986) по содержанию, кормлению и уходу за подопытными животными, выводу их из эксперимента и последующей утилизации.
В период эксперимента за кроликами проводили наблюдение в течение 21 дня. У погибших животных проводили вскрытие и исследование следующих органов: почек, легких, печени и головного мозга. Определяли в органах концентрацию культивируемых бактерий. Из органов готовили гистологические срезы и определяли наличие патологических изменений в органах. Для гистологических исследований внутренние органы фиксировали в 10 % растворе нейтрального формалина. Гистологические срезы готовили методом заморозки и заливки в парафин. Гистологические препараты окрашивали гематоксилином и эозином, суданом III (выявление капель жира), по Pero, Бесту (выявление гранул гликогена), скопление фибрина определяли по методу Д.Д. Зербино.
Результаты исследования и их обсуждение
Анализ проведенных исследований показал, что наблюдались существенные отличия в сроках гибели животных после подкожного введения культивируемых и некультивируемых бактерий P. aeruginosa и S. aureus на фоне ожоговой травмы (рис. 1). Гибель животных после введения некультивируемых бактерий наблюдалась в период с 18 часов по 13 сутки и достигала 87,5 % от числа животных взятых в опыт. Четыре кролика погибло в течение 23-х часов. Через 56 часов погибало 62,5 % животных. После введения культивируемых бактерий гибель животных регистрировалась с 12 по 15 день после термической травмы. Погибало 75,0 % животных.
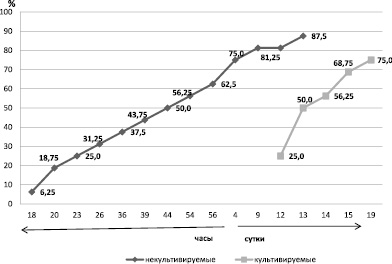
Рис. 1. Динамика гибели животных после подкожного введения культивируемых и некультивируемых бактерий S.aureus и P.aeruginosa на фоне ожоговой травмы
Микробиологические исследования внутренних органов животных показали, что у кроликов, погибших с 1 по 4 день после введения некультивируемых бактерий, инфекционный процесс был вызван культивируемыми бактериями P. aeruginosa. В печени кроликов, погибших в первый день инфекционного процесса, концентрация культивируемых P. aeruginosa составила 2,04 ± 0,3∙103 микробных клеток в 1 мл, а к 4-му дню болезни достигла 1,6 ± 0,06∙108 микробных клеток в 1 мл. Культивируемые бактерии S. aureus и E.coli в печени в течение первых суток выделить не удалось. Аналогичная тенденция увеличения концентрации P. aeruginosa отмечалась в легких и почках.
Микробиологические исследования внутренних органов животных после введения культивируемых бактерий P. aeruginosa и S. aureus на фоне ожоговой травмы показали, что в органах животных происходило увеличение концентрации P. aeruginosa в острой стадии ожоговой болезни.
У кроликов, погибших после подкожного введения культивируемых бактерий на фоне ожоговой травмы, температура тела повышалась за 4 дня до летального исхода до 39,8–40,7 °С, что характерно для развития инфекционного процесса.
Отмечались различия в типах температурных кривых у кроликов, инфицированных некультивируемыми бактериями на фоне термической травмы. У кроликов, погибших на 2–3 сутки, перед гибелью наблюдалось снижение температуры тела до 37,2–37,4 °С. Гибель кроликов в первые сутки (4 кролика) и снижение температуры тела кроликов перед гибелью характерно для шокового состояния. У кроликов, погибших на 4-е сутки, наблюдалась атипичная лихорадка с большими перепадами температуры в течение суток, достигающими 2–2,5 °С. Подобная динамика температурной кривой характерна для септических состояний. У животных, погибших на 11,0 ± 2,5 сутки, перед гибелью наблюдалось повышение температуры тела до 40,2–40,5 °С, что характерно для развития генерализованного инфекционного процесса.
Таким образом, температурная кривая у животных, инфицированных некультивируемыми бактериями, свидетельствует о различном патологическом процессе в организме животных в различные периоды ожоговой болезни.
Культивируемые бактерии на фоне ожоговой травмы вызывали клиническую симптоматику поражения желудочно-кишечного тракта на 12–15 день заболевания, а при введении некультивируемых бактерий в первые дни болезни у животных наблюдались симптомы поражения центральной нервной системы, в период с 4 дня болезни появилась клиническая симптоматика поражения желудочно-кишечного тракта.
При патологоанатомическом вскрытии животных, инфицированных некультивируемыми бактериями на фоне ожоговой травмы, отмечался отек головного мозга у 4 кроликов (28,6 %).
Клиническая симптоматика поражения головного мозга, развитие шокового состояния, гибель животных в течение первых двух суток и отек мозговой ткани при патологоанатомическом вскрытии согласуются с данными гистологических исследований. В гистологических срезах головного мозга погибших животных обнаружены признаки отека мягких мозговых оболочек, их утолщение, разрыхление волокнистых структур (рис. 2).
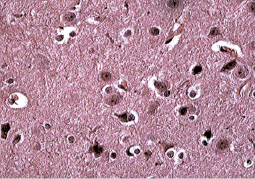
Рис. 2. Периваскулярный и перицеллюлярный отек головного мозга у кролика, погибшего после подкожного введения некультивируемых бактерий на фоне ожоговой травмы. Окр. ГЭ, х 40
В крупных оболочечных сосудах наблюдалось полнокровие, а в мелких – стаз. Наблюдался неравномерно выраженный перицеллюлярный отек мозговой ткани. В эндотелии сосудов наблюдались клетки с набухшими ядрами и со сморщиванием ядра вплоть до пикноза. Накапливались липиды в эндотелии сосудов и адвентициальных клетках. В отделах коры больших полушарий, мозжечка, в полосатом теле, ядрах зрительного бугра, субталамическом ядре Льюиса обнаружены различной формы некробиотические изменения нервных клеток. На рис. 2 видны дистрофически-дегенеративные изменения нервных клеток.
Анализ микробного пейзажа внутренних органов животных, инфицированных культивируемыми и некультивируемыми бактериями на фоне ожоговой травмы, согласуется с микробным пейзажем выделения культивируемых бактерий от больных с ожоговой болезнью. На ожоговой поверхности и в организме пациентов определялись условно-патогенные и патогенные бактерии, биопленкообразующие бактерии и их планктонная фракция, на поверхности ожоговой раны уже через 48 часов бактерии P. aeruginosa формировали биопленку [22, 23, 24, 25, 26].
В результате проведенных нами исследований установлено, что в различных стадиях инфекционного процесса в организме кроликов наблюдались изменения в соотношениях между количеством культивируемых и некультивируемых бактерий (рис. 3).
Непосредственно после введения некультивируемых бактерий при наличии благоприятных условий для размножения бактерий в организме кроликов происходил процесс перехода некультивируемых бактерий в культивируемое состояние. В остром периоде болезни в микробных популяциях преобладали культивируемые бактерии, а в период реконвалесценции происходило снижение в микробных популяциях концентрации культивируемых бактерий и увеличение количества некультивируемых бактерий.
В организме кроликов переход некультивируемых бактерий в культивируемое состояние происходил в течение 2–3 суток. В более поздний период наблюдался переход культивируемых бактерий в некультивируемое состояние под влиянием специфических и неспецифических защитных факторов макроорганизма. Бактерии теряли способность размножаться в различных биологических жидкостях животных. Формировалось определенное количество бактерий с признаками анабиоза.
На развитие патологических процессов в организме кроликов существенное влияние оказывала транслокация бактерий (рис. 4).
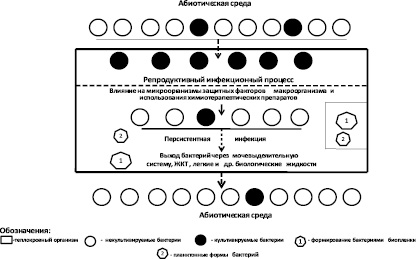
Рис. 3. Принципиальная схема изменчивости биопленкообразующих бактерий P. aeruginosa в организме кроликов породы шиншилла
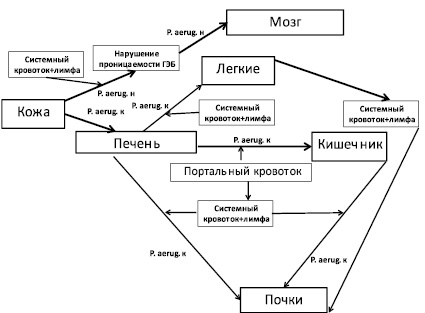
Рис. 4. Динамика транслокации P. aeruginosa в организме кроликов породы шиншилла после подкожного введения животным некультивируемых бактерий на фоне ожоговой травмы. Обозначения: P. aerug. н – некультивируемые бактерии P. aeruginosa; P. aerug. к – культивируемые бактерии P. aeruginosa
В течение первых двух суток некультивируемые бактерии P. aeruginosa из подкожных локусов при нарушении проницаемости гематоэнцефалитического барьера (ГЭБ) проникали в головной мозг животных.
Через 24–54 часа после подкожного введения некультивируемых бактерий P. aeruginosa лабораторным животным наблюдался переход их в культивируемое состояние и происходила транслокация культивируемых бактерий P. aeruginosa в печень из подкожных локусов. Из печени культивируемые бактерии P. aeruginosa проникали через портальный кровоток в легкие, почки и в кишечник.
Наличие культивируемых бактерий P. aeruginosa в выше перечисленных органах подтверждено результатами микробиологических исследований (табл. 1).
Динамика изменения концентрации культивируемых P. aeruginosa во внутренних органах животных, инфицированных некультивируемыми бактериями на фоне ожоговой травмы
Читайте также:


