Ассоциированные инфекции при туберкулезе
Считают, что ВИЧ, приводящий к дестабилизации иммунитета, является наиболее значимым из всех известных факторов, способствующих переходу туберкулоносительства в активный туберкулез [10,18]. Там, где сосуществуют туберкулез и ВИЧ-инфекция, риск развития активного туберкулеза измеряется в диапазоне от 5 до 15% в год, в то время как среди лиц, не инфицированных ВИЧ, вероятность прогрессирования заболевания составляет около 10% на протяжении жизни [29]. По-видимому, наибольшей опасности развития активного туберкулеза подвергаются те пациенты, которые ранее были инфицированы ВИЧ, а затем М. Tuberculosis (МБТ). Показано, что туберкулез может увеличивать скорость репликации ВИЧ, ускоряя таким образом наступление СПИДа [21].
У ВИЧ-инфицированных пациентов туберкулез возникает в числе первых оппортунистических инфекций, хотя может развиться на любой стадии ВИЧ-инфекции [3]. Туберкулёз, в определённой степени, можно рассматривать как своеобразный маркер, который на относительно ранней стадии позволяет заподозрить ВИЧ-инфекцию. Изучение особенностей течения туберкулёза у больных с ВИЧ-инфекцией показало, что на ранних стадиях ВИЧ-инфекции его проявления не имеют особенностей, а на поздних - структура форм туберкулёза и клинико-морфологические проявления существенно изменяются [5,23] У больных СПИДом туберкулёз прогрессирует мультифокально и часто экстрапульмонально [5]. Проявления СПИД, которые чаще развиваются через 7-8 лет после инфицирования, приводят к бурному прогрессированию туберкулёзного процесса и летальному исходу [7]. Тяжесть и продолжительность обострений туберкулёза определяются степенью нарушений клеточного иммунитета [4,11].
Клинические проявления туберкулеза также зависит от степени иммуносупрессии: при относительно высоком уровне CD4+ обычно отмечается легочный туберкулез [24]. В исследовании А. Saini (2004) показано, что у 66% ВИЧ-инфицированных пациентов доминировала атипичная клиническая картина туберкулёза лёгких [28]. По мере прогрессирования ВИЧ-инфекции возрастает вероятность развития лимфатической и серозной форм заболевания, менингита и диссеминированного туберкулеза, что в свою очередь нередко приводит к генерализации туберкулёза и смертельному исходу [8]. На фоне ВИЧ-инфекции могут возникать редкие локализации туберкулёза. Сообщается о трёх случаях церебрального туберкулёза у пациентов со СПИДом [32]. В Мексике зарегистрирован случай реактивации туберкулёза у больного СПИДом, единственным проявлением которой была язва языка [26].
Активный туберкулез, в сочетании с ВИЧ-инфекцией, имеет множество клинических проявлений и может скрываться под видом других заболеваний. Легочный туберкулез протекает с образованием каверн, инфильтратов в верхних долях, сопровождается пневмониями и фиброзными изменениями в легких [2]. Анализ форм туберкулёза у больных на поздних стадиях ВИЧ-инфекции показал, что в их структуре преобладали диссеминированные процессы и туберкулёз внутригрудных лимфатических узлов составляя суммарно 61,4%. У 36% больных на поздних стадиях ВИЧ-инфекции имела место генерализация туберкулёзного процесса. Изолированный внелёгочной туберкулёз зафиксирован в незначительном числе случаев 2,2% [5].
При анализе рентгенологической картины в лёгких установлено преимущественное поражение всего лёгкого или верхних долей. Однако в работе зарубежных авторов отмечается поражение нижних долей [24]. При значительном снижении количества CD4+лимфоцитов на рентгенограммах часто наблюдаются нетипичные
изменения. Так, A. Saini (2004) наблюдали доминирование диффузных очаговых теней, внутригрудных аденопатий, плевритов [28]. Причем нередко изменения в легких не удается обнаружить даже у больных, выделяющих МБТ с мокротой [11]. Полости распада на поздних стадиях ВИЧ-инфекции отмечаются нечасто [14], что связано с резким снижением эксудативно-пролиферативных процессов на фоне тяжелого иммунодефицита. Возможно, поэтому количество бактериовыделителей среди больных на поздних стадиях ВИЧ-инфекции составляет всего 18%. Диагноз туберкулёза может быть затруднен у больных со СПИД, в связи с тем, что вместо верхнедолевых полостных инфильтратов, типичных для реактивации болезни, у них могут выявляться признаки, более свойственные первичному туберкулёзу с внутригрудной лимфаденопатией, нижнедолевыми инфильтратами, плевральным выпотом или даже нормальной рентгенографической картиной [2, 24, 28]. Обычно у таких больных есть симптомы: кашель, утомляемость, потеря веса, ночные поты. Установлено также, что туберкулёз является наиболее частой причиной длительной лихорадки у ВИЧ-инфицированных [27]. При легочном туберкулёзе с множественной лекарственной устойчивостью также зафиксировано утяжеление клинической картины, характеризующееся двусторонним поражением с образованием каверн, плевральными повреждениями, распостраненностью и быстрой прогресией туберкулёзного процесса [20].
Вдвое чаще у ВИЧ-позитивных пациентов встречаются внелёгочные формы туберкулёза [9]. Внелегочный туберкулез на фоне ВИЧ-инфекции наиболее часто проявляется в виде лимфаденопатии, серозных выпотов (в полости плевры, брюшины и в полость перикарда), а также диссеминированного или милиарного туберкулеза [3, 24]. Внелегочный туберкулез может поражать ЦНС, желудочно-кишечный тракт, позвоночник, а также кости и суставы [5]. Но в то же время симптоматика у больных ВИЧ-сочетанным туберкулёзом может быть столь неспецифической, что во многих госпиталях США изолируют любого больного со СПИД, если у него есть изменения на рентгенограмме грудной клетки [1].
Анализ причин смерти у лиц, имевших активный туберкулёз на поздних стадиях ВИЧ-инфекции, показал, что он являлся ведущей причиной смерти в 86,7% случаев, причем в 93,4% наблюдений имела место диссеминация туберкулёза с легочными и внелёгочными локализациями [8].
MAC (Mycobacterium avium complex) обычно поражает больных СПИД с показателями CD4 менее 50 в мкл, в то время как ТБ может возникнуть у больного с любыми показателями CD4 [6]. Примерно в 90% случаев MAC у больных ВИЧ легкие остаются интактными, а поражаются кишечник, костный мозг, печень и селезенка [1]. Типичная картина для MAC - это, как правило, кахектичный больной СПИД с хроническими симптомами истощения, лихорадкой, болью в животе, диареей, но без особых изменений на рентгенограмме грудной клетки с тяжелой анемией и повышенными значениями печеночных функциональных проб [1,6]. Следует отметить, что за последние несколько лет клиническая картина туберкулёза несколько изменилась в связи с началом применения ингибиторов протеаз, которые, как представляется, глобально снижают ретровирусный пул микроорганизмов у пациентов с ВИЧ, при этом существенно увеличивая содержание CD4 [19]. Это привело к иммунной болезни восстановления (IRD) или воспалительному синдрому иммунного восстановления (IRIS) у ВИЧ-инфицированных пациентов в течение начальных месяцев высокоактивной антиретровирусной терапии (ВААРТ) [22]. При этом возникают "парадоксальные реакции" или так называемые "клинические сигналы (clinical flares)", которые были определены как переходное ухудшение или появление новых признаков, симптомов или рентгенографических и гистопатологических проявлений [31], скорее из-за раннего восстановления "дисрегулированной" иммунной реакции хозяина, чем в результате неудачи антиретровирусного лечения или рецидива оппортунистических инфекций [13,15]. Это положение подтверждается недавними клиническими исследованиями, показывающими, что у ВИЧ-позитивных пациентов с IRIS преобладают распостраненные формы ТБ на фоне снижения уровня CD4+ до 100 кл/ттЗ и быстрого его повышения в первые 3 месяца ВААРТ [17, 22]. Возможно, чтобы избежать синдрома иммунного восстановления, следует назначать ВААРТ до падения уровня CD4+ ниже 100 кл/мкл. Однако, этиология воспалительного синдрома иммунного восстановления до конца не ясна. Есть предположение, что он возникает, по крайней мере, частично, как следствие формирования резистентности к ВААРТ [16, 22]. Об эффекте восстановления иммунологической функции, индуцированной ВААРТ, стало известно в 1998 г., когда были описаны первые пять случаев фокального гранулематозного лимфаденита из-за инфекции Mycobacterium avium complex и парадоксальные реакции при ВИЧ-ассоциированном туберкулёзе [25]. В настоящее время в литературе описано 166 случаев IRD, связанной с микобактериальными инфекциями [19]. Отмечено, что болезнь иммунного восстановления ведет к изменению клинической картины туберкулёза. К примеру, МТБ может дать картину, в большей степени похожую на реактивацию, а не на "первичный ТБ". Влияние на MAC еще более выражено [19, 25, 30]. Испанскими исследователями проведено сравнительное изучение клинических особенностей между заболеваниями, вызванными M.Tuberculosis и М. Kansasii у ВИЧ-инфицированных пациентов, в результате которого не выявлено каких-либо клинических и рентгенологических особенностей, но установлено, что при инфицировании М. Kansasii более выражена иммуносупрессия и прогрессирование ВИЧ-инфекции [12].
Туберкулиновые пробы на поздних стадиях ВИЧ-инфекции в большинстве случаев являются неинформативными, в то время как на ранних стадиях частота их выявления не отличается от таковой у больных туберкулёзом без ВИЧ-инфекции.
Таким образом, по мере развития иммунодефицита и перехода ВИЧ-инфекции в поздние стадии клинико-морфологические симптомы туберкулёза значительно усугубляются. Учитывая вышеизложенное, в целях своевременного выявления туберкулёза целесообразно после установления диагноза ВИЧ-инфекции и до развития стадий выраженного иммунодефицита определять больных, входящих в группу высокого риска заболевания туберкулёзом, для последующего динамического наблюдения за ними фтизиатра и своевременного назначения химиопрофилактики или лечения туберкулёза.
Проблема ВИЧ-инфекции более 25 лет остается актуальной для мирового сообщества, масштабы распространения иммунодефицита человека приобрели глобальный характер и стали реальной угрозой для социально-экономического развития большинства стран мира. Всемирная организация здравоохранения указывает, что в мире более 34 млн человек страдают этой инфекцией и уже более 2,5 млн умерло от ВИЧ-ассоциированных заболеваний [7]. В России в настоящее время эпидемическая ситуация по ВИЧ-инфекции остается напряженной – продолжается распространение данной инфекции среди населения России: 463 случая на 100 тыс. населения; получается, что один из 216 жителей является носителем вируса иммунодефицита [5]. На начало января 2016 г. в Алтайском крае зарегистрировано 22 349 случаев ВИЧ-инфекции. Проживает на территории края – 17 480 чел., пораженность на 100 тыс. населения – 728,7, что на 17% ниже, чем в Сибирском федеральном округе (828,4 на 100 тыс. населения). По уровню пораженности ВИЧ-инфекцией, из 12 территорий СФО, Алтайский край занимает 4-е рейтинговое место [1].
При этом растет и количество смертей от ВИЧ-инфекции и ассоциированных с ней заболеваний [9]. ВИЧ-инфекция на стадии вторичных заболеваний 4 (А, Б, В) резко увеличивает риск развития туберкулезного процесса. Активный туберкулез может развиться на любой из стадий ВИЧ-инфекции и имеет множество клинико-рентгенологических, морфологических особенностей, которые зависят от выраженности иммунодефицита. Значительная распространенность ВИЧ-инфекции в сочетании с туберкулезом, частота развития и тяжесть осложнений при двойной инфекции определили ее как социально значимое заболевание, приводящее к инвалидизации, снижению качества жизни и высокой смертности, что требует мультифакторного анализа и подхода в контексте этой проблемы. Остаются мало изученными причины смерти и особенности морфологических изменений в органах при туберкулезе на фоне ВИЧ-инфекции с учетом медико-социальных параметров [7].
Одной из основной причиной смерти ВИЧ-инфицированных лиц остается туберкулез, осложняющий течение ВИЧ-инфекции [7; 9], диагностика которого при таком сочетании до сих пор остается затрудненной [2; 6]. ВИЧ-инфекция на стадии вторичных заболеваний в IV стадию (А, Б, В) значительно увеличивает количество форм активного туберкулеза у таких пациентов. По данным российских и зарубежных авторов, доля больных туберкулезом среди ВИЧ-инфицированных достигает 75% [7; 10].
Следует отметить, что наряду с количественными изменениями в структуре аутопсий умерших от туберкулеза произошли и качественные изменения. Стали преобладать генерализованные формы заболевания с нетипичной микроскопической картиной и преимущественно альтеративным характером воспаления в туберкулезных очагах, отсутствием эпителиоидных и гигантских клеток, сомнительными, а зачастую отрицательными результатами окрашивания по Циль-Нильсену при выявлении кислотоустойчивых бактерий на срезах. Появление и доминирование данных атипичных форм туберкулеза связывают с увеличением числа больных с иммунодефицитными состояниями на фоне наркомании и ВИЧ-инфекции, которые сопровождаются резким снижением уровня СD4+-лимфоцитов, играющих важную роль в механизме противотуберкулезной защиты [8].
Все это позволяет нам вынести туберкулез, ассоциированный с ВИЧ-инфекцией, в группу довольно значимых социальных заболеваний, которые, несмотря на довольно обширное освещение в научных трудах как в отечественной, так и в зарубежной литературе, требуют более комплексного анализа и подхода для правильного понимания истинных причин смертности в данной группе пациентов.
Цель исследования – изучить особенности морфологической картины ВИЧ-ассоциированного туберкулеза у пациентов, не получающих противовирусную терапию, с определением основных причин смерти у данной категории лиц.
Материалы и методы исследования. Было изучено 20 случаев протоколов вскрытия ВИЧ-инфицированных с клиникой туберкулеза, по той или иной причине не получающих противовирусную терапию (в большинстве случае отказ самих больных), и 20 больных с туберкулезом без ВИЧ-инфекции. Критериями включения в исследование были: ВИЧ-инфекция с положительным иммуноблотом и подтвержденный туберкулез методами морфологического и гистологического исследования. В I группу вошли больные ВИЧ-ассоциированные с туберкулезом, среди которых мужчины составили 12 (60%) человек, а женщины 8 (40%) человек. Средний возраст среди мужчин – 32±5 лет, среди женщин 36±4 года. Все умершие были жители города. Среди них 15 (0,75%) умерших последние несколько месяцев не употребляли наркотики, оставшиеся утверждали, что не принимали наркотики в течение 1-2 лет. В группу II вошли больные с туберкулезом без ВИЧ-инфекции (ограниченные формы). Средний возраст в этой группе составил 51±6 лет, мужчин было 11 (55%) человек, женщин – 9 (45%).
При анализе клинико-морфологических особенностей в исследовании учитывали возраст, пол умерших и количество клеток CD4+/мкл. При этом все умершие имели IV Б – IV В и V стадию ВИЧ-инфекции, согласно классификации, утвержденной Приказом МЗ СР РФ № 166 от 17 марта 2006 года, с количеством клеток CD4+ 100-200/мкл и менее 100 клеток/мкл. У всех умерших в анамнезе имелся факт употребления инъекционных наркотических средств.
При изучении микроскопической картины стеклопрепаратов, окрашенных гематоксилином и эозином и методом по Циль-Нильсену, для морфометрического анализа применяли программу UTHSCSA Image Tool 3.0 (разработанную в University of the Texas Health Science Center of San Antonio, Tеxas, USA, 2007 и свободно доступную в Интернете). С каждого случая делали по 10 снимков. Определяли площадь казеозного некроза в туберкулезных очагах, а также толщину лимфоцитарно-макрофагального вала клеток.
Результаты исследования и их обсуждение.
В I группе встречался генерализованный туберкулез с поражением головного мозга, лимфатических узлов, легких, почек, селезенки, печени, а также диссеминированные и милиарные формы туберкулеза, казеозная пневмония 1 (5%). В патологический процесс при туберкулезе были вовлечены следующие органы: двусторонние поражения легких – 20 (100%), печень – 9 (45%), селезенка – 12 (60%), мозг – 7 (35%), позвоночник – 2 (10%), миокард – 7 (35%). Генерализованные формы туберкулеза сопровождались выраженной интоксикацией, что нашло отражение в увеличении печени и селезенки. Масса печени была зафиксирована в пределах средних цифр – 3200±140 г, желтого цвета с поверхности с субкапсулярными бугорками серо-белого цвета по 2 мм. На разрезе гладкая, имеет сальный блеск, при микроскопировании отмечена диффузная крупнокапельная жировая дистрофия гепатоцитов. Масса селезенки достигала 720 г, среднее значение составило – 520±50 г, дрябловатой консистенции, капсула слабой напряженности. Субкапсулярно и на разрезе определяются мелкие очаги (бугорки) белесого цвета по 1-2 мм, в 5 (10%) случаях отмечено их слияние до 1 см. При гистологическом исследовании отмечена атрофия лимфоидных фолликулов, гемосидероз, утолщение и склероз синусов.
Во II группе у 11 (55%) человек были выявлены милиарные и диссеминированные формы туберкулеза, у 9 (45%) человек процесс был локализован только в легких с одной стороны, не затрагивая другие органы. Селезенка в процесс не вовлекалась, а печень в 12 (60%) случаях была увеличена – 2500±85 г. Морфологическая картина туберкулеза во II группе была классической, с типичными формами течения туберкулезной инфекции. В туберкулезных очагах выявлены типичное продуктивное воспаление и типичные клеточные реакции. Площадь казеозного некроза в определяемых туберкулезных очагах составила 210,4±12,2 мкм2, толщина вала клеточной популяции на периферии казеозного некроза составила 67,1±11,2 мкм, среди клеток определялись в большом количестве эпителиоидные клетки и классические клетки Пирогова-Лангханса.
В морфологической картине I группы преобладали распространенные формы туберкулеза легких, миллиарные и диссеминированные формы, с поражением других внутренних органов. Отмечены обширные очаги казеозного некроза, не отграниченные коллагеном, размером до 1 см, со снижением количества эпителиодных клеток и клеток Пирогова-Лангханса, экссудативными компонентом, диссеминацией процесса и генерализованными формами. Площадь казеозного некроза широко варьировала от 257 до 410 мкм2, средняя площадь составила – 350±36,7 мкм2, вал клеток был меньше и составил 32-49 мкм в среднем – 41,5±5,3 мкм. Во многих очагах (легкие, печень, селезенка) преобладали экссудативные реакции с лейкоцитарной инфильтрацией в центре казеозного некроза, что свойственно ВИЧ-ассоциированному туберкулезу при многих других исследованиях [8]. Гигантские клетки были единичные, мелких размеров и с наименьшим количеством ядер в клетке, их малым диаметром. Эпителиоидные клетки были также единичными, в очагах выявлено большое количество микобактерий туберкулеза, что совпадает с данными ряда других исследователей [9]. Корреляционной анализ выявил взаимосвязь между клетками СD4+ и толщиной клеточного вала в туберкулезных очагах в группе I – r=0,58, р=0,0000. Корреляция CD4+ клеток с площадью некроза казеозного – r=-0,7, р=0,0000 (рисунок). На течение заболевания неблагоприятное влияние оказывает нерегулярное лечение, а порой и полный отказ от противовирусной терапии, а при сочетании с туберкулезом прием до 5 препаратов приводит к более тяжелому токсическому повреждению печени, что неблагоприятно сказывается на течении ВИЧ-ассоциированного туберкулеза [3].
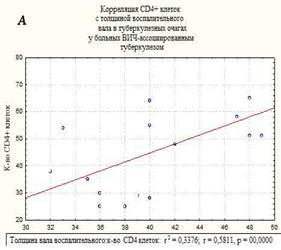
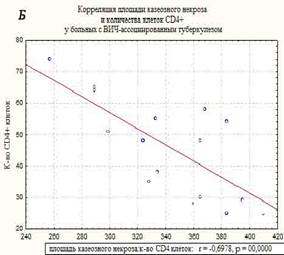
Корреляционные взаимосвязи CD4+-клеток и толщины воспалительного вала в очагах казеозного некроза (А), и с площадью казеозного некроза (Б) у больных ВИЧ-ассоциированным туберкулезом
В терминальной стадии также отмечены диссеминированные и генерализованные формы туберкулеза. Встречаются очаги различных размеров, от милиарных до 1 см. Поражения легких носят двусторонний характер, плевра тусклая, иногда с фибрином, спайки между листками междолевой плевры, висцеральной и костальной плевры. Микроскопически отмечена многочисленность фокусов казеозного некроза с поражением мелких бронхов и бронхиол.
По мере прогрессирования иммунодефицита на стадиях IVБ-В преобладают альтеративно-экссудативные изменения над продуктивными. В терминальной стадии - только альтерация с экссудацией, нередко с экссудацией по типу гнойного воспаления в центре некротических очагов.
Теоретическое обоснование содержания лимфоцитов и их участия в дифференцировке клеток в туберкулезных очагах и выраженность продуктивных реакций, возможно, связано с тотальной иммунной анергией и дисбалансом между Th1 и Th2 лимфоцитами, которые не способны активировать клетки моноцитарного ряда в очаге воспаления и обеспечить нужную продуктивную тканевую реакцию с формированием гранулем и фиброза. Все эти клеточные реакции рассматриваются как проявление гиперчувствительности немедленного типа с потерей биологического смысла реакции гиперчувствительности замедленного типа, что связано с иммунносупрессией и лимфогенной диссеминацией микобактерий туберкулеза по типу туберкулезного сепсиса Ландузи [4].
В большинстве наших наблюдений диагностика ВИЧ-инфекции была только посмертной со скудным анамнезом болезни и жизни, что не позволяло в полной и должной мере оценить и выявить основные и непосредственные причины смерти с большой долей вероятности. Эти трудности свойственны многим другим специалистам, занимающимся проблемой ВИЧ-инфекции, ассоциированной с туберкулезом. Причины смерти в I группе – это, как правило, туберкулез генерализованный или диссеминированный с его интоксикационными проявлениями в виде глубоких дистрофических изменений во внутренних органах, отеком легких. В некоторых случаях доминировали признаки сердечной и легочно-сердечной недостаточности, отека мозга (при менингоэнцефалите). Непосредственная причина смерти у ВИЧ-инфицированных с туберкулезом в стадии IV Б-В и V – это генерализованные и диссеминированные формы туберкулеза, основная причина смерти – ВИЧ-инфекция, подвергающаяся кодированию по МКБ-10. При определении основной и непосредственной причины смерти при стадии менее IVА – это, как правило, туберкулез, кодируемый по МКБ-10. У всех умерших этой группы было диагностировано второе конкурирующее заболевание – гепатит C, а у 9 (45%) была диагностирована двусторонняя бактериальная полисегментарная пневмония.
Заключение. ВИЧ-ассоциированный туберкулез характеризуется атипичной морфологической картиной с преобладанием альтеративно-экссудативных тканевых реакций над продуктивными, склонностью к генерализации и диссеминации туберкулезного процесса с преобладанием его среди мужчин трудоспособного возраста. На данный процесс оказывают влияние отсутствие, отказ или нерегулярный прием противовирусных препаратов, а также наличие конкурирующего заболевания в виде гепатита С. Снижение содержания количества СD4+ клеток находит свое отражение в полном отсутствии и снижении степени выраженности продуктивных тканевых реакций.
Полный текст:
Представлены материалы изучения особенностей социального статуса, клинико-рентгенологических, микробиологических и иммунологических проявлений туберкулеза органов дыхания, сочетанного с микобактериозом, у 26 больных на поздних стадиях ВИЧ-инфекции при количестве СD4+ лимфоцитов менее 30 клеток/мкл крови в отсутствие антиретровирусной терапии, выделяющих микобактерии туберкулеза и нетуберкулезные микобактерии. Видовая принадлежность нетуберкулезных микобактерий устанавливалась путем молекулярно-генетической идентификации. M. avium complex были выявлены у 84,6% пациентов, M. kansasii — у 7,7%, M. fortuitum — у 3,8±% и M. xenopi — у 3,8%. Заболевание проявлялось через 6–9 лет после диагностики ВИЧ-инфекции, протекало с выраженным синдромом интоксикации, бронхолегочными и внелегочными проявлениями, сочеталось с другими оппортунистическими инфекциями. Методами лучевой диагностики выявляли синдром диссеминации с преимущественной локализацией в средних и нижних отделах легких, наличие мелких инфильтратов с полостями распада легочной ткани и поражение междолевой и висцеральной плевры.
3. ВИЧ-инфекция и СПИД / Под ред. В.В.Покровского. 4-е изд., перераб. и доп. М.: ГЕОТАР-Медиа. 2019. 156 с. [HIV infection and AIDS. Ed. by V.V. Pokrovsky. 4th ed., revised and amended. Moscow, GEOTAR-Media, 2019, 156 p. (In Russ.)].
4. Михайловский А.М., Чуркин С.А., Пашкова Н.А., Лепеха Л.Н. Частота выявления и особенности морфологии нетуберкулезного микобактериоза у больных на поздней стадии ВИЧ-инфекции (по данным Оренбургской области) // Туберкулез и болезни легких. 2016. Т. 94, №12. С. 57–61. [Mikhailovsky A.M., Churkin S.A., Pashkova N.A., Lepekha L.N. The detection rate and morphology of nontuberculous mycobacteriosis in patients with advanced HIV infection (according Orenburg region). Tuberculosis and Lung Diseases, 2016, Vol. 94, No. 12, pp. 57–61 (In Russ.)].
5. Мишин В.Ю. Туберкулез и другие микобактериальные инфекции // Пульмонология: Национальное руководство. 3-е изд., перераб. и доп. / Под ред. А.Г.Чучалина. Глава 9. С. 226–235. М.: ГЕОТАР-Медиа, 2018. 800 с. [Mishin V.Yu. Tuberculosis and other mycobacterial infections. In: Pulmonology: National leadership. 3rd ed., revised and amended. A.G.Chuchalina. Chapter 9. P. 226–235. Moscow: GEOTAR-Media, 2018, 800 p. (In Russ.)].
6. Мишин В.Ю., Мишина А.В., Эргешов А.Э., Романов В.В., Собкин А.Л. Диспансерное наблюдение и медицинская реабилитация больных туберкулезом, сочетанным с ВИЧ-инфекцией // ВИЧ инфекция и иммуносупрессии. 2018. Т. 10, № 3. С. 81–90. [Mishin V.Yu., Mishina A.V., Ergeshov A.E., Romanov V.V., Sobkin A.L. Dispensary follow-up and medical rehabilitation of TB patients with HIV co-infection. HIV Infection and Immunosuppressive Disorders, 2018, Vol. 10, No. 3, pp. 81–90 (In Russ.)].
7. Бартлетт Дж., Галлант Д., Фам П. Клинические аспекты ВИЧ-инфекции / Пер. с англ. М.: Р.Валент, 2012. 528 с. [Bartlett J., Gallant D., Pham P. Clinical aspects of HIV infection. Transl. from English. Moscow: R. Valent, 2012, 528 p. (In Russ.)].
8. Tortoli E. Microbiological features and clinical relevance of new species of the genus mycobacterium. Clin. Microbiol. Rev., 2014, Vol. 27, No. 4, pp. 727–752.
9. ТБ/ВИЧ в Российской Федерации. Эпидемиология, особенности клинических проявлений и результаты лечения. М.: РИО ЦНИИ организации и информатизации здравоохранения, 2018. 67 с. [TB/HIV in the Russian Federation. Epidemiology, features of clinical manifestations and results of treatment. Moscow: RIO Central research Institute of health organization and Informatization, 2018, 67 р. (In Russ.)].
10. Шульгина М.В., Нарвская О.В., Мокроусов И.В., Васильева И.А. Патогенные и условно-патогенные микобактерии. М.: НЬЮ-ТЕРРА, 2018. 104 с. [Shulgina M.V., Narvskaya O.V., Mokrousov I.V., Vasilyeva I.A. Pathogenic and conditionally pathogenic mycobacteria. Moscow: NEW-TERRA, 2018, 104 p. (In Russ.)].
11. Эргешов А.Э., Шмелев Е.И., Ковалевская М.Н., Карпина Н.Л., Ларионова Е.Е., Черноусова Л.Н. Микобактериозы в практике врачей пульмонологов и фтизиатров // Туберкулез и болезни легких. 2016. Т. 94, № 9. С. 39–43. [Ergeshov A.E., Shmelev E.I., Kovalevskaya M.N., Karpina N.L., Larionova E.E., Chernousova L.N. Mycobacteriosis in the practice of the physicians of chest diseases and tuberculosis. Tuberculosis and Lung Diseases, 2016, Vol. 94, No. 9, pp. 39–43 (In Russ.)].
12. Daley C.L., Griffith D.E. 36 nontuberculous mycobacterial infections. In: Murray and Nadel’s. Textbook of Respiratory Medicine, 6ed. Elsevier Inc., 2016, pp. 629–645.
13. Зюзя Ю.Р., Пархоменко Ю.Г., Зимина В.Н., Альварес Фигероа М.В. Морфологическая верификация ВИЧ-ассоциированного микобактериоза, вызванного нетуберкулезными микобактериями M. аvium complex // Клиническая и экспериментальная морфология. 2015. Т. 3, № 15. С. 11–21. [Zyuzya Yu.R., Parkhomenko Yu.G., Zimina V.N., Alvarez Figueroa M.V. Morphological verification of HIV-associated mycobacteriosis caused by non-tuberculosis mycobacteria M. avium complex. Clinical and Experimental Morphology, 2015, Vol. 3, No. 15, pp. 11–21 (In Russ.)].
14. Мишин В.Ю., Эргешов А.Э., Мишина А.В. Диагностика и дифференциальная диагностика диссеминированных поражений легких у больных с ВИЧ-инфекцией (обзор) // Consilium Medicum. 2018. Т. 20, № 3. С. 8–13. [Mishin V.Yu., Ergeshov A.E., Mishina A.V. Diagnosis and differential diagnosis of disseminated lung lesions in patients with HIV infection (review). Consilium Medicum, 2018, Vol. 20, No. 3, pp. 8–13 (In Russ.)].
15. Пантелеев А.М., Драчева М.С., Никулина О.В., Соколова О.С., Зонова А.В. Клинико-лабораторные особенности микобактериоза у больных ВИЧ-инфекцией // Журнал инфектологии. 2016. Т. 8, № 3. С. 40–45. [Panteleev A.M., Dracheva M.S., Nikulina O.V., Sokolova O.S., Zonova A.V. Clinical and laboratory features of mycobacteriosis in patients with HIV infection. Journal of Infectology, 2016, Vol. 8, No. 3, pp. 40–45 (In Russ.)].
16. Пантелеев А.М., Никулина О.В., Христусев А.С., Драчева М.С., Соколова О.С., Зонова А.В. Дифференциальная диагностика туберкулеза и микобактериоза у больных ВИЧ-инфекцией // Туберкулез и болезни легких. 2017. Т. 95, № 10. С. 48–52. [Panteleev A.M., Nikulina O.V., Christusev A.S., Dracheva M.S., Sokolova O.S., Zonova A.V. Differential diagnostics of tuberculosis and mycobacteriosis in patients with HIV infection. Tuberculosis and Lung Diseases, 2017, Vol. 95, No. 10, pp. 48–52 (In Russ.)].
17. Henkle E., Winthrop K.L., Nontuberculous mycobacteria infections in immunosuppressed hosts. Clin. Chest. Med., 2015, Vol. 36, No. 1, pp. 91–99.
18. British Thoracic Society (BTS) for guidelines for the management of non-tuberculous micobacterial pulmonary disease (NTM-PD). Thorax. 2017. URL: DOI:10.1136/thoraxjni-2017–210927.
19. Griffith D.E., Aksamit T., Brown-Elliott B.A., Catanzaro A., Daley C., Gordin F., Holland S.M., Horsburgh R., Huitt G., Iademarco M.F., Iseman M., Olivier K., Ruoss S., von Reyn C.F., Wallace R.J.Jr., Winthrop K. ATS Mycobacterial Diseases Subcommittee, American Thoracic Society, Infectious Disease Society of America. 2007. An official ATS/IDSA statement: diagnosis, treatment, and prevention of nontuberculous mycobacterial diseases. Am. J. Respir. Crit. Care Med., No. 175, pp. 367–416. URL: DOI:10.1164/rccm.200604-571ST.
20. Hedjazi A., Hosseini M., Hoseinzadeh A. Lymph node co-infection of mycobacterium avium complex and cytomegalovirus in an acquired immunodeficiency syndrome patient. Infect. Dis. Rep., 2013, Vol. 22, Vol. 5, No. 1, pp. e2. URL: DOI:10.4081/idr.2013.e2.
21. Федеральные клинические рекомендации по диагностике и лечению туберкулеза у больных ВИЧ-инфекцией. М.; Тверь: Триада, 2014, 56 с. [Federal clinical guidelines for the diagnosis and treatment of tuberculosis in patients with HIV infection. Moscow; Tver: Triada, 2014, 56 p. (In Russ.)].

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Читайте также:


