Артрит при микоплазменной инфекции

Оглавление диссертации Сафина, Айгуль Зиннуровна :: 2004 :: Уфа
Глава 1. Литературный обзор 7
Глава 2. Клиническая характеристика больных и методы исследования 31
2.1. Клиническая характеристика больных ревматоидным артритом
2.2. Характеристика методов исследования
Глава 3. Результаты исследований 39
3.1. Характеристика герпетической, микоплазменной, хламидийной инфекции у больных ревтамотидным артритом с применением метода иммуноферментного анализа и полимеразной цепной реакции
3.2. Зависимость активности ревматоидного артрита от выявления герпесвирусов, микоплазм и хламидий
3.3. Взаимосвязь герпетической, микоплазменной, хламидийной инфекции с наличием ревматоидного фактора при ревматоидном артрите
3.4. Особенности герпетической, микоплазменной, хламидийной инфекции у больных ревматоидным артритом с синдромом кортикостероидной зависимости
Глава 4. Применение экзогенного индуктора интерферона 57
4.1. Сравнительная характеристика больных ревматоидным артритом, получавших и не получавших циклоферон
4.2. Оценка частоты элиминации герпетической, микоплазменной, хламидийной инфекции у больных ревматоидным артритом, получавших циклоферон
Глава 5. Обсуждение результатов 68
Введение диссертации по теме "Внутренние болезни", Сафина, Айгуль Зиннуровна, автореферат
Актуальность проблемы. Ревматоидный артрит (РА) - аутоиммунное воспалительное заболевание соединительной ткани неизвестной этиологии, которым поражено, по разным данным, от 0,5% до 3,8% женщин и от 0,16% до 1,3% мужчин. По данным ВОЗ, больные РА составляют 2% населения планеты. Заболевание характеризуются длительностью и тяжестью течения и часто приводит к пожизненной инвалидизации людей трудоспособного возраста^ 1]
Этиология и некоторые механизмы патогенеза РА остаются до сих пор неясными, что заставляет ученных проводить постоянный поиск причин развития болезни (Барнес К.Дж.,1990, Давлетшин Р.А.,1995). Поиски инфекционного агента при РА не дали однозначных результатов. Не исключено, что фактором, учавствующим в развитии РА, являются микроорганизмы, обладающими такими свойствами, как тропизм к суставным тканям, способность длительно в них персистировать и вызывать характерный иммунологический ответ. Антигенные компоненты микробных клеток, включенные в иммунные комплексы, могут, вероятно длительно сохраняться в макрофагах, хондроци-тах, слабоваскуляризированных участках сустава, стимулируя, особенно в генетически предрасположенном организме, ответные воспалительные реакции и обусловливая хроническое течение процесса (Агабабова Э.Р., Алекбе-рова 3.с.,1983)
Вирусная теория оказалась заманчивой, так как именно вирусы тесно контактируют с клеткой, вмешиваются в ее метаболизм и, разрушая ее, могут вызвать аутоиммунный ответ. Эти свойства присущи и микоплазмам и хла-мидиям; с этих позиций может быть рассмотрена патогенетическая роль микоплазм и хламидий в развитии ревматоидного воспаления.[3,4]
Многочисленные данные о возможной роли вирусно-бактериальной инфекции в этиопатогенезе ревматических болезней, а также сведения об иммунотропном действии интерферонов создали предпосылки для изучения системы интерферона при этих заболеваниях.
Цель работы. Представить роль вирусов герпеса, микоплазм и хламидий в ревматоидном воспалении и определить эффективность циклоферона. Задачи исследования:
1. Изучить уровень специфических иммуноглобулинов к антигенам герпеса, микоплазмам и хламидиям в период активности ревматоидного артрита.
2. Выявить наличие вирусов герпеса, микоплазм и хламидий в сыворотке крови больных ревматоидным артритом
3. Определить эффективность комбинации циклоферона с базисной терапией у больных при ревматоидном артрите.
Научная новизна. Представлено, что патогенетическая роль герпесвирусов, микоплазм, хламидий определяется в формировании активности ревматоидного воспаления и рефрактерности к базисным препаратам. Выработка антител IgM и IgG к герпесвирусам, микоплазмам и хламидиям не сопровождается снижением активности ревматоидного воспаления.
Практическая значимость. При ревматоидном артрите умеренная и высокая активность воспаления характеризуется присутствием специфического ДНК цитомегаловируса, вируса Эпштейна-Барр, Mycoplasma hominis и Chlamydia trachomatis, что вероятно определяет высокую потребность в базисных препаратах. При этом показано комбинированное лечение базисными препаратами и циклофероном. При синдроме кортикостероидной зависимости целесообразно лечение с циклофероном, что снижает потребность в глюкокор-тикоидных гормонах.
Основные положения, выносимые на защиту:
1. При ревматоидном артрите герпетические, микоплазменные инфекции способствует прогрессированию аутоиммунного воспаления и выявлению, преимущественно, у больных с висцеральными проявлениями ревматоидного артрита, а также выраженными костно-хрящевыми деструкциями и не зависит от серореакции по ревматоидному фактору.
2. Иммуноглобулины к вирусам герпеса, микоплазм, хламидиям определяются в составе иммуноглобулинов класса G и М; сочетание их с ан-тигенемией вызывает высокую активность и хронизацшо ревматоидного воспаления. Высокий риск инфицирования вирусами герпеса, микоплазмами и хламидиями присутствует при синдроме кортикостероидной зависимости.
3. Комбинирование базисной терапии с циклофероном при ревматоидном артрите способствует уменьшению случаев выявления специфических ДНК вирусов герпеса, микоплазм.
Внедрения: Результаты настоящего исследования внедрены в работу терапевтических отделений ГКБ№18, №22 города Уфы.
Объем и структура диссертации: Диссертация изложена на 106 листах машинописного текста, включает 5 рисунков и 11 таблиц, состоит из введения, 5 глав, выводов и списка литературы, содержащего 250 источников (100 отечественных и 150 зарубежных авторов).
справочника
Инфекционные болезни, фармакотерапия
Микоплазменные инфекции (синоним – микоплазмоз) – группа инфекционных болезней, широко распространенных в различных странах мира и характеризующихся преимущественным поражением органов дыхания, суставов и мочеполовой системы, возбудителями являются микоплазмы из рода Mycoplasma семейства Mycoplasmataceae.
Микоплазмы – группа разнообразных микроорганизмов, занимающих промежуточное положение между вирусами и бактериями. В отличие от бактерий, они не имеют клеточной стенки, но могут расти на специальных бесклеточных средах. Подобно вирусам, проходят через бактериальные фильтры. Для микоплазм характерен полиморфизм микроструктур и многообразие форм репродукции: бинарное деление, почкование, развитие нитевидных форм и мельчайших зернистых структур.
Заболевание у человека способны вызвать M. pneumoniae, M. hominis и U. urealyticum, M. genitalium. M. pneumoniae является возбудителем заболеваний верхних дыхательных путей и первичных атипичных пневмоний (респираторного микоплазмоза), U. urealyticum, M. hominis являются причиной урогенитальных заболеваний, патологии плода и новорожденных.
Возбудитель неустойчив во внешней среде. Разрушается прогреванием при 40° и выше, воздействием ультразвука, ультрафиолета, действием рентгеновского облучения.
Источником возбудителя инфекции являются больной человек и носитель микоплазм (сохранение и выделение возбудителя – длительное). Основной путь передачи М. pneumoniae – воздушно-капельный; М. hominis и Т-микоплазмы передаются, в основном, половым путем. Возможно (хотя значительно реже) заражение воздушно-пылевым, а также контактно-бытовым путем, через контаминированные возбудителем руки или предметы обихода.
М. pneumoniae вызывает вспышки респираторного микоплазмоза во вновь организованных коллективах детей и взрослых, где за 2-3 мес. заражаются до 50% членов коллектива. Эта инфекция наиболее часто регистрируется у лиц в возрасте от 1 года до 29 лет. Иммунитет после перенесенного заболевания сохраняется до 5-10 и более лет.
Возбудители респираторного микоплазмоза проникают в организм через дыхательные пути, фиксируются на поверхности эпителия слизистой оболочки трахеи и бронхов. Выделение микроорганизмами супероксидантов вызывает блокаду механизмов мукоцилиарного клиренса, а затем и гибель эпителия. Затем микоплазмы достигают альвеолоцитов, внедряются в межальвеолярные перегородки, вследствие чего формируются перибронхиальные, периваскулярные и интерстициальные инфильтраты. В легочной ткани развиваются клеточные иммунные реакции ГЗН, которые лежат в основе очагов некроза эпителия с последующим заполнением альвеол экссудатом, преимущественно в прикорневых зонах легких.
Поражения кожи, артриты, возникающие при микоплазмозе, также связаны с развитием реакции ГЗН, и депонированием иммунных комплексов в прилежащих тканях. Кроме того, многочисленные исследования показали, что М.pneumonia можно выявить практически во всех органах и тканях – печени, почках, ликворе, сердечной мышце, веществе мозга, перикардиальной и внутрисуставной жидкостях, крови. Это дает возможность утверждать, что микоплазменную инфекцию можно рассматривать как генерализованный процесс с диссеминацией возбудителя и развитием полиорганных поражений. Внереспираторные проявления микоплазменной инфекции, связанные с диссеминацией возбудителя, возникают в первые 2-3 недели болезни. Симптомы, возникающие позже, обусловлены действием иммунных комплексов.
Под воздействием гемолизина, перекисей, а также способности М.pneumonia вызывать синтез холодовых антител, возможно развитие гемолитической анемии.
Возбудители могут внедряться в организм через слизистую оболочку мочеполовых органов, обусловливая развитие уретрита, простатита, вагинита, цервицита, сальпингита. Внедрение микоплазм в организм не всегда вызывает развитие болезни.
Общепринятой классификации микоплазмоза нет. Классификация ВОЗ (1978) предполагает выделение микоплазменной пневмонии как отдельной формы. Согласно классификации Прозоровского (1977), выделяют следующие клинические формы микоплазмоза:
- острое респираторное заболевание (ринит, фарингит, трахеит и т.д.),
- микоплазменная пневмония,
- внереспираторные формы заболевания (менингит, менингоэнцефалит, миокардит, артрит, поражение кожи, гемолитическая пневмония),
- сочетанные формы заболевания (микоплазменно-бактериальные и микоплазменно-вирусные).
По степени тяжести – легкое средней степени тяжести и тяжелое течение.
Симптомы инфекции M. pneumoniae можно разделить на легочные и внелегочные. К легочным проявлениям относят трахеобронхит и пневмонию.
Инкубационный период – 7-14 дней. Симптомы этой формы болезни очень сходны с острой респираторной вирусной инфекцией (ОРВИ). С первого дня болезни возникают кашель, першение в горле, заложенность носа, легкий озноб, утомляемость, миалгии, артралгии. Температура лишь в редких случаях поднимается до высоких цифр, обычно бывает субфебрильной или нормальной.
При осмотре можно отметить гиперемию лица и конъюнктив, инъекцию сосудов склер, увеличение подчелюстных и шейных лимфатических узлов. Характерна яркая гиперемия слизистой оболочки рта и глотки, особенно задней стенки, где видны увеличенные фолликулы. При вовлечении в процесс бронхов болезнь затягивается, появляются жесткое дыхание, сухие хрипы. У детей болезнь протекает тяжелее, с более выраженной интоксикацией. Течение, как правило, доброкачественное.
В большинстве случаев микоплазменная пневмония протекает легко (с клинической картиной ОРЗ без пневмонита) и может не выявляться. После инкубационного периода, 2-3 недели после заражения (чем короче продромальный период, тем выраженнее интоксикация), у больного постепенно возникают выраженные признаки интоксикации и симптомы поражения верхних дыхательных путей (ОРЗ, фарингит – в 30-50% случаев), появляется головная боль (иногда очень сильная), слабость, недомогание, ломота в теле, полимиалгии; наблюдается умеренное повышение температуры тела до 38 °С (редко – более 39 °С) с проливным потом.
Внелегочные проявления касаются центральной нервной системы (ЦНС), сердечно-сосудистой, пищеварительной, суставной (описаны редкие случаи), а также патологии со стороны системы крови и кожи.
При поражении ЦНС характерны асептический менингит, парезы черепных нервов, церебральная атаксия, менингоэнцефалит, периферическая нейропатия, поперечный миелит. Эти проявления встречаются достаточно редко и чаще наблюдаются у детей. Гематологические проявления заключаются в образовании IgM к антигенам мембраны эритроцитов. Это приводит к появлению холодовых агглютининов и, в свою очередь, к гемолизу.
Кожная симптоматика характеризуется макулопапулезными или везикулярными высыпаниями, может также развиваться синдром Стивенса-Джонсона. Назначаемая антибактериальная терапия в большей степени потенцирует дерматочувствительность, вызванную M. pneumoniae.
При поражении сердца могут развиваться миокардит, перикардит, гемоперикард, явления сердечной недостаточности, а также нарушение проводимости в виде блокад различной степени тяжести.
Симптомы со стороны пищеварительного тракта включают тошноту, рвоту, диарею, а также явления панкреатита.
Диагноз устанавливают на основании клинической картины, данных эпидемиологического анамнеза (возможные контакты с больными) и результатов лабораторных исследований.
Изменения в периферической крови не имеют диагностического значения: в острый период может определяться умеренный лейкоцитоз, но чаще бывает нормальная нормоцитоз (с лимфоцитозом); СОЭ обычно повышена. Число эритроцитов может быть несколько снижено, что обусловлено наличием в крови холодовых агглютининов.
Микоплазма как возбудитель респираторных заболеваний может диагностироваться достаточно редко из-за отсутствия стандартизированных специфических диагностических тестов.
Для постановки окончательного диагноза выделяют возбудителя из мокроты, крови, плевральной жидкости. Однако растут микоплазмы очень медленно, ответ можно получить только через несколько недель, поэтому диагностическая польза от культурального исследования незначительная.
Для выявления антител используются методы: реакция связывания комплемента, реакция непрямой гемагглютинации, иммуноферментный анализ. Кровь для исследований берут до 6-го дня болезни и спустя 10-14 дней. Однако определение уровня повышения титров IgM и IgG к M. pneumoniae также не является достаточно эффективным, так как иммунный ответ, связанный с образованием данных иммуноглобулинов, часто задерживается и необходимое нарастание титра антител в 4 раза можно определить, если кровь исследуется с интервалом 2-4 недели.
В лабораторной диагностике МП могут помочь определение титров холодовых агглютининов. Уровень холодовых агглютининов более 1:64 свидетельствует о микоплазменной инфекции, он может коррелировать с тяжестью легочных симптомов. Недостатками теста являются низкая чувствительность и специфичность. Иммунный ответ развивается приблизительно через 7-10 дней после дебюта заболевания, и пиковый уровень антител сохраняется около 3 недель.
В некоторых руководствах отмечено, что применение ПЦР-диагностики может быть перспективным. Однако использование данного метода также ассоциируется с определенными техническими проблемами, хотя и позволяет в ранние термины и с высокой степенью точности определить микоплазмы и их антигены в исследуемом материале.
Дифференциальный диагноз
Дифференциальный диагноз проводят с орнитозом, Ку-лихорадкой, туберкулезом. Острое респираторное заболевание, вызванное микоплазмами, не имеет специфических симптомов. При остром развитии его дифференцируют с гриппом; при постепенном, в случаях сочетанного поражения верхних и нижних дыхательных путей – с респираторно-синцитиальной инфекцией. При подозрении на микоплазменную пневмонию необходимо учитывать скудость физикальных проявлений при этой болезни, наличие изнурительного кашля, отсутствие эффекта от пенициллинотерапии.
Осложнения
Асептический менингит, менингоэнцефалит, перикардит, миокардит. Встречаются достаточно редко.
Большая часть больных микоплазменной пневмонией не требует госпитализации и лечится амбулаторно, с благоприятным прогнозом.
Больных госпитализируют по клиническим показаниям. Наиболее эффективными этиотропными средствами являются тетрациклины, (0,25 г 4 раза в сутки), эритромицин (0,5 г 3 раза в сутки), канамицин, применяемые в течение 6-8 дней. Существует мнение, что иногда курс лечения нужно продолжить до 2 недель и более, поскольку клиническое улучшение не всегда сопровождается освобождением организма от возбудителя. Однако при поражении только верхних дыхательных путей можно ограничиться симптоматическими средствами. При многоморфной эритеме, миелите, энцефалите необходимо назначение кортикостероидов, при артритах к лечению добавляют нестероидные противовоспалительные препараты.
Используются также индукторы ИФН – Неовир 250 мг (1 ампула) в/м с интервалом 48 часов № 5-10.
Прогноз обычно благоприятный, но может быть серьезным при развитии тяжелых осложнений.
В очаге проводят раннее и активное выявление больных и их изоляцию. Больных изолируют при остром респираторном заболевании на 5-7 дней на дому, при пневмонии – на 2-3 нед. Специфическая профилактика не разработана.
Натуральная оспа (variola vera) – особо опасное высококонтагиозное вирусное заболевание с аэрозольным механизмом передачи, ведущими проявлениями которого являются выраженная интоксикация, лихорадка, характерные высыпания на коже и слизистых оболочках.
Хотя микоплазма (Mycoplasma hyorhinis) представляет собой комменсал, она может вызвать серьезные внутренние заболевания через механизмы, которые до сих пор не до конца изучены.
Полисерозит и артрит являются главными тяжелыми заболеваниями, поражающими свиней, выкормивших поросят. Как правило, гемофилёз и стрептококк считаются главной причиной таких случаев поражения животных. Однако за последние годы было замечено, что микоплазма (М. hyorhinis) также играет роль в развитии полисерозита и артрита, увеличивая процент заболеваемости и смертности. Эту бактерию часто обнаруживают на свинофермах, связывая ее с поражением верхней части респираторного тракта свиней. Считается, что поросята инфицируются от свиноматок или от старших поросят. Хотя микоплазма hyorhinis представляет собой комменсал, она может вызвать серьезные внутренние заболевания через механизмы, которые до сих пор не до конца изучены. Как полагают, различие между породами, сопутствующие инфекции и определенные условия содержания усугубляют болезнь, способствуя ее прогрессированию.


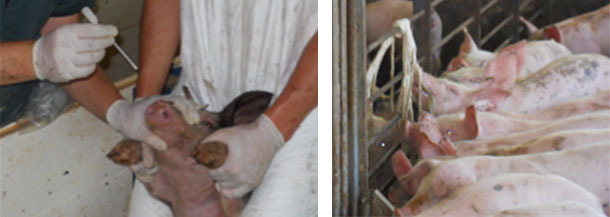
Рис. 1. Хромота после отъема поросят от свиноматки – частый клинический признак, наблюдаемый при внутреннем поражении микоплазмой hyorhinis.
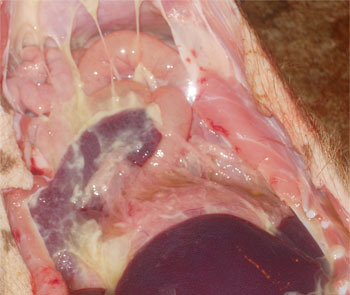
Клинически выявленные симптомы включают жар, одышку, хромоту, нежелание двигаться у поросят в возрасте от 3 до 15 недель (Рис. 1) Клинические симптомы и поражения были значительно выражены в результате экспериментальных прививок. Острые поражения характеризуются плевритом, фибринозным перикардитом и перитонитом (Рис.2). Хронические поражения характеризуются плевральными и перикардиальными спайками. В итоге микоплазма hyorhinis вызывает главным образом артрит, который зачастую поражает задние ноги поросят. Суставы могут содержать большее количество жидкости и фибрина, при этом синовиальная мембрана - утолщенная и красная. Грубые поражения и те, что наблюдались по гистопатологии, оказались идентичными поражениям, вызванным болезнью Глассера, поэтому требуется выполнить ПЦР-тест или попытку бактериальной изоляции, чтобы правильно диагностировать этиологию болезни и определить соответствующие антибиотики для лечения пострадавшего поголовья скота.
 |
| Рис. 3. Сбор мазков из носовой полости у молочных поросят на выявление микоплазмы hyorhinis |