Абдоминальный синдром в инфекции
По механизму возникновения боли в брюшной полости подразделяются на висцеральные, паристальные (соматические), отраженные (иррадиирующие) и психогенные Каковы причины абдоминального болевого синдрома? В чем заключается терапия абдоминального болевог
Каковы причины абдоминального болевого синдрома?
В чем заключается терапия абдоминального болевого синдрома?
Абдоминальный болевой синдром является ведущим в клинике большинства заболеваний органов пищеварения. Боль — это спонтанное субъективное ощущение, возникающее вследствие поступления в центральную нервную систему патологических импульсов с периферии (в отличие от болезненности, которая определяется при обследовании, например, при пальпации). Тип боли, ее характер не всегда зависят от интенсивности инициальных стимулов. Органы брюшной полости обычно нечувствительны ко многим патологическим стимулам, которые при воздействии на кожу вызывают сильную боль. Разрыв, разрез или раздавливание внутренних органов не сопровождаются заметными ощущениями. В то же время растяжение и напряжение стенки полого органа раздражают болевые рецепторы. Так, натяжение брюшины (опухоли), растяжение полого органа (например, желчная колика) или чрезмерное сокращение мышц вызывают абдоминальные боли. Болевые рецепторы полых органов брюшной полости (пищевод, желудок, кишечник, желчный пузырь, желчные и панкреатические протоки) локализуются в мышечной оболочке их стенок. Аналогичные рецепторы имеются в капсуле паренхиматозных органов, таких как печень, почки, селезенка, и их растяжение также сопровождается болью. Брыжейка и париетальная брюшина чувствительны к болевым стимулам, в то время как висцеральная брюшина и большой сальник лишены болевой чувствительности.
Абдоминальные боли подразделяются на острые, которые развиваются, как правило, быстро или, реже, постепенно и имеют небольшую продолжительность (минуты, редко несколько часов), а также хронические, для которых характерно постепенное нарастание. Эти боли сохраняются или рецидивируют на протяжении недель и месяцев. Этиологическая классификация абдоминальных болей представлена в табл. 1.
По механизму возникновения боли в брюшной полости подразделяются на висцеральные, париетальные (соматические), отраженные (иррадиирующие) и психогенные.
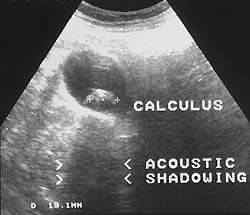 |
| Рисунок 1. Причиной абдоминальной боли может быть калькулезный холецистит (УЗИ) |
Висцеральная боль возникает при наличии патологических стимулов во внутренних органах и проводится симпатическими волокнами. Основными импульсами для ее возникновения являются внезапное повышение давления в полом органе и растяжение его стенки (наиболее частая причина), растяжение капсулы паренхиматозных органов, натяжение брыжейки, сосудистые нарушения.
Соматическая боль обусловлена наличием патологических процессов в париетальной брюшине и тканях, имеющих окончания чувствительных спинномозговых нервов.
Основными импульсами для ее возникновения являются повреждение брюшной стенки и брюшины.
Дифференциально-диагностические признаки висцеральной и соматической боли представлены в табл. 2.
Иррадиирующая боль локализуется в различных областях, удаленных от патологического очага. Она возникает в тех случаях, если импульс висцеральной боли чрезмерно интенсивен (например, прохождение камня) или при анатомическом повреждении органа (например, ущемление кишки). Иррадиирующая боль передается на участки поверхности тела, которые имеют общую корешковую иннервацию с пораженным органом брюшной области. Так, например, при повышении давления в кишечнике вначале возникает висцеральная боль, которая затем иррадиируют в спину, при билиарной колике — в спину, в правую лопатку или плечо.
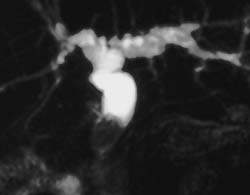 |
| Рисунок 2. Камень в общем желчном протоке у пациента после холецистэктомии (МРТ) |
Одной из разновидностей болей центрального генеза является абдоминальная мигрень. Последняя чаще встречается в молодом возрасте, носит интенсивный разлитой характер, но может быть локальной в параумбиликальной области. Характерны сопутствующие тошнота, рвота, понос и вегетативные расстройства (побледнение и похолодание конечностей, нарушения ритма сердца, артериального давления и др.), а также мигренозная цефалгия и характерные для нее провоцирующие и сопровождающие факторы. Во время пароксизма отмечается увеличение скорости линейного кровотока в брюшной аорте. Наиболее важными механизмами контроля болевого синдрома являются эндогенные опиатные системы. Опиатные рецепторы локализуются в окончаниях чувствительных нервов, в нейронах спинного мозга, в стволовых ядрах, в таламусе и лимбических структурах головного мозга. Связь данных рецепторов с рядом нейропептидов, таких как эндорфины и энкефалины, обусловливает морфиноподобный эффект. Опиатная система работает по следующей схеме: активация чувствительных окончаний приводит к выделению субстанции Р, что вызывает появление периферических восходящих и центральных нисходящих ноцицептивных (болевых) импульсов. Последние активизируют выработку эндорфинов и энкефалинов, которые блокируют выделение субстанции Р и снижают болевые ощущения.
Существенное значение в формировании болевого синдрома имеют серотонин и норадреналин. В структурах мозга находится большое количество серотонинергических и норадренергических рецепторов, а в состав нисходящих антиноцицептивных (противоболевых) структур входят серотонинергические и норадренергические волокна. Уменьшение уровня серотонина приводит к снижению болевого порога и усилению болей. Норадреналин опосредует увеличение активности антиноцицептивных систем.
Наличие болевого абдоминального синдрома требует углубленного обследования больного для уточнения механизмов его развития и выбора тактики лечения. Подавляющему большинству больных с наличием соматических болей, как правило, необходимо хирургическое лечение. Висцеральные боли, возникающие у больных как с наличием органических поражений органов пищеварения, так и без них, являются следствием нарушения, в первую очередь, моторной функции последних. В результате в полых органах повышается давление и/или наблюдается растяжение его стенки, и возникают условия для формирования восходящих ноцицептивных импульсов.
Моторная функция желудочно-кишечного тракта определяется активностью гладкомышечных клеток, находящейся в прямо пропорциональной зависимости от концентрации цитозольного Са 2+ . Ионы кальция, активируя внутриклеточные биоэнергетические процессы (фосфорилирование белков, превращение АТФ в цАМФ и др.), способствуют соединению нитей актина и миозина, что обеспечивает сокращение мышечного волокна. Одним из условий, необходимых для сокращения мышечного волокна, является высокая активность фосфодиэстеразы, которая участвует в расщеплении цАМФ и обеспечении энергией процессов соединения актина с миозином.
В регуляции транспорта ионов кальция участвуют ряд нейрогенных медиаторов: ацетилхолин, катехоламины (норадреналин), серотонин, холецистокинин, мотилин и др. Связывание ацетилхолина с М-холинорецепторами способствует открытию натриевых каналов и вхождению ионов натрия в клетку. Последнее снижает электрический потенциал клеточной мембраны (фаза деполяризации) и приводит к открытию кальциевых каналов, через которые ионы кальция поступают в клетку, вызывая мышечное сокращение.
Серотонин оказывает существенное влияние на моторику желудочно-кишечного тракта, активируя ряд рецепторов, локализирующихся на эффекторных клетках. Выделяют несколько подтипов рецепторов (5-МТ1-4), однако наиболее изучены 5-МТ3 и 5-МТ4. Связывание серотонина с 5-МТ3 способствует расслаблению, а с 5-МТ4 — сокращению мышечного волокна. В то же время механизмы действия серотонина на мышечные волокна желудочно-кишечного тракта до конца не установлены. Имеются лишь предположения о вовлечении в эти процессы ацетилхолина.
Тахикинины, в состав которых входят три типа пептидов (субстанция Р, нейрокинин А и В), связываясь с соответствующими рецепторами миоцитов, повышают их моторную активность не только в результате прямой активации, но и вследствие выделения ацетилхолина. Определенную роль в регуляции моторной функции кишечника играют эндогенные опиаты. При связывании их с μ- и δ-опиоидными рецепторами миоцитов происходит стимуляция, а с κ-рецепторами — замедление моторики пищеварительного тракта.
Основные направления купирования болевого абдоминального синдрома включают: а) этиологическое и патогенетическое лечение основного заболевания; б) нормализацию моторных расстройств; в) снижение висцеральной чувствительности; г) коррекцию механизмов восприятия болей.
Нарушения двигательной функции органов желудочно-кишечного тракта играют значительную роль в формировании не только болевого синдрома, но и большинства диспепсических расстройств (чувство переполнения в желудке, отрыжка, изжога, тошнота, рвота, метеоризм, поносы, запоры). Большинство из указанных выше симптомов могут иметь место как при гипокинетическом, так и при гиперкинетическом типе дискинезии, и только углубленное исследование позволяет уточнить их характер и выбрать адекватную терапию.
Одним из наиболее частых функциональных нарушений, в том числе и с наличием органической патологии органов пищеварения, является спастическая (гиперкинетическая) дискинезия. Так, при спастической дискинезии любого отдела пищеварительного тракта наблюдается повышение внутрипросветного давления и нарушение продвижения содержимого по полому органу, что создает предпосылки для возникновения боли. При этом скорость нарастания давления в органе пропорциональна интенсивности боли.
Спастическая дискинезия мышечной оболочки стенки полого органа или сфинктеров представляет собой наиболее частый механизм развития болевого синдрома при эзофагоспазме, дисфункции сфинктера Одди и пузырного протока, синдроме раздраженного кишечника.
В настоящее время для купирования болевого синдрома в комплексном лечении вышеуказанных заболеваний используются релаксанты гладкой мускулатуры, которые включают несколько групп препаратов. Антихолинергические средства снижают концентрацию интрацеллюлярных ионов кальция, что приводит к мышечной релаксации. Важно отметить, что степень релаксации находится в прямой зависимости от предшествующего тонуса парасимпатической нервной системы. Последнее обстоятельство определяет существенные различия индивидуальной эффективности препаратов данной группы. В качестве спазмолитиков используют как неселективные (препараты красавки, метацин, платифиллин, бускопан и др.), так и селективные М1-холиноблокаторы (гастроцепин и др.). Однако довольно низкая эффективность и широкий спектр побочных эффектов ограничивают их применение для купирования болевого синдрома у значительной части больных.
Механизм действия миотропных спазмолитиков в конечном итоге сводится к накоплению в клетке цАМФ и уменьшению концентрации ионов кальция, что тормозит соединение актина с миозином. Эти эффекты могут достигаться ингибированием фосфодиэстеразы, или активацией аденилатциклазы, или блокадой аденозиновых рецепторов, либо их комбинацией. Основными представителями данной группы препаратов являются дротаверин (но-шпа, но-шпа форте, спазмол), бенциклан (галидор), отилония бромида (спазмомен), метеоспазмил и др. При использовании миогенных спазмолитиков, так же как и М-холиноблокаторов, необходимо учитывать существенные индивидуальные различия их эффективности, отсутствие селективности эффектов (действуют практически на всю гладкую мускулатуру, включая мочевыделительную систему, кровеносные сосуды и др.), развитие гипомоторной дискинезии и гипотонии сфинктерного аппарата пищеварительного тракта, особенно при длительном применении. Данные препараты используются кратковременно (от однократного приема до двух-трех недель) для купирования спазма, а следовательно, болевого синдрома.
В ряду миотропных спазмолитиков следует отметить препарат мебеверин (дюспатолин), механизм действия которого сводится к блокаде быстрых натриевых каналов клеточной мембраны миоцита, что нарушает поступление натрия в клетку, замедляет процессы деполяризации и блокирует вход кальция в клетку через медленные каналы. В результате прекращается фосфорилирование миозина и отсутствует сокращение мышечного волокна. Известно также, что выход ионов кальция из внутриклеточных депо в результате активации α1-адренорецепторов приводит к открытию калиевых каналов, выходу ионов калия из клетки, гиперполяризации и отсутствию мышечного сокращения, что может становиться в течение длительного времени причиной мышечной гипотонии. В отличие от других миотропных спазмолитиков мебеверин препятствует пополнению внутриклеточных кальциевых депо, что в конечном итоге приводит лишь к кратковременному выходу ионов калия из клетки и ее гипополяризации. Последняя предупреждает развитие постоянного расслабления или гипотонии мышечной клетки. Следовательно, назначение мебеверина (дюспатолина) приводит только к снятию спазма без развития гипотонии гладкой мускулатуры, т. е. не нарушает моторики желудочно-кишечного тракта. Препарат оказался эффективным для купирования абдоминальных болей и дискомфорта, нарушений стула, обусловленных синдромом раздраженного кишечника, а также возникающих на фоне органических заболеваний.
Среди миотропных спазмолитиков также обращает на себя внимание препарат гимекромон (одестон). Одестон (7-гидрокси-4-метилкумарин) оказывает избирательное спазмолитическое действие на сфинктер Одди и сфинктер желчного пузыря, обеспечивает отток желчи в двенадцатиперстную кишку, снижает давление в билиарной системе и, как следствие, купирует билиарный болевой синдром. Одестон не обладает прямым желчегонным действием, но облегчает приток желчи в пищеварительный тракт, тем самым усиливая энтерогепатическую рециркуляцию желчных кислот, которые участвуют в первой фазе образования желчи. Преимущество одестона по сравнению с другими спазмолитиками заключается в том, что он практически не оказывает влияния на другие гладкие мышцы, в частности, кровеносной системы и кишечной мускулатуры.
Чрезвычайно перспективным направлением в лечении моторных расстройств является использование селективных блокаторов кальциевых каналов. В настоящее время из этой группы широкое распространение получил пинавериум бромид (дицетел). Дицетел блокирует потенциалзависимые кальциевые каналы миоцитов кишечника, резко снижает поступление в клетку экстрацеллюлярных ионов кальция и тем самым предотвращает мышечное сокращение. К числу достоинств дицетела относятся местное (внутрикишечное) действие препарата, тканевая селективность, отсутствие побочных, в т. ч. и кардиоваскулярных эффектов. Препарат можно применять в течение длительного времени, не опасаясь развития гипотонии кишечника. Клинические исследования показали высокую эффективность дицетела в лечении синдрома раздраженного кишечника и других заболеваний, при которых наблюдается спастическая дискинезия толстой кишки.
В купировании болевого синдрома особая роль отводится препаратам, влияющим на висцеральную чувствительность и механизмы восприятия болей. Это касается, в первую очередь, больных с функциональными заболеваниями желудочно-кишечного тракта (функциональная диспепсия, синдром раздраженного кишечника, функциональные абдоминальные боли и др.) и психогенными абдоминальными болями.
В настоящее время широко обсуждается возможность использования антидепрессантов, антагонистов 5-НТ3, агонистов κ-опиоидных рецепторов, аналогов соматостатина (октреотида). Из них лучше всего изучены антидепрессанты, реализующие противоболевой эффект двумя путями: 1) за счет уменьшения депрессивной симптоматики, учитывая тот факт, что хроническая боль может быть маской депрессии; 2) за счет активации антиноцицептивных серотонинергических и норадренергических систем. Антидепрессанты назначаются в терапевтических (но не в низких) дозах (амитриптилин 50-75 мг/сут., миансерин 30-60 мг/сут. и т. д.), продолжительность их приема должна составлять не менее 4-6 недель. Препараты эффективны в комплексной терапии.
Таким образом, генез абдоминальных болей является полиэтиологическим и полипатогенетическим. Лечение болевого синдрома должно быть направлено на нормализацию структурных и функциональных нарушений пораженного органа, а также на нормализацию функций нервной системы, отвечающих за восприятие болей.
1. Вегетативные расстройства. Руководство для врачей. Под ред. проф. А.М. Вейна. М., 1998.
2. Вейн А. М., Данилова А. Б. Кардиалгии и абдоминалгии // РМЖ, 1999. 7, № 9. С. 428-32.
3. Григорьев П. Я., Яковенко А. В. Клиническая гастроэнтерология. М.: Медицинское информационное агентство, 2001. С. 704.
4. Ивашкин В. Т. Синдром раздраженной кишки // Рос. журн. гастроэнтерол., гепатол., колопроктол. 1993, т. 2, № 3. С. 27-31.
5. Яковенко Э. П. Григорьев П. Я. Хронические заболевания внепеченочных желчевыводящих путей. Диагностика и лечение. Метод. пособие для врачей. М.: Медпрактика, 2000. С. 31.
- Генерализованный перитонит, развившийся в результате перфорации полого органа, внематочной беременности или первичный (бактериальный и небактериальный); периодическая болезнь
- Воспаление определенных органов: аппендицит, холецистит, пептические язвы, дивертикулит, гастроэнтерит, панкреатит, воспаление органов малого таза, колит язвенный или инфекционный, региональный энтерит, пиелонефрит, гепатит, эндометрит, лимфаденит
- Обструкция полого органа: интестинальная, билиарная, мочевыводящих путей, маточная, аорты
- Ишемические нарушения: мезентериальная ишемия, инфаркты кишечника, селезенки, печени, перекруты органов (желчного пузыря, яичек и др.)
- Другие: синдром раздраженного кишечника, ретроперитонеальные опухоли, истерия, синдром Мюнхаузена, отмена наркотиков
- Заболевания органов грудной полости (пневмония, ишемия миокарда, заболевания пищевода)
- Неврогенные (herpes zoster, заболевания позвоночника, сифилис)
- Метаболические нарушения (сахарный диабет, порфирия)
Примечание. Частота заболеваний в рубриках указана в убывающем порядке.
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
МЦ Управления делами Президента РФ, Москва
Органы брюшной полости обычно не чувствительны ко многим стимулам, которые при действии на кожу провоцируют сильную боль. Порезы, разрывы или другие повреждения внутренних органов брюшной полости не вызывают болевых ощущений. Основными воздействиями, к которым висцеральные болевые волокна чувствительны, являются растяжение или нарушение стенки кишечника. Это могут быть: натяжение брюшины (например, при опухоли), растяжение полого органа (например, при желчной колике) или сильные мышечные сокращения (например, при кишечной непроходимости). Нервные окончания волокон, отвечающих за боль в полых органах (кишечник, желчный пузырь, мочевой пузырь), локализуются в мышечных слоях. В паренхиматозных органах (печень, почки, селезенка) нервные окончания находятся в их капсуле и отвечают на ее растяжение при увеличении объема органа. Брыжейка, париетальная плевра и перитонеальная выстилка задней стенки брюшной полости чувствительны к боли, тогда как висцеральная плевра и большой сальник – нет. Для появления боли скорость нарастания напряжения должна быть достаточно большой. Постепенное же нарастание напряжения, например, такое, как при опухолевой обструкции желчевыводящих путей, может долго протекать безболезненно.
Воспаление и ишемия также способны вызывать висцеральную боль, при этом воспаление может повышать чувствительность нервных окончаний и снижать порог чувствительности к боли от других стимулов (в том числе и в процессе развития одного заболевания в разные его фазы). В механизмах возникновения и прогрессирования боли при воспалении участвуют многие биологические активные вещества (брадикинин, серотонин, гистамин, простагландины и др.).
Перечисленные коротко патофизиологические механизмы формирования абдоминальной боли являются исходной трудностью, нередко приводящей к поздней, в лучшем случае отсроченной диагностике. Вот почему повторное обращение к этой проблеме всегда является важным и полезным.
Первую группу составляют внутрибрюшные очаговые гнойные воспалительные процессы и их осложнения.
Острый аппендицит. Независимо от первоначальной локализации боли, в дальнейшем у абсолютного большинства больных боли и симптомы раздражения брюшины локализуются в правом нижнем отделе живота, фиксируется нарастающий лейкоцитоз и увеличение СОЭ. При отсутствии тенденции к нормализации названных показателей и при нарастании симптоматики показана лапаротомия. Необходимо иметь в виду и левостороннюю локализацию процесса при полном обратном расположении органов.
Нагноение кист и дивертикулов червеобразного отростка: клинических признаков, отличающих эту патологию от острого аппендицита, нет, но они могут появиться при проведении ургентного ультразвукового исследования.
Холецистит, эмпиема и водянка желчного пузыря. Локализация боли в правом верхнем отделе живота с симптомами раздражения брюшины или без таковых. Лейкоцитоз со сдвигом формулы влево и увеличение СОЭ. При обострении хронического холецистита у пожилых, при закупорке пузырного протока без признаков воспаления указанные признаки могут отсутствовать. Эту же симптоматику может продемонстрировать и острый аппендицит (при значительной длине и расположении аппендицита).
Наиболее надежным диагностическим приемом в данной ситуации является ультразвуковое исследование, так как рентгенологическое исследование при остром и обострении хронического процесса оказывается неэффективным.
Дивертикулит. Преимущественно в сигмовидной кишке; болезненность и симптомы раздражения брюшины, главным образом в левом нижнем отделе живота. Чаще болеют пожилые люди, страдающие патологией толстой кишки, нередко обострению предшествуют стойкие запоры (редко послабления). Нередко имеются явления частичной кишечной непроходимости и кровь в кале. Колоноскопия и ирригоскопия в этой ситуации противопоказаны. Анамнез, клиническое наблюдение и динамическое ультразвуковое исследование являются наиболее адекватными диагностическими приемами.
Острый аднексит. Симптомы раздражения брюшины незначительны. По клинико–лабораторным данным может быть сходен с любой острой очаговой патологией. Диагностический прием наиболее адекватный – ультразвуковое исследование, при неэффективности – лапароскопия.
В представленной группе болезней (особенно на ранней стадии) следует отметить преобладание местных симптомов над общими расстройствами. В осложненной стадии болезни – при стабилизации местных проявлений начинают нарастать и выходить вперед общие расстройства и интоксикация в первую очередь.
Перитонит (острый, хронический).
Эта группа болезней четко делится на две подгруппы: первую составляет острый перитонит, в диагностике которого основную роль играет предшествующий анамнез (за исключением дебюта язвенной болезни у молодых); вторая – хронические формы перитонита, диагностика которых крайне сложна. Положение облегчается, если основное заболевание известно и его продолжением или осложнением является процесс в брюшной полости.
Кишечная непроходимость (острая, хроническая). По механизму развития: механическая (спаечная, вследствие ущемления грыжи, опухоли, инвагинации – чаще у детей). У взрослых нередко причиной инвагинации являются полипы кишки, язвенные рубцы, закупорка просвета инородными телами (желчные камни, безоары и др.). При обтурации – боль схваткообразная, при странгуляции – наряду со схватками боль постоянна (часто явления шока); паралитическая (вследствие расстройства иннервации и кровоснабжения кишечной стенки), интоксикационная, вследствие тромбоза и эмболии мезентериальных сосудов, инфаркта брыжейки, после тяжелых операций, при перитоните, при тяжелых инфекциях, нервнорефлекторно; лекарственная – при лечении ганглиоблокаторами, b -адреноблокаторами в больших дозах и др.
В диагностике этой группы больных большое значение имеет тщательный анализ анамнестических данных (в т.ч. лекарственный) и общего состояния больного, в частности, сосудистых поражений у пожилых и старых людей, страдающих заболеваниями сердца и сосудов, приводящих к тромбозу и эмболии мезентериальных вен. При этом важным диагностическим признаком являются кровянистые жидкие испражнения. Эта группа больных является наиболее рельефной и понятной в практическом отношении. Особого внимания заслуживает хроническая (или частичная) кишечная непроходимость, которая часто является ранним симптомом опухолевой непроходимости и требует очень тщательного обследования больного с обязательным использованием колоноскопии. Не менее значимой является также группа с лекарственной паралитической непроходимостью, и в этом отношении лекарственный анамнез является ведущим, что позволяет избежать ненужного хирургического вмешательства.
Болезни, которые начинаются с болей и сопровождаются развитием желтухи:
а) острый и хронический калькулезный холецистит;
в) острый или обострение хронического панкреатита;
г) прогрессирующий стеноз терминального отдела общего желчного протока;
д) рак желчного пузыря, общего желчного протока и пожелудочной железы;
е) болезни печени: острый и обострение хронического гепатита, цирроз печени, первичный склерозирующий холангит, метастатическая печень.
Основной анализируемый признак – желтуха. Из лабораторных тестов наибольшее значение для подозрения о ее механическом характере имеет определение щелочной фосфатазы. Дальнейшая программа исследования, уточняющая характер и патогенез желтухи, должна строиться следующим образом:
Ультразвуковое исследование (выявляющее билиарную гипертензию – протоковую и внутрипеченочную; нередко при этом определяется и уровень препятствия. Им может быть не только открыта программа исследования, но и закончена).
Эндоскопия верхних отделов желудочно–кишечного тракта (могут быть получены относительные признаки поражения поджелудочной железы, поражение фатерова соска, опухоли желудка и двенадцатиперстной кишки, парафатеральный дивертикул с явлениями дивертикулита).
Ретроградная панкреатохолангиография (поражение панкреатических, общих желчных и печеночных протоков, камни в них, обтурирующая патология).
Лапароскопия (имеет преимущество в случаях, когда предыдущие методы не позволили уточнить диагноз, а клиническая картина заболевания свидетельствует о нарастании острого процесса – операция становится неизбежной. С помощью лапароскопии нередко удается не только установить уровень обтурации, но и провести разгрузку билиарной системы (дренировать желчный пузырь, рассматривая это как первый этап операции, дренировать малую сальниковую сумку и др.).
Поскольку основным симптомом ПАС является боль, то и основным диагностическим приемом для выяснения ее причин является метод дифференциальной диагностики. Программа исследования формируется в зависимости от симптомов, входящих в конкретный синдром. В качестве основного симптома ПАС, кроме боли, могут быть:
- нарастающая анемия
- падение артериального давления
- повышение температуры тела
- стойкий запор
- рвота
- понос
- изменение мочевого осадка
- желтуха
- изменения в биохимическом спектре крови.
Так, острая боль в животе и лихорадка – могут быть при острой пневмонии, базальном плеврите, остром перикардите, ревматическом кардите, тиреотоксическом кризе, периодической болезни, ненагнаивающемся панникулите (болезнь Вебера–Крисчена – кожно–висцеральном, висцеральном, абдоминальном вариантах), остром мезадените, пиелонефрите, опоясывающем лишае, геморрагическом васкулите и воспалительных заболеваниях органов брюшной полости; острая боль в животе и падение артериального давления – наблюдаются при остром инфаркте миокарда, остром панкреатите, расслаивающей гематоме брюшного отдела аорты, острой надпочечниковой недостаточности, при разрыве трубной беременности, перфорации язвы желудка, остром нарушении мезентериального кровообращения и т.д. Каждый симптомокомплекс позволяет ограничить круг нозологических форм и сделать диагностику вероятной, а так как в каждый симптомокомплекс входят острые заболевания органов брюшной полости, то и программа исследования должна строиться так, чтобы либо подтвердить их, либо отвергнуть. При этом во всех случаях после проведения общепринятого исследования применение инструментальных методов следует начинать с ультразвукового, который нужно проводить следующим образом:
Рассматривая эту группу заболеваний, следует иметь в виду:
Прекоматозные состояния у больных, страдающих сахарным диабетом (гипергликемия, ацетоурия, гипогликемия).
Тиреотоксический криз. Повышение температуры тела до фебрильных цифр, гиперемия и цианоз кожных покровов, особенно щек, шеи и конечностей, тахикардия до 150–160 ударов в минуту, увеличение пульсового давления, учащение дыхания, появление или нарастание психических расстройств. Очень часто возникают боли в животе, сопровождающиеся рвотой, диареей, что и служит причиной диагностики острого живота. Нередко тиреотоксический криз сопровождает желтуха, что является признаком нарастающей печеночной недостаточности. Скрининг–тестом тиреотоксического криза может служить определение в плазме крови концентрации связанного с белком йода (СБЙ), которая, будучи повышенной при тиреотоксикозе, резко возрастает во время криза. Вторым тестом является терапия ex juvantibus: внутривенное введение блокаторов синтеза тиреоидных гормонов – тиамазол в дозе 100 мг и b -блокаторов в дозе 2–10 мг (эффект около 3–4 часов).
В диагностике помогает выявление гиперхолестеринемии, снижение уровня СБЙ ниже 3,5 мг%; из клинических данных – низкое артериальное давление, брадикардия, гипотермия, урежение дыхания, олигурия–анурия.
Хроническая надпочечниковая недостаточность (криз): обращает на себя внимание пигментация кожи и слизистых; как правило, всегда имеются провоцирующие моменты.
Вторичная порфирия (в основе классической картины лежит парез капилляров брюшной полости). Определяется только корпопорфирин.
Тетания (развивается при снижении уровня кальция, известно два клинических варианта: первый – с затруднением дыхания по типу удушья и второй – с болями в животе, связанными с парезом кишечника (выраженным в разной степени). В диагностике – симптом Хвостека, удлинение интервала Q–Т на ЭКГ, снижение уровня кальция. Клинические проявления купируются в/венным введением раствора кальция.
Хроническая почечная недостаточность.
В целом диагностика их не сложна, основным и необходимым условием является напоминание, что они должны быть введены в круг нозологических форм, схожих по симптоматике.
Системные васкулиты (абдоминальный вариант узелкового артериита, капилляротоксикоз). При их диагностике следует помнить, что геморрагические высыпания могут быть и на коже; высокая артериальная гипертензия, артралгии, кровянистая рвота, примесь крови в кале и отсутствие органических изменений отмечаются при программном обследовании.
Сухотка спинного мозга. Знание ее в последнее время приобретает определенный смысл, т.к сифилис неуклонно растет. Если анализ болей в животе вызывает подозрение на наличие спинной сухотки, следует искать и другие симптомы этого страдания: глазные симптомы (анизокория, птоз, рефлекторная неподвижность); нарушение рефлексов (коленные снижены, отсутствуют); явления атаксии; атрофия зрительного нерва.
Диагноз табеса абсолютно достоверен при наличии 4–х симптомов и весьма вероятен при наличии 3–х. Из лабораторных подтверждений необходима реакция Вассермана и исследование спинно–мозговой жидкости.
Читайте также:


