Выявление у донора гепатита с
Аннотация научной статьи по ветеринарным наукам, автор научной работы — Еремеева Ж.Г., Фазылов В.Х.
Похожие темы научных работ по ветеринарным наукам , автор научной работы — Еремеева Ж.Г., Фазылов В.Х.
DETECTING OCCULT HEPATITIS В WHEN TESTING DONATED BLOOD
Individuals carrying occult (latent) hepatitis В pose epidemiological threat. Testing donated blood donors for surface antigen HBsAg (hepatitis В virus, HBV) only does not allow to assume the blood safe from the point of view of infections, which can result in post-transfusion transmission of infection. Lack of confidence here is due to the fact that the virus is present in the body even when HBsAg is negative. The study analyzes data of 61,155 blood donors of the Republican Blood Center (Kazan), collected in 2010-2014. The tests applied were those aimed at detecting HBsAg , anti-HBc-total , anti-HBc IgM ( enzyme immunoassay ), and determining DNA of the virus in the blood by polymerase chain reaction in "real time". It was found that donors with occult hepatitis В are identified each year, but their numbers decrease gradually. To prevent the spread of the virus it is recommended to add the anti-HBc-total test to the standard set of diagnostic tests.
ВЫЯВЛЕНИЕ ОККУЛЬТНОГО ГЕПАТИТА B ПРИ ТЕСТИРОВАНИИ ДОНОРСКОЙ КРОВИ
Ж. Г. Еремеева1 В. Х. Фазылов2
1 Республиканский клинический кожно-венерологический диспансер, Казань
2 Кафедра инфекционных болезней, медико-профилактический факультет, Казанский государственный медицинский университет, Казань
Ключевые слова: оккультный гепатит B, латентный гепатит B, HBV-инфекция, донор, кровь, иммуноферментый анализ, ПЦР-диагностика, HBsAg, anti-HBc-total, anti-HBc IgM
Благодарности: авторы благодарят Рамиля Тураева из Республиканского центра крови (Казань) за возможность работать с картами доноров и отчетными формами учреждения.
Сх] Для корреспонденции: Еремеева Жанна Григорьевна
пр-т Победы, д. 39, кв. 91, г Казань, 420110; fin5zhannik@rambler.ru
Статья получена: 01.02.2017 Статья принята в печать: 18.02.2017
DETECTING OCCULT HEPATITIS B WHEN TESTING DONATED BLOOD
Eremeeva ZhG1 Fazylov VH2
1 Republican Clinical Dermatovenerologic Dispensary, Kazan, Russia
2 Department of Infectius Diseases, Medico-Prophylactic Faculty, Kazan State Medical University, Kazan, Russia
Individuals carrying occult (latent) hepatitis B pose epidemiological threat. Testing donated blood donors for surface antigen HBsAg (hepatitis B virus, HBV) only does not allow to assume the blood safe from the point of view of infections, which can result in post-transfusion transmission of infection. Lack of confidence here is due to the fact that the virus is present in the body even when HBsAg is negative. The study analyzes data of 61,155 blood donors of the Republican Blood Center (Kazan), collected in 2010-2014. The tests applied were those aimed at detecting HBsAg, anti-HBc-total, anti-HBc IgM (enzyme immunoassay), and determining DNA of the virus in the blood by polymerase chain reaction in "real time". It was found that donors with occult hepatitis B are identified each year, but their numbers decrease gradually. To prevent the spread of the virus it is recommended to add the anti-HBc-total test to the standard set of diagnostic tests.
Keywords: occult hepatitis B, latent hepatitis B, HBV infection, donor, blood, enzyme immunoassay, PCR diagnostics, HBsAg, anti-HBc-total, anti-HBc IgM
Acknowledgements: authors thank Ramil Turaev from the Republican Blood Center (Kazan, Russia) for the opportunity to work with donor cards and Center's reports.
[X] Correspondence should be addressed: Zhanna Eremeeva
prospekt Pobedy, d. 39, kv. 91, Kazan, Russia, 420110; fin5zhannik@rambler.ru
Received: 01.02.2017 Accepted: 18.02.2017
Инфекционная безопасность донорской крови определяет предупреждение передачи гемоконтактных инфекций от донора реципиенту. Скрининговая диагностика вирусного гепатита B (hepatitis B virus, HBV) привела к значительному снижению заболеваемости этой инфекцией [1]. Однако, несмотря на доступность чувствительных тест-систем для обнаружения поверхностного антигена HBV (HBsAg), по-прежнему имеют место случаи посттрансфузионного гепатита В [2, 3]. Это связано с тем, что вирус может длительное время находиться в латентном состоянии в ткани печени, а в некоторых случаях — и в крови HBsAg-отрица-
тельных пациентов [4, 5]. Поэтому оккультный (латентный) гепатит В представляет опасность при донорстве крови и трансплантации органов [6]. Описаны случаи обнаружения ДНК ИВУ у реципиентов, получавших Ь^-негативную кровь от доноров, имевших скрытую ИВУ-инфекцию. Таким образом, латентный гепатит В представляет реальную угрозу распространения вируса в популяции и его активации в организме человека в условиях иммуносупрессии [5].
Целью нашего исследования явилась диагностика скрытой формы ИВУ-инфекции, выявленной при тестировании донорской крови.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование провели на базе Республиканского центра крови (РЦК) в г. Казани. Были проанализированы данные 61 155 донора, полученные в 2010-2014 гг.: результаты тестирования на HBsAg, антитела к ядерному антигену суммарные (anti-HBc-total), иммуноглобулины класса M к ядерному антигену (anti-HBc IgM), ДНК HBV.
HBsAg — скрининговый маркер HBV-инфекции. Регистрация данного маркера при тестировании донорской крови подтверждает наличие активных источников инфекции. Лиц, в крови которых обнаруживают HBsAg, отводят от донорства, в отношении них проводят необходимые противоэпидемические мероприятия. В казанском РЦК
в 2010-2014 гг. было зафиксировано от 6 до 25 случаев выявления маркера в год (рис. 1), при этом отмечена тенденция к снижению числа таких случаев.
Положительные результаты на а^-НВс^а! регистрировали ежегодно в 3,5-6,9 % случаев, т е. кровь от 400 до 900 доноров не могла быть использована в дальнейшем (рис. 2). При выявлении этого маркера проводится также дополнительная диагностика на аг^-НВс 1дМ. В 20102014 гг. иммуноглобулины класса М обнаруживались в 2,5-9, 9 % образцов крови доноров с признаками присутствия в организме НВУ-нфекции в латентной форме (образцов с положительным результатом по агШ-НВс^а!) (рис. 3). Аг^-НВс 1дМ — маркер активности вируса в организме, который указывает на необходимость детального обследования человека.
2010 2011 2012 2013
100 -80 -60 -40 -20 -
2010 2011 2012 2013
Год исследования Положительный тест на апА-НВс 1дМ Положительный тест на апА-НВс-Ь^а! и/или НВэДО
Рис. 1. Статистика положительных результатов скрининг-теста (НВэАд) за Рис. 2. Статистика по числу случаев обнаружения в крови доноров апй-
HBc-total за 2010-2014 гг.
14000 12000 10000 -8000 -6000 -4000 -2000
2012 Год исследования
■ Численность доноров с положительным _ „. „„,,„„„„,„,„„т, „„,,„„„„
г Ш Общая численность доноров
результатом теста на апй-НВс-Ь^а!
Рис. 3. Доля доноров, в крови которых обнаружены иммуноглобулины класса М, в группе доноров с положительными результатами на апИ-НВс^а! и/или НВэАд в 2010-2014 гг.
ВЕСТНИК РГМУ | 1, 2017 | VESTNIKRGMU.RU
2010 2011 2012 2013 2014
■ Положительный тест на anti-HBc-total и/или HBsAG
■ Обнаружена ДНК HBV
Рис. 4. Число случаев обнаружения ДНК вируса гепатита В в крови доноров с положительными результатами тестов на HBsAg и/или anti-HBc-total в 2010-2014 гг.
В России далеко не во всех лечебно-профилактических учреждениях исследуют кровь доноров на наличие антител к вирусу гепатита В (с помощью маркеров anti-HBc-total или anti-HBc IgM), что затрудняет своевременное выявление латентной формы HBV-инфекции. Полученные нами данные позволяют заключить, что отсутствие в крови HBsAg не является гарантией инфекционной безопасности донорской крови, поскольку положительный результат на anti-HBc-total указывает на наличие контакта с вирусом в прошлом, а на anti-HBc IgM — на активную инфекцию. В HBsAg-негативной фазе ДНК вируса может присутствовать в организме на низком уровне: с определением в пе-
чени и редко — в сыворотке крови [8]. Поэтому эта фаза не означает полного выздоровления, т. к. в любой момент может наступить рецидив заболевания — стадия реактивации [9, 10]. У пациентов с латентной HBV-инфекцией было выявлено сохранение эффективного иммунологического ответа (анти-HBc total), что может привести к реактивации HBV с повторным появлением HBsAg [11].
Трудность выявления оккультного гепатита B объясняется отсутствием обязательного исследования крови на маркеры латентной HBV-инфекции и дальнейшего обследования донора. В эпидемиологическую службу поступают сведения о донорах с положительным результатом только по одному маркеру — HBsAg. Для своевременной реализации профилактических и противоэпидемических мероприятий необходимо дополнительно обследовать и наблюдать диспансерно лиц, в крови которых обнаружены anti-HBc-total и anti-HBc IgM. В противном случае использование крови доноров с оккультным гепатитом B увеличивает риск инфицирования при гемотрансфузиях и способствует циркуляции вируса в популяции [12, 13].
Ежегодно среди доноров выявляются лица с положительными результатами тестирования на маркеры HBV-ин-фекции (HBsAg, anti-HBc-total, anti-HBc IgM, ДНК HBV). Введение в стандарт диагностики вирусного гепатита B в центрах крови определения anti-HBc-total позволит повысить выявляемость латентной HBV-инфекции [14, 15]. Организация преемственности работы специалистов центров крови и других лечебно-профилактических учреждений обеспечит раннее выявление активных форм инфекции и предупреждение хронизации процесса, а также поможет предотвратить заражение других лиц.
1. Enticott JC, Kandane-Rathnayake RK. Prevalence versus incidence. Transfusion. 2012 Sep; 52 (9): 1868-70. DOI: 10.1111/j.1537-2995.2012.03687.x.
2. Saraswat S, Banerjee K, Chaudhury N, Mahant T, Khandekar P, Gupta RK, et al. Post-transfusion hepatitis type B following multiple transfusions of HBsAg-negative blood. J Hepatol. 1996 Nov; 25 (5): 639-43.
3. Satake M, Taira R, Yugi H, Hino S, Kanemitsu K, Ikeda H, et al. Infectivity of blood components with low hepatitis B virus DNA levels identified in a lookback program. Transfusion. 2007 Jul; 47 (7): 1197-205.
4. Ивашкин В. Т., Морозова М. А., Маевская М. В., Соколи-на И. А, Герман Е. Н. Бундина М. В. Факторы риска развития гепатоцеллюлярной карциномы. Российский журнал гастроэнтерологии, гепатологии и колопроктологии. 2009; (1): 4-15.
6. Фазылов В. Х. Этиологические и патогенетические аспекты диагностики и лечения вирусных гепатитов. Казанский медицинский журнал. 2013; ( 6): 785-92.
7. Hollinger FB. Hepatitis B virus infection and transfusion medicine: science and the occult. Transfusion. 2008 May; 48 (5): 1001-26. DOI: 10.1111/j.1537-2995.2008.01701.x.
8. Zerbini A, Pilli M, Boni C, Fisicaro P, Penna A, Di Vincenzo P, et al. The characteristics of the cell-mediated immune response
identify different profiles of occult hepatitis B virus infection. Gastroenterology 2008 May;134 (5): 1470-81.
10. Нечаев В. В. Мукомолов С. Л., Назаров В. Ю., Пожидае-ва Л. Н., Чахарьян В. В. Хронические вирусные гепатиты: прошлое, настоящее, будущее. Эпидемиология и инфекционные болезни. 2013; (3): 4-10.
11. Raimondo G, Allain JP, Brunetto MR, Buendia MA, Chen DS, Colombo M, et al. Statements from the Taormina expert meeting on occult hepatitis B virus infection. J Hepatol. 2008 Oct; 49 (4): 652-7. DOI: 10.1016/j.jhep.2008.07.014.
12. Еналеева Д. Ш. Современные аспекты естественного течения хронического вирусного гепатита B. Казанский медицинский журнал. 2012; 93 (2): 161-6.
13. Еналеева Д. Ш., Фазылов В. Х., Созинов А. С. Хронические вирусные гепатиты В, С и D. М.: МЕДпресс-информ; 2011. 464 с.
14. Морозов И. А., Ильченко Л. Ю., Федоров И. Г., Гордей-чук И. В., Гордейчук И. Н., Княженцева А. К. и др. Скрытый гепатит В: клиническое значение и проблемы диагностики. Архив внутренней медицины. 2012; (4): 39-45.
15. Гордейчук И. В., Малинникова Е. Ю., Попова О. Е. Латентный гепатит В у пациентов с ВИЧ-инфекцией. Мир вирусных гепатитов. 2008; (6): 3-7.
1. Enticott JC, Kandane-Rathnayake RK. Prevalence versus incidence. Transfusion. 2012 Sep; 52 (9): 1868-70. DOI: 10.1111/j.1537-2995.2012.03687.x.
2. Saraswat S, Banerjee K, Chaudhury N, Mahant T, Khandekar P, 9. Gupta RK, et al. Post-transfusion hepatitis type B following multiple transfusions of HBsAg-negative blood. J Hepatol. 1996 Nov; 25 (5): 639-43.
3. Satake M, Taira R, Yugi H, Hino S, Kanemitsu K, Ikeda H, et al. 10. Infectivity of blood components with low hepatitis B virus DNA levels identified in a lookback program. Transfusion. 2007 Jul; 47
4. Ivashkin VT, Morozova MA, Maevskaya MV, Sokolina IA, German YeN, Bundina MV. [Risk factors of development of hepatocellular carcinoma]. The Russian Journal of Gastroenterology, Hepatology and Coloproctology. 2009; (1): 12. 4-15. Russian.
5. Aleshkin VA, Zubkin ML, Selkova EP, Chervinko VI, Suslov AP, Ovchinnikov YuV, et al. [Epidemiological and clinical significance 13. of "occult" HBV-infection]. Epidemiology and Infectious Diseases. Topical issues. 2015; (4): 55-64. Russian.
6. Fazylov VH. [Etiological and pathogenetic aspects of diagnosis 14. and treatment, of viral hepatitis]. Kazan Medical Journal. 2013;
7. Hollinger FB. Hepatitis B virus infection and transfusion medicine: science and the occult. Transfusion. 2008 May; 48 (5): 1001-26. 15. DOI: 10.1111/j.1537-2995.2008.01701.x.
8. Zerbini A, Pilli M, Boni C, Fisicaro P, Penna A, Di Vincenzo P, et
al. The characteristics of the cell-mediated immune response
identify different profiles of occult hepatitis B virus infection.
Gastroenterology 2008 May;134 (5): 1470-81.
World Gastroenterology Organisation. WGO Global Guideline —
Nechaev VV, Mukomolov SL, Nazarov VYu, Pozhidaeva LN, Chakharyan VV. [Chronic viral hepatitis: past, present and future]. Epidemiology and Infectious Diseases. 2013; (3): 4-10. Russian. Raimondo G, Allain JP, Brunetto MR, Buendia MA, Chen DS, Colombo M, et al. Statements from the Taormina expert meeting on occult hepatitis B virus infection. J Hepatol. 2008 Oct; 49 (4): 652-7. DOI: 10.1016/j.jhep.2008.07.014. Enaleeva DSh. [Modern aspects of the natural history of chronic hepatitis B-virus wi-B]. Kazan Medical Journal. 2012; 93 (2): 1616. Russian.
Enaleeva DSh, Fazylov VH, Sozinov AS. Khronicheskie virusnye gepatity B, C i D. Moscow: MED-press-infrom; 2011. 464 p. Russian.
Morozov IA, Ilchenko LYu, Fedorov IG, Gordeychuk IV, Gordeychuk IN, Knyazhentseva AK, et al [Hidden Hepatitis B: Clinical significance and problems of diagnostics]. Archive of Internal Medicine. 2012; (4): 39-45. Russian. Gordeychuk IV, Malinnikova EYu, Popova OE. [The latent hepatitis B in patients with HIV infection]. World of Viral Hepatitis. 2008; (6): 3-7. Russian.
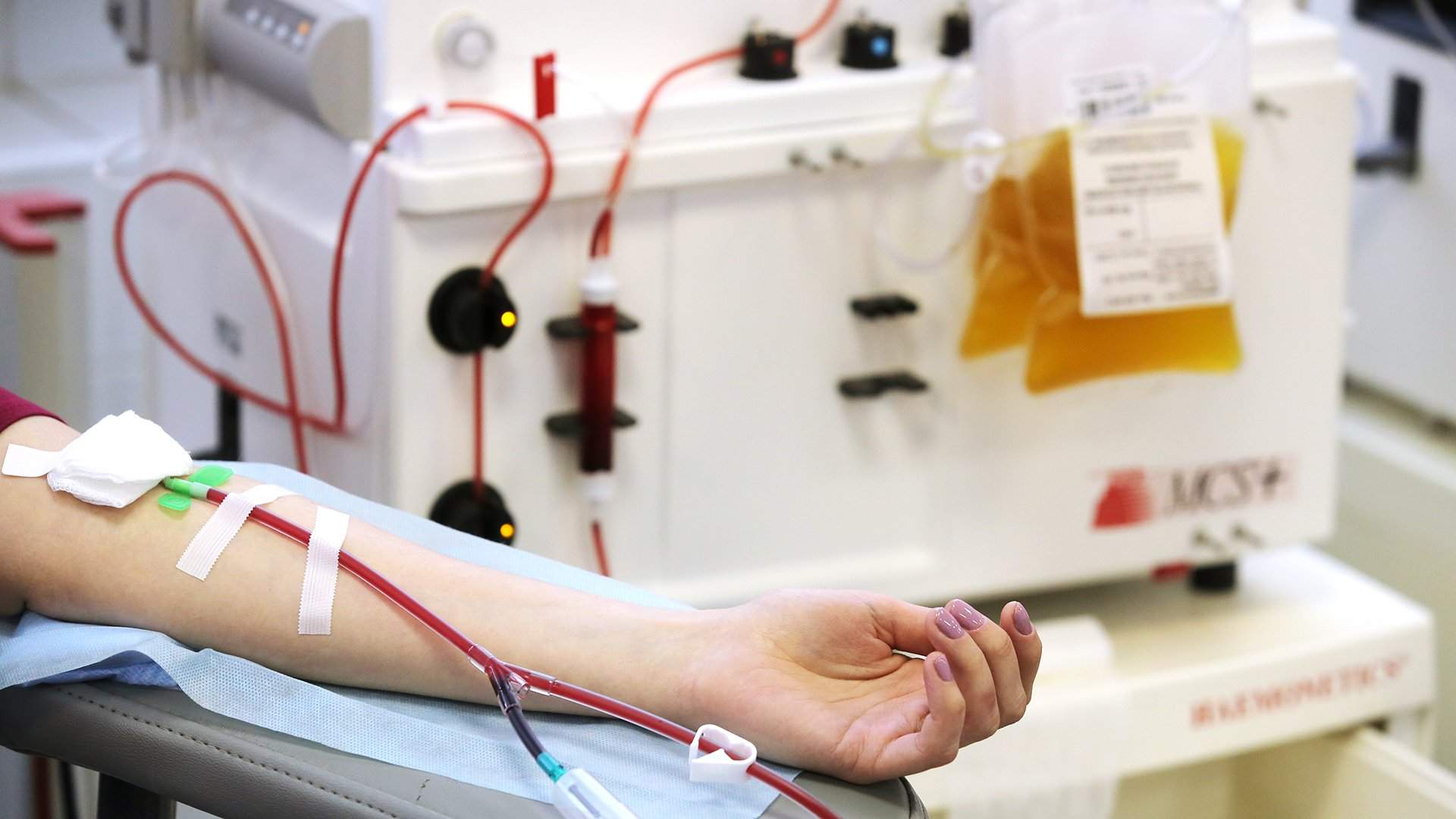
Догадка как повод
26 онкобольных детей заразились гепатитом С в больнице Амурской области. Заражены они были в течение двух лет, однако об этом стало известно только в декабре 2018 года. В региональном минздраве заверили, что инфицированы не 26, а 12 детей и подростков, больных тяжелыми заболеваниями крови. При этом депутат заксобрания Амурской области Сергей Труш заявлял, что к нему поступает всё больше обращений от родителей. Точное число инфицированных неизвестно.
Управление СК РФ по Амурской области возбудило дело о нарушении санитарно-эпидемиологических правил. Следствие рассматривает несколько версий. Первая — медперсонал грубо нарушал санитарно-эпидемиологические правила (предположительно, многократно использовал медицинские перчатки и пробки от катетеров). Вторая — кровь, которую переливали детям, могла быть получена от зараженного донора. Губернатор Амурской области уверял, доноров проверили в первую очередь — вируса гепатита у них выявлено не было.
Опрошенные корреспондентом врачи-трансфузиологи сочли эту версию близкой к фантастике, однако следователи ее пока не отметают. А в Минюсте и Госдуме после инцидента в Амурской области предложили ужесточить наказание за заражение при переливании и усилить контроль за службой крови.
Приговор по крови

В 1988 году в России был зафиксирован массовый случай заражения ВИЧ при переливании крови. В больнице Элисты были инфицированы 76 детей и пятеро взрослых. Зараженные разъехались по соседним регионам, в итоге вирус разошелся дальше. Итог — порядка 270 инфицированных. Результаты расследования показали, что медперсонал использовал нестерильные инструменты.
В конце 1990-х дважды заражения ВИЧ происходили в столичных клиниках. В первом случае нескольким пациентам перелили кровь от инфицированного донора по ошибке — при лабораторных исследованиях в ней не удалось отловить вирус. А во втором оказалось, что при исследовании был получен положительный результат на СПИД, но кровь при этом не отбраковали. Заразились трое детей, один из них умер.
В Пензе почти 20 лет назад женщине при операции по удалению селезенки перелили кровь от инфицированного ВИЧ донора, которым оказался врач той же больницы. Аналогичный случай был зафиксирован в 2016-м в екатеринбургской клинике: трем женщинам в ходе процедуры иммунизации лимфоцитами для лечения бесплодия перелили кровь от ВИЧ-инфицированной санитарки. В подавляющем большинстве случаев уголовное дело не заводилось, но суд назначал крупные компенсации, вплоть до нескольких миллионов рублей.
С конца 1980-х по 2013 год зарегистрировано почти 80 случаев заражения ВИЧ при переливании крови. Статистики по инфицированию гепатитом С нет.

Главный внештатный специалист-трансфузиолог Минздрава РФ Татьяна Гапонова приводила цифры, согласно которым до 2005 года около 95% больных гемофилией, нуждавшихся в препаратах крови, заражались гепатитом С — после начали проводить вирусную инактивацию (по сути, обеззараживание) компонентов крови и риски были сведены к минимуму.
Закон донора
С 1 января 2019 года вступила в силу новая редакция закона. Технический регламент отменяется, а новые правила должны быть установлены постановлением правительства. Пока его нет. Безопасность оборота крови будет обеспечена, но этого недостаточно, считает вице-спикер Госдумы Ирина Яровая. Она готовит законопроект, которым вводится административная и уголовная ответственность за качество и безопасность подготовки донорской крови.
Жесткий отвод

Вместе с тем он не исключил, что в отдаленной Амурской области система контроля может быть не столь отлаженной. Десять лет массовые критические нарушения Росздравнадзор выявлял именно в регионах.
Неуловимый вирус
Основная проблема в том, что даже самые современные методы диагностики могут не выявить вирус. Методики, которые используются для определения наличия возбудителя в крови донора, как и любые измерительные методики, имеют инструментальные ошибки и погрешности, подчеркивает завотделением переливания крови НМИЦССХ им. А.Н. Бакулева Алексей Купряшов.

Сначала пряник
Главное при поиске виновных — выяснить, имел ли место злой умысел, уверен юрист Асад Юсуфов. Если есть все доказательства того, что после всех этапов проверки вирус не был выявлен, наказание не должно применяться, считает он.


Дата публикации: 17.01.2017 2017-01-17
Статья просмотрена: 1046 раз
Проведено комплексное изучение уровня инфекционной безопасности донорской крови и факторов, ассоциированных с наличием маркеров парентеральных инфекций (анти-ВИЧ, анти-ВГС и HBsAg) среди донорской популяции.
Оценена чувствительность и специфичность тестирования донорской крови на anti-HIV, anti-HCV, anti-Паллидум и HBsAg в лаборатории Республиканского Центра Крови, после чего проводили сравнение чувствительности тестирования донорской крови на парентеральные инфекции до и после внедрения системы контроля качества в лабораторную службу Центра крови.
Сравнительный анализ качества лабораторной диагностики в РЦК показал, что чувствительность тестирования донорской крови на маркеры парентеральных инфекций составила: анти-ВГС (92,1 %), HBsAg (97,6 %) и анти-паллидум (20,4 %).
Повышение чувствительности тестирования на маркеры вирусных гепатитов является статистически значимым и свидетельствует об эффективности внедрения системы контроля качества лабораторной диагностики в РЦК, осуществляемой при технической поддержке СиДиСи/ЦАР и Министерства здравоохранения КР.
Ключевые слова: гемотрансмиссивные инфекции, безопасная кровь, чувствительность, маркеры
В последние годы во многих странах возникли трудности с набором и сохранением донорских кадров, связанные с резким ростом инфекций, связанных с гемотрансфузиями: гепатита В и С, СПИДа, сифилиса (1–6, 9–10).
В многочисленных как отечественных, так и зарубежных публикациях (7- 9) отмечается, что одним из факторов повышенного риска передачи гемотрансмиссивных инфекций являются первичные доноры.
Этот контингент лиц (в основном, люди молодого возраста) составляет большинство т. н. “семейных” доноров, предлагающих свою кровь для больных, получающих лечение в Национальном хирургическом центре МЗ КР.
Однако, известно, что именно эти доноры крови подвержены риску заражения инфекционными агентами пропорционально распространенности заболевания среди населения страны. Наблюдается также значительное повышение частоты HBsAg- носителей среди первичных доноров (14), а среди HBsAg-негативных доноров выявлен существенный уровень анти-НВс IgM-позитивных лиц.
В связи с этим, обеспечение вирусной безопасности крови и ее компонентов, в частности, для хирургического центра с высокой операционной активностью, является важнейшей совместной задачей как хирургов, так и службы крови, в частности, в аспекте изучения встречаемости и анализа динамики выявления маркеров гемотрансмиссивных инфекций, особенно при отборе перспективных первичных доноров (11–14).
В целях оценки состояния инфекционной безопасности донорской крови в Кыргызской Республике, на базе Республиканского Центра Крови (РЦК) Министерства здравоохранения КР, при содействии и непосредственном участии специалистов Национального центра хирургии МЗ КР, а также регионального офиса Центров по контролю и профилактике заболеваний (CDC) в Центральной Азии, было проведено специальное исследование, задачами которого были:
- Оценить уровень инфекционной безопасности донорской популяции, которая прошла обследование и сдала кровь как в РЦК, так и в выездных условиях
- Определить факторы, ассоциированные с наличием маркеров парентеральных инфекций (анти-ВИЧ, анти-ВГС и HBsAg) среди донорской популяции
- Оценить чувствительность и специфичность тестирования донорской крови на anti-HIV, anti-HCV, anti-Паллидум и HBsAg в лаборатории Республиканского Центра Крови
- Сравнить чувствительность тестирования донорской крови на парентеральные инфекции до и после внедрения системы контроля качества в лабораторную службу Центра крови
Материал иметоды:
Контингент: С апреля по июнь 2012 г. на базе Республиканского Центра крови и в выездных условиях было собрано 2500 образцов сывороток крови доноров. В исследуемую группу вошли все доноры, сдавшие кровь однократно за этот период, независимо от их типа (доноры крови или/и плазмы) и вида (безвозмездные, платные, и доноры-родственники для больных Национального центра хирургии МЗ КР). Для забора крови у доноров использовали закрытые системы одноразового пользования (гемаконы).
Анкетирование: Сбор эпидемиологических данных проводили на основе специально разработанной анкеты. Анкета включала демографические данные и возможные факторы риска инфицирования доноров крови.
Было собрано 843 заполненных вопросника на отстраненных доноров на до-лабораторном этапе с целью описания донорской популяции, что составило 33,7 % от общего числа опрошенных доноров. Вопросник включал демографические данные, а также причину отстранения (временную или постоянную) от дачи крови.
Получение образца сыворотки крови: По окончании забора крови в гемакон, после получения согласия донора, согласно разработанным операционным процедурам, дополнительно собирали кровь в 2 пробирки-спутника и в пробирку в объеме 8 мл для проведения данного исследования.
Тестирование образцов сывороток крови доноров влаборатории Республиканского Центра крови.
В лаборатории Центра крови исследуемые образцы (n=2500) были тестированы методом ИФА, при использовании тест-систем Российского производства:
Диагностика сифилиса осуществлялась методом микрореакции и РПГА в клинико-биохимической лаборатории.
Обеспечение контроля качества исследований, проведенных в лаборатории Центра крови
Входной контроль тест-систем для диагностики ВИЧ инфекции каждой серии проводился в РО СПИД, после чего тест-системы централизованно поступали в центры крови. Входной контроль тест-систем для диагностики вирусных гепатитов В и С каждой серии проводился в Центре контроля качества лабораторной диагностики инфекционных болезней (ЦККЛДИБ) согласно договору между РЦК и ЦККЛДИБ.
Внутрилабораторный контроль качества проводился ежедневнопри каждой постановке, с использованием внутрилабораторных стандартных образцов на анти-ВИЧ, анти-ВГС собственного производства; внутрилабораторные стандартные образцы на HBsAg получали из ЦККЛДИБ.
Тестирование образцов сывороток крови доноров вРеференс-лаборатории
Контрольный скрининг аналогичных образцов сывороток крови доноров (n=2500) проводили на базе ЦККЛДИБ в три этапа:
I этап— скрининг 2500 образцов сывороток крови доноров методом ИФА, с использованием тест-систем Российского производства:
II этап— все положительные образцы крови доноров + 10 % из числа отрицательных образцов, тестировали методом ИФА, при использовании экспертных тест-систем:
Обеспечение контроля качества исследований, проведенных в Референс лаборатории
Качество результатов обеспечивалось соблюдением правил и условий проведения пре-аналитического, аналитического и пост-аналитического этапов лабораторного исследования и контролировалось с помощью выполнения программы внутрилабораторного контроля качества, включающего:
‒ Позитивные и негативные образцы на анти-ВИЧ
‒ Позитивные и негативные образцы на анти-ВГС
‒ Позитивные и негативные образцы на HBsAg
‒ Позитивные и негативные образцы на анти-Паллидум
- Использование низкотитражных внутрилабораторных стандартов при каждой постановке для выявления недопустимых погрешностей и оценки степени точности проводимых исследований.
Использование системы внутрилабораторного контроля качества позволило гарантировать надежность полученных результатов.
Все референс — панели и стандартные образцы были разработаны и аттестованы в ЦККЛИДБ согласно требований ISO (GUIDE 34–35) и ВОЗ (WHO Working/Report 3. — Geneva — 2000). Референс-панель сывороток на HBsAg была откалибрована по международному стандарту HBsAg NIBS 00/588.
Значения равные или выше оптической плотности критического уровня учитывали как положительные, т. е. содержащие исследуемые маркеры. Значения ниже ОП критического уровня учитывали как отрицательные, т. е. не содержащие исследуемые маркеры.
Чувствительность и специфичность использованных тест-систем была определена как 100 % при входном контроле качества. Выявление случайных и систематических погрешностей при постановке ИФА проводили по внутрилабораторным позитивным стандартам и учитывали при построении контрольной карты Шухарта, с применением правил Вестгарта. Данные контрольных измерений погрешности, впоследствии были проанализированы и устранены.
Определение чувствительности испецифичности (Таблица 4-х полей)
Испытуемая
Система (ЦК)

Чувствительность — способность системы выявлять истинно положительные результаты. Формула: А/(А+С) х 100%
Специфичность— способность испытуемой системы выявлять истинно отрицательные результаты. Формула: D/(D+B) x 100%
Определение “положительных” случаев на основании лабораторного тестирования
‒ ВИЧ положительными считали доноров, у которых положительные результаты скринингового и экспертного тестов ИФА подтверждались в иммуноблоте.
‒ HBsAg, анти-ВГС, анти-Паллидум положительными считали доноров, у которых положительные результаты скринингового теста в ИФА подтверждались экспертным тестом в ИФА
Ввод иобработка данных
По результатам анкетирования доноров крови была создана база данных. Статистический анализ демографических данных и факторов риска инфицирования доноров проводили с использованием компьютерной программы EpiInfo 2000.
Результаты исследования
Факторы, ассоциированные с наличием маркеров парентеральных инфекций среди доноров крови
Характеристика донорской популяции
Всего было исследовано 2500 доноров, из них 1507 (60,3 %) — жители г. Бишкека и 993 (39,7 %) жители других населенных пунктов; из них 72,4 % составили мужчины (1810/2500). Большинство 1601 (64 %) исследуемых доноров, составили люди, пришедшие в Центр крови, и лишь 899 (36 %) доноров было обслужено в выездных условиях. Минимальный возраст доноров был равен 18 годам, максимальный — 60 лет, медиана возраста — 28 лет, мода — 20 лет. Наибольшее количество доноров наблюдается в возрастных группах от 18 до 30 лет (55,2 %), рис. 1.
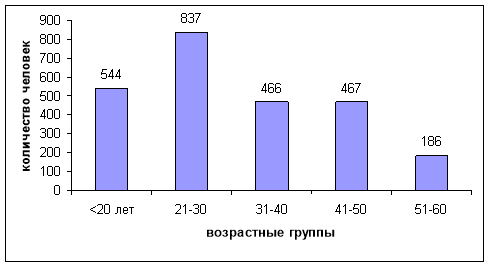
Рис. 1. Возрастное распределение абсолютного количества доноров (n=2500)
Доля доноров с первой группой крови составила 34 %, второй группы — 29,5 %, третьей группы — 28 %, и четвертой группы — 8,5 %. Положительный резус — фактор был у 93,6 % доноров.
По типу сдачи крови платные доноры составили 12,6 %, доноры-родственники — 49,9 %, безвозмездные — 37,5 %.
54 % доноров имели среднее и среднее специальное образование, 43 % — высшее и неоконченное высшее образование, и почти 3 % — неполное среднее образование.
В качестве мотивации для донорства, 84,1 % доноров указывали на желание помочь больному, 12,3 % — получить деньги, 3,6 % доноров указали другие причины.
Данные распространенности ВИЧ, вирусных гепатитов В и С, антител к сифилису и повышенного уровня АЛТ представлены на рис. 2.
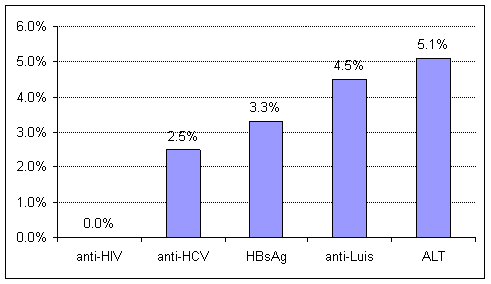
Рис. 2. Процент распространенности случаев anti-HIV, anti- HCV, HBsAg, anti-Паллидум и АЛТ среди доноров крови, г. Бишкек, апрель-июль 2012 г.
Возраст отстраненных доноров составил от 18 до 59 лет (средний возраст 34,0±11,4), из них 52,9 % составили мужчины (446/843). Из числа 843 отстраненных доноров, большинство, то есть 510 человек (60,5 %) были жителями г. Бишкека.
Большинство из них (676 человек, т. е. 80,2 %) имели постоянную работу.
По роду занятий большинство отстраненных доноров были медработники — 23 % (157/843); студенты — 17,7 % (119/843); служащие — 16,6 % (112/843) и военнослужащие -10,8 % (73/843).
При изучении мотивации среди отстраненных доноров 80,7 % человек указывали на желание помочь больному; в получении денег было заинтересовано 12,6 % потенциальных доноров. Большинство отстраненных доноров — это первичные доноры 65,8 % (555/843); доноры — родственники — 50,4 % и безвозмездные доноры — 36,9 %. Наиболее частой причиной отстранения было “временное отстранение от кроводачи” — 62,1 % (522/843). В структуре причин отстранения доминирующую долю занимают следующие группы причин: соматические — 38,7 %; анемия — 23,1 %; недавние хирургические вмешательства — 5,1 %; перенесенный в анамнезе вирусный гепатит — 5 % и низкий вес — 2,1 %. На базе РЦК за время исследования было отстранено 539 человек, что составляет 63,9 % от общего числа отстраненных доноров. Доля отстраненных от кроводачи в условиях РЦК и на выезде была примерно одинакова — 25 % и 25,3 %, соответственно.
Распространенность anti-HIV среди различных групп доноров
Среди исследуемой популяции доноров не было ни одного случая anti-HIV ИФА положительного, подтвержденного в иммуноблоте. Согласно определению случая ВИЧ — инфекции в данном исследовании не было ни одного ВИЧ-инфицированного донора.
Распространенность anti-HCV среди различных групп доноров
Среди исследуемой популяции доноров было выявлено 63 анти-ВГС положительных человека. Из этого числа анти-ВГС положительных доноров, двое были исключены из дальнейшего анализа ввиду наличия у них второго маркера — HBsAg, что помешало бы определить ассоциацию именно с наличием анти-ВГС. В группу сравнения вошло 2355 доноров, у которых не было обнаружено анти-ВГС и HBsAg. В таблице 1 представлены факторы, ассоциированные с наличием антител к ВГС, которые имели статистическую значимость в моновариабельном анализе.
Как видно из таблицы, распространенность анти-ВГС выше среди лиц, получавших переливание крови в анамнезе (ОР 4,4; 95 %ДИ 1,8–10,6); подвергавшихся оперативному лечению (ОР 1,8; 95 %ДИ 1,1–3,1); имевших в анамнезе факт задержания правоохранительными органами (ОР 2,4; 95 %ДИ 1,1–5,3); находившихся в местах лишения свободы (ОР 9,3; 95 %ДИ 2,6–33,6); среди лиц, не имеющих высшего образования (ОР 1,9; 95 %ДИ 1,1–3,2).
Повышенный уровень АЛТ во время тестирования ассоциировался с наличием анти-ВГС (ОР 5,0; 95 % ДИ 2,6–9,7). Распространенность анти-ВГС была ниже в возрастной группе доноров до 30 лет (ОР 0,44; 95 % ДИ 0,26–0,73); в группе доноров, сдающих кровь на регулярной основе (ОР 0,2; 95 % 0,03–1,4).
С целью исключения возможного влияния факторов смешивания был проведен многофакторный анализ.
В таблице 2 представлены факторы, имеющие статистическую значимость в многофакторном анализе. Значимыми факторами, ассоциированными с наличием анти-ВГС были установлены следующие: получение переливания крови в анамнезе (ОР 126,8; 95 %ДИ 13,8–1164,4); факт задержания правоохранительными органами (ОР 7,0; 95 %ДИ 1,3–37,8), повышенный уровень АЛТ (ОР 6,3; 95 %ДИ 1,1–35,2). При этом, регулярность донаций крови является “защитным” фактором (ОР 0, 3; 95 % ДИ 0, 1–0,96).
Факторы, ассоциированные сналичием анти-ВГС среди доноров (моновариабельный анализ)
Читайте также:



